Адсорбция.pptx
- Количество слайдов: 37

Фонтана Адсорбция 1777 –. Свежеприготовленный уголь поглощает разные газы Шееле: «воздух, поглощённый углём, при нагревании выделяется и вновь поглощается при охлаждении» Сосюр 1814 Митчерлих 1848 1

ТЕРМИН АДСОРБЦИЯ Термин адсорбция (Кайзер 1881 г. ) – концентрирование вещества на границе раздела фаз (твёрдое – газ, твёрдое – жидкость) Адсорбция, абсорбция, капиллярная конденсация в порах адсорбат адсорбент Сорбция осуществляется за счёт физических сил взаимодействия или хемосорбции 2

a=f(p, T) (1) при T=const a=f(p)T или a=f(p/ps)T (2) 1 и 2 являются уравнениями изотермы сорбции Большинство изотерм физической адсорбции можно отнести к одному из 5 типов (классификация БДДТ) 3

ПОВЕРХНОСТЬ РАЗДЕЛА ФАЗ Тенденция к сокращению поверхности твёрдого тела поверхностное натяжение твёрдого тела больше, чем жидкого. σ(Н 2 О)=72, 75 дн/см, σ(С 6 Н 6)=28, 8 дн/см, σ(Ba. SO 4)=310 дн/см Любой процесс, ведущий к уменьшению поверхностной энергии σS , протекает самопроизвольно и ведёт к уменьшению изобарно-изотермического потенциала (ΔG<0). Адсорбированные молекулы могут быть связаны с активными центрами неподвижно, или могут перемещаться вдоль поверхности ΔSгаз>Δsадс т. е. при адсорбции энтропия уменьшается ΔG=ΔH-TΔS <0 <0 т. е. ΔH<0 4

ЭНЕРГИЯ АДСОРБЦИОННЫХ СИЛ Адсорбция простых неполярных молекул на неполярных адсорбентах При этом действуют лишь дисперсионные силы притяжения и отталкивания 1. φ=-Cr-6 +Br-12 (1) (2) m=9, 1· 10 -28 г. с=3, 0· 1010 см/сек 5

(3) Рассмотрим адсорбцию Ar на базисной грани графита (4) (5) чтобы провести дифференцирование величин ∑r-6 и ∑r-12 надо выразить в функции z 6

(6) p, a, m, n – константы, которые находят расчётом сумм для нескольких значений z Ф=-cpz-q+Bmz-n (7) (8) Величина z 0 зависит от положения атома Ar относительно решётки графита 7

(9) Подставляем (9) в (7) при z=z 0 (11) 8

q/n – характеризует энергию отталкивания (30 -40%) от энергии дисперсионного притяжения -Ф 1=1, 82 ккал/моль -Ф 2=2, 44 ккал/моль RT=(-195+273) • 1, 98=0, 155 ккал/моль 9

АДСОРБЦИЯ СЛОЖНЫХ НЕПОЛЯРНЫХ МОЛЕКУЛ НА НЕПОЛЯРНОМ СОРБЕНТЕ н-алканы, звенья СН 3 и СН 2 -Ф=0, 85+1, 88 n ккал/моль 10
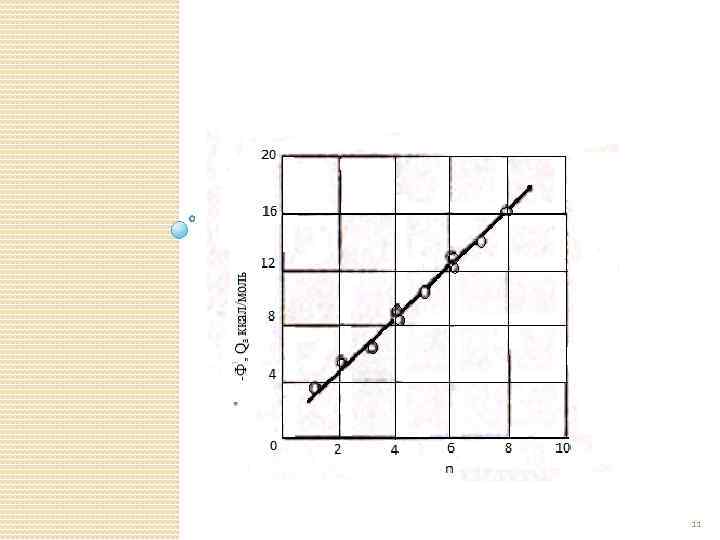
11

ЭЛЕКТРОСТАТИЧЕСКИЕ СИЛЫ Адсорбция неполярных молекул на поверхности ионных решёток. Возникают индукционные силы взаимодействия, притяжение диполя, индуцированного в молекуле адсорбата электрическим полем, создаваемым решётки сорбента 1) (12) FI зависят от заряда иона, типов решётки и грани. В случае грани [100] – чередование ионов противоположны знаков 12

2) Адсорбция полярных молекул на неполярном адсорбенте Постоянный дипольный момент адсорбата поляризует атомы адсорбента, т. е. индуцирует в них электрические моменты. Возникает индукционное притяжение, которое добавляется к дисперсионному (13) на графите с поляризуемостью α 1 сорбция сорбата с дипольным моментом μ 2. Предельный случай – сорбция диполей на металлах. . 13
14

АДСОРБЦИЯ ПОЛЯРНЫХ МОЛЕКУЛ НА ПОВЕРХНОСТЯХ, ИМЕЮЩИХ ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ Возникают ориентационные взаимодействия (кулоновские) v – валентность иона ε – заряд электрона l – расстояние между зарядами 15
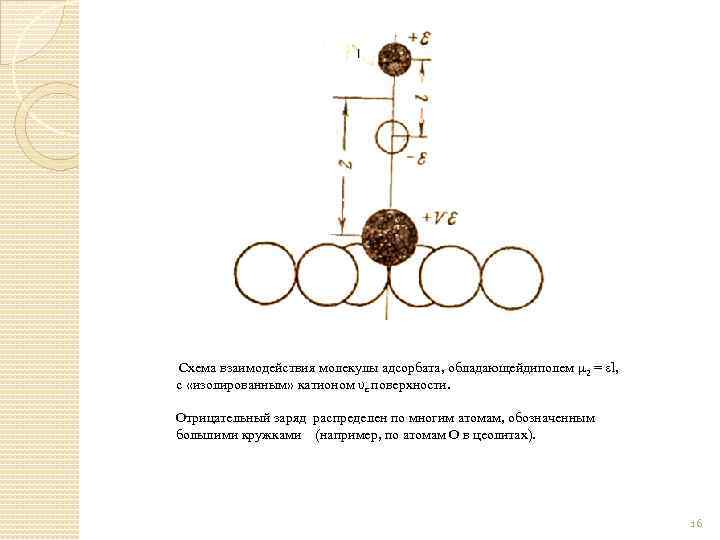
Схема взаимодействия молекулы адсорбата, обладающейдиполем μ 2 = εl, с «изолированным» катионом υε поверхности. Отрицательный заряд распределен по многим атомам, обозначенным большими кружками (например, по атомам О в цеолитах). 16

В расчёте на моль При адсорбции спиртов с большим углеводородным радикалом или фенола энергия дисперсионных сил больше энергии электростатического взаимодействия. 17
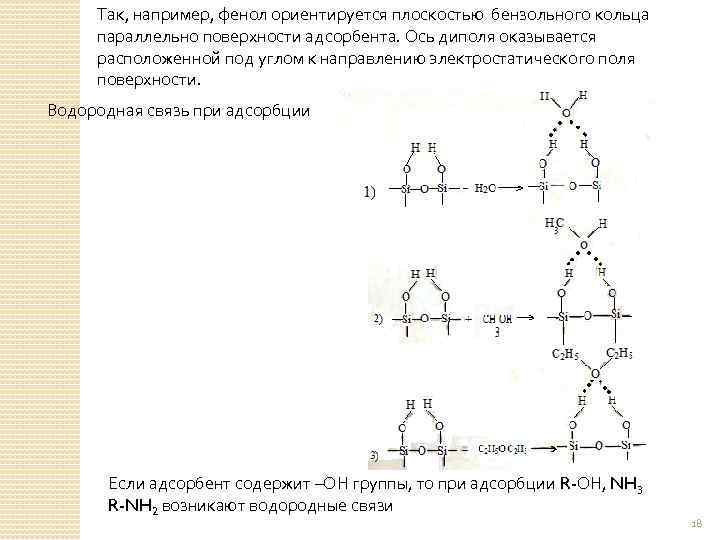
Так, например, фенол ориентируется плоскостью бензольного кольца параллельно поверхности адсорбента. Ось диполя оказывается расположенной под углом к направлению электростатического поля поверхности. Водородная связь при адсорбции Если адсорбент содержит –ОН группы, то при адсорбции R-ОН, NH 3 R-NH 2 возникают водородные связи 18
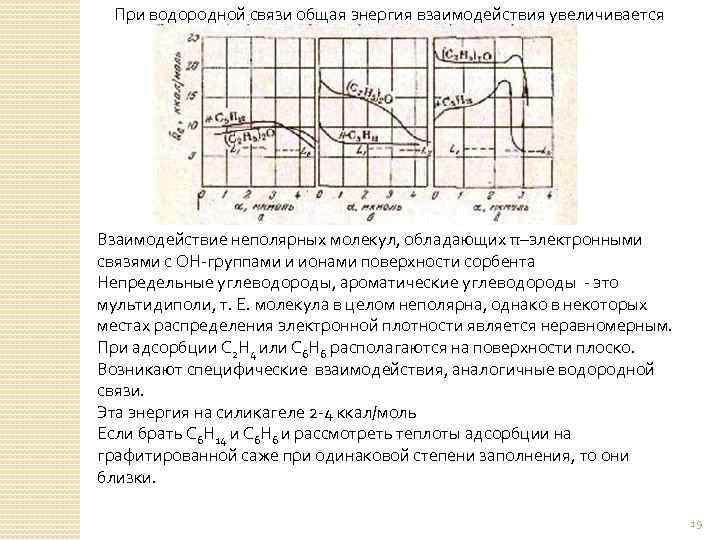
При водородной связи общая энергия взаимодействия увеличивается Взаимодействие неполярных молекул, обладающих π–электронными связями с ОН-группами и ионами поверхности сорбента Непредельные углеводороды, ароматические углеводороды - это мультидиполи, т. Е. молекула в целом неполярна, однако в некоторых местах распределения электронной плотности является неравномерным. При адсорбции С 2 Н 4 или С 6 Н 6 располагаются на поверхности плоско. Возникают специфические взаимодействия, аналогичные водородной связи. Эта энергия на силикагеле 2 -4 ккал/моль Если брать С 6 Н 14 и С 6 Н 6 и рассмотреть теплоты адсорбции на графитированной саже при одинаковой степени заполнения, то они близки. 19

Если рассмотреть теплоты адсорбции на силикагеле (гидроксилированная поверхность) или цеолите, то они сильно различаются. Молекулы N 2, CO 2 – обладают большим квадрупольным моментом Для таких молекул, как и для органических соединений с π-связями сорбция зависит от наличия гидроксильных групп или зарядов на поверхности Адсорбаты: А) сферически симметричные оболочки или σ-связи, например, углеводороды Б) π-связи, например ненасыщенные или ароматические углеводороды или свободные пары электронов (эфиры, третичные амины) В) положительные заряды, сосредоточенные на периферии молекул Г) функциональные группы с электронной плотностью или положительным зарядом, сосредоточенном на периферии молекулы с например –ОН или =NH группами 20
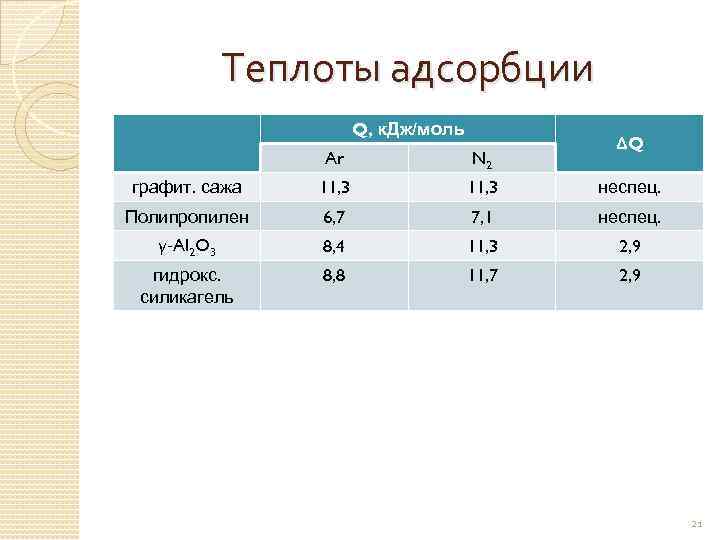
Теплоты адсорбции Q, к. Дж/моль ΔQ Ar N 2 графит. сажа 11, 3 неспец. Полипропилен 6, 7 7, 1 неспец. γ-Al 2 O 3 8, 4 11, 3 2, 9 гидрокс. силикагель 8, 8 11, 7 2, 9 21

Реальные твёрдые тела Схематическое изображение ступеней спайности Фотография ансамбля пузырьков, иллюстрирующая природу дислокаций. Вблизи Y видна разупорядоченная область 22

. Точечные дефекты: а-вакансии (дефекты Шотки); б – дефекты внедрения (дефекты Френкеля); в – идеальный кристалл Изменение величины φ0 при перемещении центра адсорбционного атома вдоль прямой, параллельной поверхности твердого тела и удаленной от нее на расстояние z 0. 23
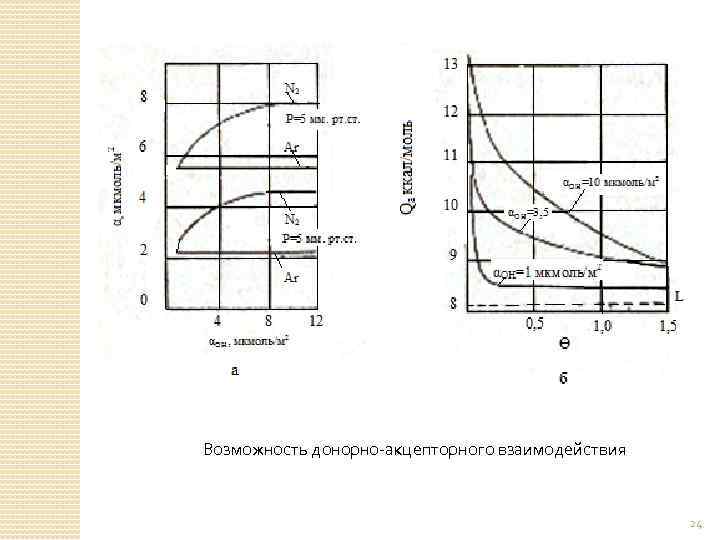
Возможность донорно-акцепторного взаимодействия 24

Энергия взаимодействия адсорбат -адсорбат Молекулы адсорбата притягиваются не только к сорбенту, но и друг к другу. Оно увеличивается с увеличением заполнения до некоторого предела, при плотном заполнении заменяются силами отталкивания. Это в основном дисперсионные силы взаимодействия, а также в случае диполей или зарядов – электростатические взаимодействия. При адсорбции на очень неоднородных поверхностях взаимодействия адсорбат маскируется влиянием неоднородности и теплота адсорбции с увеличением заполнения не меняется 25

Специфическая и неспецифическая адсорбция Киселёв А. В. разделил адсорбцию на неспецифическую (дисперсионные силы взаимодействия и специфическую (ещё и кулоновские взаимодействия). Адсорбенты на: I графитированная термическа сажа (нет на поверхности никаких групп) II гидроксилированные оксиды. На них сосредоточенн + заряд, например –ОН -группа III на поверхности сосредоточен отрицат. Заряд, например =О; =СО 26

Получение активных углей 1. Исходный материал подвергается термической обработке без доступа воздуха. При этом удаляются летучие частицы, влага, смолы. Получается крупнопористый уголь 2. Для получение микропористой структуры используется активация: а) парогазовая активация CO 2 (900 0 C ) C+CO→ 2 CO б) окисление водяным паром (850 0 С) С+H 2 O→CO+H 2 побочная реакция CO+H 2 O→CO 2+H 2+4, 2 к. Дж/моль Реакция экзотермическая. Катализаторы процесса –окислы и карбонаты щелочных металлов, соединения Cu и Fe. 27

в) активация воздухом С+О 2→СО 2+376 к. Дж/моль С+О 2→ 2 СО+227 к. Дж/моль Из-за большой экзотермичности и большой скорости реакции применяются редко. г) Обработка угля солями, которые при высокой температуре выделяют CO 2 (карбонаты, сульфаты , нитраты) 3. Химическая активация проводится при температурах 200 -650 о С 28

Силикагели Гидратированный аморфный кремнезем: Si. O 2∙n. H 2 O С+О 2→СО 2+376 к. Дж/моль Превращения протекают по механизму поликонденсации: n (Si(OH)4)→Sin. O 2 n-m+(2 n-m)∙H 2 O Процесс поликонденсации ведет к образованию частиц коллоидных растворов, форма близкая к сферической 20200 Ao При высушивании гидрогеля кремниевой структурная сетка из связанных между собой сферических частиц сохраняется. На свойства силикагеля влияет группы ≡Si-OH. OH- группы занимают вершины тетраэдров. 29

Получение Сырьем является твердый силикат Na Na 2 O∙ 3 Si. O 2+H 2 SO 4→ 3(Si. O 2+H 2 O)+Na 2 SO 4 аморфный кремнезем Активная окись алюминия Получают прокаливанием гидроокиси Al 2 O 3∙n. H 2 O 0<n<0, 6, t=600 o. C. Цеолиты а) природные б)синтетические Цеолит Na. A: Na 2 O∙Al 2 O 3∙ 2 Si. O 2∙ 4, 5 H 2 O Кремнезем Si. O 2: Al 2 O 3 не более 2 30
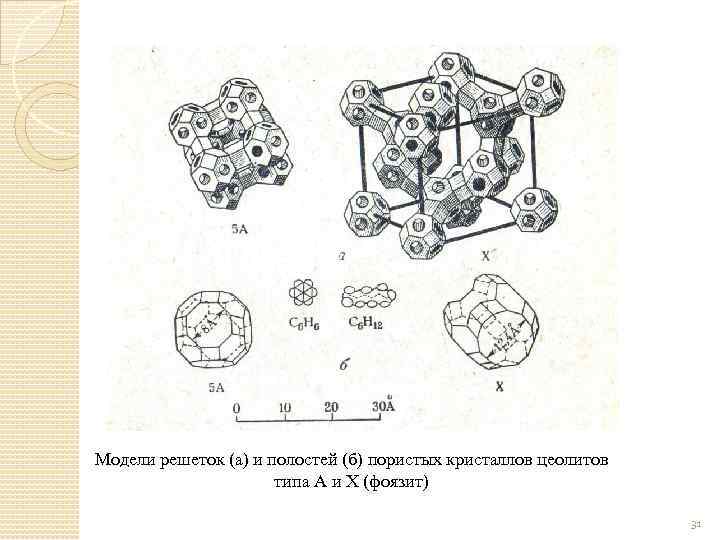
Модели решеток (а) и полостей (б) пористых кристаллов цеолитов типа А и X (фоязит) 31

Классификация молекул и адсорбентов А. В. Киселёва молекулы Группа А адсорбенты Тип III Неспецифические взаимодействия, определяемые в основном дисперсионными силами Группа В Группа С Неспецифические взаимодействия Неспецифические+специфические взаимодействия Группа D 32

Классификация по геометрической структуре Тип адсорбентов S, м 2/г Dср, нм Объём пор, см 3/г 1 Непористые 5 -200 - - 2 Однородно макропористые 5 -100 >50 До 1, 5 3 Однородно тонкопористые 500 -1000 0, 4 -10 0, 5 -0, 8 4 Неоднородно пористые 250 -800 1 -20 0, 3 -1, 2 33
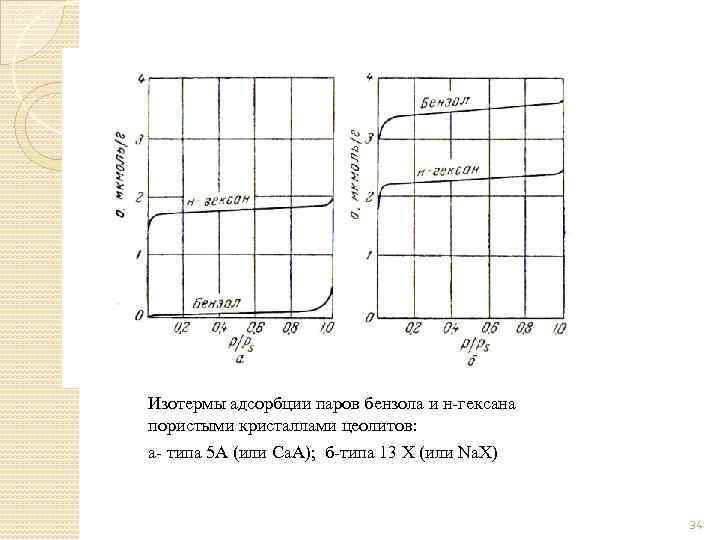
Изотермы адсорбции паров бензола и н-гексана пористыми кристаллами цеолитов: а- типа 5 А (или Са. А); б-типа 13 Х (или Na. X) 34

Важная причина размывания хроматографических полос - нелинейность изотермы, медленность внешнедиффузионной массопередачи (за счет достаточно узких пор) Модификация неорганических адсорбентов 1. Обработка кислотами и щелочами (неорганические соли, удаление примесей) 2. Связывание гидроксильных групп, расположенных на поверхности хлометисиланами 3. Насыщение парами воды (дезактивация) 4. Геометрическая модификация (прокаливание адсорбента при 900 -1000 о. С, изменяется поровая структура, остаются крупные поры; поверхность также дегидрокилируется). 35

Полимерные сорбенты Получается полимеризацией в среде инертных разбавителей, в результате которой образуется пространственные полимеры с ячейками, заполненными растворителем, который удаляется перегонкой с водяным паром или вакуумной откачкой. В результате образуется полимер с пористым каркасом. Пористые полимеры являются сорбентами с регулируемой структурой. 36
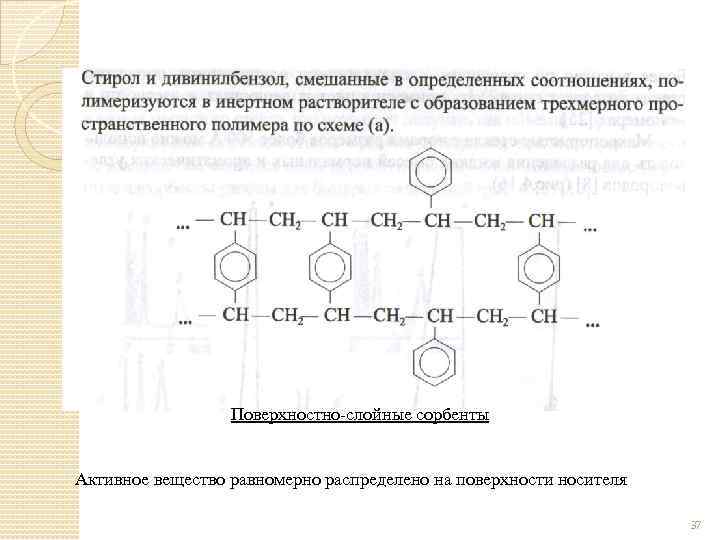
Поверхностно-слойные сорбенты Активное вещество равномерно распределено на поверхности носителя 37
Адсорбция.pptx