4. Мезенхимные стволовые клетки.pptx
- Количество слайдов: 95
 Физиология мезенхимных стволовых клеток
Физиология мезенхимных стволовых клеток
 Стволовые мезенхимные клетки (МСК) • Костный мозг состоит из 2 тканей (кроветворной и стромальной) и соответственно в нем присутствуют 2 стволовые клетки – • Стволовая кроветворная клетка (СКК) • Стволовая мезенхимная клетка (МСК) (термин ввел Arnold Caplan в 1991 году - это фибробластоподобные, прилипающие к пластику клетки)
Стволовые мезенхимные клетки (МСК) • Костный мозг состоит из 2 тканей (кроветворной и стромальной) и соответственно в нем присутствуют 2 стволовые клетки – • Стволовая кроветворная клетка (СКК) • Стволовая мезенхимная клетка (МСК) (термин ввел Arnold Caplan в 1991 году - это фибробластоподобные, прилипающие к пластику клетки)
 1962: А. Я. Фриденштейн и Е. Лурия
1962: А. Я. Фриденштейн и Е. Лурия
 Стромальные механоциты клетки образующие колонии фибробластов (КОЕФ)
Стромальные механоциты клетки образующие колонии фибробластов (КОЕФ)
 Критерий стволовых клеток • 1. Способность к дифференцировке во все тканевые клеточные линии. • 2. Способность к «самоподдержанию» .
Критерий стволовых клеток • 1. Способность к дифференцировке во все тканевые клеточные линии. • 2. Способность к «самоподдержанию» .
 Характеристика мультипотентных мезенхимных стромальных клеток человека (МСК) Первоначально МСК по определению это прилипающие к пластику стромальные клетки, выделенные из костного мозга человека или других источников (Caplan, 1991; Deans and Moseley, 2000).
Характеристика мультипотентных мезенхимных стромальных клеток человека (МСК) Первоначально МСК по определению это прилипающие к пластику стромальные клетки, выделенные из костного мозга человека или других источников (Caplan, 1991; Deans and Moseley, 2000).
 The Russian connection: 4 genera- tions of Caplans born in the US; ALL GRANDPARENTS RUSSIAN. 1999
The Russian connection: 4 genera- tions of Caplans born in the US; ALL GRANDPARENTS RUSSIAN. 1999
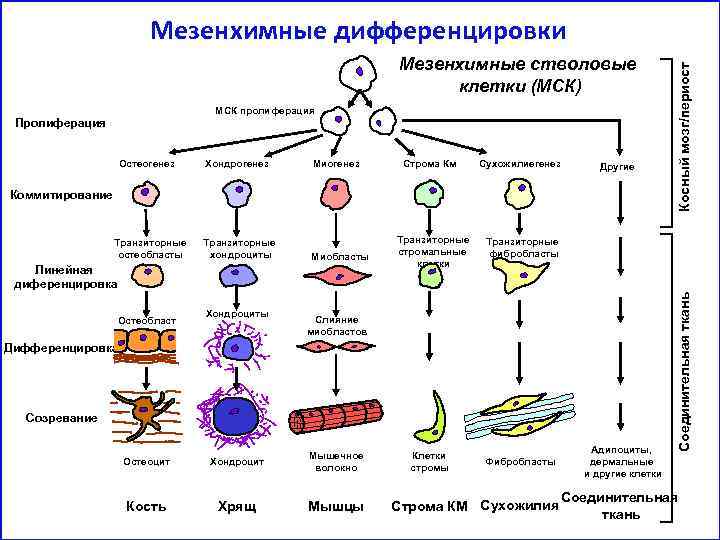
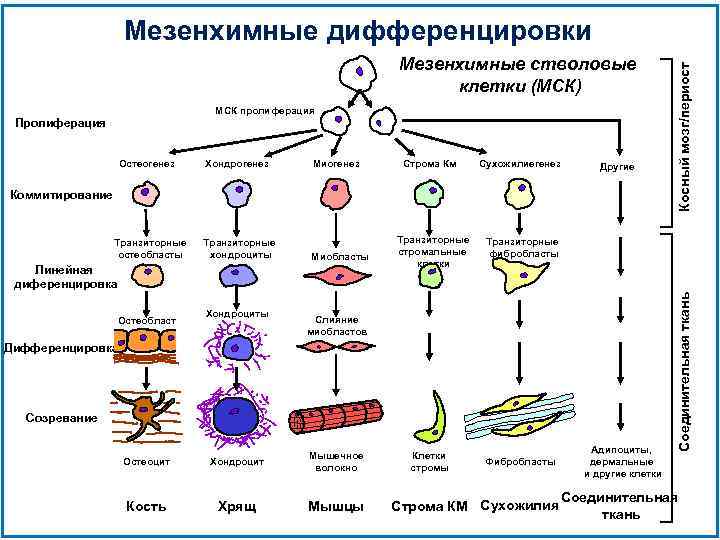 Мезенхимные стволовые клетки (МСК) МСК пролиферация Пролиферация Хондрогенез Миогенез Строма Км Сухожилиегенез Другие Коммитирование Транзиторные остеобласты Транзиторные хондроциты Миобласты Линейная диференцировка Остеобласт Хондроциты Транзиторные стромальные клетки Транзиторные фибробласты Слияние миобластов Дифференцировка Созревание Остеоцит Хондроцит Мышечное волокно Кость Хрящ Мышцы Клетки стромы Фибробласты Строма КМ Сухожилия Адипоциты, дермальные и другие клетки Соединительная ткань Остеогенез Косный мозг/периост Мезенхимные дифференцировки Соединительная ткань
Мезенхимные стволовые клетки (МСК) МСК пролиферация Пролиферация Хондрогенез Миогенез Строма Км Сухожилиегенез Другие Коммитирование Транзиторные остеобласты Транзиторные хондроциты Миобласты Линейная диференцировка Остеобласт Хондроциты Транзиторные стромальные клетки Транзиторные фибробласты Слияние миобластов Дифференцировка Созревание Остеоцит Хондроцит Мышечное волокно Кость Хрящ Мышцы Клетки стромы Фибробласты Строма КМ Сухожилия Адипоциты, дермальные и другие клетки Соединительная ткань Остеогенез Косный мозг/периост Мезенхимные дифференцировки Соединительная ткань
 Способность мезенхимных стволовых клеток (МСК) к самоподдержанию – остается открытым вопросом.
Способность мезенхимных стволовых клеток (МСК) к самоподдержанию – остается открытым вопросом.
 Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement • EM Horwitz, K Le Blanc, M Dominici, I Mueller, I Slaper-Cortenbach, FC Marini, RJ Deans, DS Krause, A Keating • Cytotherapy, Volume 7, Number 5 / November 2005, 393 - 395
Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement • EM Horwitz, K Le Blanc, M Dominici, I Mueller, I Slaper-Cortenbach, FC Marini, RJ Deans, DS Krause, A Keating • Cytotherapy, Volume 7, Number 5 / November 2005, 393 - 395
 • The plastic-adherent cells isolated from BM and other sources have come to be widely known as mesenchymal stem cells (MSC). However, the recognized biologic properties of the unfractionated population of cells do not seem to meet generally accepted criteria for stem cell activity, rendering the name scientifically inaccurate and potentially misleading to the lay public. Nonetheless, a bona fide MSC most certainly exists. To address this inconsistency between nomenclature and biologic properties, and to clarify the terminology, we suggest that the fibroblast-like plastic-adherent cells, regardless of the tissue from which they are isolated, be termed multipotent mesenchymal stromal cells, while the term mesenchymal stem cells is used only for cells that meet specified stem cell criteria. The widely recognized acronym, MSC, may be used for both cell populations, as is the current practice; thus, investigators must clearly define the more scientifically correct designation in their reports. The International Society for Cellular Therapy (ISCT) encourages the scientific community to adopt this uniform nomenclature in all written and oral communications.
• The plastic-adherent cells isolated from BM and other sources have come to be widely known as mesenchymal stem cells (MSC). However, the recognized biologic properties of the unfractionated population of cells do not seem to meet generally accepted criteria for stem cell activity, rendering the name scientifically inaccurate and potentially misleading to the lay public. Nonetheless, a bona fide MSC most certainly exists. To address this inconsistency between nomenclature and biologic properties, and to clarify the terminology, we suggest that the fibroblast-like plastic-adherent cells, regardless of the tissue from which they are isolated, be termed multipotent mesenchymal stromal cells, while the term mesenchymal stem cells is used only for cells that meet specified stem cell criteria. The widely recognized acronym, MSC, may be used for both cell populations, as is the current practice; thus, investigators must clearly define the more scientifically correct designation in their reports. The International Society for Cellular Therapy (ISCT) encourages the scientific community to adopt this uniform nomenclature in all written and oral communications.
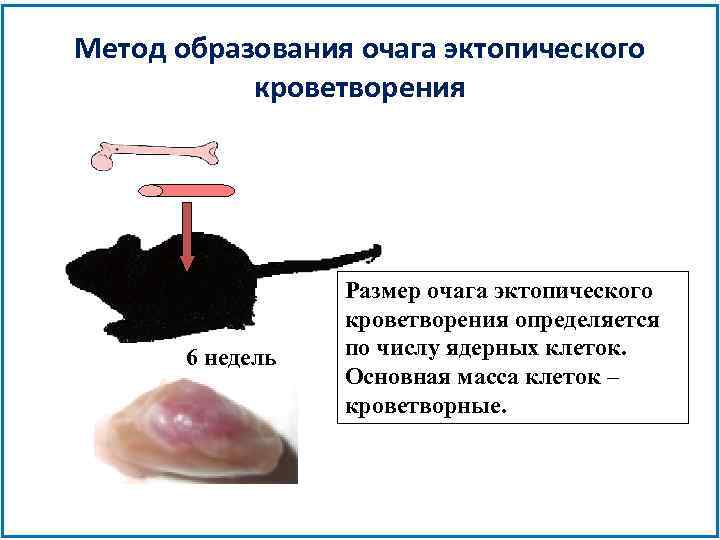 Метод образования очага эктопического кроветворения 6 недель Размер очага эктопического кроветворения определяется по числу ядерных клеток. Основная масса клеток – кроветворные.
Метод образования очага эктопического кроветворения 6 недель Размер очага эктопического кроветворения определяется по числу ядерных клеток. Основная масса клеток – кроветворные.
 Метод посадки под капсулу почки
Метод посадки под капсулу почки
 Метод посадки под капсулу почки
Метод посадки под капсулу почки
 Метод посадки под капсулу почки
Метод посадки под капсулу почки
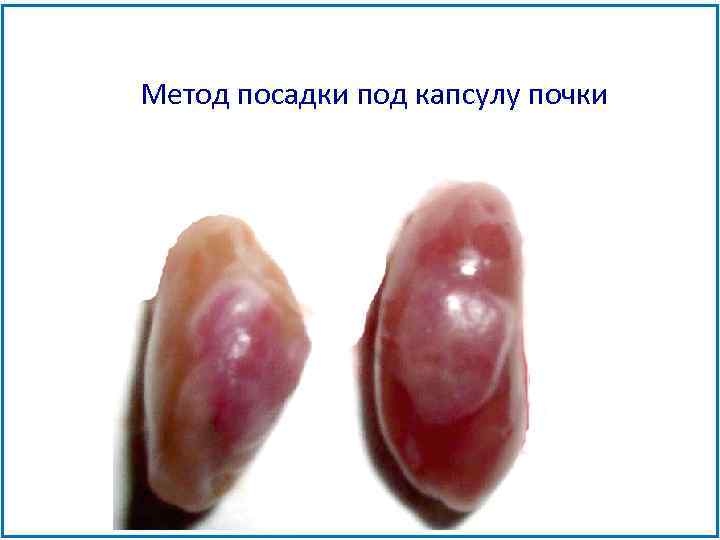 Метод посадки под капсулу почки
Метод посадки под капсулу почки
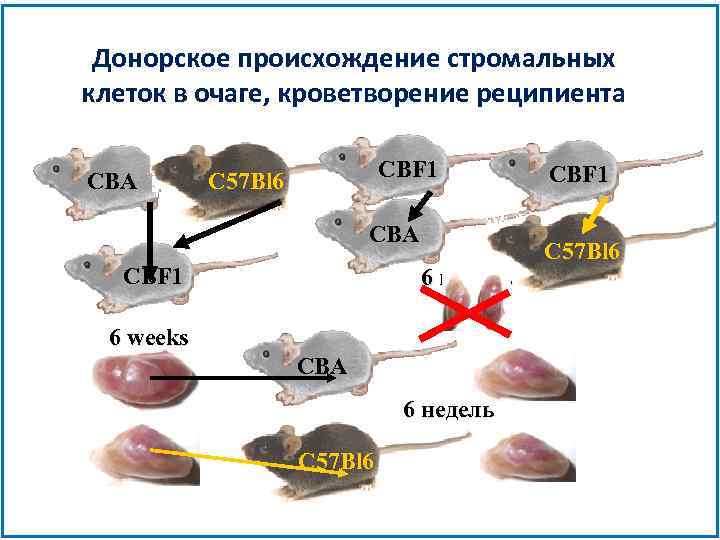 Донорское происхождение стромальных клеток в очаге, кроветворение реципиента CBA CBF 1 C 57 Bl 6 CBA CBF 1 6 недель 6 weeks CBA 6 недель C 57 Bl 6 CBF 1 C 57 Bl 6
Донорское происхождение стромальных клеток в очаге, кроветворение реципиента CBA CBF 1 C 57 Bl 6 CBA CBF 1 6 недель 6 weeks CBA 6 недель C 57 Bl 6 CBF 1 C 57 Bl 6
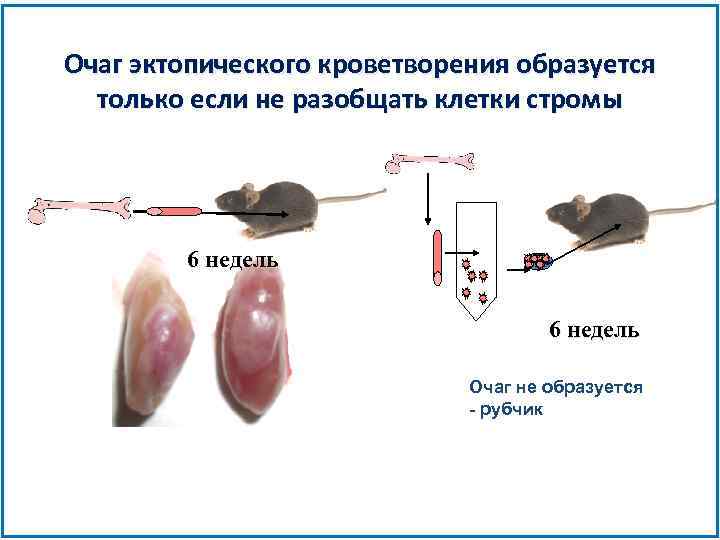 Очаг эктопического кроветворения образуется только если не разобщать клетки стромы 6 недель Очаг не образуется - рубчик
Очаг эктопического кроветворения образуется только если не разобщать клетки стромы 6 недель Очаг не образуется - рубчик
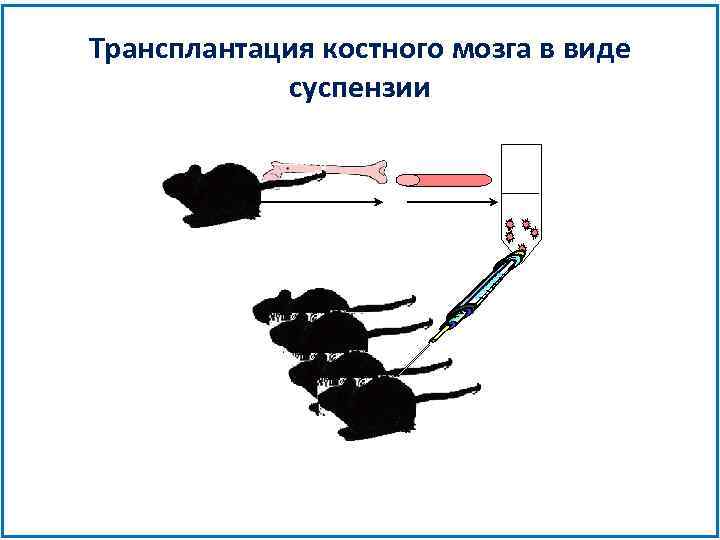 Трансплантация костного мозга в виде суспензии
Трансплантация костного мозга в виде суспензии
 Принадлежность СКК и МСК в одной ткани зависит от метода трансплантации 1. Имплантация костного мозга в виде цилиндра: Строма Кроветворение Донорская Реципиента 2. Трансплантация клеток костного мозга: Строма Кроветворение Реципиента Донорское
Принадлежность СКК и МСК в одной ткани зависит от метода трансплантации 1. Имплантация костного мозга в виде цилиндра: Строма Кроветворение Донорская Реципиента 2. Трансплантация клеток костного мозга: Строма Кроветворение Реципиента Донорское
 Метод очага эктопического кроветворения не только качественный, но и количественный.
Метод очага эктопического кроветворения не только качественный, но и количественный.
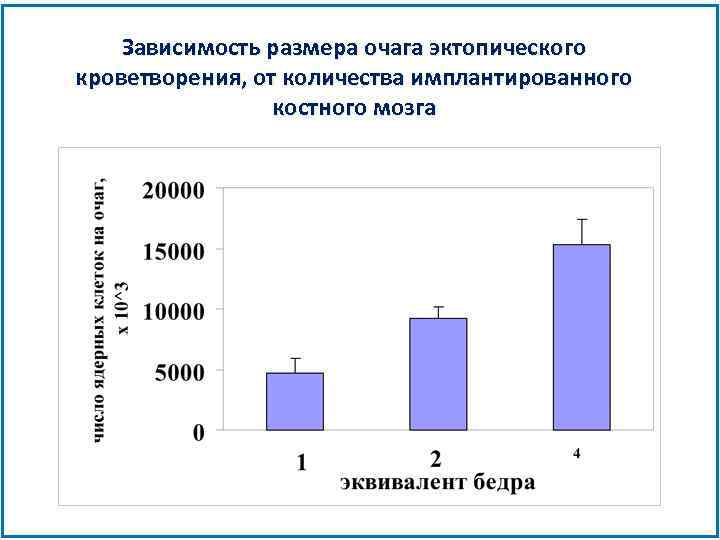 Зависимость размера очага эктопического кроветворения, от количества имплантированного костного мозга
Зависимость размера очага эктопического кроветворения, от количества имплантированного костного мозга
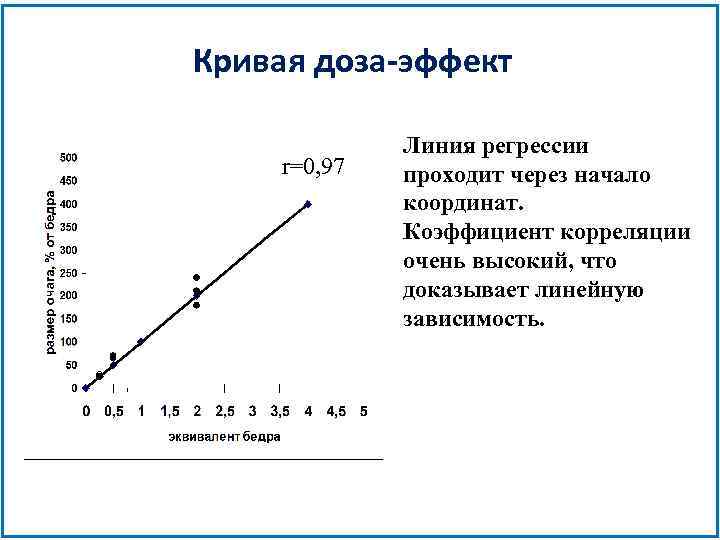 Кривая доза-эффект r=0, 97 Линия регрессии проходит через начало координат. Коэффициент корреляции очень высокий, что доказывает линейную зависимость.
Кривая доза-эффект r=0, 97 Линия регрессии проходит через начало координат. Коэффициент корреляции очень высокий, что доказывает линейную зависимость.
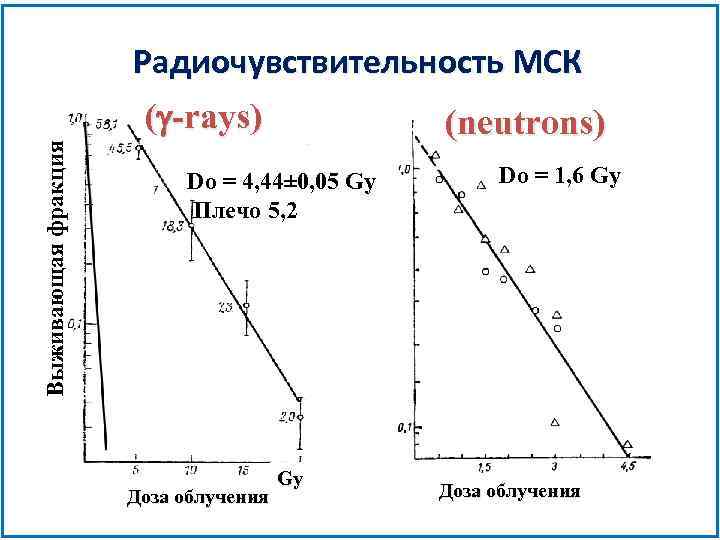 Радиочувствительность МСК Выживающая фракция (g-rays) (neutrons) Do = 4, 44± 0, 05 Gy Плечо 5, 2 Доза облучения Gy Do = 1, 6 Gy Доза облучения
Радиочувствительность МСК Выживающая фракция (g-rays) (neutrons) Do = 4, 44± 0, 05 Gy Плечо 5, 2 Доза облучения Gy Do = 1, 6 Gy Доза облучения
 Самоподдержание МСК (эктопический очаг) 12, 5 x 106 17, 2 x 106 20, 5 x 106 21, 3 x 106 11, 5 x 106 24, 7 x 106 25, 2 x 106 19, 8 x 106 22, 9 x 106
Самоподдержание МСК (эктопический очаг) 12, 5 x 106 17, 2 x 106 20, 5 x 106 21, 3 x 106 11, 5 x 106 24, 7 x 106 25, 2 x 106 19, 8 x 106 22, 9 x 106
 Основные свойства МСК • МСК (Do = 4, 44 ± 0, 05 Gy) более радиорезистентны чем СКК (Do=1, 2 ± 0, 15 Gy) • Система репарации ДНК очень хорошо развита у МСК • МСК обладают высоким пролиферативным потенциалом
Основные свойства МСК • МСК (Do = 4, 44 ± 0, 05 Gy) более радиорезистентны чем СКК (Do=1, 2 ± 0, 15 Gy) • Система репарации ДНК очень хорошо развита у МСК • МСК обладают высоким пролиферативным потенциалом
 Иерархия МСК Если МСК действительно стволовая клетка, то должны быть промежуточные, отвечающие на ростовые факторы предшественники.
Иерархия МСК Если МСК действительно стволовая клетка, то должны быть промежуточные, отвечающие на ростовые факторы предшественники.
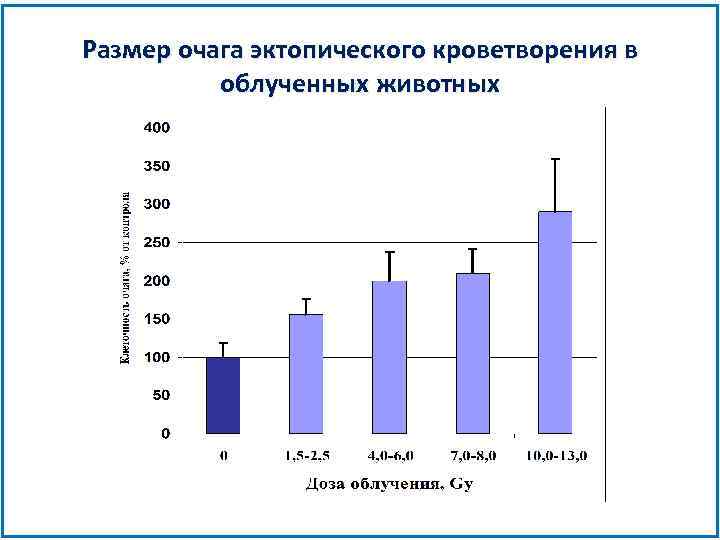 Размер очага эктопического кроветворения в облученных животных
Размер очага эктопического кроветворения в облученных животных
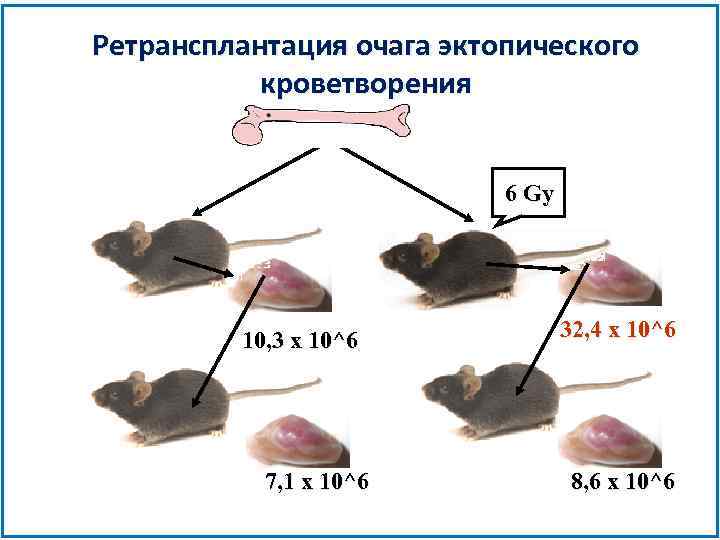 Ретрансплантация очага эктопического кроветворения 6 Gy 10, 3 x 10^6 7, 1 x 10^6 32, 4 x 10^6 8, 6 x 10^6
Ретрансплантация очага эктопического кроветворения 6 Gy 10, 3 x 10^6 7, 1 x 10^6 32, 4 x 10^6 8, 6 x 10^6
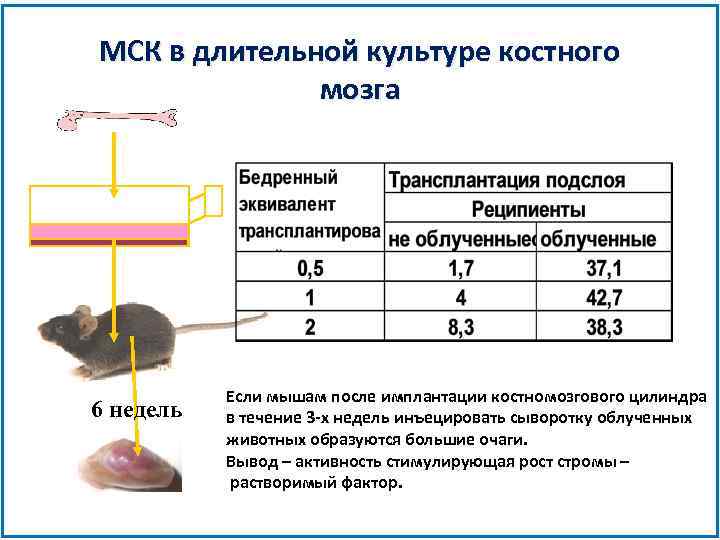 МСК в длительной культуре костного мозга 6 недель Если мышам после имплантации костномозгового цилиндра в течение 3 -х недель инъецировать сыворотку облученных животных образуются большие очаги. Вывод – активность стимулирующая рост стромы – растворимый фактор.
МСК в длительной культуре костного мозга 6 недель Если мышам после имплантации костномозгового цилиндра в течение 3 -х недель инъецировать сыворотку облученных животных образуются большие очаги. Вывод – активность стимулирующая рост стромы – растворимый фактор.
 Изучение источника стромального фактора роста 6 Gy Костный мозг Кости Селезенка Тимус Печень Имплантация под кожу
Изучение источника стромального фактора роста 6 Gy Костный мозг Кости Селезенка Тимус Печень Имплантация под кожу
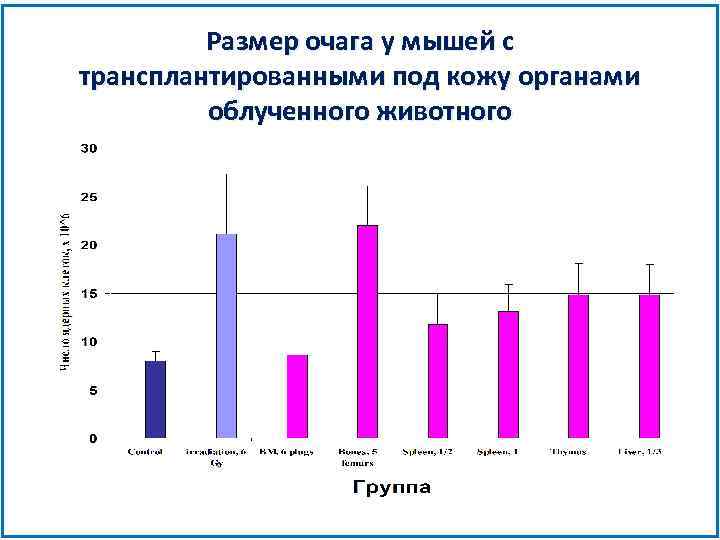 Размер очага у мышей с трансплантированными под кожу органами облученного животного
Размер очага у мышей с трансплантированными под кожу органами облученного животного
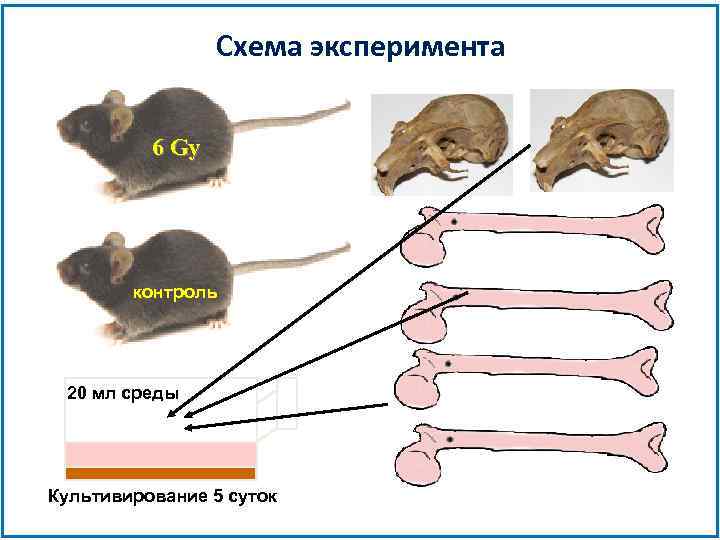 Схема эксперимента 6 Gy контроль 20 мл среды Культивирование 5 суток
Схема эксперимента 6 Gy контроль 20 мл среды Культивирование 5 суток
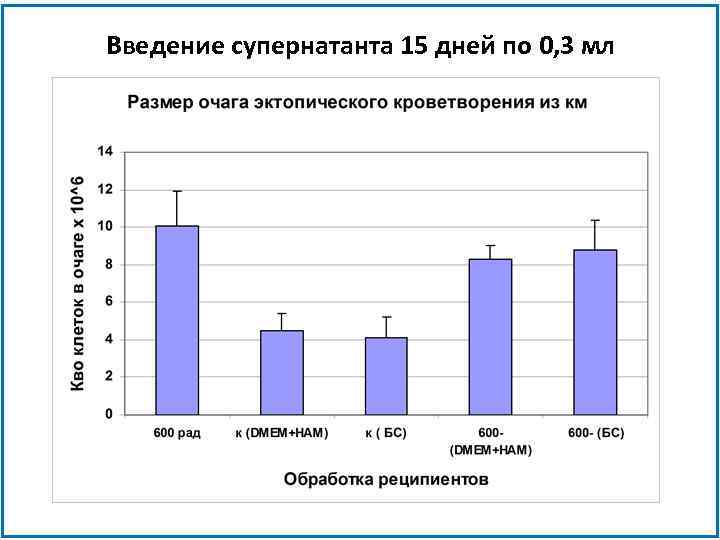 Введение супернатанта 15 дней по 0, 3 мл
Введение супернатанта 15 дней по 0, 3 мл
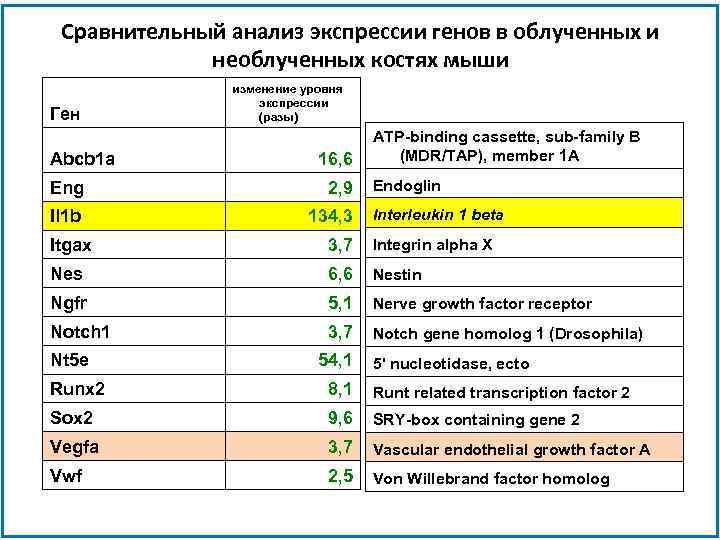 Сравнительный анализ экспрессии генов в облученных и необлученных костях мыши Ген Abcb 1 a изменение уровня экспрессии (разы) 16, 6 Eng 2, 9 Il 1 b 134, 3 ATP-binding cassette, sub-family B (MDR/TAP), member 1 A Endoglin Interleukin 1 beta Itgax 3, 7 Integrin alpha X Nes 6, 6 Nestin Ngfr 5, 1 Nerve growth factor receptor Notch 1 3, 7 Notch gene homolog 1 (Drosophila) Nt 5 e 54, 1 5' nucleotidase, ecto Runx 2 8, 1 Runt related transcription factor 2 Sox 2 9, 6 SRY-box containing gene 2 Vegfa 3, 7 Vascular endothelial growth factor A Vwf 2, 5 Von Willebrand factor homolog
Сравнительный анализ экспрессии генов в облученных и необлученных костях мыши Ген Abcb 1 a изменение уровня экспрессии (разы) 16, 6 Eng 2, 9 Il 1 b 134, 3 ATP-binding cassette, sub-family B (MDR/TAP), member 1 A Endoglin Interleukin 1 beta Itgax 3, 7 Integrin alpha X Nes 6, 6 Nestin Ngfr 5, 1 Nerve growth factor receptor Notch 1 3, 7 Notch gene homolog 1 (Drosophila) Nt 5 e 54, 1 5' nucleotidase, ecto Runx 2 8, 1 Runt related transcription factor 2 Sox 2 9, 6 SRY-box containing gene 2 Vegfa 3, 7 Vascular endothelial growth factor A Vwf 2, 5 Von Willebrand factor homolog
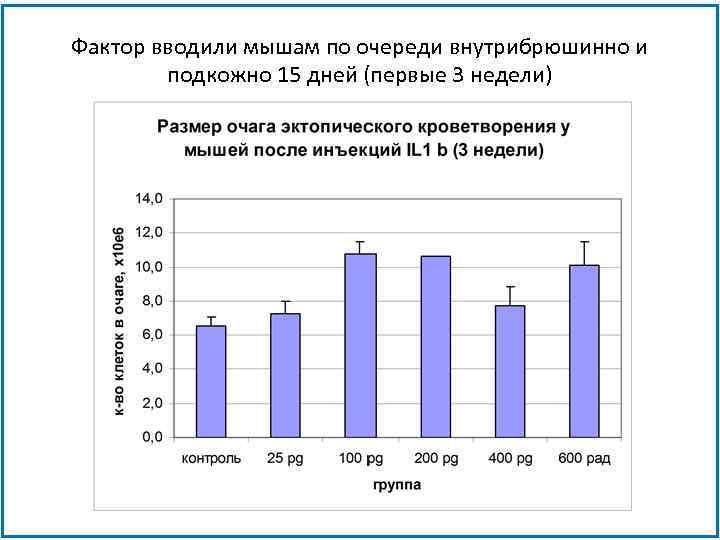 Фактор вводили мышам по очереди внутрибрюшинно и подкожно 15 дней (первые 3 недели)
Фактор вводили мышам по очереди внутрибрюшинно и подкожно 15 дней (первые 3 недели)
 Мультипотентные, но не способные к самоподдержанию предшественники – следующий шаг в иерархии МСК.
Мультипотентные, но не способные к самоподдержанию предшественники – следующий шаг в иерархии МСК.
 Колоние образующие единицы фибробластные (КОЕф) • В 1970 году Фриденштейн А. Я. опубликовал работу (Friedenstein, A. J. , Chailakhjan, R. K. , and Lalykina, K. S. (1970). The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Cell Tissue Kinet. 3, 393– 403. ) в которой показал, что в костном мозге существуют клональные клеткипредшественники, которые способны дифференцироваться в костную и жировую ткань in vivo. • Некоторые исследователи считают, что эти клетки аналогичны или являются мезенхимными стволовыми клетками (МСК).
Колоние образующие единицы фибробластные (КОЕф) • В 1970 году Фриденштейн А. Я. опубликовал работу (Friedenstein, A. J. , Chailakhjan, R. K. , and Lalykina, K. S. (1970). The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Cell Tissue Kinet. 3, 393– 403. ) в которой показал, что в костном мозге существуют клональные клеткипредшественники, которые способны дифференцироваться в костную и жировую ткань in vivo. • Некоторые исследователи считают, что эти клетки аналогичны или являются мезенхимными стволовыми клетками (МСК).
 Колониеобразующие единицы фибробластные (КОЕф)
Колониеобразующие единицы фибробластные (КОЕф)
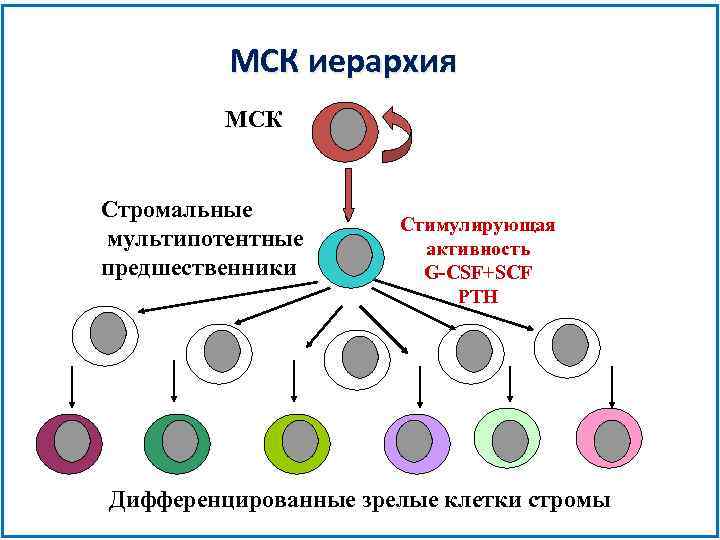 МСК иерархия МСК Стромальные мультипотентные предшественники Стимулирующая aктивность G-CSF+SCF PTH Дифференцированные зрелые клетки стромы
МСК иерархия МСК Стромальные мультипотентные предшественники Стимулирующая aктивность G-CSF+SCF PTH Дифференцированные зрелые клетки стромы
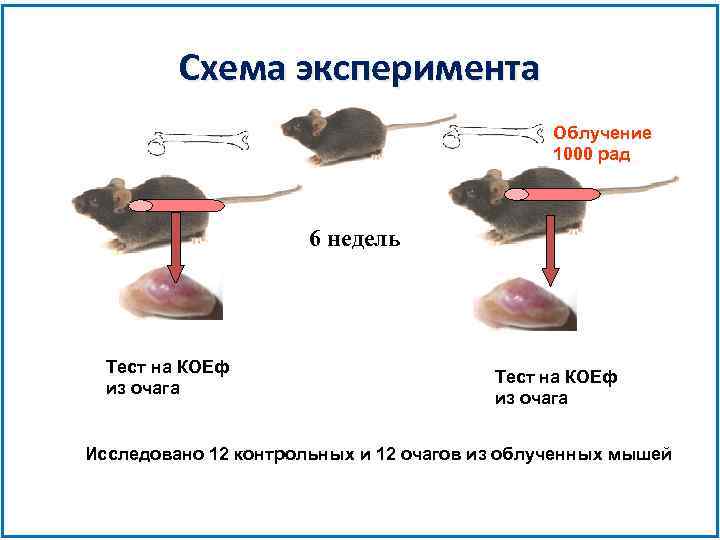 Схема эксперимента Облучение 1000 рад 6 недель Тест на КОЕф из очага Исследовано 12 контрольных и 12 очагов из облученных мышей
Схема эксперимента Облучение 1000 рад 6 недель Тест на КОЕф из очага Исследовано 12 контрольных и 12 очагов из облученных мышей
 Какие могут быть возможности ответа? • 1. Количество КОЕф не изменилось. • 2. Количество КОЕф увеличилось в очаге у облученного животного. • 3. Количество КОЕф уменьшилось в очаге у облученного животного.
Какие могут быть возможности ответа? • 1. Количество КОЕф не изменилось. • 2. Количество КОЕф увеличилось в очаге у облученного животного. • 3. Количество КОЕф уменьшилось в очаге у облученного животного.
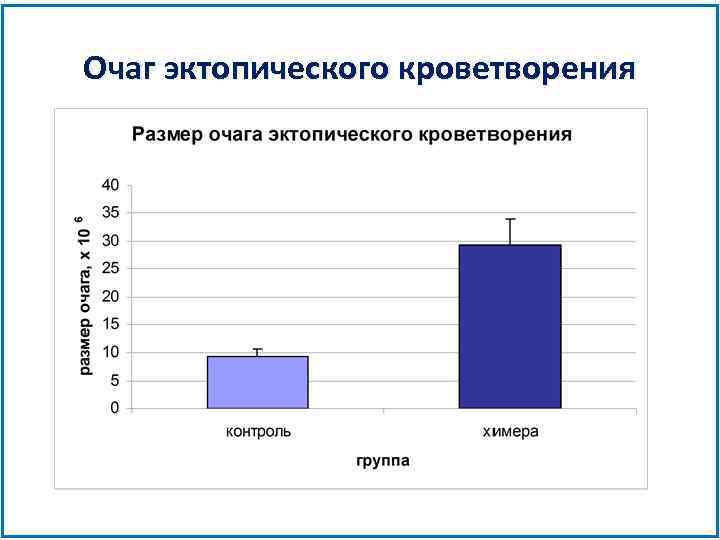 Очаг эктопического кроветворения
Очаг эктопического кроветворения
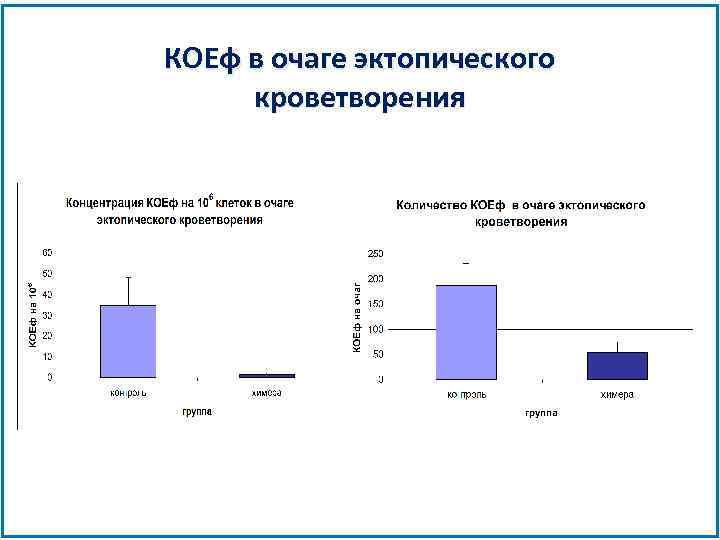 КОЕф в очаге эктопического кроветворения
КОЕф в очаге эктопического кроветворения
 КОЕф в очаге эктопического кроветворения Таким образом в очаге эктопического кроветворения у облученных мышей концентрация КОЕф в 20 раз ниже, чем в нормальном, а количество КОЕф на очаг в 3 раза меньше. Это означает, что КОЕф в иерархии находятся выше, чем индуцированные предшественники.
КОЕф в очаге эктопического кроветворения Таким образом в очаге эктопического кроветворения у облученных мышей концентрация КОЕф в 20 раз ниже, чем в нормальном, а количество КОЕф на очаг в 3 раза меньше. Это означает, что КОЕф в иерархии находятся выше, чем индуцированные предшественники.
 Добавление мышиной сыворотки к культурам КОЕф
Добавление мышиной сыворотки к культурам КОЕф
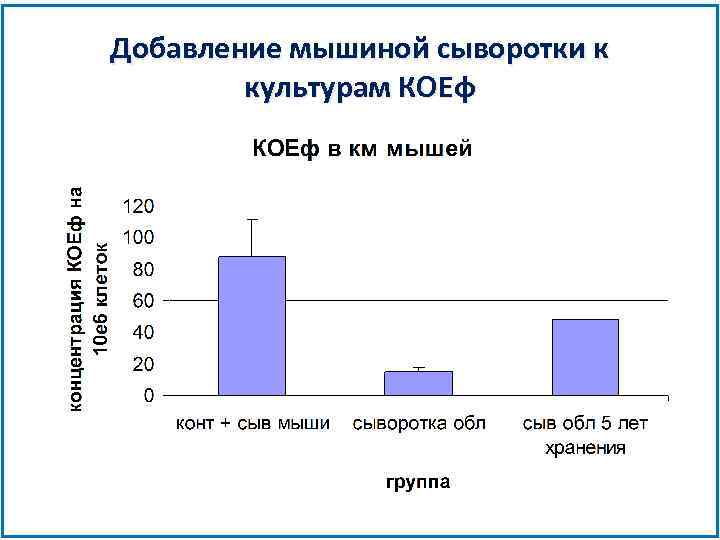 Добавление мышиной сыворотки к культурам КОЕф
Добавление мышиной сыворотки к культурам КОЕф
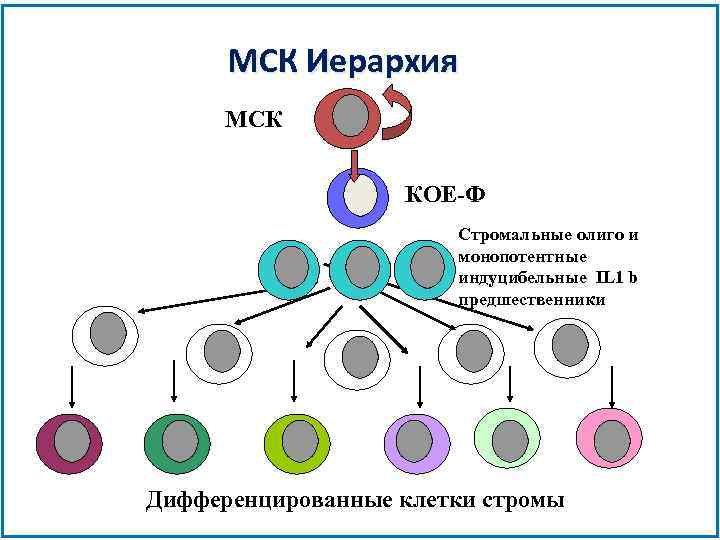 МСК Иерархия МСК КОЕ-Ф Стромальные олиго и монопотентные индуцибельные IL 1 b предшественники Дифференцированные клетки стромы
МСК Иерархия МСК КОЕ-Ф Стромальные олиго и монопотентные индуцибельные IL 1 b предшественники Дифференцированные клетки стромы
 Авторы этой работы Главный автор Чертков И. Л. Эршлер М. А. Шипунова И. Н. Свинарева Д. А. Сац Н. В. Бигильдеев А. Е. Жиронкина О. А. Дризе Н. И. Гуревич О. А. Удалов Г. А.
Авторы этой работы Главный автор Чертков И. Л. Эршлер М. А. Шипунова И. Н. Свинарева Д. А. Сац Н. В. Бигильдеев А. Е. Жиронкина О. А. Дризе Н. И. Гуревич О. А. Удалов Г. А.
 Мультипотентные мезенхимные стромальные клетки (ММСК) человека Человеческие мультипотентные мезенхимные стромальные клетки (ММСК) по определению представляют из себя популяцию прилипающих к пластику стромальных клеток, выделенных из костного мозга, жировой ткани и других источников.
Мультипотентные мезенхимные стромальные клетки (ММСК) человека Человеческие мультипотентные мезенхимные стромальные клетки (ММСК) по определению представляют из себя популяцию прилипающих к пластику стромальных клеток, выделенных из костного мозга, жировой ткани и других источников.
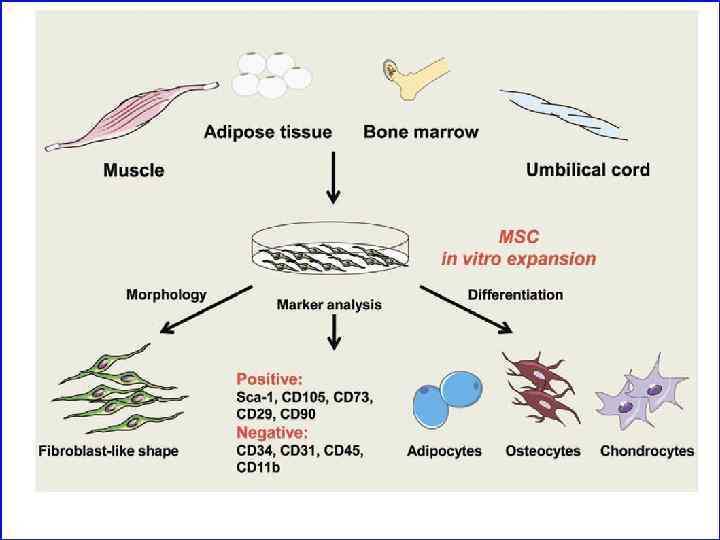
 Фенотипические характеристики ММСК На поверхности клеток экспрессированы не специфические маркеры: • CD 105 (SH 2 или эндолгин - отвечает за связывание с TGF-b 1) • CD 73 (SH 3 и SH 4 –эктонуклеотидазы, утилизация нуклеозидов) • CD 90 (Thy 1 отвечает за дифференцировку) • CD 166 (активированная молекула адгезии лейкоцитов) • CD 44 • CD 29 ( интегрин b 1 - рецептор для VCAM 1) • СD 146 (отвечает за адгезию) • CD 271 (TNF рецептор – семейство) • • • На поверхности не экспрессированы маркеры кроветворных клеток: CD 45 (общий пан лейкоцитарный антиген) CD 31 (PECAM 1 отвечает за адгезию и является рецептором к CD 38) CD 14 (рецептор к LPS на моноцитах и макрофагах) CD 11 b (Мас 1, интегрин a. M)
Фенотипические характеристики ММСК На поверхности клеток экспрессированы не специфические маркеры: • CD 105 (SH 2 или эндолгин - отвечает за связывание с TGF-b 1) • CD 73 (SH 3 и SH 4 –эктонуклеотидазы, утилизация нуклеозидов) • CD 90 (Thy 1 отвечает за дифференцировку) • CD 166 (активированная молекула адгезии лейкоцитов) • CD 44 • CD 29 ( интегрин b 1 - рецептор для VCAM 1) • СD 146 (отвечает за адгезию) • CD 271 (TNF рецептор – семейство) • • • На поверхности не экспрессированы маркеры кроветворных клеток: CD 45 (общий пан лейкоцитарный антиген) CD 31 (PECAM 1 отвечает за адгезию и является рецептором к CD 38) CD 14 (рецептор к LPS на моноцитах и макрофагах) CD 11 b (Мас 1, интегрин a. M)
 Мезенхимные стволовые клетки (МСК) МСК пролиферация Пролиферация Хондрогенез Миогенез Строма Км Сухожилиегенез Другие Коммитирование Транзиторные остеобласты Транзиторные хондроциты Миобласты Линейная диференцировка Остеобласт Хондроциты Транзиторные стромальные клетки Транзиторные фибробласты Слияние миобластов Дифференцировка Созревание Остеоцит Хондроцит Мышечное волокно Кость Хрящ Мышцы Клетки стромы Фибробласты Строма КМ Сухожилия Адипоциты, дермальные и другие клетки Соединительная ткань Остеогенез Косный мозг/периост Мезенхимные дифференцировки Соединительная ткань
Мезенхимные стволовые клетки (МСК) МСК пролиферация Пролиферация Хондрогенез Миогенез Строма Км Сухожилиегенез Другие Коммитирование Транзиторные остеобласты Транзиторные хондроциты Миобласты Линейная диференцировка Остеобласт Хондроциты Транзиторные стромальные клетки Транзиторные фибробласты Слияние миобластов Дифференцировка Созревание Остеоцит Хондроцит Мышечное волокно Кость Хрящ Мышцы Клетки стромы Фибробласты Строма КМ Сухожилия Адипоциты, дермальные и другие клетки Соединительная ткань Остеогенез Косный мозг/периост Мезенхимные дифференцировки Соединительная ткань
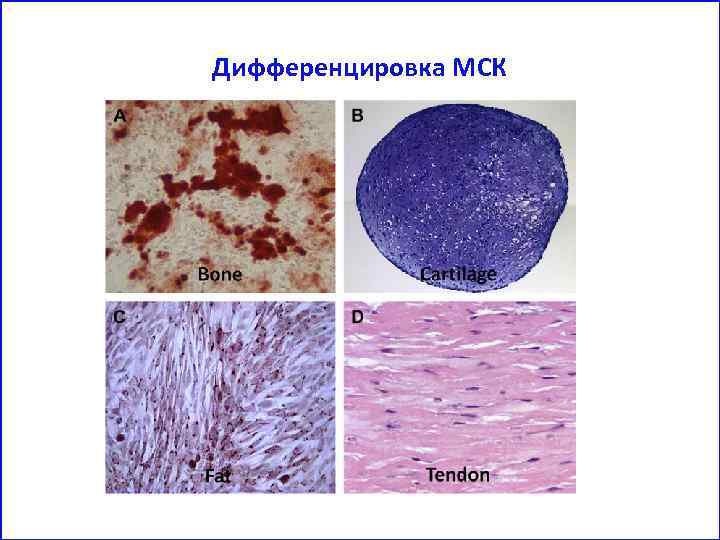 Дифференцировка МСК
Дифференцировка МСК
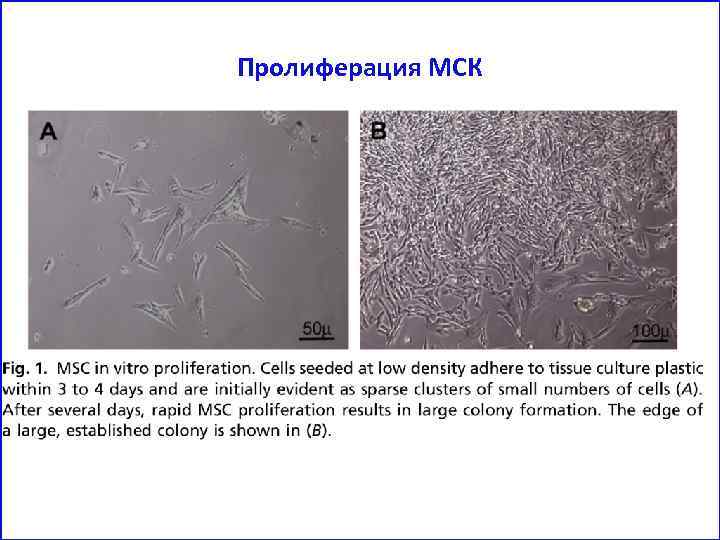 Пролиферация МСК
Пролиферация МСК
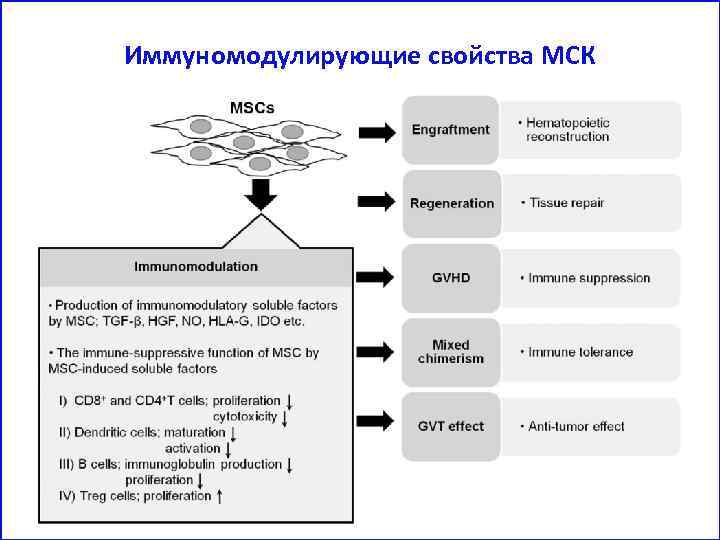 Иммуномодулирующие свойства МСК
Иммуномодулирующие свойства МСК
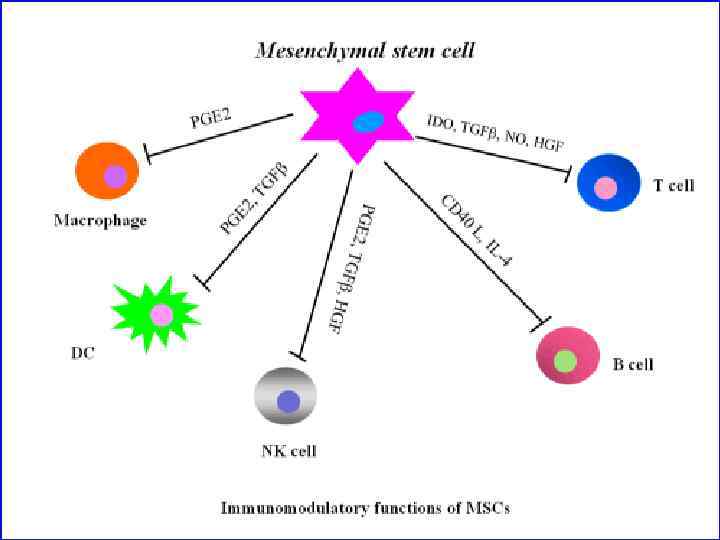
 Молекулы, которые продуцируют МСК
Молекулы, которые продуцируют МСК
 Клиническое применение ММСК
Клиническое применение ММСК
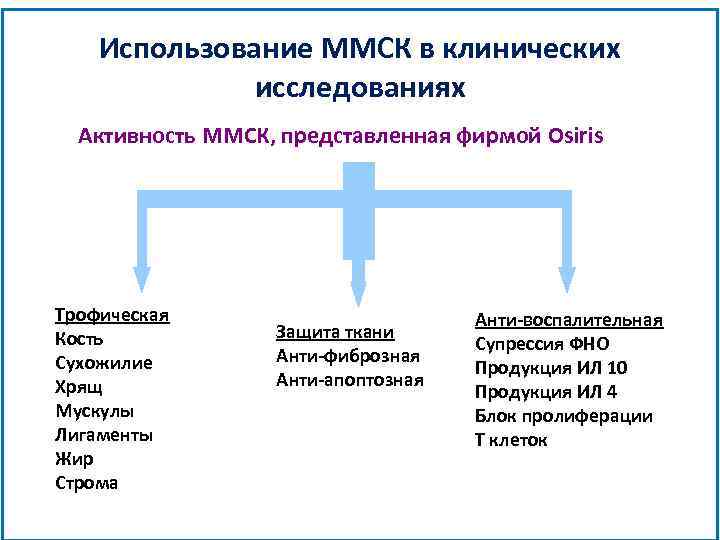 Использование ММСК в клинических исследованиях Активность ММСК, представленная фирмой Osiris Трофическая Кость Сухожилие Хрящ Мускулы Лигаменты Жир Строма Защита ткани Анти-фиброзная Анти-апоптозная Анти-воспалительная Супрессия ФНО Продукция ИЛ 10 Продукция ИЛ 4 Блок пролиферации Т клеток
Использование ММСК в клинических исследованиях Активность ММСК, представленная фирмой Osiris Трофическая Кость Сухожилие Хрящ Мускулы Лигаменты Жир Строма Защита ткани Анти-фиброзная Анти-апоптозная Анти-воспалительная Супрессия ФНО Продукция ИЛ 10 Продукция ИЛ 4 Блок пролиферации Т клеток
 Использование ММСК в клинических исследованиях • Предотвращение и лечение острой и хронической реакции трансплантат против хозяина (РТПХ) • Лечение аутоиммунных заболеваний • Лечение детей с Osteogenesis imperfecta • Регенерация кости и хряща при дегенеративных нарушениях • Восстановление после инфаркта и инсульта
Использование ММСК в клинических исследованиях • Предотвращение и лечение острой и хронической реакции трансплантат против хозяина (РТПХ) • Лечение аутоиммунных заболеваний • Лечение детей с Osteogenesis imperfecta • Регенерация кости и хряща при дегенеративных нарушениях • Восстановление после инфаркта и инсульта
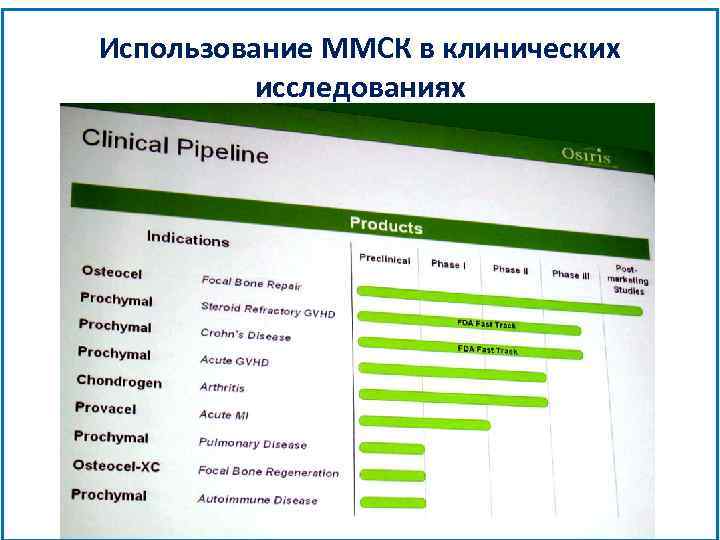 Использование ММСК в клинических исследованиях
Использование ММСК в клинических исследованиях
 Клиническое применение МСК • В 2011 году на сайте http: //clinicaltrials. gov было опубликовано 123 клинических протокола с использованием МСК для терапии различных заболеваний. • В 2015 году на сайте http: //clinicaltrials. gov 4604 клинических протокола.
Клиническое применение МСК • В 2011 году на сайте http: //clinicaltrials. gov было опубликовано 123 клинических протокола с использованием МСК для терапии различных заболеваний. • В 2015 году на сайте http: //clinicaltrials. gov 4604 клинических протокола.
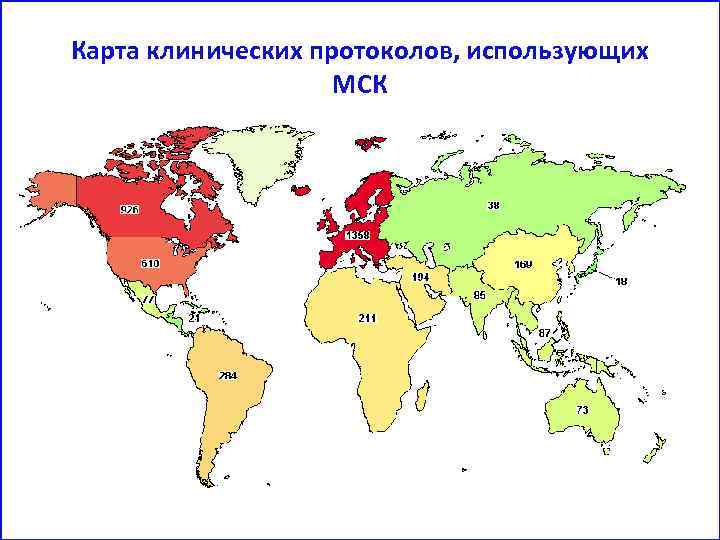 Карта клинических протоколов, использующих МСК
Карта клинических протоколов, использующих МСК
 Клиническое применение иммуномодулирующих свойств МСК • рассеянного склероза • болезни Крона • системной красной волчанки • склеродермии • острая почечная недостаточность • реакции трансплантат против хозяина (РТПХ)
Клиническое применение иммуномодулирующих свойств МСК • рассеянного склероза • болезни Крона • системной красной волчанки • склеродермии • острая почечная недостаточность • реакции трансплантат против хозяина (РТПХ)
 Мультипотентные мезенхимные стромальные клетки (ММСК) человека Способны ли ММСК к самоподдержанию, т. е. обладают ли очень высоким пролиферативным потенциалом до настоящего времени не показано. Существует ли иерархия в популяции ММСК?
Мультипотентные мезенхимные стромальные клетки (ММСК) человека Способны ли ММСК к самоподдержанию, т. е. обладают ли очень высоким пролиферативным потенциалом до настоящего времени не показано. Существует ли иерархия в популяции ММСК?
 Мультипотентные мезенхимные стромальные клетки (ММСК) человека Для того, чтобы попытаться ответить на эти очень важные вопросы необходимо попробовать изучить популяцию на уровне единичных клеток. ММСК необходимо индивидуально маркировать, клонировать и изучить их пролиферативный потенциал и разнообразие клонов.
Мультипотентные мезенхимные стромальные клетки (ММСК) человека Для того, чтобы попытаться ответить на эти очень важные вопросы необходимо попробовать изучить популяцию на уровне единичных клеток. ММСК необходимо индивидуально маркировать, клонировать и изучить их пролиферативный потенциал и разнообразие клонов.
 Мультипотентные мезенхимные стромальные клетки (ММСК) человека В работе использовали ММСК, полученные из костного мозга доноров. Все образцы костного мозга были получены во время эксфузии донорского костного мозга для аллогенной трансплантации в отделении высокодозной химиотерапии гемобластозов и трансплантации костного мозга ФБГУ ГНЦ после подписания донорами информированного согласия.
Мультипотентные мезенхимные стромальные клетки (ММСК) человека В работе использовали ММСК, полученные из костного мозга доноров. Все образцы костного мозга были получены во время эксфузии донорского костного мозга для аллогенной трансплантации в отделении высокодозной химиотерапии гемобластозов и трансплантации костного мозга ФБГУ ГНЦ после подписания донорами информированного согласия.
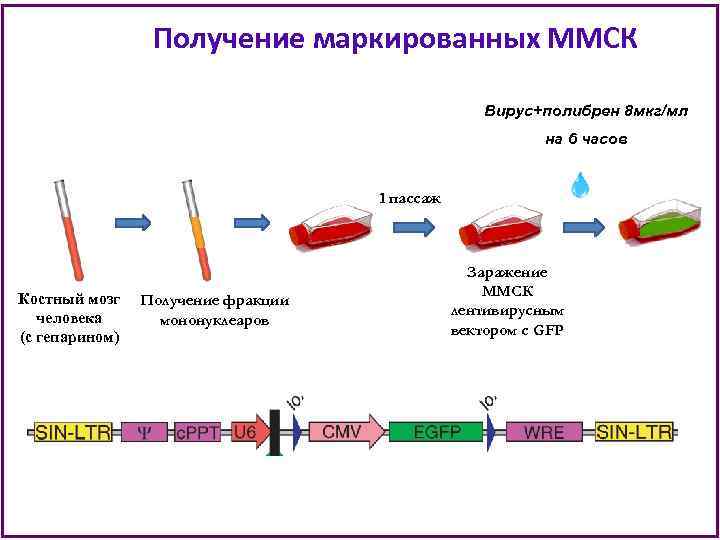 Получение маркированных ММСК Вирус+полибрен 8 мкг/мл на 6 часов 1 пассаж Костный мозг Получение фракции человека мононуклеаров (с гепарином) Заражение ММСК лентивирусным вектором с GFP
Получение маркированных ММСК Вирус+полибрен 8 мкг/мл на 6 часов 1 пассаж Костный мозг Получение фракции человека мононуклеаров (с гепарином) Заражение ММСК лентивирусным вектором с GFP
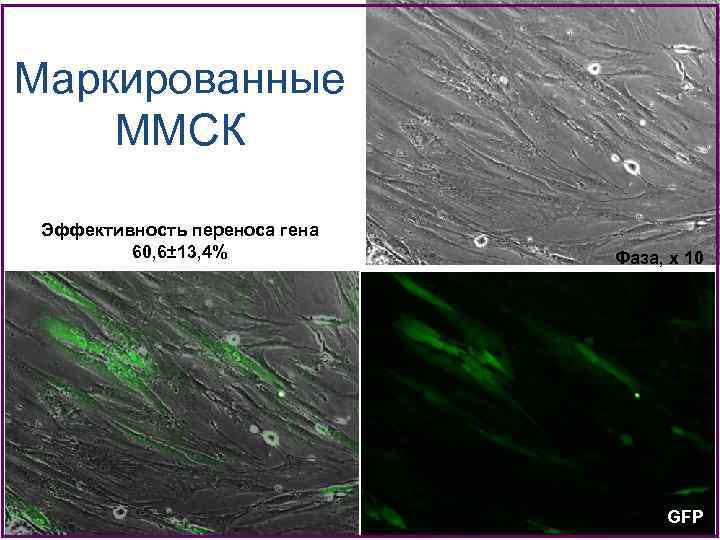 Маркированные ММСК Эффективность переноса гена 60, 6± 13, 4% Фаза, х 10 GFP
Маркированные ММСК Эффективность переноса гена 60, 6± 13, 4% Фаза, х 10 GFP
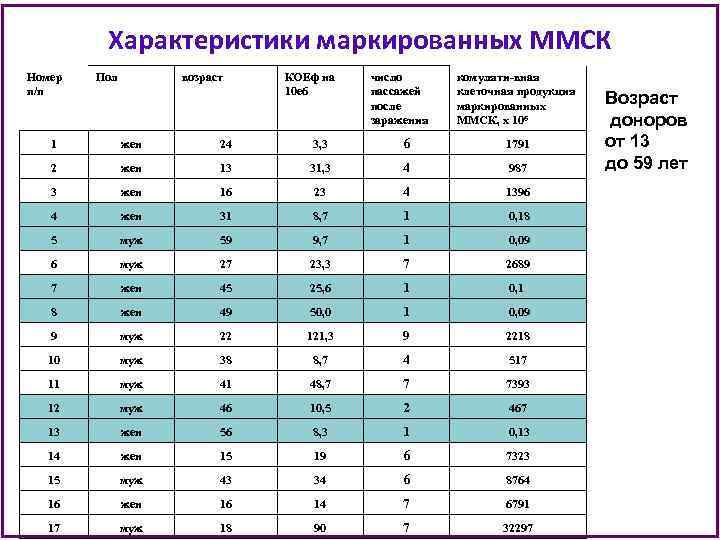 Характеристики маркированных ММСК Номер п/п Пол возраст КОЕф на 10 е 6 число пассажей после заражения комуляти-вная клеточная продукция маркированных ММСК, х 106 1 жен 24 3, 3 6 1791 2 жен 13 31, 3 4 987 3 жен 16 23 4 1396 4 жен 31 8, 7 1 0, 18 5 муж 59 9, 7 1 0, 09 6 муж 27 23, 3 7 2689 7 жен 45 25, 6 1 0, 1 8 жен 49 50, 0 1 0, 09 9 муж 22 121, 3 9 2218 10 муж 38 8, 7 4 517 11 муж 41 48, 7 7 7393 12 муж 46 10, 5 2 467 13 жен 56 8, 3 1 0, 13 14 жен 15 19 6 7323 15 муж 43 34 6 8764 16 жен 16 14 7 6791 17 муж 18 90 7 32297 Возраст доноров от 13 до 59 лет
Характеристики маркированных ММСК Номер п/п Пол возраст КОЕф на 10 е 6 число пассажей после заражения комуляти-вная клеточная продукция маркированных ММСК, х 106 1 жен 24 3, 3 6 1791 2 жен 13 31, 3 4 987 3 жен 16 23 4 1396 4 жен 31 8, 7 1 0, 18 5 муж 59 9, 7 1 0, 09 6 муж 27 23, 3 7 2689 7 жен 45 25, 6 1 0, 1 8 жен 49 50, 0 1 0, 09 9 муж 22 121, 3 9 2218 10 муж 38 8, 7 4 517 11 муж 41 48, 7 7 7393 12 муж 46 10, 5 2 467 13 жен 56 8, 3 1 0, 13 14 жен 15 19 6 7323 15 муж 43 34 6 8764 16 жен 16 14 7 6791 17 муж 18 90 7 32297 Возраст доноров от 13 до 59 лет
 Характеристики маркированных ММСК • После заражения ММСК можно разделить на 2 группы: • группа 1, в которой ММСК прошли 1 -2 пассажа и более не пролиферировали и • группа 2, где ММСК прошли более 4 пассажей. Возраст доноров в первой группе был 47, 7± 4, 0, а во второй 24, 8 ± 3, 3 лет (Р=0, 001). Таким образом, даже на примере такой небольшой выборки видно, что стрессовое воздействие выявляет снижение пролиферативного потенциала ММСК доноров с возрастом.
Характеристики маркированных ММСК • После заражения ММСК можно разделить на 2 группы: • группа 1, в которой ММСК прошли 1 -2 пассажа и более не пролиферировали и • группа 2, где ММСК прошли более 4 пассажей. Возраст доноров в первой группе был 47, 7± 4, 0, а во второй 24, 8 ± 3, 3 лет (Р=0, 001). Таким образом, даже на примере такой небольшой выборки видно, что стрессовое воздействие выявляет снижение пролиферативного потенциала ММСК доноров с возрастом.
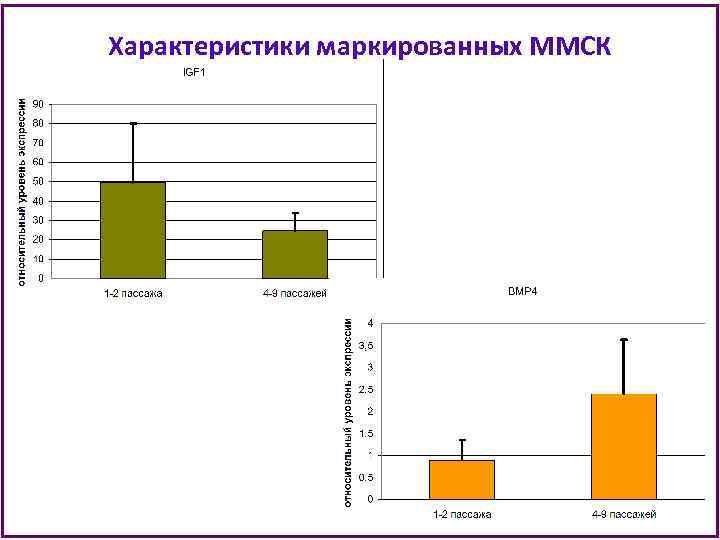 Характеристики маркированных ММСК
Характеристики маркированных ММСК
 Характеристики ММСК • Эта часть работы показала, что ММСК представляют собой популяцию клеток, различающихся по своим ростовым характеристикам, которые отчетливо выявляются после стресса. В данном случае переносе маркерного гена с помощью лентивирусного вектора. Истинные МСК мыши (и от старых, и от молодых животных) были способны к «самоподдрежанию» и выдерживали как минимум 4 «стрессовых» переноса кроветворного микроокружения.
Характеристики ММСК • Эта часть работы показала, что ММСК представляют собой популяцию клеток, различающихся по своим ростовым характеристикам, которые отчетливо выявляются после стресса. В данном случае переносе маркерного гена с помощью лентивирусного вектора. Истинные МСК мыши (и от старых, и от молодых животных) были способны к «самоподдрежанию» и выдерживали как минимум 4 «стрессовых» переноса кроветворного микроокружения.
 Характеристики ММСК Как ведут себя маркированные ММСК при длительном культивировании?
Характеристики ММСК Как ведут себя маркированные ММСК при длительном культивировании?
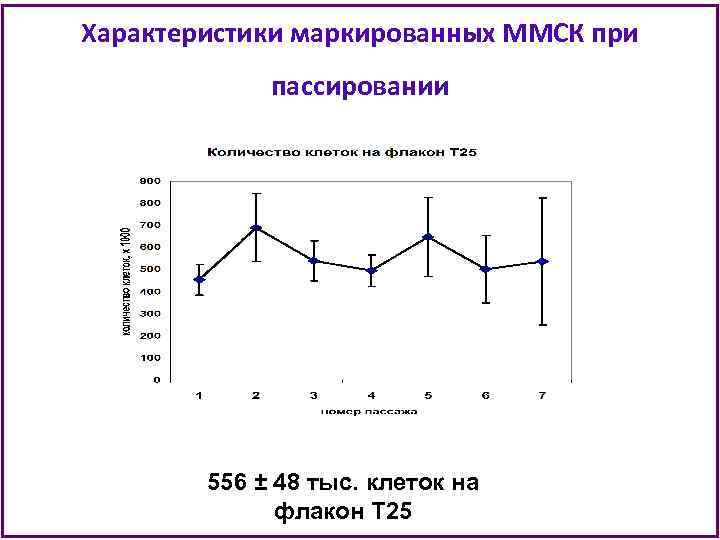 Характеристики маркированных ММСК при пассировании 556 ± 48 тыс. клеток на флакон Т 25
Характеристики маркированных ММСК при пассировании 556 ± 48 тыс. клеток на флакон Т 25
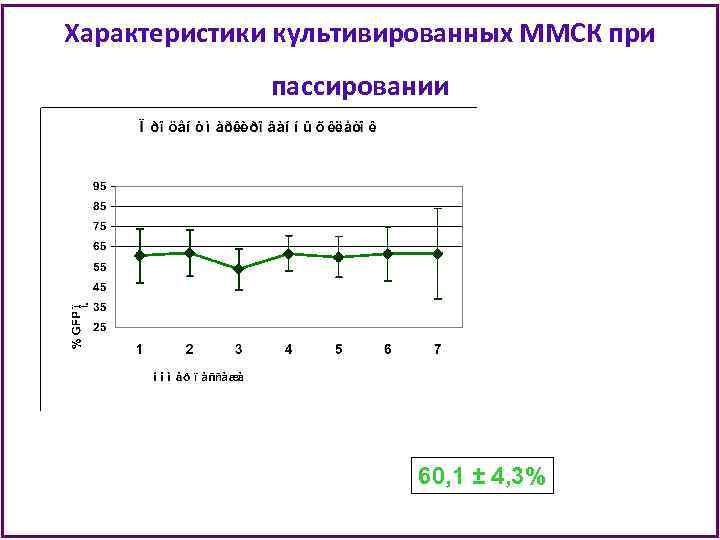 Характеристики культивированных ММСК при пассировании 60, 1 ± 4, 3%
Характеристики культивированных ММСК при пассировании 60, 1 ± 4, 3%
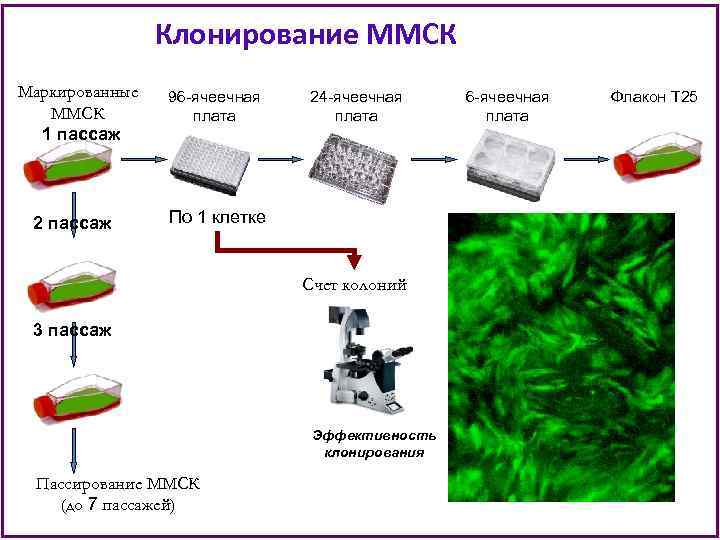 Клонирование ММСК Маркированные ММСК 1 пассаж 2 пассаж 96 -ячеечная плата 24 -ячеечная плата По 1 клетке Счет колоний 3 пассаж Эффективность клонирования Пассирование ММСК (до 7 пассажей) 6 -ячеечная плата Флакон Т 25
Клонирование ММСК Маркированные ММСК 1 пассаж 2 пассаж 96 -ячеечная плата 24 -ячеечная плата По 1 клетке Счет колоний 3 пассаж Эффективность клонирования Пассирование ММСК (до 7 пассажей) 6 -ячеечная плата Флакон Т 25
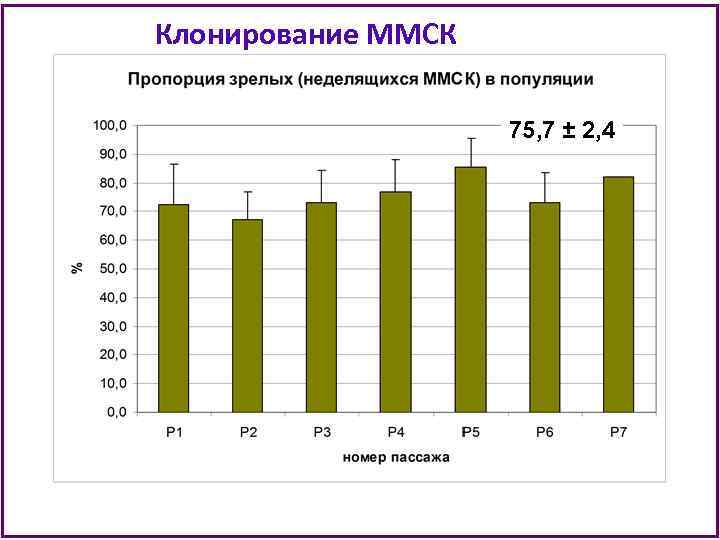 Клонирование ММСК 75, 7 ± 2, 4
Клонирование ММСК 75, 7 ± 2, 4
 Выделение популяций ММСК 96 -ячеечная плата Количество митозов Пролиферативный потенциал 11 ± 0, 3 24 -ячеечная плата 14 ± 0, 3 6 -ячеечная плата Низкий НПП 16 ± 0, 3 Флакон Т 25 Высокий ВПП 18 ± 0, 1 Различия относительны – от 3 до 7 делений
Выделение популяций ММСК 96 -ячеечная плата Количество митозов Пролиферативный потенциал 11 ± 0, 3 24 -ячеечная плата 14 ± 0, 3 6 -ячеечная плата Низкий НПП 16 ± 0, 3 Флакон Т 25 Высокий ВПП 18 ± 0, 1 Различия относительны – от 3 до 7 делений
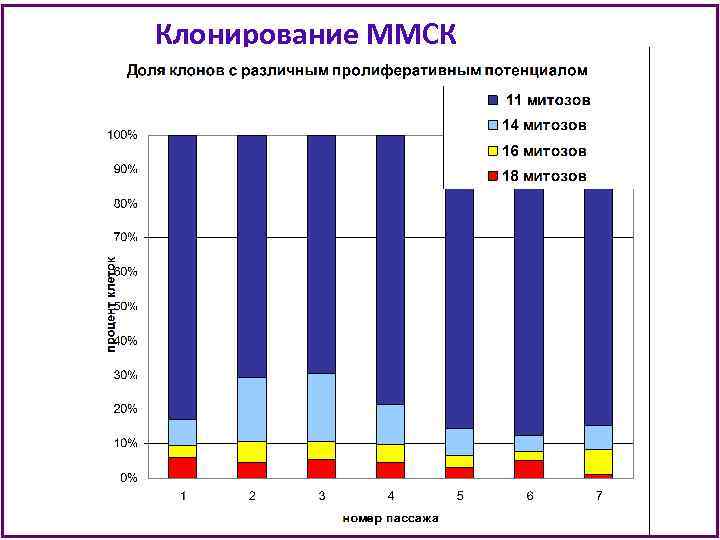 Клонирование ММСК
Клонирование ММСК
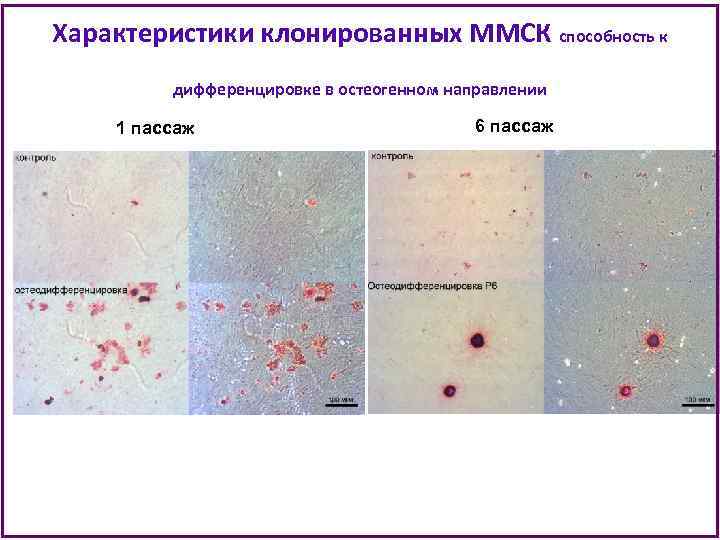 Характеристики клонированных ММСК способность к дифференцировке в остеогенном направлении 1 пассаж 6 пассаж
Характеристики клонированных ММСК способность к дифференцировке в остеогенном направлении 1 пассаж 6 пассаж
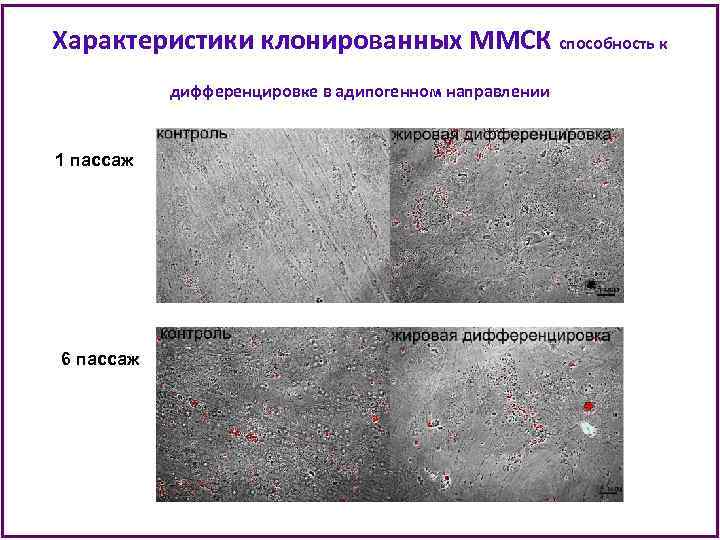 Характеристики клонированных ММСК способность к дифференцировке в адипогенном направлении 1 пассаж 6 пассаж
Характеристики клонированных ММСК способность к дифференцировке в адипогенном направлении 1 пассаж 6 пассаж
 Иерархия в популяции ММСК 1. с очень высоким ПП (проделывают 18 митозов и более); 2. со средним ПП (проделывают 17 митозов); 3. с относительно низким ПП (проделывают 15 митозов); 4. с низким ПП (проделывают менее 12 митозов); 5. зрелые клетки, неспособные образовывать клон.
Иерархия в популяции ММСК 1. с очень высоким ПП (проделывают 18 митозов и более); 2. со средним ПП (проделывают 17 митозов); 3. с относительно низким ПП (проделывают 15 митозов); 4. с низким ПП (проделывают менее 12 митозов); 5. зрелые клетки, неспособные образовывать клон.
 Клональный состав ММСК Как можно различить полученные клоны ММСК? • Для этого необходимо определить места встраивания лентивирусного вектора, содержащего ген зеленого белка (GFP) в геном ММСК. • Лучший способ это выявить – метод Саузерн блот гибридизации. • Так клоны гетерогенны по пролиферативному потенциалу, в наших условиях не удается получить достаточное количество клеток. • В связи с этим необходимо использовать метод определения сайтов интеграции, требующий небольшого количества ДНК. • Таким методом является LM-PCR (Ligation mediated polymerase chain reaction).
Клональный состав ММСК Как можно различить полученные клоны ММСК? • Для этого необходимо определить места встраивания лентивирусного вектора, содержащего ген зеленого белка (GFP) в геном ММСК. • Лучший способ это выявить – метод Саузерн блот гибридизации. • Так клоны гетерогенны по пролиферативному потенциалу, в наших условиях не удается получить достаточное количество клеток. • В связи с этим необходимо использовать метод определения сайтов интеграции, требующий небольшого количества ДНК. • Таким методом является LM-PCR (Ligation mediated polymerase chain reaction).
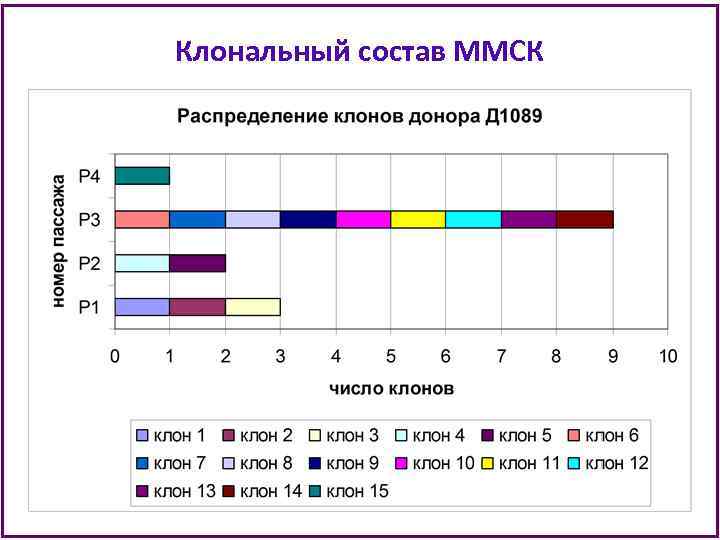 Клональный состав ММСК
Клональный состав ММСК
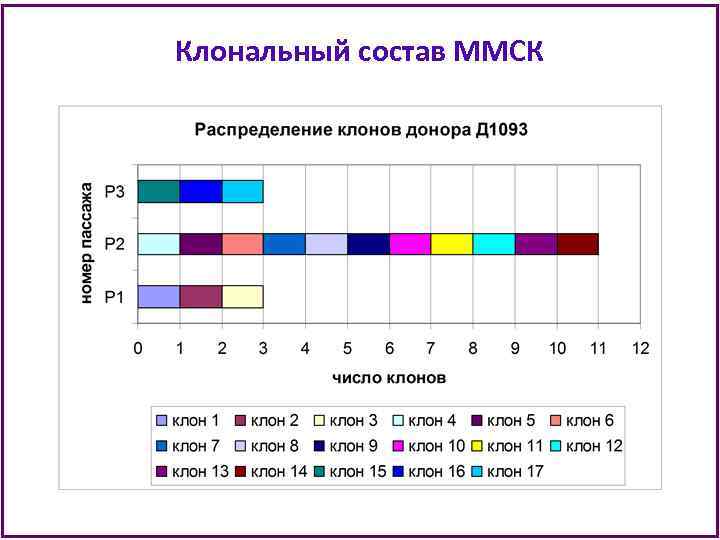 Клональный состав ММСК
Клональный состав ММСК
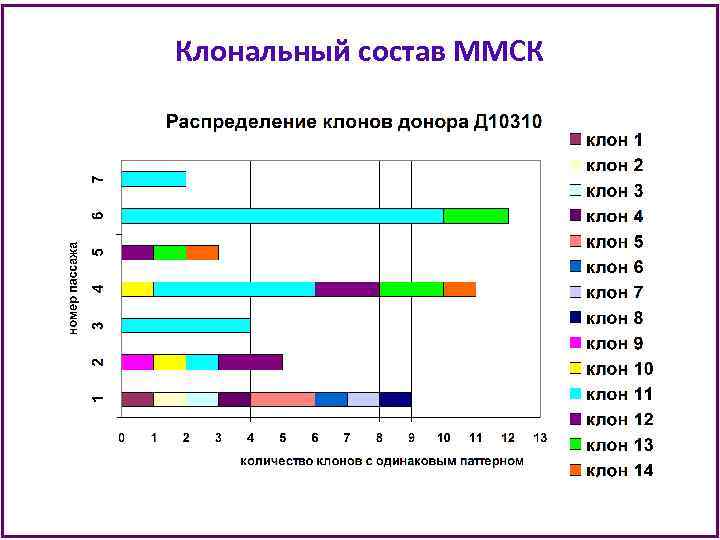 Клональный состав ММСК
Клональный состав ММСК
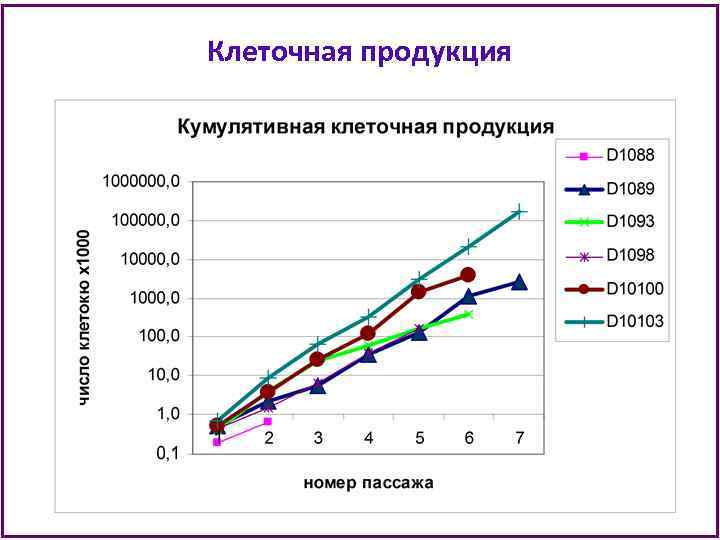 Клеточная продукция
Клеточная продукция
 Клональный состав ММСК • В анализ при клонировании попадает примерно 1/3000 часть ММСК из флакона Т 25 на каждом пассаже (из 500 тыс клеток клонируют 180 -240 клеток). • Можно предполагать, что увеличенная в несколько раз клеточная продукция ММСК донора Д 10103 объясняется наличием доминантных клонов с очень высоким пролиферативным потенциалом. • Культура ММСК Д 10103 истощила пролиферативный потенциал к 8 пассажу и не утратила способности к дифференцировкам в процессе культивирования. • Можно заключить, что иммортализации клеток не произошло и среди ММСК этого донора были клетки, наиболее близкие по своим характеристикам к стволовым.
Клональный состав ММСК • В анализ при клонировании попадает примерно 1/3000 часть ММСК из флакона Т 25 на каждом пассаже (из 500 тыс клеток клонируют 180 -240 клеток). • Можно предполагать, что увеличенная в несколько раз клеточная продукция ММСК донора Д 10103 объясняется наличием доминантных клонов с очень высоким пролиферативным потенциалом. • Культура ММСК Д 10103 истощила пролиферативный потенциал к 8 пассажу и не утратила способности к дифференцировкам в процессе культивирования. • Можно заключить, что иммортализации клеток не произошло и среди ММСК этого донора были клетки, наиболее близкие по своим характеристикам к стволовым.
 Клональный состав ММСК В костном мозге мыши содержится 500 х106 ядерных клеток из них 95% кроветворных. Мышь весит 25 -30 грамм, т. е. примерно 20 х106 на грамм веса, а не кроветворных всего 106 В костном мозге человека, весом 70 кг содержится 1. 4 х 1012 ядерных клеток из них не кроветворных 7 х1011. Для получения ММСК используется 1/106 часть костного мозга, из которой не более 5% ( 1, 5 х105) клеток являются не кроветворными. Таким образом, вероятность попадания мезенхимных стволовых клеток в образец невелика, и большинство культур ММСК не содержат истинно стволовых клеток.
Клональный состав ММСК В костном мозге мыши содержится 500 х106 ядерных клеток из них 95% кроветворных. Мышь весит 25 -30 грамм, т. е. примерно 20 х106 на грамм веса, а не кроветворных всего 106 В костном мозге человека, весом 70 кг содержится 1. 4 х 1012 ядерных клеток из них не кроветворных 7 х1011. Для получения ММСК используется 1/106 часть костного мозга, из которой не более 5% ( 1, 5 х105) клеток являются не кроветворными. Таким образом, вероятность попадания мезенхимных стволовых клеток в образец невелика, и большинство культур ММСК не содержат истинно стволовых клеток.
 Выводы • Популяция ММСК является гетерогенной и состоит из множества короткоживущих клонов, сменяющих друга в процессе культивирования, и обладающих различным пролиферативным потенциалом. • Клоны с очень высоким, но лимитированным пролиферативным потенциалом встречаются крайне редко, что можно объяснить низкой концентрацией мезенхимных стволовых клеток в костном мозге человека.
Выводы • Популяция ММСК является гетерогенной и состоит из множества короткоживущих клонов, сменяющих друга в процессе культивирования, и обладающих различным пролиферативным потенциалом. • Клоны с очень высоким, но лимитированным пролиферативным потенциалом встречаются крайне редко, что можно объяснить низкой концентрацией мезенхимных стволовых клеток в костном мозге человека.
 Выводы В целом популяция ММСК, изученная на уровне единичных клеток не отвечает критерию «стволовых клеток» , т. е. ММСК способны к дифференцировке, но не обладают способностью к самоподдержанию.
Выводы В целом популяция ММСК, изученная на уровне единичных клеток не отвечает критерию «стволовых клеток» , т. е. ММСК способны к дифференцировке, но не обладают способностью к самоподдержанию.
 Авторы работы • • • Бигильдеев Алексей Евгеньевич Жиронкина Оксана Николаевна Сац Наталья Владимировна Шипунова Ирина Николаевна Свинарева Дарья Анатольевна Петинати Наталья Арнольдовна
Авторы работы • • • Бигильдеев Алексей Евгеньевич Жиронкина Оксана Николаевна Сац Наталья Владимировна Шипунова Ирина Николаевна Свинарева Дарья Анатольевна Петинати Наталья Арнольдовна


