Студн. сердце.ppt
- Количество слайдов: 161

Физиология кровообращения физиология сердца

Цель: Изучить клеточные механизмы электрической и сократительной активности клеток сердца. Мотивация: Понять механизмы определяющие сердце – как генератор электрической и сократительной активности в организме.

План: 1. История изучения сердечно-сосудистой системы 2. Функции сердца 3. Электрофизиологические свойства и особенности атипических кардиомиоцитов и сократительного миокарда 4 Проведение возбуждения по сердцу 5. Электромеханическое сопряжение 6. Физиологические свойства и особенности сердца

ВЕХИ ИСТОРИИ VII в. до н. э — II в. н. э. — Гиппократ, Эразистрат, Аристотель (Древняя Греция), К. Гален (С. Galenus Древний Рим) создали учение о кровообращении, согласно которому кровь зарождалась в печени, двигалась по сосудам от сердца к тканям и там исчезала. Различие между артериями и венами не было известно. Предполагалось наличие сообщения между правой и левой половинами сердца. Эти представления оставались догмой в течение последующих 1500 лет. XIII в. — Ибн Нафис (Ibnul—Nafiess, Арабский Восток) описал легочный кровоток и правильно понял его назначение Отверг представление о сообщении между правой и левой половинами сердца. XV в. — Леонардо да Винчи (Leonardo da Vinci, Италия) описал четыре камеры сердца, атриовентрикулярные клапаны, их сухожильные хорды и сосочковые мышцы. XVI в. — М. Сервет (М. Servet, Испания) повторно открыл существование малого круга кровообращения. 1628 – У. Гарвей (W. Harvey, Англия) в трактате «Анатомические исследования о движении сердца и крови у животных» описал большой и малый круги кровообращения и объяснил их функции. 1661 — М. Мальпиги (М. Malpighi, Италия) открыл существование капилляров. 1842 — А. П. Вальтер (Россия) открыл влияние симпатических нервов на просвет кровеносных сосудов.

1845 — Я. Пуркинье (Пуркине) (J. Purkinje, Чехия) описал специфические мышечные волокна, проводящие возбуждение по сердцу (волокна Пуркинье), положил начало изучению проводящей системы сердца. 1845 — Братья Эд. и Эр. Г. Веберы (Ed. Weber, Er. H. Weber, Германия) обнаружили торможение сердца вплоть до полной его остановки в диастоле при раздражении блуждающих нервов. 1843— 1860 — К. Людвиг (К. Ludwig, Германия) установил наличие в продолговатом мозгу сосудодвигательного центра. Разработал метод графической регистрации кровяного давления на кимографе изобрел прибор для измерения скорости движения крови по сосудам (часы Людвига) Первым предложил метод перфузии для поддержания функций изолированных органов животных. В 1866 г. обнаружил центростремительный нерв—депрессор (чувствительные волокна, идущие от барорецепторов сосудов в составе блуждающего нерва). 1852 — К. Бернар (К. Bernard, Франция) описал роль симпатической нервной системы в регуляции просвета сосудов. 1867 — И. Ф. Цион (Россия) описал учащение сердечной деятельности при раздражении симпатических нервов сердца (положительный хронотропный эффект). 1871 — Ф. В. Овсянников (Россия) открыл сосудодвигательный центр и описал его локализацию в продолговатом мозгу. 1871 — Г. Боудич (Н. Bowditch, США) обнаружил постепенное достижение максимальной амплитуды сокращений сердца при последовательных раздражениях одинаковой силы ( «лестница Боудича» ).

1880 — Г. Станниус (Н. Stannius, Германия) показал убывание степени автоматии проводящей системы сердца лягушки— градиент автоматии. 1893 — В. Гис (W. His, Германия) обнаружил предсердно—желудочковый пучок (пучок Гиса). 1895 — О. Франк (О. Frank, Германия), Э. Старлинг (Е. Starling, Великобритания) открыли физиологический закон, согласно которому сила сокращения волокон миокарда пропорциональна первоначальной длине перед началом сокращения ( «закон сердца» , или закон Франка—Старлинга). 1906 — Л. Ашофф (L. Ashoff, Германия) и С. Тавара (S. Tawara, Япония) описали предсердно—желудочковый узел (узел Ашоффа—Тавары). 1907 — А. Кис и М. Флек (A. Keith, M. Flack, Великобритания) обнаружили синусно— предсердный узел (узел Киса—Флека) — водитель ритма сердца. 1916—Дж. Бахман (J. Bachman, США) открыл пучок волокон, соединяющий миокард обоих. предсердий (пучок Бахмана). 1921— 1936 — О. Леви (О. Loewi, Австрия) установил, что при раздражении симпатического или блуждающего нервов изолированного сердца лягушки в перфузате появляются вещества, оказывающие соответственно симпатический или парасимпатический эффекты. В 1936 г. вместе с Г. Дейлом (Н. Dale, Великобритания) удостоен Нобелевской премии «за открытия, связанные с химической передачей нервных импульсов» . 1923 — Г. Геринг (Н. Hering, Германия) описал рефлексогенную зону в области разветвления общей сонной артерии. 1967 — К. Барнард (Ch. Barnard, ЮАР) впервые пересадил больному сердце погибшего человека.

Кровообращение млекопитающих (А) и распределение крови в сосудах различного типа (Б) 1 — капилляры головы, 2 — легочная вена, 3 — дуга аорты, 4 — левое предсердие, 5 —левый желудочек, 6 — брюшная аорта, 7 — капилляры большого круга, 8 — кишечная артерия, 9 — воротная вена, 10 — печеночная вена, 11 — правый желудочек, 12 — правое предсердие, 13 — легочная артерия, 14 — капилляры, 15 — русло емкостных сосудов, 16 — русло резистивных сосудов, 17 — ткани, 18 — русло обменных сосудов.

Функции сердца: 1. 2. 3. 4. Резервуарная Насосная Распределительная Эндокринная

Внешний вид сердца, его главных артерий (А) и вен (Б) 1 — левая общая сонная артерия, 2 — левая подключичная артерия, 3 — левое предсердие, 4 — левая венечная артерия, 5 — огибающая ветвь левой венечной артерии, 6 — передняя нисходящая ветвь венечной артерии, 7 — задняя нисходящая ветвь левой венечной артерии. 8 — правая венечная артерия, 9 — ушко правого предсердия, 10 — легочный ствол, 11 — верхняя полая вена, 12 — аорта, 13 — плечеголовной ствол, 14 — большая вена сердца, 15 — средняя вена сердца, 16 — малая вена сердца, 17 — передняя вена сердца, 18 — венечный синус (впадает в правое предсердие), 19 — правое предсердие (оттянуто)


Клапанный аппарат сердца 1 — клапан аорты 2 — правый предсердно— желудочковый (трехстворчатый) клапан. 3 — левый предсердно— желудочковый (митральный, двухстворчатый) клапан 4 — клапан легочного ствола (артерии)

Внутреннее строение сердца Видны клапаны и места впадения и выхода основных артерий и вен. 1 — плечеголовной ствол, 2 — левая общая сонная артерия, 3 — левая подключичная артерия, 4 — аорта, 5 — ветви левой легочной артерии, 6 — левые легочные вены, 7 — левое предсердие, 8 — двустворчатый (левый атриовентрикулярный) клапан, 9 — аортальный полулунный клапан, 10— левый желудочек, 11 — межжелудочковая перегородка, 12 — верхушка сердца, 13 — нисходящая аорта, 14 — правый желудочек, 15 — сосочковая мышца, 16 — нижняя полая вена, 17 — сухожильные нити, 18 — трехстворчатый (правый атриовентрикулярный) клапан, 19— правое предсердие, 20 — полулунный клапан легочной артерии, 21 — правые легочные вены, 22— ветви правой легочной артерии, 23 — верхняя полая вена.

СВОЙСТВА МИОКАРДА • • АВТОМАТИЯ ВОЗБУДИМОСТЬ ПРОВОДИМОСТЬ СОКРАТИМОСТЬ


Рис 1. Схематическое изображение обобщенной модели ионно мембранных транспортных систем клеток сердца (по Luo Ridy, 1991 г. ). INa – быстрый натриевый ток, потенциало зависимых натриевых каналов (Nav); ICa(L) – кальциевый ток L типа кальциевых каналов (Cav. L); ICa(T) – кальциевый ток Т типа кальциевых каналов (Cav. T); IKr – быстрый (от англ. rapid) выходящий калиевый ток задержанного выпрямления; I s – медленный (от англ. slow) выходящий калиевый ток задержанный выпрямления; K Ito – кратковременный выходящий калиевый ток (от англ. transient); IK 1 – входящий калиевый ток аномального выпрямления (внутрь направленного выпрямления, от англ. inward rectifier); IK(АТФ) – АТФ – зависимый калиевый ток; IKp – калиевый ток плато потенциала действия; IK(Na) – натрий активируемый калиевый ток (возникает в условиях внутриклеточной перегрузки ионами натрия); Ins(Ca) – неспецифический кальций активированный ток (возникает в условиях кальциевой перегрузки); INa, b – возвратный натриевый ток; ICa, b – возвратный кальциевый ток; INa. K – ток натрий калиевого насоса; INa. Ca – ток натрий кальциевого обменника; Ip(Ca) – ток кальциевого насоса сарколеммы; Irel – освобождение ионов кальция из Т цистерн саркоплазматического ретикулума (СПР); Iup – захват ионов кальция из миоплазмы в систему продольного СПР кальциевым насосом; Ileak – утечка ионов кальция из продольного СПР; Itr – перенос ионов кальция из продольного в терминальные отделы СПР; Кальмодулин и тропонин являются основными кальций связывающими белками миоплазмы, а кальсеквестрин – кальциевым буфером в СПР.

Табл. Основные типы кардиомиоцитов млекопитающих и их свойства Морфофункциональная характеристика P Клетки Основная локализация Электрофизиологиче ская характеристика Максимальный диа столический потен циал (м. В) Сократительные кардиомиоциты Проводящие СА узел АВ узел Клетки с медленным ответом 60÷ 50 70÷ 60 60— 70 0 10 100 300 1— 10 до 0, 05 70— 80 5— 15 100— 300 5— 20 0, 1 60— 80 40— 60 Клетки Пуркинье Система Гиса— Пуркинье Остальной миокард Клетки с быстрым ответом 95÷ 90 90÷ 80 Параметры потенциа ла действия: амплитуда (м. В) овершут (м. В) длительность (мс) скорость нараста ния фазы 0 (В/с) скорость проведе ния (м/с) Собственная частота импульсации (имп/мин) 100— 120 20— 30 300— 500— 1000 1— 4 20— 40 100— 120 20— 30 200— 300* 100— 300 0, 1— 0, 5** Не обладают автоматией ____ *Длительность потенциала действия в предсердиях – 100− 300 мс. **Скорость проведения в АN зоне атриовентрикулярного соединения около 0, 05 м/с. В пучке Гисса – меньше, чем в волокнах Пуркинье, а в сократительных миоцитах предсердий – меньше, чем в желудочках.

Табл №. 2 Сравнительная характеристика кардиомиоцитов с «быстрым» и «медленным» ответом. Параметр Клетки с быстрым ответом Клетки с медленным ответом Сократительные кардиомиоциты и проводящие волокна предсердий и же лудочков СА узел, АВ соединение; коронарный синус и кла паны Есть только у клеток Пуркинье Есть «Быстрые» Na каналы Есть Нет «Медленные» Са каналы Есть Пороговый потенциал (м. В) 70÷ 60 50÷ 40 Основной ионный ток фа зы 0, его блокатор, скорость активации и инак тивации Na+ Лидокаин Высокая Са 2+ Верапамил Низкая Сравнительные значения МДП и параметров ПД (ско рость нарастания фазы 0, амплитуда, скорость и на дежность проведения) Высокие Низкие Продолжительность реф рактерного периода Примерно равна длитель ности ПД Превышает длительность ПД на 100 мс и более Расположение в сердце МДД и автоматия (фаза 4)

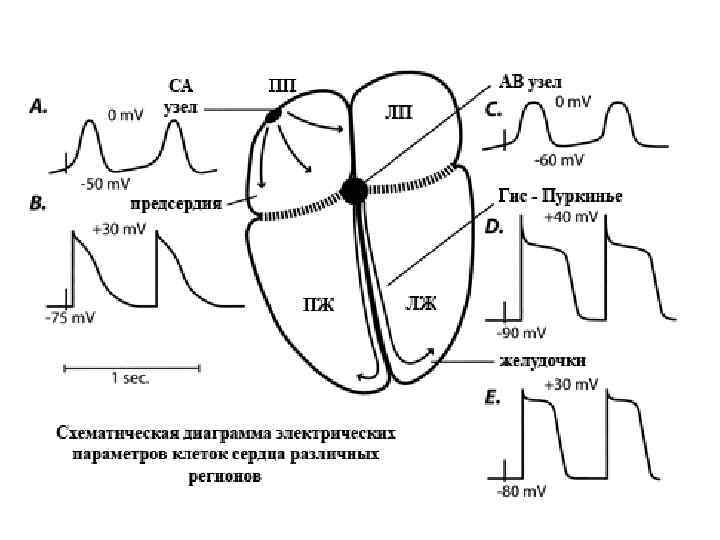
По классификации американского электрофизиолога П. Крейнфилда (1975 г. ) миокардиальные волокна способны генерировать два принципиально различных вида ПД: 1. Быстрые ПД проводящих сердечных миоцитов и рабочего миокарда желудочков и предсердий. 2. Медленные ПД специализированных волокон сердца – синоатриального и атриовентрикулярного узлов. Наличие и свойства различных параметров входящего и выходящего тока мембраны кардиомиоцитов определяют особенности формирования ПД и электрофизиологические параметры клеток с «быстрым» и «медленным» ответом, сравнительная характеристика которых приведена в таблице № 1. Распространение активности и координирование электромеханического функционирования желудочков зависит также от электрического сопряжения между клетками, что опосредуется щелевыми контактами…. Генерация ПД в сердце отражает последовательную активацию и инактивацию ионных каналов, которые приводят к деполяризации (входящие Na+ и Сa 2+) и реполяризации (выходящие К+ токи). Формирование ПД в разных регионах сердца является различным (рис. 1), что в свою очередь связано с различиями в экспрессии и свойствах ионных каналов. Эти различия влияют на однонаправленное распространение возбуждения по сердцу и на генерацию нормального сердечного ритма. Изменение в свойствах или функциональной экспрессии миокардиальных ионных каналов в результате наследственных мутаций в генах, энкодирующих эти каналы или вследствии миокардинальных повреждений, могут привести к изменению формирования ПД, синхронизации и распространению возбуждения, что предполагает возникновение в сердце потенциально угрожающих жизни аритмий. Все это определяет значительный интерес в определении молекулярных, клеточных и системных механизмов влияющих на генерацию и сохранение нормального сердечного ритма, а также в понимании того, как эти механизмы изменяются при заболеваниях миокарда. Электрическая активность сердца инициируется в пейсмекерных клетках синоатриального (СА) узла и затем распространяется через предсердия к атриовентрикулярному (АВ) узлу, от которого по пучку Гиса и волокнам Пуркинье поступает к верхушке сердца и внутрь рабочего миокарда желудочков (рис № 1). В предсердных, желудочковых миоцитах и волокнах Пуркинье развивается «быстрый» ПД в результате активации потенциалозависимых Na+ (Na+V) каналов. Клетки СА и АВ узлов формируют «медленные» ПД, предполагая, что Na+V-каналы не играют доминирующей роли в деполяризации и формировании фазы 0, однако Na+V-токи описаны в клетках СА узла кролика, а также в АВ клетках кролика и морской свинки.

Для «быстрых» ПД характерно наличие фазы 1 – фазы быстрой начальной реполяризации, отражающей инактивацию Na+V-каналов и активацию быстрого потенциалозависимого выходящего К+-тока (Ito, f) (от англ. fast – быстрый, transient – проходящий, outword - выходящий), которая достаточно хорошо выражена в клетках Пуркинье и желудочков, определяя амплитуду и продолжительность плато ПД (фаза 2). При этом развитие фазы 0 приводит к активации потенциалозависимых Са 2+ (Са 2+V) каналов, определяя вход ионов Са 2+через L-тип Са 2+V каналов во время плато ПД (фаза 2), являющейся основным тригерным источником для сопряжения электромеханического сопряжения в клетках предсердий и желудочков. В клетках СА и АВ узлов активация Са 2+-каналов L-типа определяет формирование фазы 2 ПД. При этом в формировании фазы 0 ПД этих клеток определённая роль принадлежит Ca 2+V каналам Т-типа (…………. . ), играющих определяющую роль в природе автоматии сердца. Подобно Na+V каналам, электрофизиологические свойства L- и Т-типов Са 2+V каналов сердца являются достаточно сходными не только в клетках разных типов, но и у различных видов, предполагая, что молекулярные основы, лежащие в формировании этих каналов являются достаточно сходными (см. табл…. ) для всех клеток сердца. Движущей силой для К+- тока во время фазы плато ПД является достаточно высокий электрический потенциал, определяющий формирование фазы 3 ПД клеток миокарда. В отличие от Na+V и Сa 2+V каналов существует весьма большое функциональное разнообразие среди К+V – каналов, определяющих фазу реполяризации ПД. Основными из них являются потенциалозависимые К+-каналы задержанного выпрямления, формирующие Iкr (от англ. rapid – быстрый), Iкs (от англ. slow - медленный) и Iкur (от англ. ultrarapid – ультра быстрый) (см. табл………. . ) Потенциало- и временные электрофизиологические свойства этих токов являются достаточно сходными у кардиомиоцитов не только различных регионов сердца но и видов, предполагая, что различия в макромолекулярных структурах этих каналов весьма сходны и определяют формирование фазы 3 ПД характерным образом в разных типах клеток сердца. При этом уровни экспрессии K+V-каналов различаются в различных типах кардиомиоцитов и эта гетерогенность влияет на региональные различия параметров ПД. Различные повреждения миокарда могут вызвать изменения в свойствах и функциональной экспрессии К+Vканалов, что в свою очередь отразится самыми драматическими эффектами на формирование и распространение ПД, а также на автоматию сердца.

Как упоминалось выше, нормальная сократительная (насосная) функция сердца человека и млекопитающих зависит от собственной электрической активности, что отражается в последовательности активации клеток в специализированных ( «пейсмейкерных» ) регионах и распространение электрической активности через желудочки (рис. 1). Если электрическая активность сердца является атрибутом генерации ПД в отдельных кардиальных клетках, то нормальное координирование распространения возбуждения по сердцу определяется на ЭКГ (рис…. ).

ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА
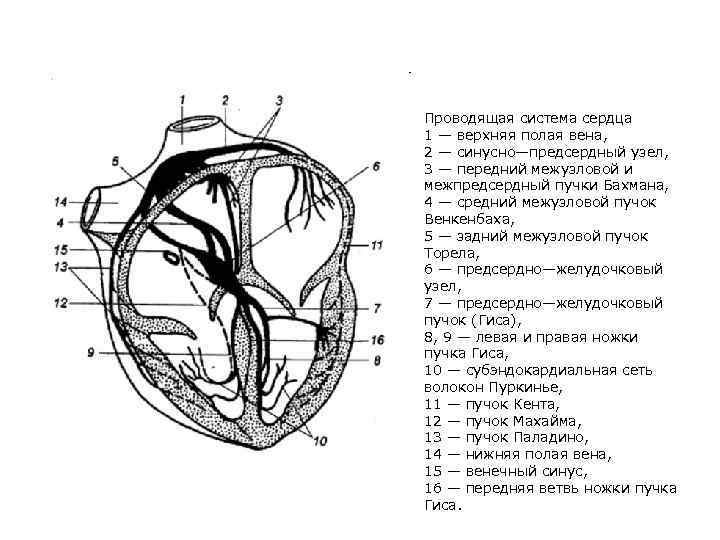
Проводящая система сердца 1 — верхняя полая вена, 2 — синусно—предсердный узел, 3 — передний межузловой и межпредсердный пучки Бахмана, 4 — средний межузловой пучок Венкенбаха, 5 — задний межузловой пучок Торела, 6 — предсердно—желудочковый узел, 7 — предсердно—желудочковый пучок (Гиса), 8, 9 — левая и правая ножки пучка Гиса, 10 — субэндокардиальная сеть волокон Пуркинье, 11 — пучок Кента, 12 — пучок Махайма, 13 — пучок Паладино, 14 — нижняя полая вена, 15 — венечный синус, 16 — передняя ветвь ножки пучка Гиса.

Проводящая система сердца

ОСОБЕННОСТИ АТРИОВЕНТРИКУЛЯРНОГО УЗЛА • • Малый диаметр волокон Множество мелких разветвлений Низкая скорость проведения Длительная меняющаяся рефрактерность • Блокирование быстрых повторных импульсов ( проведение с декрементом) • Ретроградная блокада проведения

СКОРОСТЬ ПРОВЕДЕНИЯ В МИОКАРДЕ • • • Предсердия - 0, 8 - 1, 0 м/с А/В-узел - 0, 01 - 0, 05 м/с Пучок Гиса и его ножки - 2, 0 м/с Волокна Пуркинье - 3, 0 - 4, 0 м/с Миокард желудочков: субэндокардиальный - 1, 0 м/с субэпикардиальный - 0, 4 - 1, 0 м/с

РАСПРОСТРАНЕНИЕ ВОЗБУЖДЕНИЯ ПО СЕРДЦУ • Распространение возбуждения в узлах, проводящих волокон и сократительном миокарде определяется электрическими параметрами этих образований и их морфологическими особенностями. С морфологической точки зрения миокард не является синцитием, так как в области вставочных дисков имеются двойные мембраны, которые, не прерываясь, переходят в поверхностные. Однако низкое сопротивление в области нексусов, имеющих плотные щелевые контакты, позволяет говорить о существовании контактов между клетками по типу электрического синапса, имеющего коннексоны.
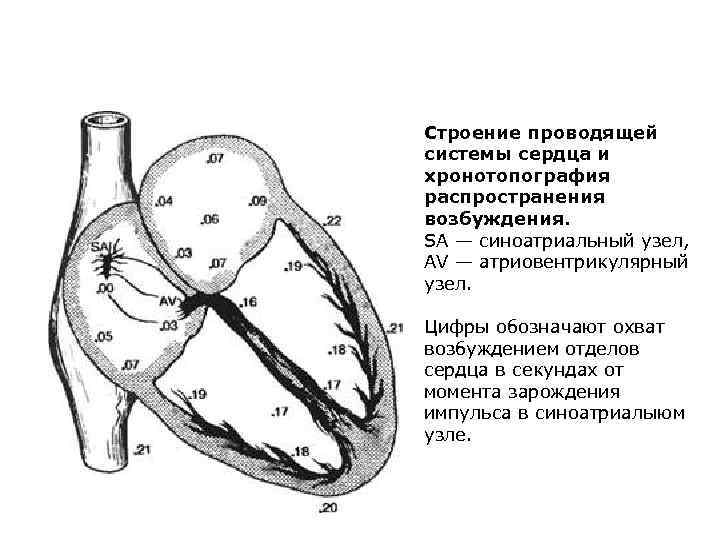
Строение проводящей системы сердца и хронотопография распространения возбуждения. SA — синоатриальный узел, AV — атриовентрикулярный узел. Цифры обозначают охват возбуждением отделов сердца в секундах от момента зарождения импульса в синоатриалыюм узле.


Коннексон - структурная субъединица плотного щелевого контакта

• • Это дает возможность проводить возбуждение от клетки к клетке без задержки и, кроме этого, обмениваться низкомолекулярными соединениями. Электрические параметры миокарда, как синцития (электрического), в различных участках сердца, существенно влияют на генерацию и распространение возбуждения, в связи с различными размерами клеток, количеством межклеточных контактов, ходом и числом проводящих мышечных волокон, особенностями строения мембран (наличия Т систем), размерами ячеек синцития и др. Тем не менее, для объяснения механизма распространения возбуждения по сердцу применяются элементы кабельной теории, согласно которой возбуждение распространяется за счет локальных токов, возникающих между возбужденным и невозбужденным участками. Параметры такого электрического синцития существенно влияют на физиологические и функциональные характеристики самого миокарда. Так, миокардиальную ткань трудно возбудить, если стимулирующее воздействие является точечным, локальным. Это обусловлено низким входным сопротивлением синцития, а для создания на таком сопротивлении пороговой деполяризации требуется сильный раздражающий ток.

• Кроме этого, крутой спад электротонического потенциала (по сравнению с нервными волокнами) от точки возбуждения, приводит к тому, что возбуждением охватывается лишь малая область, что ограничивает скорость проведения возбуждения. Все это делает миокард помехоустойчивым, и, при ограниченных, локальных повреждениях в нем, ритмическая работа сердца не нарушается. Однако, в случае локального нарушения проведения возбуждения в элементах проводящей системы сердца, может возникнуть полный блок передачи возбуждения на сократительный миокард. В этом случае надежность и синхронность передачи возбуждения с проводящей системы желудочков на рабочий миокард обеспечивается развитой сетью волокон Пуркинье.

• Распространение возбуждения в С-А-узле в значительной степени определяется структурой самого узла. Клетки узла сравнительно малы, тесно контактируют друг с другом во всех направлениях, посредством Т клеток, образуя синцитий. Поэтому возбуждение, возникнув в определенной области узла, распространяется достаточно равномерно во все стороны со скоростью всего лишь 0, 1 0, 2 м/сек. Это связано с тем, что ПД имеют небольшой градиент нарастания фазы деполяризации и небольшую амплитуды ПД, что обуславливает формирование слабых локальных токов и малых факторов надёжности. • С удалением от водителя ритма скорость распространения возрастает до 1 м/сек. Переход возбуждения от Р клеток С А узла к предсердным миоцитам происходит без заметных изменений.

• Из С А узла возбуждение распространяется на миоциты правого предсердия и по специальному пучку к левому предсердию. Одновременно, возбуждение по межузловым трактам распространяется в область А В соединения. А В соединение является единственной структурой, соединяющей между собой в электрическом отношении предсердия и желудочки, так как во всех остальных участках граница между предсердиями и желудочками представлена соединительной тканью, которая не проводит возбуждение. В А В соединении выделяют 3 зоны: AN (atrium nodus) – зона перехода от предсердных кардиомиоцитов к А В узлу; N (nodus) – атривентрикулярный узел, расположенный непосредственно над местом прикрепления септальной створки трёхстворчатого клапана; NH (nodus His) – зона перехода от А В узла к общему стволу пучка Гиса. В А В соединении имеются Р клетки (в меньшем количестве, чем в С А узле), клетки Пурькинье и Т клетки.

• В А-В-соединении возбуждение сначала возникает в маленьких соединительных волокнах (AN зона) и проводится со скоростью 0, 02 0, 05 м/сек, что в 20 50 раз ниже, чем скорость проведения по предсердиям. Эти волокна, далее, переходят в узловые, а затем, через переходные волокна в пучок Гиса. Снижение скорости проведения возбуждения со стороны предсердного края А В узла, обуславливает А -В-задержку, благодаря которой возбуждение желудочков и их сокращение начинается через 0, 08 -0, 1 сек после начала сокращения предсердий. Считается, что снижение скорости в этой зоне обусловлено особенностью контакта миоцитов: ход волокон перпендикулярен направлению волны распространения возбуждения, что ведет к замедлению скорости проведения (морфофункциональный синапс). Кроме этого, возбуждение в А В узле возникает лишь в том случае, если возбуждаются одновременно несколько миоцитов, а это достигается за счет того, что через него идет фронт возбуждения, его токи суммируются, и импульс проходит. Благодаря задержке проведения возбуждения происходит блокирование импульсов при высокой частоте возбуждения в предсердиях.

• В проводящей системе желудочков (пучок Гиса, его ножки и волокна Пуркинье) скорость проведения возбуждения достигает 4, 5 5 м/сек, что в 5 раз больше скорости распространения возбуждения по сократительному миокарду (≈ 0, 5 1 м/сек). Это обеспечивается как за счет особенностей строения проводящих миоцитов (относительно редко ветвятся), так и характером ПД, имеющим большой фактор надежности распространения возбуждения. Благодаря этому обеспечивается строгая синхронность возбуждения, а, следовательно, и сокращения всей массы ткани желудочков. Синхронность возбуждения сократительных миоцитов повышает мощность миокарда и эффективность нагнетательной функции желудочков. Так, если бы возбуждение к сократительному миокарду приходило диффузно, то период асинхронного сокращения продолжался бы значительно дольше, клетки миокарда вовлекались в сокращение не одновременно, а постепенно, и желудочки потеряли бы до 50% своей мощности. Область контактов проводящих волокон с сократительным миокардом, осуществляется немногочисленными их разветвлениями, состоящими из типичных клеток Пуркинье, характеризуется задержкой и снижением надежности проведения возбуждения в прямом направлении. Это имеет функциональное значение, так как импульсы, пришедшие раньше или позже других по отдельным проводящим волокнам, могут не пройти на рабочий миокард. Для этого необходим синхронный приход таких импульсов, в противном случае возникали бы асинхронные возбуждения в разных участках рабочего миокарда, что функционально невыгодно. Кроме этого, окончание волокон Пуркинье имеют весьма длительный ПД, поэтому играют роль своеобразного «частотного фильтра» , препятствующего слишком частым сокращениям желудочков при чрезмерно высокой частоте возбуждения предсердий.

• • В желудочках возбуждение распространяется через межклеточные контакты, обеспечивая сначало возбуждение эндокарда, а затем волна возбуждения проходит к эпикарду желудочков, со скоростью от 0, 5 до 1 м/сек. При этом, чем лучше проводящая система желудочков и выше плотность ее окончаний в рабочем миокарде, тем реже встречаются межклеточные контакты в сократительном миокарде. Таким образом, наличие проводящей системы обеспечивает ряд физиологических особенностей сердца: 1. ритмическую генерацию импульсов автоматию; 2. наличие градиента автоматии; 3. необходимую координацию возбуждения и сокращения предсердий и желудочков (задержка проведения возбуждения); 4. синхронное вовлечение в процесс сокращения желудочков (эффективность систолы); 5. продолжительную фазу абсолютной рефрактерности, что не позволяет сердцу переходить в режим тетанического сокращения скелетных мышц; 6. подчинение правилу «все или ничего» .

Автоматия Градиент автоматии

ЗАКОН ГРАДИЕНТА АВТОМАТИИ В. ГАСКЕЛЛА • СТЕПЕНЬ АВТОМАТИИ ТЕМ ВЫШЕ, ЧЕМ БЛИЖЕ РАСПОЛОЖЕН УЧАСТОК ПРОВОДЯЩЕЙ СИСТЕМЫ К СИНОАТРИАЛЬНОМУ УЗЛУ • СИНОАТРИАЛЬНЫЙ УЗЕЛ - 60 -80 имп/мин • АТРИОВЕНТРИКУЛЯРНЫЙ - 40 -50 имп/мин • ПУЧОК ГИСА - 30 -40 имп/мин • ВОЛОКНА ПУРКИНЬЕ - 20 имп/мин

ЛИГАТУРЫ СТАННИУСА НОРМА 1 лигатура 2 лигатура 3 лигатура

1 -й МЕХАНИЗМ ИЗМЕНЕНИЯ АВТОМАТИИ

2 -й МЕХАНИЗМ ИЗМЕНЕНИЯ АВТОМАТИИ ЕК

3 -й МЕХАНИЗМ ИЗМЕНЕНИЯ АВТОМАТИИ

ОЦЕНКА ИЗМЕНЕНИЙ АВТОМАТИИ ПО ЧАСТОТЕ ПУЛЬСА • ВЫШЕ АВТОМАТИЯ - ЧАЩЕ ПУЛЬСТАХИКАРДИЯ • НИЖЕ АВТОМАТИЯ - РЕЖЕ ПУЛЬС БРАДИКАРДИЯ • МЕНЯЮЩАЯСЯ АВТОМАТИЯ - ПУЛЬС РАЗНОЙ ЧАСТОТЫ - СИНУСОВАЯ АРИТМИЯ

ЭКСТРАСИСТОЛА И КОМПЕНСАТОРНАЯ ПАУЗА
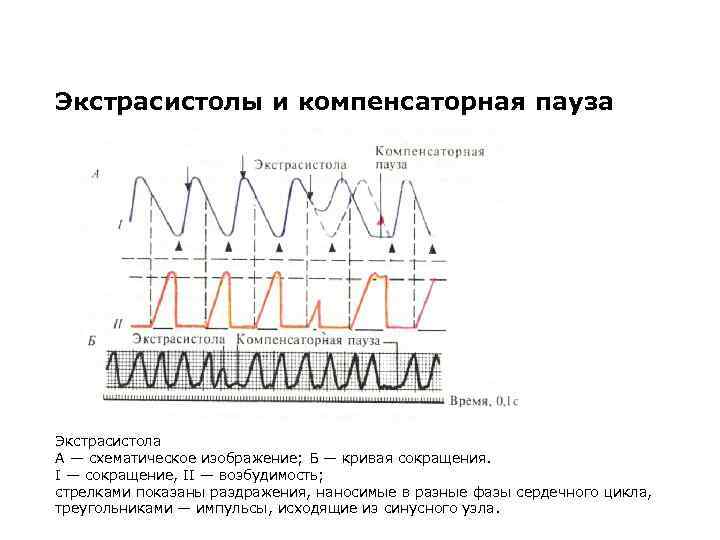
Экстрасистолы и компенсаторная пауза Экстрасистола А — схематическое изображение; Б — кривая сокращения. I — сокращение, II — возбудимость; стрелками показаны раздражения, наносимые в разные фазы сердечного цикла, треугольниками — импульсы, исходящие из синусного узла.

Правило “Всё или ничего” Сократительные свойства сердечной мышцы (закон «все или ничего» — А) и скелетной мышцы (градуальностъ —Б) I — амплитуда сокращений, II — сила раздражения.

Каналы сарколеммы кардиомиоцитов

Натриевые каналы Потенциалозависимые натриевые каналы (Nа. V) кардиомиоцитов являются гетеромультимерными интегральными мембранными белками, принадлежащими к суперсемейству ионных каналов, состоящих более чем из 140 членов. Состоят из основную образующую пору канала α-субъединицу и дополнительные β. α – субъединица Na. V каналов имеет молекулярный вес (МВ) ≈260 к. Да и содержит ≈2000 аминокислотных остатков. Состоит из 4 -х гомологичных доменов (ДI – ДIV), каждый из которых содержит 6 мембраннопроникающих α – спиральных сегментов (S 1 – S 6) (cм. рис…). Регионы S 5 – S 6 каждого домена имеют P-петли и формируют селективную пору определяющую ионную избирательность Nav канала. S 4 сегмент каждого домена несет избыточный положительный заряд, определяемый аминокислотными остатками, являясь потенциалосенсором канала. Cтруктурно – функциональные исследования выявили много важных особенностей в работе ворот Na. V каналов. Так цитоплазматический линкер между ДIII и ДIV доменами играет основную роль в процессе инактивации Na. V каналов, а мотив изолейцина, фенилаланина и метионина (IFM) в этом участке является важным молекулярным компонентом в процессе инактивации канала. Этот участок внутриклеточной спиралевидной петли канала определяет потенциалозависимую инактивацию канала, посредством блокады отверстия канальной поры с внутренней стороны за миллисекунды мембранной деполяризаии. Свойства Na. V, экспрессированых в разных кардиальных клетках, являются сходными, хотя биофизические и фармокологические свойства этих каналов отличаются от Na. V каналов других возбудимых клеток, таких как нейроны и скелетная мышца. Так кардиальные Na. V каналы не обладают высокой чувствительностью к тетродоксину (ТТХ), который связывается с высоким сродством (н. М) с нейрональными и скелетномышечными Na. V каналами. Это является одним из доказательств того, что молекулярная идентичность Na. V каналов в кардиальных миоцитах, нейронах и скелетной мышце является различной.

Рис. Трансмембранная организация субъединиц Nav канала. А. Формирующая канал a субъединица представлена 4 высокогомологичными доменами (D 1 – D 4), каждый из которых состоит из 6 сегментов (S 1 – S 6), которые объединяясь в мембране образуют ионно селективную пору выстланную петлевыми S 5 – S 6 сегментами, имеющего в своем составе положительно заряженный потенциалочувствительный сенсор (S 4) и внутриклеточную инактивационную воротную часть (h) между D 3 – D 4. Внутриклеточные полипептидные цепи изображены примерно пропорционально числу аминокислотных остатков и имеют участки модуляции со стороны регулирующих систем (ПКА – протеинкиназы А; ПКС – протеинкиназы С). Дополнительные b 1 и b 2 субъединицы являются однодоменными интегральными белками с внеклеточными N – терминалями гликозиляции. a и b Sc. Tx a и b токсины скорпиона. Б. Схематическое изображение формирования a субъединицей поры Nav каналов с наружным селективным фильтром. В. Трехмерная модель структуры a субъединицы Nav канала полученная при реконструкции электронных микрофотографий при 20 Å разрешении.

Хотя существует ряд гомологов α - субъединиц Na. V каналов (см. табл…), Na. V 1. 5 (SCN 5 A) является основной α – субъединицей, экспрессируемой в миокарде млекопитающих, которые лежат в основе фазы быстрой деполяризации (фаза 0) в миоцитах предсердий, желудочков и волокнах Пуркинье. Необходимо отметить, что наряду с Na. V 1. 5 α – субъединицей в этих клетках энкодируются и другие Na. V α – субъединицы (т. е. Na. V 1. 1, Na. V 1. 3, Na. V 1. 4), которые обычно рассматриваются как Na. V α – субъединицы мозга и скелетных мышц. Натриевые каналы имеют одно семейство дополнительных субъединиц, от β 1 до β 4, которые взаимодействуют в различных комбинациях с α-субъединицами и изменяют их электрофизиологические свойства и субклеточную локализацию. Эти белки имеют один трансмембранный сегмент, большую Nтерминальную внеклеточную петлю, которая является гомологичной по структуре вариабельной Ig G иммуноглобулинов и короткий С-терминальный внутриклеточный сегмент (см. рис…). β-субъединицы Na. V каналов взаимодействуют с α-субъединицами за счет внеклеточных Ig-складчатых участков, модулируют функцию α-субъединиц, потенциалозависимость и увеличивают клеточную поверхностную экспрессию. Подобно другим белкам с внеклеточной Ig-складкой, они также служат как клеточные адгезионные молекулы при взаимодействии с внеклеточными матриксными белками, клеточными адгезионными молекулами и цитоскелетными белками. Считается, что эти субъединицы являются наиболее поздним эволюционным дополнением к семейству ионно-канальных ассоциированных белков, так как они определяются только у позвоночных животных.

При мембранной деполяризации кардиальные Na. V каналы активируются и инактивируются достаточно быстро (см. рис…), а порог активации этих каналов находится в области ≈-60÷-55 м. В. Важно отметить, что инактивация каналов является также потенциалозависимой. Тем не менее открытие кардиальных Na. V каналов может наблюдаться даже при деполяризующих мембранных потенциалах. Так при потенциалах, соответствующих плато ПД (фаза 2) в вентрикулярных миоцитах доля Na. V каналов, находящихся в инактивированном состоянии составляет 99 %, а примерно 1% каналов находиться в открытом состоянии. Необходимо отметить, что этот входящий ток ионов Na+ во время плато ПД- будет противодействовать эффектам выходящего калиевого тока, и таким образом замедлять или ослаблять реполяризацию и повышать длительность ПД. Электрофизиологические исследования показывают наличие устойчивого компонента Na. V тока при пролонгированных мембранных деполяризациях и хотя этот ток является небольшим, он может влиять на продолжительность ПД. Также необходимо отметить, что уровень эспрессии постоянного компонента Na. V тока меняется в разных регионах желудочков, а эти различия отражают регионарную гетерогенность в длительности ПД желудочков. Кроме этого наличие постоянного Na. V тока показано в мутациях генов (SCN 5 A), энкодирующих ТТХ – нечувствительные кардиальные Na. V каналы у пациентов с врождённой формой синдрома продолжительного QT (LQT 3).

Функциональные состояния Nav – каналов в возбудимых тканях. А. Схематическое изображение Nav – каналов в закрытом, открытом и инактивированном состоянии. Б. Динамика INa в ответ на мембранную деполяризацию от -120 м. В до -10 м. В.

Кальциевые каналы Потенциалозависимые кальциевые (Са. V) каналы являются гетеротримерными полипептидными комплексами, состоящими из α 1, α 2/δ, β и γ-субъединиц, которые определяют приток Са 2+ в цитозоль при деполяризации. Во всех возбудимых тканях Са. V каналы содержат необходимый набор субъединиц α 1, α 2/δ и β, которые составляют функциональный минимум ансамбля белков канала. Вспомогательные субъединицы (β, α 2/δ) являются тесно, но не ковалентно связанными с α 1 -субъединицей и модулируют биофизические свойства и траффик α 1 -субъединицы к плазматической мембране от места синтеза. Подобно Na. V–каналам, Ca. V каналы имеют каналообразующую α 1–субъединицу (МВ≈170 -240 к. Да), которая является основным структурным и функциональным компонентом канального комплекса. Состоит из 4 гомологичных доменов (I-IV), каждый из которых содержит 6 трансмембранных α-спиральных белковых сегментов (S 1 – S 6), с мембранно-повторяющейся проникающей петлёй между S 5 и S 6 сегментами, формирующими селективную пору (П). Цитоплазматические петли названы согласно доменам, которые они связывают (I – II линкер; II – III линкер; III – IV линкер). Содержит потенциалозависимый сенсор (S 4) в виде положительно заряженных остатков аргинина и лизина. α 1 -субъединицы кодируются не менее чем 10 генами, которые обеспечивают уникальные функциональные свойства Ca. V каналов в разных типах клеток. Подразделяются на три семейства на основании их идентичности в последовательности. Ca. V 1. 1(α 1 S); 1. 2(α 1 С); 1. 3(α 1 D) и 1. 4(α 1 F) - формируют L-тип Са 2+-каналов (символ L от анг. long-lasting - долгоживущие) и локализуются во всех типах возбудимых клеток. Относятся к высокопотенциалоактивируемым каналам и, будучи активированы, сохраняют это состояние относительно долго. Их повторяющиеся открывания обеспечивают длительный кальциевый ток (ICа. L) через мембрану. Характерным признаком, отличающим эти каналы от других, является их высокая чувствительность к дигидропиридинам и другим кальциевым антагонистам. Только α 1 С-субъединица экспрессируется на высоком уровне в сердечной мышце.


Белок Ген Хромосома Основные ткани Кальциевый ток Са 1. 1 (а. IS) CACNA IS 1 q 32 Скелетные мышцы L тип Са 1. 2 (а. IC) CACNA IC 12 p 13. 3 Сердце Гладкая мышца Мозг, сердце, гипофиз Надпочечник L тип Са 1. 3 (а. ID) CACNA ID 3 p 14. 3 Мозг, поджелудочная железа, почка, яичник, кортиев орган L тип Са 1. 4 (а. IF) CACNA IF Xp 11. 23 Сетчатка L тип Са 2. 1 (а. IA) CACNA IA 19 p 13 Мозг, кортиев орган, гипофиз P/Q тип Са 2. 2 (а. IB) CACNA IB 9 q 34 Мозг, нервная система N тип Са 2. 3 (а. IE) CACNA IE 1 q 25 31 Мозг, кортиев орган, сетчатка, сердце, гипофиз R тип Са 3. 1 (а. IG) CACNA IG 17 q 22 Мозг, нервная система T тип Са 3. 2 (а. IH) CACNA IH 16 p 13. 3 Мозг, сердце, почки, печень Т тип Са 3. 3 (а. II) CACNA II 22 q 12. 3 13 2 Мозг Т тип


Ca. V 2. 1(α 1 А), 2. 2(α 1 В) и 2. 3(α 1 Е) формируют P/Q-, N и R-тип высоко-потенциалоактивируемых каналов. В основном локализованы в мозге и отвечают за инициацию синаптической трансмиссии в нервной системе. Имеют наибольшую внутриклеточную петлю, соединяющую II и III домены, содержащую сайт взаимодействия с SNARE-белками, вовлекаемыми в процесс экзоцитоза пресинаптических везикул. Ca. V 3. 1(α 1 G), 3. 2(α 1 H) и 3. 3(α 1 I) – образуют Т-тип каналов (символ T от анг. transient – кратковременный, проходящий), локализованных в мозге, почках и сердце, определяемых как низкопотенциалоактивируемых. В отличии от L-типа Са 2+-каналов они являются относительно малочувствительными к органическим блокаторам, таким как дигидропиридины, бензотиазепины и фенилалкиламины. Ca. V 3 -каналы определяют Т-тип Са 2+-тока (ICa. T), который является важным для выполнения различных физиологических функций, включая возбуждение нейронов, секрецию гормонов, сокращение гладкой мышцы и клеточную пролиферацию. В сердце Т-тип Са 2+-каналов представлен в Рклетках пейсмекеров и волокнах Пуркинье. Является важным элементом в формировании автоматии синоатриального узла. α 1 -субъединица формирует ионселективную пору, потенциалосенсор, воротный механизм, участки связывания для канал-модулирующих препаратов и является ауторегуляторной. Пора канала является асимметричной с законсервированными остатками глутамата (или аспартата в ТСа 2+-каналах), включая ионселективный фильтр, который локализуется между S 5 -S 6 сегментами каждого домена.

Положительно заряженный четвёртый трансмембранный сегмент (S 4) каждого домена является высокозаконсервированным и формирует α-спираль, в которой каждый третий или четвёртый аминокислотный остаток представлен аргинином или лизином. Согласно большинству исследований потенциалосенсорной теории активации Ca. V–каналов предполагается спирально-скользящая или ротационная модель передвижения воротных зарядов в канальном белке через электрическое поле мембраны. Полагается, что S 4 или S 3+S 4 αспирали пересекают электрическое поле мембраны в ответ к деполяризующему стимулу, передвигаясь в наружном направлении внеклеточного пространства, инициируя конформационные изменения от непроводящего (закрытого) к проводящему (открытому) состоянию канала. Дополнительная β-субъединица (МВ≈50 - 55 к. Да) Ca. V-каналов кодируется 4 генами, энкодирующими от β 1 до β 4, каждая из которых имеет несколько сплис вариантов. β-субъединицы являются гидрофильными негликозированными цитоплазматическими белками, которые ассоциируют с α 1 -субъединицами в области I – II линкерного региона. Это взаимодействие обеспечивается наличием в их структурах взаимодействующих участков, т. е. α- и β-взаимодействующих доменов (αВD и βBD рис…). βBD проявляет сходство с Src гомологом 3 -гуанилат киназного (SH 3 - GK) модуля мембранно-ассоциированного гуанилат-киназного семейства строительных белков. Считается, что наличие SH 3 - GK модуля в βBD обеспечивает передвижение канального комплекса от эндоплазматического ретикулума к мембране и влияет на воротные свойства канала. Этот регион β 2α-субъединицы подвергается действию фосфатидилинозитол-3, 4, 5 -трифосфат активируемой протеинкиназы В (РI-3 К), также называемой Акt, что определяет её траффик к плазматической мембране и является основным механизмом регуляции входа Са 2+ в клетки. β 2α субъединица является преобладающей изоформой в кардиомиоцитах, хотя имеются значительные видовые вариации.

α 2/δ-субъединицы (МВ ≈ 165 - 175 к. Да) тесно взаимодействуют с α 1. Между собой связаны посредством дисульфидного мостика. α 2–субъединица является полностью внеклеточной и высокогликозилированной, а δ-субъединица имеет одиночный трансмембранный сегмент с очень короткой С-терминальной внеклеточной частью, большим внеклеточным участком, который по разному гликозилируется. Образуется из белка предшественника, который энкодируется одним геном. Различают 4 изоформы, которые кодируются различными генами - α 2/δ 1, 2, 3, 4. Совместно с β-субъединицами определяют движение α 1 -субъединицы к мембране клеток и участвует в регуляции ICа 2+. α 2/δсубъединица связывается с высоким сродством с определёнными ГАМК- антагонистами, такими как габапентин, который используется для лечения эпилепсии, расстройств сна, острой боли и многих других параксизмальных нейрологических заболеваний. γ-субъединица (МВ ≈ 30 -35 к. Да) кодируется 8 генами, энкодирующими разные изоформы, от γ 1 до γ 8. Входит в состав Са. V-каналов скелетных мышц и мозга, но не экспрессируются в сердце. В отличие от других вспомогательных субъединиц (β и α 2/δ) γ-субъединицы не играют существенной роли в траффике α 1 -субъединицы, но модулируют биофизические свойства Са. V-каналов. Кальциевые каналы, подобно другим потенциалозависимым каналам, претерпевают ряд конформационных перестроек в ответ к изменению величины мембранного потенциала, что результируется их открытием (активацией), закрытием и инактивацией. Процесс инактивации кальциевых каналов определяет несколько уникальных функций в возбудимых клетках: предотвращает падение градиента ионов кальция, определяет точность регуляции уровня внутриклеточного кальция и, таким образом, предотвращает возникновение массивных его уровней, что является токсичным для большинства клеток, определяет длительность ПД и рефрактерный период. Кроме этого, многие фармакологические агенты, используемые в терапевтической практике взаимодействует преимущественно с инактивированными кальциевыми каналами. Все это позволяет считать, что понимание молекулярных механизмов, лежащих в основе процесс инактивации, имеет не только важное фундаментальное, но и клиническое значение.





Потенциалозависимые К+ каналы 1. К+- каналы утечки, участвующие в формировании МПП клеток. 2. К+ - каналы аномального выпрямления, инактивируются при деполяризации от больших исходных величин МПП, обеспечивая снижение К+- проводимости мембраны в начальный момент фазы 0 ПД ( ранний инактивируемый выходящий К+- ток ). Работа этих каналов облегчает развитие фазы деполяризации, крутизну ее нарастания и формирование фаз 1 и 2 ПД. 3. К+ - каналы задержанного выпрямления, аналогичны таковым в мембране нервного и скелетного мышечного волокна, и обеспечивают формирование задержанного выходящего калиевого тока, который появляется при деполяризации мембраны до - 50 ÷ 40 м. В, и, в дальнейшем, по мере роста деполяризации - увеличивается. По мере того, как во время конечной фазы быстрой реполяризации (фаза 3) мембранный потенциал становится все более отрицательным, т. е. приближается к уровню МПП, каналы выходящего К+ - тока - деактивируются, а задержанный выходящий ток уменьшается.

Трансмембранная топология и архитектура Kv каналов. А. a-субъединица Kv каналов является интегральным белком содержащим 6 трансмембранных сегментов (S 1 – S 6), внутриклеточные N – и C – терминали и положительно заряженный S 4 регион, что определяет их принадлежность к суперсемейству потенциалозависимых ионных каналов. Дополнительные (b- и min. K) субъединицы являются однодоменными белками определяющими специфические характеристики канала. Б. Схематическое изображение формирования селективной поры a-тетрамерных Kv каналов с участками S 5 – S 6, a S 1, S 2 и S 3 формируют внешние части канала с S 4, как потенциало-сенсором. (а, б, г), в – поперечное сечение канала. В и Г. Функциональные модели Kv каналов с образующими пору a-субъединицами (KCNQ 1)(1), дополнительными цитозольными b (или KCh. AP)(3) и min. K (или Mi. RP 1/Mi. RP 2)(2) субъединицами. АКАР – А-киназный заякоревающий белок; П – пора; ПКА – протеинкиназа А.



Рецепторзависимые К+ каналы: • • 1. Са 2+ - активируемые К+ - каналы аналогичны описанным выше, обеспечивают развитие кальцийиндуцируемого выходящего калиевого тока (JKCa), который участвует в формировании 2 и 3 фаз ПД проводящих волокон. По мере снижения свободного цитозольного Са 2+, каналы закрываются. 2. Nа+ - активируемые К+ - каналы. (см. выше). 3. АТФ - чувствительные К+ - каналы - внутриклеточный АТФ ингибирует, а низкое соотношение концентраций АТФ/АДФ открывает каналы. Активность их зависит также от градиента р. Н снаружи и внутри клеток, очень слабо от мембранного потенциала. 4. АЦХ – активируемые К+ - каналы - обеспечивают формирование Jкацх при активации М 2 мускариновых рецепторов кардиомиоцитов, которые через сопрягающий G белок открывают специальные К+ каналы, противодействующие снижению Jк, вызывая гиперполяризацию мембраны.


• • • Молекулярная структура и топология АТФ – зависимых К каналов (КАТФ). А. Трансмембранная топология двух субъединиц КАТФ канала: однодоменной (М 1 -М 2) Kir 6. 2 субъединицы формирующей пору и трехдоменной ( TDM 0 TDM 2) регуляторной SUR субъединицы. АТФ и АДФ связываясь с Kir 6. 2 ингибирует пору канала, этот эффект не требует Mg 2+. Связывание с фосфолипидами, такими как фосфатидилинозитон бифосфат ( PIP 2) и длинноцепочечными (ДЦ) ацил-Co. A, стимулирует активность КАТФ канала, снижая его АТФ-чувствительность. Mg-нуклеотидное связывание и гидролиз АТФ (Mg АТФ Mg АДФ + Фн) на нуклеотид-связывающих доменах (НСД 1 и НСД 2) SUR субъединицы стимулируют канальную активность и противодействует ингибиторному эффекту АТФ. Сульфонилуроны (стимуляторы и блокаторы) также связываются с SUR субъединицей. Б. Схематическое изображение октамерного КАТФ канального комплекса (поперечное сечение) в котором четыре Kir 6. 2 субъединицы формируют центральную селективную пору (П) и ассоциируют с SUR субъединицами в стоихометрическом соотношении 1: 1. В. Модель формирования поры КАТФ канала Kir 6. 2 субъединицами (продольное сечение) с формированием селективного фильтра в наружном (1) или внутреннем (2) участке поры посредством М 1 и М 2 спиралей ( а) и схематическое изображение двух противоположных трансмембранных и цитоплазматических доменов Kir 6. 2 смоделированных на основе их кристаллической структуры ( г). К 185 – участок связывания АТФ. Г. Модель КАТФ канала сформированного Kir 6. 2 и SUR 1 субъединица показывающая, что канальный комплекс содержит 4 АТФ-связывающих сайта (на Kir 6. 2) и 8 Mg-нуклеотид-связывающих сайтов (на SUR 1).







• • В общем виде генерация ПД в волокнах Пуркинье связана с приходом возбуждения от вышележащих участков проводящей системы. Возникающие локальные токи вызывают деполяризацию мембраны до Екрит ≈ 60 м. В и активацию Nа+ каналов. Это приводит к появлению большого входящего Nа+ тока, генерирующего быструю восходящую фазу (фазу 0) ПД с овершутом (+40 м. В). Одновременно с этим инактивируются К+ каналы аномального выпрямления, что снижает калиевую проводимость мембраны и облегчает процесс деполяризации мембраны. Развивающаяся деполяризация ПД в фазе 0 смещает МП к уровню -40 м. В, при которой Nа+- каналы инактивируются. Это ведет к значительному уменьшению входящего Nа+ тока, что соответствует началу фазы 1 ПД. На фоне овершута в клетку входят ионы Cl по открытым Cl каналам и довершают фазу быстрой начальной реполяризации.

• Одновременно с этим, когда МП смещается до уровня 30 ÷ 40 м. В и ниже, открываются кальциевые каналы L типа, определяя медленный входящий JCa. L и активируются К+ каналы задержанного выпрямления, обуславливающие медленно нарастающий задержанный калиевый ток JКз. в. Динамика этих токов определяет формирование фазы плато ПД (фаза 2). Задержка спада Na проницаемости мембраны в фазу плато ПД обусловлена тем, что Са каналы L типа пропускают и ионы Na+. • По мере течения фазы плато ПД кальциевый входящий ток ослабевает вследствии развивающейся инактивации Са 2+ каналов L типа (потенциало и токозависимая инактивация), а выходящий потенциалозависимый задержанный калиевый ток усиливается. Кроме этого, в это время активируются Са 2+ зависимые и Nа+ зависимые К+ каналы мембраны миоцитов, довершая фазу 2 и ускоряя развитие фазы 3 ПД.

• • • Комбинация инактивации кальциевого входящего тока и активации выходящего калиевого тока, а также развития их во времени дает результирующий выходящий ток, ведущий к развитию конечной фазы быстрой реполяризации ПД (фаза 3). Относительный вклад инактивации кальциевого медленного входящего тока и активации калиевого выходящего тока в продолжительность фазы плато ПД неодинаков и зависит от типа волокон. Так, в волокнах Пуркинье продолжительность плато ПД зависит, главным образом, от активации выходящего К тока, тогда как в миоцитах желудочка главную роль играет инактивация медленного входящего Са тока. По мере реполяризации ПД (фаза 3) мембранный потенциал становится все более отрицательным и происходит деактивация калиевых каналов. Одновременно с этим Са каналы L типа (на уровне 40 м. В) и Nа каналы (на уровне от ≈ 40 до 75 м. В) реактивируются, т. е. переходят из инактивированного состояния, в закрытое состояние. Это и определяет продолжительность фаз абсолютной и относительной рефрактерности, а также форму и продолжительность ПД вызванных внеочередным раздражением

• • • Необходимость, что кроме Са каналов L типа, определяющих величину медленного входящего тока, некоторый вклад в его развитие вносит электорогенный компонент Nа+/Са 2+- обменного механизма мембраны кардиомиоцитов, осуществляющий транспорт ионов в соотношении 3: 1. Эта система работает обратимо и на фоне деполяризации мембраны (фаза 2), наряду с уменьшением трансмембранного градиента ионов Nа+, перенос ионов меняет свое направление ( реверсирует ). Это приводит к тому, что происходит вход ионов Са 2+ снаружи в обмен на внутриклеточный Nа+. В миокарде, белок, обеспечивающий Nа+/Са 2+ обмен, фосфорилируется Са 2+- кальмодулин зависимой протеинкиназой, в результате чего скорость обмена возрастает в несколько раз. Селективные ингибиторы Nа+/Са 2+ обмена не описаны. Чаще всего используются амилорид и доксорубицин. После достижения величины максимальной диастолической поляризации фазы 3 в миоцитах проводящей системы желудочков, развивается МДД фазы 4, до прихода новой волны возбуждения. Определенный вклад в величину максимальной диастолической поляризации и временное развитие реполяризации (фаза 3) может вносить выходящий ток, генерируемый электрогенным натриевым насосом.

Мембранно-ионные механизмы электрических явлений в сердце. МЕХАНИЗМЫ АВТОМАТИИ СА-УЗЛА • Синоатриальный (СА) узел представляет собой соединительнотканный остов, в котором расположены специализированные атипические округлые мышечные Р клетки (от англ. рale – бледный), собранные в агрегаты (Рис. 1. 1). Эти клетки имеют светлую цитоплазму, практически лишённую сократительных элементов. Р-клетки СА-узла, выделенные из сердца макаки резуса. Эти клетки, объединяясь характерным образом, вместе образуют своеобразные группы

Р-клетка СА-узла сердца макаки резуса. Вставочные диски Р-клеток характеризуются высокой степенью развития нексуса (Н).

Р-клетка СА-узла сердца макаки резуса. Z - диски клеток имеют множество дефектов. Для этих клеток характерно наличие многочисленных сферических образований «корбулярного» саркоплазматического ретикулума (к. СПР).

Р-клетка СА-узла сердца кошки. Для которых характерно впячивания сарколеммы (стрелки) заполенные межклеточным веществом. Они характеризуются наличием заполненных гранулами тел (звездочка – *), из которых формируются контакты между сарколеммами клеток.

Р клетки посредством Т клеток (от англ. transient – переходные), связаны между собой и сократительными кардиомиоцитами предсердия. Каждая из P клеток обладает автоматией и способна генерировать медленную диастолическую деполяризацию (МДД), которая приводит к возникновению «медленных» и низкоамплитудных потенциалов действия (ПД). Потенциал действия Р клеток СА узла. По оси ординат – Емп мембранный потенциал (м. В); по оси абсцисс – время (мс), Екрит. пороговый потенциал ( критический порог деполяризации). 0 – быстрая поляризация; 2 – 3 – реполяризация; 4 – медленная (спонтанная) диастолическая деполяризация. МДП – максимальная диастолическая поляризация. МДД медленная диастолическая деполяризация.

• До настоящего времени остаются неясными многие механизмы, приводящие к развитию МДД и генерации спонтанных ПД, хотя понятно, что они связаны с особенностями функционирования мембранных ионтранспортирующих систем клеток. Тем не менее, считается, что единый пейсмекерный ритм СА узла строится на основе интегративного взаимодействия всех элементов гетерогенного пейсмекера. • Роль водителя ритма 1 го порядка огромна, так как все регулирующие воздействия, меняющие автоматию, оказывают свое влияние посредством воздействия на Р клетки СА узла. Если этот водитель ритма «выходит» из работы, то ни симпатическая, ни парасимпатическая системы, сами по себе не могут запустить деятельность сердца. А в тех случаях, когда СА узел повреждается, то больному вживляют электростимулятор, задающий самостоятельный ритм работы сердца.

• Р клетки, составляющие основу СА узла, имеют ряд существенных особенностей электрогенеза, отличающих их от клеток сократительного миокарда, скелетных и нервных клеток: • 1. Низкий уровень мембранного потенциала (МП), около 50 ÷ 60 м. В на пике максимальной диастолической поляризации (МДП) то есть он значительно ниже равновесного К+ потенциала (Ек). • 2. Генерируют, так называемые «медленные» ПД, по своей форме приближающиеся к пикообразным, длительностью до 300 мсек. • 3. Имеется спонтанное снижение уровня мембранного потенциала (МДД) до критического уровня деполяризации мембраны (Екрит). 30 ÷ 40 м. В, в результате чего происходит генерация спонтанного ПД. • 4. Амплитуда ПД очень низкая (ЕПД 30 ÷ 50 м. В) и часто без явления реверсии заряда (овершута).

• • • Все эти особенности электрической активности Р клеток СА узла объясняются тем, что: В условиях «покоя» мембрана имеет очень высокую проницаемость для ионов Nа+; РК+: РNа+: РCl = 1: 0, 58: 0, 02. Для сравнения в нервных волокнах; в скелетных мышцах. Аксон кальмара: 1: 0, 04: 0, 45 Фаза деполяризации ПД, от Екрит. до пика овершута, обусловлена активацией только медленных потенциалозависимых Са каналов L типа (L Са каналы или JCa. L), частично проницаемых для ионов Nа+, так как быстрые потенциалозависимые Nа+ каналы уже в исходном состоянии инактивированы (Екрит. Na каналов 60 м. В). Фаза спонтанной МДД до Екрит. обусловлена снижением К+ проводимости мембраны (закрытие Са активируемых К+ каналов или снижение JKCа, закрытием Nа зависимых К каналов или снижением JKNa+) и активацией быстрых потенциалозависимых Са каналов Т типа (Т Са каналы или JСа. Т) мембраны клеток. Максимальная диастолическая поляризация Р клеток, обусловлена значительно высокой К+ проводимостью мембраны во время фазы 3 ПД, за счет работы Са активируемых К+ каналов (JKCа) и Nа зависимых К каналов (JKNa). Фаза реполяризации ПД Р клеток обусловлена активацией К+ проводимости мембраны за счет работы 3 основных типов калиевых каналов : а. потенциалозависимых К каналов задержанного выпрямления (JКз. в. ); б. Са активируемых К+ каналов (JКСа); в. Nа зависимых К каналов (JKNa).


Таким образом, генерация «медленных» спонтанных ПД Р-клеток, обусловлена работой как потенциалозависимых калиевых (К-каналы задержанного выпрямления), кальциевых (Т-и L-Са-каналы) и Са- и Nа-зависимых К-каналов, на фоне достаточно высокой Nа+-проводимости мембраны и интенсивной работы Nа-К и Са-насосов.

Характеристика АР свойств клеток СА узла. Для каждого ионного свойства предполагается основа ионных механизмов. Морфологические и мембранные характеристики паукообразных и веретенных клеток, изолированных из синусного узла кроликов.

• • • МЕХАНИЗМЫ АВТОМАТИИ АВ-УЗЛА В норме возбуждение клеток АВ узла обеспечивается за счет волны возбуждения, приходящей от СА узла. Однако, в тех случаях, когда имеется блокада проведения возбуждения от СА узла, по разным причинам, то клетки АВ соединения способны генерировать собственные спонтанные ПД. Этот водитель ритма локализован в NH зоне АВ соединения (см. ниже по тексту). Отличительной особенностью этих ПД в АВ узле от СА узла, является более значительная максимальная диастолическая поляризация клеток, достигающая -65 ÷ -70 м. В. Это, в свою очередь, обуславливает более продолжительную по времени фазу МДД до Екрит. , а, следовательно, и меньшую автоматию (примерно в 2 раза) клеток АВ узла (40 60 в мин). В остальном динамика ионных токов клеток АВ узла сходна с таковой клеток СА узла. Необходимо отметить, что рефрактерность медленных ПД клеток СА и АВ узлов часто длится и некоторое время после окончания фазы реполяризации. Это определяет их низкую частоту возбуждения и высокую чувствительность к частотному блоку.

Электрофизиологические свойства морфологических отличных клеток, изолированных из атриовентрикулярного узла (AVN).

ЭЛЕКТРИЧЕСКИЕ ЯВЛЕНИЯ ПРОВОДЯЩЕЙ СИСТЕМЫ ЖЕЛУДОЧКОВ


• Клетки проводящей системы пучка и ножек Гиса, волокон Пуркинье млекопитающих имеют мембранный потенциал покоя = 80 ÷ 90 м. В. Фоновая натриевая проницаемость мембраны этих клеток в норме мала. Имеется МДД, которая в этих клетках обусловлена особыми ионными каналами, которые активируются лишь при существенной поляризации мембраны и пропускают как Nа+, так и К+, так называемый неспецифический входящий ток. Крутизна нарастания МДД значительно меньше, чем в клетках АВ узла. Порог активации (Екрит) тетродототсинчувствительных (ТТХ) потенциалозависимых Nа каналов составляет ≈ 60 м. В. По этой причине автоматия клеток еще меньше (примерно в 2 раза), чем клеток АВ узла (20 40 в мин). Когда МДД в проводящих волокнах достигает порога активации ТТХ чувствительных Nа каналов, неспецифический ток деактивируется развивающейся фазой деполяризации ПД.

Конфигурация ПД волокон Пуркинье считается «типичной» формой «быстрых» ПД миокарда, в котором выделяют несколько фаз: фаза 0 - фаза быстрой начальной деполяризации, имеет овершут (+40 м. В), обусловлена активацией быстрых Nа-каналов и входом ионов Nа+. Ее длительность 1 -2 мсек. фаза 1 - ранняя фаза быстрой реполяризации связана с закрытием Nа-каналов и входом ионов Сl-. фаза 2 - продленная фаза плато медленной реполяризации (фаза плато - ПД), обусловлена активацией Са-каналов L-типа (Екрит. = -30 ÷ -40 м. В) и входом ионов Са 2+ и Nа+. Ее длительность до 300 мсек. фаза 3 - конечная фаза быстрой реполяризации связана с закрытием Са-каналов и выходом ионов К+ через К-каналы до уровня МПП. фаза 4 - фаза медленной диастолической деполяризации, приводящая к развитию фазы 0 ПД, обусловлена работой неспецифических каналов, пропускающих ионы Nа+ и К+.

• • В общем виде генерация ПД в волокнах Пуркинье связана с приходом возбуждения от вышележащих участков проводящей системы. Возникающие локальные токи вызывают деполяризацию мембраны до Екрит ≈ 60 м. В и активацию Nа+ каналов. Это приводит к появлению большого входящего Nа+ тока, генерирующего быструю восходящую фазу (фазу 0) ПД с овершутом (+40 м. В). Одновременно с этим инактивируются К+ каналы аномального выпрямления, что снижает калиевую проводимость мембраны и облегчает процесс деполяризации мембраны. Развивающаяся деполяризация ПД в фазе 0 смещает МП к уровню -40 м. В, при которой Nа+- каналы инактивируются. Это ведет к значительному уменьшению входящего Nа+ тока, что соответствует началу фазы 1 ПД. На фоне овершута в клетку входят ионы Cl по открытым Cl каналам и довершают фазу быстрой начальной реполяризации.

• Одновременно с этим, когда МП смещается до уровня 30 ÷ 40 м. В и ниже, открываются кальциевые каналы L типа, определяя медленный входящий JCa. L и активируются К+ каналы задержанного выпрямления, обуславливающие медленно нарастающий задержанный калиевый ток JКз. в. Динамика этих токов определяет формирование фазы плато ПД (фаза 2). Задержка спада Na проницаемости мембраны в фазу плато ПД обусловлена тем, что Са каналы L типа пропускают и ионы Na+. • По мере течения фазы плато ПД кальциевый входящий ток ослабевает вследствии развивающейся инактивации Са 2+ каналов L типа (потенциало и токозависимая инактивация), а выходящий потенциалозависимый задержанный калиевый ток усиливается. Кроме этого, в это время активируются Са 2+ зависимые и Nа+ зависимые К+ каналы мембраны миоцитов, довершая фазу 2 и ускоряя развитие фазы 3 ПД.

• • • Комбинация инактивации кальциевого входящего тока и активации выходящего калиевого тока, а также развития их во времени дает результирующий выходящий ток, ведущий к развитию конечной фазы быстрой реполяризации ПД (фаза 3). Относительный вклад инактивации кальциевого медленного входящего тока и активации калиевого выходящего тока в продолжительность фазы плато ПД неодинаков и зависит от типа волокон. Так, в волокнах Пуркинье продолжительность плато ПД зависит, главным образом, от активации выходящего К тока, тогда как в миоцитах желудочка главную роль играет инактивация медленного входящего Са тока. По мере реполяризации ПД (фаза 3) мембранный потенциал становится все более отрицательным и происходит деактивация калиевых каналов. Одновременно с этим Са каналы L типа (на уровне 40 м. В) и Nа каналы (на уровне от ≈ 40 до 75 м. В) реактивируются, т. е. переходят из инактивированного состояния, в закрытое состояние. Это и определяет продолжительность фаз абсолютной и относительной рефрактерности, а также форму и продолжительность ПД вызванных внеочередным раздражением

• • • Необходимость, что кроме Са каналов L типа, определяющих величину медленного входящего тока, некоторый вклад в его развитие вносит электорогенный компонент Nа+/Са 2+- обменного механизма мембраны кардиомиоцитов, осуществляющий транспорт ионов в соотношении 3: 1. Эта система работает обратимо и на фоне деполяризации мембраны (фаза 2), наряду с уменьшением трансмембранного градиента ионов Nа+, перенос ионов меняет свое направление ( реверсирует ). Это приводит к тому, что происходит вход ионов Са 2+ снаружи в обмен на внутриклеточный Nа+. В миокарде, белок, обеспечивающий Nа+/Са 2+ обмен, фосфорилируется Са 2+- кальмодулин зависимой протеинкиназой, в результате чего скорость обмена возрастает в несколько раз. Селективные ингибиторы Nа+/Са 2+ обмена не описаны. Чаще всего используются амилорид и доксорубицин. После достижения величины максимальной диастолической поляризации фазы 3 в миоцитах проводящей системы желудочков, развивается МДД фазы 4, до прихода новой волны возбуждения. Определенный вклад в величину максимальной диастолической поляризации и временное развитие реполяризации (фаза 3) может вносить выходящий ток, генерируемый электрогенным натриевым насосом.

ЭЛЕКТРОМЕХАНИЧЕСКОЕ СОПРЯЖЕНИЕ В КАРДИОМИОЦИТАХ. • • В отличии от проводящей системы, клетки сократительного миокарда предсердий и желудочков, имеют удлиненную форму (40 100 мкм в длину и 10 20 мкм в диаметре) и зигзагообразные концы, увеличивающие контактную поверхность с последовательно расположенными смежными клетками. Между концами клеток имеются вставочные диски, некоторые участки которых (nexus) обладают низким сопротивлением, что позволяет проводить возбуждение от клеток к клеткам электротоническим образом. Кардиомиоциты имеют сложную клеточную структуру, которая по функциональному назначению может быть разделена на следующие элементы: Сарколемму и саркоплазматический ретикулум (СПР), отвечающих за электрогенез и сопряжение процессов возбуждения сокращения расслабления. Сократительные и регуляторные белки (миозин, актин, тропомиозин и тропонин, в соотношении 7: 3: 1: 0, 5), осуществляющие механизм сокращения клеток. Митохондрии и лизосомы, обеспечивающие энергетику электрогенеза и электромеханического сопряжения. Ядра и рибосомы, ответственные за обменное восстановление клеточных структур. По всей длине клеток проходят поперечно полосатые пучки миофибриллы, которые содержат от 200 до 1000 миофиламентов тонких (актин) и толстых (миозин) нитей

По всей длине клеток проходят поперечно-полосатые пучки - миофибриллы, которые содержат от 200 до 1000 миофиламентов - тонких (актин) и толстых (миозин) нитей. Поперечно полосатая исчерченность миофибрилл обусловлена особенностями строения саркомеров – ограниченных двумя соседними Z линиями (расстояние 1, 6 2, 2 мкм), к которым прикрепляются нити актина. По краям Z линии имеются светлые полосы (J зона) которые содержат только актиновые нити. J полосы ограничивают темные А зоны, содержащие миозиновые и актиновые нити. В центре А полос. расположена светлая полоса H, состоящая только из миозиновых нитей.

САРКОЛЕММА. • Поверхностная мембрана кардиомиоцитов состоит из наружного слоя (гликокаликса) и внутреннего слоя (основной мембраны), представленного бислойным липидным матриксом с включениями белков и гликопротеинов. • Гликокаликс имеет рыхлый наружный и более плотный внутренний слой, состоит из олигосахаридов и карбогидратных цепочек, образованных из гликопротеинов, включенных в основную мембрану. Благодаря отрицательному заряду олигосахаридов (сиаловая кислота) и полярному расположению головок фосфолипидов, сарколемма содержит преимущественно анионные места, формирующие на поверхности клеток регионы, связывающие катионы, в частности Са 2+.

• Основная функция сарколеммы сохранение и генерация трансмембранных градиентов Na, К и Са, которые необходимы для нормального возбуждения и регуляции концентрации внутриклеточного свободного Са 2+. Перемещение этих ионов через мембрану осуществляется потенциалозависимыми каналами и различными переносчиками: Nа+, К+, Са 2+ Cl каналами; Nа К и Са – насосами; Nа+/Са 2+, Nа+/Н+, Cl /НСО 3 и Nа+, К+, 2 Cl переносчиками. Другая важная функция сарколеммы регенерация и трансформация гуморальных и нейротрансмиттерных сигналов в изменении концентрации вторичных мессенджеров.

САРКОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ • Мембраны сарколеммы и саркоплазматического ретикулума (около 3% объема клеток) формируют систему трубочек или тубул, связанных в единую коллекторную сеть: поперечные Т-тубулы, являющиеся инвагинациями сарколеммы в области Z линий и продольные L-тубулы СПР, идущие вдоль каждой миофибриллы, представлены продольными канальцами, которые, сливаясь, образуют бляшкообразные расширения (терминальные цистерны), тесно контактирующие с мембраной Т тубул в области Z линии, формируя Т-систему, в виде диад и триад. Между мембранами Т системы имеются электронно плотные образования (внутренние контакты или синапсы), обеспечивающие электротоническую передачу ПД с мембраны Т-тубул на мембрану L-тубул, вызывая синхронную деполяризацию продольного СПР соседних саркомеров.



• В отличие от скелетных мышц, продольные канальцы СПР в некоторых местах плотно примыкают к поверхностной сарколемме (расстояние около 100 Ǻ), эти области заполнены электронно плотным веществом и формируют периферические контакты. Канальцы не являются строго продольными, образуя непрерывно ветвящуюся сеть трубочек диаметром 350 Ǻ, которая тянется вдоль всего саркомера, располагаясь между миофибриллами и митохондриями, сливаясь в области цистерн L тубул Т системы.





• Основная функция продольных канальцев СПР состоит в способности быстро перемещать большие количества Са 2+ из миоплазмы в свой просвет против концентрационного градиента, посредством Са насоса, который обладает большим сродством к Са 2+ и кальцийстимулируемой АТФазе. • На внутренней поверхности просвета канальцев имеются протеины калсеквестрины, обладающие относительно низким аффинитетом , но большой связывающей способностью к Са 2+ , что позволяет этому белку аккумулировать Са 2+ , а в последующем перемещать его вдоль просвета канальцев в цистерны СПР.


• Кальсеквестрин Са связывающий белок (м. В 54 к. Да) имеет большое количество Са связывающих центров (более 40 на молекулу) и низкое сродство к ионам Са 2+ ( Кдисс. лежит в области 10 3 М). Локализуется, преимущественно, в терминальных цистернах СПР, что позволяет им накапливать большие количества Са 2+ без образования нерастворимого осадка. • Терминальные цистерны Т тубул СПР способны накапливать большие концентрации ионов Са 2+ (до 10 2 М) и высвобождать их в миоплазму при активации Са каналов мембраны этих образований.

МИТОХОНДРИИ И ЛИЗОСОМЫ • Митохондрии расположены между миофибриллами и тесно связаны с ними, составляют до 35% клеточного объема, что указывает на их важность для жизнедеятельности кардиомиоцитов. В них происходит непрерывный синтез АТФ на внутренней поверхности крист, содержащих энзимы трикарбоксилазного цикла и креатинфосфата (Кр. Ф). Тесное соприкосновение митохонлрий с миофибриллами и СПР облегчает переход макроэргов от места их продукции к местам утилизации. • Помимо выработки энергии митохондрии способны аккумулировать в значительных количествах ионы Са 2+, К+, а+, что позволяет рассматривать их в качестве одного из механизмов, участвующих в регуляции миоплазменного кальция. Поглащение митохондриями небольших количеств Са 2+ сопровождается выходом в миоплазму ионов Н+.

ЯДРА И РИБОСОМЫ • В клетке расположено одно, реже два или более ядер овальной формы до 7 10 мкм в длину, ориентированных вдоль кардиомиоцитов. Совместно с рибосомами обеспечивают сруктурное обновление клеток. Продолжительность существования мембран, миофибрилл и митохондрий колеблется от 2 до 12 суток.

СОКРАТИТЕЛЬНЫЕ БЕЛКИ • В миоцитах различают 2 группы белков растворимые и нерастворимые. Растворимые входят в состав саркоплазмы и представлены миоглобином и ферментами, осуществляющими внутриклеточные биохимические реакции. К нерастворимым относятся сократительные белки миозин, актин, тропонин и тропомиозин. • Миозин (МВ = 500 к. Да) гексамерный, ассиметричный протеин, длиной 140 н. М и толщиной 2 н. М. Состоит из 2 тяжелых и 4 легких цепочек. Тяжелые цепочки, скручиваясь между собой, образуют удлиненное тело миозиновой молекулы, заканчивающееся элипсовидной головкой. Под действием трипсина расщепляется на легкий меромиозин (ЛММ тело миозина МВ = 150 к. Да) и тяжелый меромиозин (ТММ головка миозина МВ = 350 к. Да).





Схематическое изображение кардиального саркомера (слева), показывающая атомную структуру тропонинового остова регуляторного домена (увеличенная панель изображения). Домен тропанинового остова представлен из работы Tokada t. a. Структура (PDB 1 J 1 E) показана в Са 2+-насыщенной форме при использовании тримерного комплекса усеченного с. Tn. T (Т 2 регион, остатки 183 до 288), частично усеченная с. Tn. T (остатки с 31 до 163 и 31 до 210), полная длина с. Tn. T (остатки 1 до 161). В структуре саркомера (слева) миозин – в желтом цвете, актин – в голубом, тропомиозин – в красном, и гетеротримерный тропониновый комплекс – в белом)зеленом цвете.

• Под действием папаина ТММ расщепляется на фрагменты С 1(МВ = 120 к. Да) собственно головки миозина, и фрагмент С 2 (МВ = 61 к. Да) это хвост головки миозина. ЛММ и С 2 двухспиральные структуры, которые в месте стыковки расплетают суперспираль, обладающую АТФазной активностью. С 1 фрагмент имеет головку, в состав которой входят низкомолекулярные компоненты, имеющие 2 разновидности LC 1, или А легкая миозиновая цепочка, и LС 2, или Р фосфорилируемая легкая цепочка. • Отдельные миозиновые молекулы, соединяясь задними концами образуют разнонаправленные пары, которые, примыкая боковами поверхностями друг к другу, формируют толстые нити (толщиной 15 17 нм) полимер миозиновых молекул



• Тонкие, актиновые нити (толщина около 6 нм) представлены в виде двух скрученных цепочек полимеризированного глобулярного актина (Gактин, МВ = 42 45 к. Да). Каждая цепочка фибриллярного (F-актин) состоит из 200 молекул шариков G актина, соединенных АДФ, и напоминает вытянутое ожерелье. Полный перекрут этих цепочек осуществляется через 36 40 нм, то есть через 7 молекул G актина. • Молекулы двух нитей F актина, как и молекулы миозина, представляют собой двойную спираль с той лишь разницей, что она состоит не из полипептидных цепей, как в миозине, а из двух линейных полимеров G актина.


• • • В бороздках актиновой спирали, по обеим сторонам, располагается в виде ленты белок тропомиозин (Тм), перекрывающий 7 актиновых молекул. На концах тропомиозиновых молекул располагается белковый комплекс тропонин (Тн), состоящий из трех протеинов: тропонина Т (Тн. Т МВ = 38 к. Да) белка, присоединяющего Тн комплекс к Тм и актину; тропонина J (Тн. J МВ = 18 к. Да) белка, ингибирующего Мg стимулируемую АТФазу актомиозина; тропонина С (Тн. С МВ = 22 к. Да) белка, чувствительного к Са 2+, аналогичного кальмодулину. К нити F актина они присоединены посредством Тм и располагаются от него в такой последовательности : Тн. Т, Тн. С и Тн. J. В расслабленной мышце, при низком уровне Са 2+ в саркоплазме (менее 10 -7 М) Тн. J, кроме связи с Тн. С, соединен с активным центром актина и тропомиозином. Таким образом, он блокирует возможность контакта головок молекул миозина с F-актином. При освобождении ионов Са 2+ из СПР при возбуждении, они активно связываются с Тн. С, что влечет за собой изменение конформации всего комплекса и перемещению его вместе с концевой частью Тм на 20 , по сравнению с прежним ее положением. Эти перемещения Тм обнажают активные места тонких нитей, способные взаимодействовать с головками миозина, с образованием поперечных актомиозиновых мостиков, что ведет к скольжению актиновых нитей вдоль миозиновых.

КЛЕТОЧНО-МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ СОПРЯЖЕНИЯ ПРОЦЕССОВ ВОЗБУЖДЕНИЯ СОКРАЩЕНИЯ - РАССЛАБЛЕНИЯ. • • • В результате возбуждения кардиомиоцитов, входящий через Са-каналы сарколеммы кальций (фазы 0 и 2 ПД) играет в основном триггерную роль в высвобождении ионов Са 2+ из терминальных цистерн СПР. Кроме этого, его высвобождению из СПР также способствует волна деполяризации ПД, распространяющаяся с Т-тубул на цистерны Lтубул через систему триад. Результатом этих процессов является увеличение концентрации свободного кальция в цитоплазме до 10 6 10 5 М и его взаимодействия с кальцийсвязывающими местами Тн. С. Образование комплекса Са 2+-Тн. С усиливает аффинитет Тн. С к Тн. J и ослабляет его взаимодействие с актином, что влечет за собой изменение конформации всего комплекса. Связь Тн. J с актином и Тм разрывается, и тропомиозиновая молекула перемещается в позицию, при которой открываются актиновые центры актина. Таким образом, роль Са 2+ сводится к тому, чтобы соединившись с Тн. C, оторвать Тн. J от актина и переместить Тм, раскрыть активные центры актина и сделать возможным взаимодействие головок миозина с активными центрами актина. Присоединение активного центра актина к головке миозина, заряженной энергией АТФ и находящейся в комплексе с АДФ и фосфорная кислота в присутствии ионов Мg 2+, обеспечивает процесс циклизации акто-миозиновых мостиков и развитие силы, за счет «гребущего» движения головок миозина и продвижение тонкой нити на один «шаг» , то есть на 0, 8 нм. Затем эта связь разрушается и возникает новая, между следующей головкой миозина и актином, и снова продвижение вперед на 0, 8 нм, и т. д. пока будут открыты активные центры актина.

• • • Присоединение миозиновых головок к соответствующему центру тонкой нити происходит под углом 90 , а затем она поворачивается на 45 , что приводит к развитию силы и напряжению, которое тянет тонкую нить в сторону зоны Н и продвигает ее на один «шаг» . После разрушения мостика головка миозина возвращается в исходное (90 ) состояние и взаимодействует со следующим функциональным центром актиновой нити. Поворот головки осуществляется в области «шарнирного» соединения, между фрагментами ТММ С 1 и С 2, которое наименее спирализовано. В покое этот шарнир выключен, а при циклизации акто миозиновых мостиков активирован. Таким образом, в процессе сокращения длина миозиновых и актиновых протофибрилл не меняется, они только смещаются относительно друга, и поэтому сам механизм получил название скользящей модели сокращения (Хукслей, 1973). Процесс образования и распада каждого мостика сопровождается затратой энергии одной молекулы АТФ, за счет ее гидролиза, осуществляемой АТФ азой головки миозина в присутствии Мg 2+.

• • • В настоящее время полностью неизвестен молекулярный механизм трансформации энергии концевой фосфатной связи в механическое, «гребущее» движение головок миозина. Однако, считается, что в присутствии ионов Са 2+, происходит сближение молекулы АТФ с центорм АТФ азы головки миозина, ее гидролиз, и фосфорилирование головки миозина в комплексе с АДФ (Фн+АДФ), т. е. зарядка ее энергией. Это делает возможным образование мостика между головкой миозина и активным центром актина и поворот головки миозина. После поворота головки миозина, фосфорная кислота и АДФ отщепляются от акто миозинового комплекса, в результате фосфорилирования его за счет энергии новой молекулы АТФ. Наступает диссоциация связи (разрушение мостика), возвращение головки в исходное состояние и готовность ее взаимодействовать с новым функционально активным центром актина и весь процесс повторяется. При этом энергия запасенная в головке миозина используется для ее вращения относительно актина. Таким образом, АТФ не используется непосредственно для развития силы в поперечном мостике, но она необходима для его разъединения и перевода головки миозина в высокоэнергетическое состояние, способное к образованию нового мостика и повторного цикла. Этот процесс протекает при обязательном присутствии ионов Мg 2+ и Са 2+. АТФ азная активность головок миозина регулируется Р легкой цепочкой, фосфорилирование которой позволяет АТФ азе расщеплять АТФ. Фосфорилирование Р легкой цепочки миозина осуществляется ферментом киназой легких цепей миозина (КЛМЦ), которая активируется комплексом Са кальмодулин и способна катализировать перенос Фн из Мg АТФ к Р легкой цепи. Дефосфорилирование Р легкой цепочки миозина катализируется фосфатазой легкой цепочки миозина (ФЛЦП).

• • Активный процесс циклизации акто миозиновых мостиков завершается снижением концентрации свободного цитоплазматического Са 2+ под действием Са насоса продольных трубочек СПР, Са насоса и Nа/Са обмена сарколеммы и захвата митохондриями. Это сопровождается распадом комплекса Са Тн. С и возвращением Тн и Тм в исходную позицию, т. е. закрытием активных центров актиновых протофибрилл. Одновременно под действием ФЛЦМ происходит дефосфорилирование Р легкой миозиновой цепочки и деактивация АТФ азы актомиозина. В результате этих двух процессов происходит распад акто миозиновых мостиков и развитие расслабления кардиомиоцитов. Дефицит АТФ (гипоксия, ишемия), затрудняет отсоединение головок миозина от центров актина, нарушает процесс релаксации и развивается явление контрактуры незавершенная диастола. На процесс расслабления кардиомиоцитов оказывает влияние фосфорилирование Тн. J под действием ц. АМФ зависимой протеинкиназы (ПК А). Такое фосфорилирование снижает чувствительность кальцийспецифических мест Тн. С к ионам Са 2+. И как следствие этого снижение взаимного аффинитета Тн. С и Тн. J, что устраняет взаимодействие Тн и Тм с перемещением последнего в позицию, блокирующую активные центры актина. Уровень ц. АМФ в саркоплазме, а, следовательно, и активность ПК А, регулируется посредством стимуляции рецепторов сарколеммы ( в частности, 1 адренергических рецепторов ), через активность аденилатциклазы (АЦ) и фосфодиэстеразы (ФДЭ).

• Из реализации цикла «сокращение – расслабление» следует, что в физиологических условиях сокращение сердечной мышцы не является максимальным, так как: • Во время систолы Са 2+ образует комплексы не со всеми молекулами Тн. С и многие активные центры актина остаются закрытыми. • Не все головки миозина присоединяются к функционально открытым центрам актина. • Интенсивность «гребущего» движения присоединившихся головок миозина неравномерна. • Не все головки миозина обеспечиваются энергией АТФ, а, следовательно, могут участвовать в процессе циклизации актиномиозиновых мостиков. • Во время диастолы могут сохраняться остаточные поперечные мостики, что снижает сократительную способность кардиомиоцитов. • Все это является резервом увеличения силы и амплитуды сокращения сердца на уровне миофибрилл.

• Скоростные компоненты сокращения и расслабления контролируются, в основном, темпом процессов фосфорилирования и дефосфорилирования систем, определяющих движение цитозольных ионов Са 2+ и состояние протофибрилл: • Кальциевый насос продольных канальцев СПР через фосфорилирование фосфоламбана. • Кальциевый насос и Na+/Ca 2+ обмен сарколеммы. • Кальциевых каналов сарколеммы и терминальных цистерн СПР. • Сродство протофибрилл к ионам Са 2+ через фосфорилирование и дефосфорилирование Тн. I, определяющего чувствительность Тн. С к ионам Са 2+. • Hе все Р легкие цепи головок миозина фосфорилируются КЛЦМ, что уменьшает скорость циклизации поперечных мостиков. • Данные обстоятельства являются резервом увеличения скоростных компонент систолы и диастолы сердца.

• Большую роль в регуляции цикла «сокращение расслабление» кардиомиоцитов играет Mg 2+, считающийся природным антагонистом кальция и проявляющий следующие свойства: • 1. Ингибирует триггерное высвобождение Са 2+ из терминальных цистерн СПР, вызванное поступлением внутрь клетки экстрацеллюлярного Са 2+. • 2. Стимулирует активность Са АТФазы мембраны продольных канальцев СПР, что активирует уход Са 2+ в СПР и снижение его в цитоплазме. • 3. Конкурирует с Са 2+ в связывающих местах Тн. С и кальмодулина. • 4. Необходим для распада актино миозиновых мостиков и определяет скоростную компоненту диастолы. • 5. Уменьшает развитие мышечного напряжения (МН) в соответствии с формулой:

• • • Суммируя этапность событий в цикле «возбуждение сокращение расслабление» кардиомиоцитов, очередность этих процессов можно проследить в упрощенном виде следующим образом: Во время возбуждения сарколеммы ионы Са 2+ через быстрые (Т) и медленные ( L) потенциалозависимые кальциевые каналы поступают в клетку, играя триггерную роль в высвобождении Са 2+ из терминальных цистерн СПР, за счет активации Са каналов этих образований. Это приводит к увеличению свободного цитозольного Са 2+ до 10 5 М. Свободный Са 2+ связывается с Тн. С, вызывает серию взаимодействий белок-белок, в результате чего становится возможным формирование поперечных мостиков актин-миозин, генерирование силы сокращения и укорочение миоцитов Процесс образования и распада поперечных мостиков протекает за счет энергии АТФ, при обязательном присутствии ионов Мg 2+. Одновременно с увеличением концентрации ионов Са 2+ в цитоплазме развивается процесс его удаления за счет Са 2+ насоса продольных канальцев СПР, захвата его митохондриями и кальций связывающими белками сарколеммы. Поддержание трансмембранного градиента ионов Nа+ и К+ осуществляется Nа+, К+ АТФ азой.

Модель Са 2+ цикла в кардиальном миоците (А) и эффекты гипертрофической мутации (В), вызванной кардиомиопатией

Падение концентрации свободного цитозольного кальция в саркоплазме обуславливает распад комплекса Са 2+- Тн. С и устраняет миофибриллярное напряжение. Процессы релаксации миоцитов лимитированы временем устранения взаимодействия протеин-протеин, ликвидации поперечных мостиков актин-миозин и возвращение актиновых протофибрилл в состоянии покоя. Время мембранной и миофибрилярной активации, модулирущейся фосфорилированием и дефосфорилпрованием протеинов, находящимся под контролем протеинкиназ (ПК-А, ПК-С и Сакальмодулин зависимой ПК). Так, фосфорилирование Са -каналов сарколеммы ПК-А и ПК-С увеличивает продолжительность нахождения их в открытом состоянии и, следовательно, увеличивает поток Са 2+ в просвет СПР. Фосфорилирование Тнj, посредством ПК-А, повышает обмен Са с Тн. С. Фосфорилирование Р-легких цепей головок миозина КЛЦМ повышает сродство актина и миозина, увеличивает АТФазу.


ОПРЕДЕЛЕНИЕ • СОКРАТИМОСТЬ МИОКАРДА - ЕСТЬ СПОСОБНОСТЬ ПОДДЕРЖИВАТЬ ОПТИМАЛЬНОЕ СООТНОШЕНИЕ МЕЖДУ СИЛОЙ И СКОРОСТЬЮ СОКРАЩЕНИЙ СЕРДЕЧНОЙ МЫШЦЫ

• Таким образом, регуляция инородных синхронотропных ответов сердца находится под контролем различных протеинкиназ, активность которых зависит от стимуляции мембранных рецепторов со стороны катехоламинов, ацетилхолина и других гормонов. Весь комплекс «возбуждение сокращение – расслабление» кардиомиоцитов определяется интенсивностью процессов энергообеспечения.

Таким образом физиологические свойства сердечной мышцы: -Возбудимость -Проводимость -Лабильность -Аккомодация - Сократимость

Физиологические особенности сердечной мышцы: - Меньшая возбудимость Меньшая проводимость Меньшая лабильность Большая аккомодация Меньшая сократимость Большая продолжительность ПД ПД натрий – кальциевой природы Большой период рефрактерности

ЭНЕРГЕТИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЦИКЛА ВОЗБУЖДЕНИЕ - СОКРАЩЕНИЕ - РАССЛАБЛЕНИЕ • • Энергетическое обеспечение клеток сердца осуществляется, в основном, системой аэробного окислительного фосфорилирования различных питательных веществ, поступающих в миокард из крови. В этом отношении миокард принципиально отличается отскелетных мышц, которые могут в значительной мере покрывать свои энергетические потребности за счет анаэробных процессов, а образующийся в них «кислородный долг» восполняется в дальнейшем. Количественный и качественный состав питательных веществ, используемых сердцем для выработки энергии , показывает, что сердце, в отличии от скелетных мышц, является «всеядным» органом и использует многие продукты обмена веществ глюкозу, свободные жирные кислоты, аминокислоты, пируват, молочную кислоту (лактат), кетоновые тела. В условиях покоя на нужды энергетики сердца тратится: глюкозы 31%, лактата 28%, свободных жирных кислот 34%, пирувата, кетоновых тел и аминокислот 7%.

• Обращает на себя внимание тот факт, что кардиомиоциты способны использовать в значительном количестве свободные жирные кислоты и, в отличии от скелетных мышечных волокон, молочную кислоту (лактат). При физической нагрузке существенно возрастает потребление сердцем лактата (до 60%), а потребление глюкозы снижается (до 15%). Способность использовать лактат в качестве дополнительного источника энергии дает возможностьсердцу приспосабливаться к работе организма при интенсивных физических нагрузках, когда скелетные мышцы, в результате анаэробного гликолиза, высвобождают в кровь большое количество лактата. Также, расщепляя лактат, сердце способствует поддержанию постоянства р. Н крови, что является немаловажным фактором поддержания р. Нi кардиомиоцитов на необходимом уровне. Утилизация лактата кардиомиоцитами обусловлена высокой активностью лактатдегидрогеназы (ЛДГ), которая переводит его в пируват (пировиноградная кислота). Пируват, проникает в митохондрии, где под действием пируватдегидрогеназы (ПДГ), расположенной на внутренней мембране митохондрий, образует ацетильнуюгруппу химически активного соединения ацетил Ко. А и окисляется в цикле Кребса до Н 2 О и СО 2. Свободные жирные кислоты (СЖК) в норме служат основным источником энергии миокарда, особенно при повышении частоты сердечных сокращений. Внутриклеточные процессы окисления СЖК представляют сложную систему их активации Ко. А и образования ацил Ко. А. После активации жирной кислоты происходит образование ацилкарнитина, который транспортируется в митохондрии, где вновь образуется ацил Ко. А. Последний поступает в цикл окисления жирных кислот, на выходе которого образуются молекулы ацетил Ко. А , которые включаются в цикл Кребса. При этом на каждую молекулу ацетил Ко. А освобождается 2 протона (Н+), присоединяющиеся к ФАD и НАD, образуя ФADH 2 и НАDH 2, которые окисляются в дыхательной цепи транспорта электронов и обеспечивают синтез 2 и 3 молекул АТФ, соответственно. Общий выход энергии на одну молекулу окисления СЖК (С 16) пальмитиновой, составляет 129 АТФ.

• Ферменты, катализирующие окисление ЖК, образуют мультиферментный комплекс с произвольной организацией, так что промежуточные продукты не покидают этот комплекс, за исключением входа в цикл и выхода из него. Таким образом, продукты каждой отдельной реакции не покидают ферментативного комплекса, а просто замещаются поступающими вновь свежими субстратами данной реакции. Считается, что весь углерод СЖК превращается в ацетил Ко. А. • Карнитин широко распространен в организме, по ряду свойств напоминает витамин, является амино, гидроксибутириловой кислотой и имеет следующую структуру: (СН 3)3 N+СН 2 СН(ОН)СН 2 СОО. Реагирует с ацил Со. А, в реакции катализируемой ацилкарнитинтрансферазой.

• Свободные аминокислоты, поступающие из крови или образующиеся путем распада белков, подвергаются дезаминированию или переаминированию, также включаются в цикл Кребса с участием ацетил Ко. А. Атом же азота, многократно преходя их одной формы в другую, в конце концов выводится из организма в виде мочевины. • Таким образом, в результате расщепления белков, жиров и углеводов образуется ключевая молекула ацетил Ко. А, которая вводится в митохондриальный цикл Кребса, и окисляется в присутствии атомарного кислорода до Н 2 О и СО 2. Кислород поступает в митохондрии из крови после его отщепления от гемоглобина.

• Синтез АТФ в митохондриях связан с образованием креатинфосфата (Кр. Ф) при непосредственном участии специального изомера креатинфосфокиназы (КФК), расположенного на внещней стороне внутренней мембраны митохондрий. Под действием этого изофермента в присутствии ионов Mg происходит передача энергии концевой связи АТФ к креатину (Кр) с образованием Кр. Ф и АДФ. Транспорт АТФ из митохондрий, а АДФ наоборот, через внутреннюю мембрану осуществляется АДФ АТФ трансферазой (Т). Кр. Ф диффундирует в саркоплазму и поставляет энергию к местам ее утилизации миофибриллы и мембранные ионные насосы где местная КФК осуществляет обратный перенос энергии концевой фосфатной связи от Кр. Ф к. АДФ, с образованием АТФ и Кр. АТФ используется в цикле возбуждение сокращение расслабление кардиомиоцитов, а Кр транспортируется в митохондрии и ресинтезируется в них до Кр. Ф цикл повторяется.

• • • В клинической практике эквивалентом количества вырабатываемой энергии является величина потребления миокардом кислорода (ПМО 2), так как его потребление находится в линейной зависимости от механической активности сердца. Миокард нормально функционирующего сердца потребляет приблизительно 8, 5 мл О 2/100 г миокарда в 1 мин. Из них 25% (2, 1 мл. О 2) идет на активацию кальциевой системы, 50% (4, 0 мл. О 2) на генерирование сопряжения, развиваемого миофибриллами, т. е. 75% потребляемого О 2 расходуется только этими двумя факторами. Поэтому усиление механической деятельности сердца увеличивает потребление миокардом О 2. Суммарную энергию можно расчитать из формулы: Е=q К ПМО 2, где q калорический эквивалент О 2, равный 0, 0048 ккал/мл; К механический эквивалент тепла, равный 427 кг м/ккал; ПМО 2 потребление О 2 на 100 г миокарда в 1 мин.

• • • Динамика суммарного ПМО 2 сердца определяется, в основном, 3 факторами: внешней работой сердца работой по перекачиванию объемов крови и сообщение ей дополнительной кинетической энергии. внутренней работой сердца определяемой сократительными свойствами миокарда в цикле возбуждение сокращение расслабление. При этом под увеличением сократимости сердца подразумевается увеличение скорости или развиваемой силы активного сокращения при постоянной нагрузке или длине мышцы. частотой сердечных сокращений (ЧСС) увеличение частоты сердечных сокращений сопровождается прямой зависимостью увелечения ПМО 2. Расчеты показывают, что энергия вырабатываемая кардиомиоцитами распределяется между различными процессами следующим образом: около 70% используется на сокращение, 15% расходуется на перенос ионов Са в СПР, внеклеточную среду и митохондрии, около 5% идет на процесс активного переноса ионов Nа и К против концентрационных градиентов через сарколемму , остальная часть энергии идет на покрытие нужд бисинтетический процессов, поддерживающих целостность структуры кардиомиоцита.

• • Общая энергетическая эффективность сердца как насоса, которая отражает ту часть затрат энергии, которая реализуется в движении крови, т. е. КПД, может быть определена как отношение внешней работы к потребленной энергии: КПД=(Ан/Е) 100, где: Ан внешняя работа сердца; Е суммарная энергия сердца, равная 2, 05 ПМО 2. Таким образом, общий энергетический балланс интактного сердца обеспечивается из последовательно связанных этапов: доставка энергетических субстратов и О 2 к миоцитам, которая определяется коронарным кровотоком; преобразование энергии внутримолекулярных связей жирных кислот, глюкозы и аминокислот в энергию концевой фосфатной группы АТФ и Кр. Ф в митохондриях; процесс внутриклеточного транспорта АТФ и передача энергии концевой фосфатоной связи в местах ее использования с помощью Кр. Ф и различных изоферментов КФК. трансформация биохимической энергии АТФ в механическую энергию сокращения миокарда, в работу ионных насосов и энергию биохимических связей внутриклеточных белков и других соединений, определяющих уровень ПМО 2.

• • • Согласованное протекание этих процессов во времени обеспечивается механизмами из взаимного реагирования и не сопровождается значительными колебаниями концентрации АТФ и Кр. Ф при механической активности сердца. Это обеспечивается за счет достаточно хорошего коронарного снабжения миокарда кислородом и питательными веществами, так как собственные запасы сердца этими субстратами не велики. В условиях покоя величина коронарного кровотока (ВКК) у человека составляет (0, 8 0, 9 мл г мин 1), или около 250 в минуту, что составляет около 5% от общего минутного объема сердца. При усилении сердечной деятельности ВКК увеличивается и может возрастать до 20% от общего минутного объема сердца, т. е. до 1 литра и составлять 4 мл г мин 1. В миокарде, на каждое мышечное волокно приходится 1 капилляр, а среднее расстояние между ними составляет около 25 мкм (в скелетных мышцах около 40 мкм), что способствует хорошему газообмену между кардиомиоцитами и капиллярным кровотоком.

• • Так артериовенозная разница по концентрации кислорода (ab. РО 2) в сердце в состоянии покоя составляет 0, 15. Это означает, что в норме при происхождении крови через капилляры сердца используется 50 75% кислородной емкости, в отличии от целого организма, где эта величина составляет 25% (ab. РО 2=0, 05). При тяжелой физической нагрузке ab. РО 2 сердца может возрастать до 0, 17 и составлять 85% утилизации О 2. При этом скорость потребления О 2 миокардом (VО 2), выражающая потребление О 2 в мл на 1 г за 1 мин, составляет 0, 07 0, 1 мл г 1 мин 1 в покое и может возрастать до 0, 4 при физической нагрузке. То есть, сердце массой 300 г потребляет в состоянии покоя 24 30 мл О 2 в минуту, это примерно 10% общего потребления О 2 у взрослого человека, хотя масса сердца составляет лишь 5% от массы тела. Вследствии этого, экстракция О 2 из протекающей артериальной крови максимальна (14 16 мл. О 2/л крови), что обеспечивает достаточное снабжение кардиомиоцитов О 2 и поддерживает Ро 2 в них на достаточно необходимом уровне для обеспечения аэробных окислительных процессов в митохондриях.

• Для нормального протекания окислительных процессов необходимо, чтобы напряжение О 2 в области митохондрий превосходило 0, 1 1 мм. рт. ст. (13, 3 133, 3 Па). Эта величина называется критическим напряжением О 2 в митохондриях. Если напряжение О 2 в участках цитоплазмы падает ниже критического, то полное окисление восстановленной цитохромоксидазы становится невозможным, перенос водорода и электронов в дыхательной цепи подавляется и, в результате, не может поддерживаться нормальная скорость энергетического обмена. • Снабжение миокарда кислородом претерпевает периодические колебания в связи с изменением ВКК в ходе сердечного цикла: в систоле оно минимально, а в диастоле максимально. В то же время, потребность клеток миокарда в энергии противоположна: она возрастает во время сокращения и снижается во время расслабления.

• • В нормальных условиях потребность миокарда в энергии, несмотря на снижение поступления О 2 во время систолы, полностью обеспечивается за счет 2 механизмов: Отдачи О 2 миоглобином, который играет роль кратковременного депо и внутриклеточного преносчика О 2. Обратимо связывая О 2, он служит своего рода кислородным буфером, обеспечивая протекание окислительных процессов в тех участках, кровоснабжение которых на короткий срок снижается или полностью прекращается во время систолы. Среднее содержание миоглобина в крови составляет 4 мг на 2 г ткани, обеспечивая запасы кислорода около 0, 5 10 2 мл О 2 на 1 г ткани (1, 34 мл. О 2 4 мг). Этого количества О 2 в условиях аноксии может хватить лишь для того, чтобы поддерживать окислительные процессы в течении примерно 3 4 секунд. Аноксия отсутствие доставки О 2 к миокарду при сохраненном коронарном потоке крови (остановка дыхания, отравление солями цианистого калия и др. ) Во время диастолы миоглобин миокарда полностью насыщается О 2, а клеточные запасы АТФ и Кр. Ф восполняются. При физической нагрузке, для поддержания нормальной скорости энергетического обмена сердца, требуется большое количество О 2. В то же время, увеличение ЧСС приводит к значительному укорочению диастолы, и, в результате, нарушается соответствие между снабжением сердца О 2 и потребностью в нем. В связи с этим переносимость физической нагрузки ограничена предельной частотой сокращения сердца, равно примерно 200 ударов в минуту. На ЭКГ в этих условиях часто появляются типичные симптомы гипоксии миокарда (снижение сегмента ST, уплощение или инверсия зубца Т).

• • Рост ВКК при нагрузке происходит, главным образом, вследствии расширения коронарных сосудов, открытия капилляров и обладает значительным резервом. При этом, «благополучие» сердца зависит, в основном, от приспособительных свойств коронарных сосудов менять свою пропускную способность. Коронарный кровоток (Qкор) прямо пропорционален градиенту давления между давлением крови в аорте и давлением в правом предсердии ( Ркор), куда депонируется устье коронарного синуса, и обратно пропорционален сопротивлению коронарных сосудов (Rкор): Qкор= Ркор/Rкор Как видим, лимитирующим фактором Qкор является сопротивление коронарных сосудов, величина которого определяется тонусом сосудов, величина которого регулируется нейрогенными, метаболическими, миогенными и фармакологическими факторами. При усиленной нагрузке кровоснабжение миокарда увеличивается, главным образом, за счет влияния местных процессов на коронарные сосуды. Главным фактором инициации этих процессов служит снижение Ро 2 в миокарде (гипоксия), что сопровождается увеличением содержания аденозина оказывающего сосудорасширяющий эффект. Кроме этого, большое значение играют эйкозинаиды, в частности простациклины и простагландины обладающие сосудорасширяющим действием. Увеличение тонуса симпатических нервов при нагрузке в начале приводит к увеличению тонуса коронарных сосудов и снижению кровоснабжения миокарда, за счет активации адренорецепторов сосудов. Однако, одновременно активируются и адренорецепторы, что вызывает расширение сосудов и улучшение кровоснабжения миокарда.

• • Таким образом, энергетическое снабжение насосной функции сердца в широком диапозоне его деятельности от состояния покоя до уровня максимальной нагрузки происходит за счет коронарного резерва. Величина коронарного резерва опредедяется способностью коронарного сосудистого русла во много раз увеличивать коронарный кровоток сообразно уровню ПМО 2. В обычных условиях при интактных коронарных аретериях сердце находится в ситуации «суперперфузии» , т. е. доставка О 2 превышает уровень ПМО 2. При стрессорной ситуации (нагрузка)уровень ПМО 2 увеличивается от 10 мл/мин (в покое) до 65 мл/мин на 100 г сырого веса миокарда, т. е. эквивалент коронарного резерва равен 55 мл/мин. В тех случаях, когда сердце систематически испытывает повышенную потребность В О 2, в миокарде наступают структурные изменения и масса сердца, в целом, увеличивается. Такие приспособительные процессы наблюдаются у спортсменов и масса сердца может достигать у них 500 г (при норме 200 300 г). Это происходит, главным образом, за счет увеличения отдельных кардиомиоцитов (гипертрофия). Считается, что основным стимулятором роста кардиомиоцитов служит их кратковременное кислородное голодание. Гипертрофия роста кардиомиоцитов не может развиваться бесконечно, так как при ней ухудшается снабжение клеток О 2. Так, при увеличении массы сердца до критического значения , равного примерно 500 т, увеличивается как масса мышечной ткани, приходящейся на один капилляр, так и количество капилляров; однако, прекапиллярные сосуды при этом изменяются незначительно. В результате уровень поступления О 2 к клеткам сердца снижается. В патологических условиях масса сердца может становиться больше критической и наступает кислородное голодание многих участков миокарда, разрушение части миокардиоцитов и нарушение нормальной структуры сердца патологическая гипертрофия сердца с расширением (дилатацией) его полостей.

Спасибо за Внимание !
Студн. сердце.ppt