[Медкниги]Физиология гемостаза. Регуляция гемостаза.ppt
- Количество слайдов: 35
 ФИЗИОЛОГИЯ ГЕМОСТАЗА Струкова Светлана Михайловна 3. Регуляция гемостаза. 3. 1. ТРОМБИН - РЕГУЛЯТОР ПРОЦЕССОВ СВЕРТЫВАНИЯ, воспаления и др. сопряженных процессов
ФИЗИОЛОГИЯ ГЕМОСТАЗА Струкова Светлана Михайловна 3. Регуляция гемостаза. 3. 1. ТРОМБИН - РЕГУЛЯТОР ПРОЦЕССОВ СВЕРТЫВАНИЯ, воспаления и др. сопряженных процессов

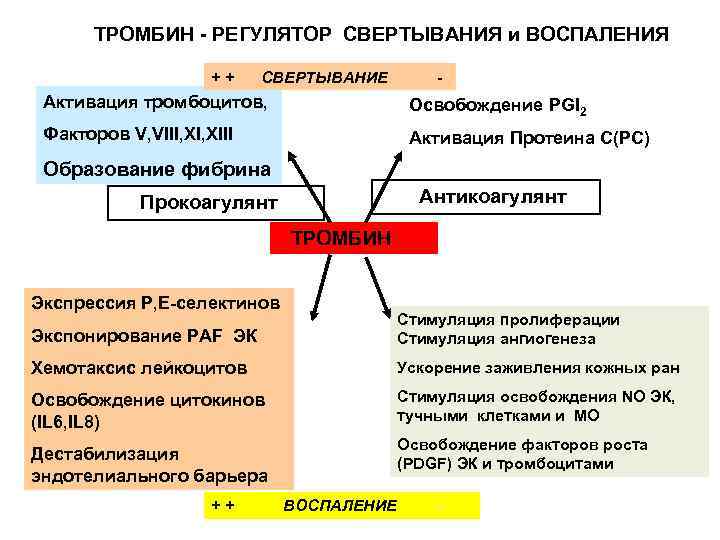 ТРОМБИН - РЕГУЛЯТОР СВЕРТЫВАНИЯ и ВОСПАЛЕНИЯ ++ СВЕРТЫВАНИЕ - Активация тромбоцитов, Освобождение PGI 2 Факторов V, VIII, XIII Активация Протеина С(PC) Образование фибрина Антикоагулянт Прокоагулянт ТРОМБИН Экспрессия Р, Е-селектинов Экспонирование PAF ЭК Стимуляция пролиферации Стимуляция ангиогенеза Хемотаксис лейкоцитов Ускорение заживления кожных ран Освобождение цитокинов (IL 6, IL 8) Стимуляция освобождения NO ЭК, тучными клетками и МО Освобождение факторов роста (PDGF) ЭК и тромбоцитами Дестабилизация эндотелиального барьера ++ ВОСПАЛЕНИЕ -
ТРОМБИН - РЕГУЛЯТОР СВЕРТЫВАНИЯ и ВОСПАЛЕНИЯ ++ СВЕРТЫВАНИЕ - Активация тромбоцитов, Освобождение PGI 2 Факторов V, VIII, XIII Активация Протеина С(PC) Образование фибрина Антикоагулянт Прокоагулянт ТРОМБИН Экспрессия Р, Е-селектинов Экспонирование PAF ЭК Стимуляция пролиферации Стимуляция ангиогенеза Хемотаксис лейкоцитов Ускорение заживления кожных ран Освобождение цитокинов (IL 6, IL 8) Стимуляция освобождения NO ЭК, тучными клетками и МО Освобождение факторов роста (PDGF) ЭК и тромбоцитами Дестабилизация эндотелиального барьера ++ ВОСПАЛЕНИЕ -
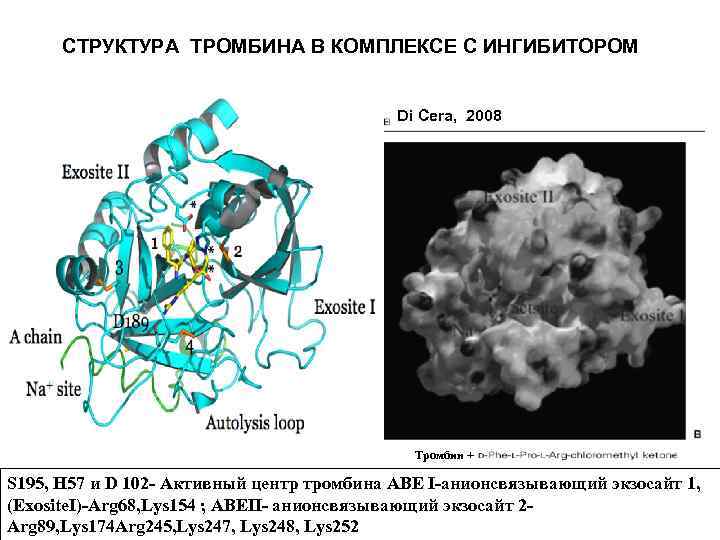 СТРУКТУРА ТРОМБИНА В КОМПЛЕКСЕ С ИНГИБИТОРОМ Di Cera, 2008 Тромбин + S 195, H 57 и D 102 - Активный центр тромбина АВЕ I-анионсвязывающий экзосайт 1, (Exosite. I)-Arg 68, Lys 154 ; ABEII- анионсвязывающий экзосайт 2 Arg 89, Lys 174 Arg 245, Lys 247, Lys 248, Lys 252
СТРУКТУРА ТРОМБИНА В КОМПЛЕКСЕ С ИНГИБИТОРОМ Di Cera, 2008 Тромбин + S 195, H 57 и D 102 - Активный центр тромбина АВЕ I-анионсвязывающий экзосайт 1, (Exosite. I)-Arg 68, Lys 154 ; ABEII- анионсвязывающий экзосайт 2 Arg 89, Lys 174 Arg 245, Lys 247, Lys 248, Lys 252
 Структура молекулы тромбина: активный центр и дополнительные участки связывания рецепторов и субстратов АВЕ I-анионсвязывающий экзосайт 1; ABEII- анионсвязывающий экзосайт 2
Структура молекулы тромбина: активный центр и дополнительные участки связывания рецепторов и субстратов АВЕ I-анионсвязывающий экзосайт 1; ABEII- анионсвязывающий экзосайт 2
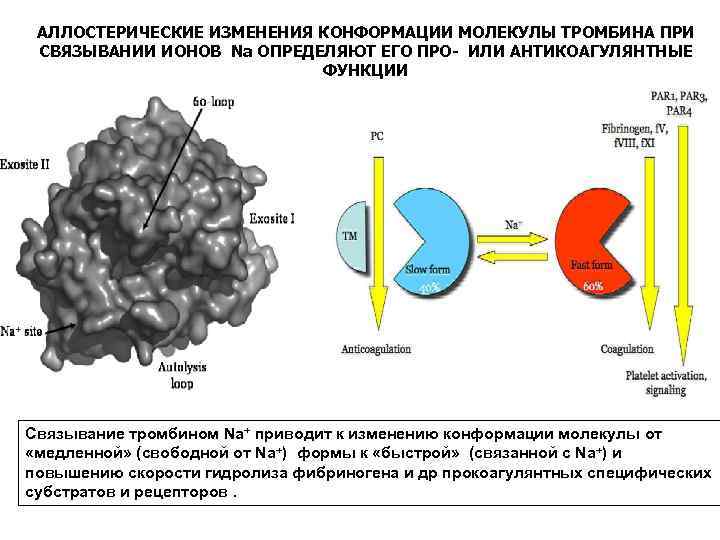 АЛЛОСТЕРИЧЕСКИЕ ИЗМЕНЕНИЯ КОНФОРМАЦИИ МОЛЕКУЛЫ ТРОМБИНА ПРИ СВЯЗЫВАНИИ ИОНОВ Nа ОПРЕДЕЛЯЮТ ЕГО ПРО- ИЛИ АНТИКОАГУЛЯНТНЫЕ ФУНКЦИИ Связывание тромбином Nа+ приводит к изменению конформации молекулы от «медленной» (свободной от Na+) формы к «быстрой» (cвязанной с Na+) и повышению скорости гидролиза фибриногена и др прокоагулянтных специфических субстратов и рецепторов.
АЛЛОСТЕРИЧЕСКИЕ ИЗМЕНЕНИЯ КОНФОРМАЦИИ МОЛЕКУЛЫ ТРОМБИНА ПРИ СВЯЗЫВАНИИ ИОНОВ Nа ОПРЕДЕЛЯЮТ ЕГО ПРО- ИЛИ АНТИКОАГУЛЯНТНЫЕ ФУНКЦИИ Связывание тромбином Nа+ приводит к изменению конформации молекулы от «медленной» (свободной от Na+) формы к «быстрой» (cвязанной с Na+) и повышению скорости гидролиза фибриногена и др прокоагулянтных специфических субстратов и рецепторов.
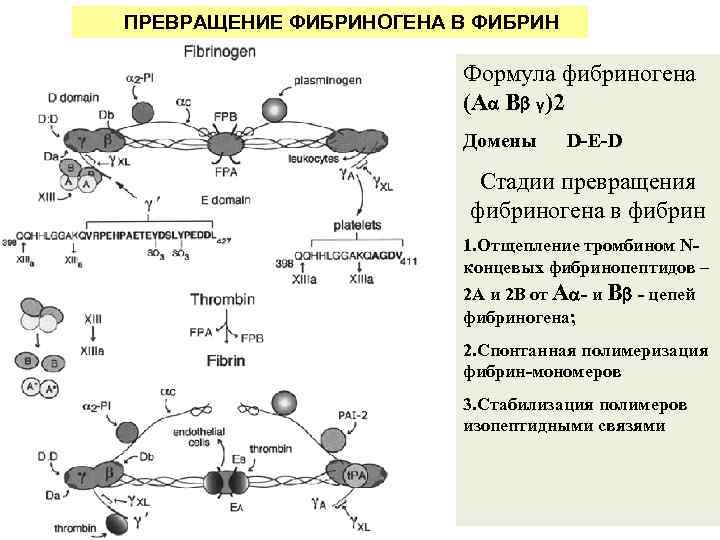 ПРЕВРАЩЕНИЕ ФИБРИНОГЕНА В ФИБРИН Формула фибриногена (A B γ)2 Домены D-E-D Стадии превращения фибриногена в фибрин 1. Отщепление тромбином Nконцевых фибринопептидов – 2 А и 2 В от A - и B - цепей фибриногена; 2. Спонтанная полимеризация фибрин-мономеров 3. Стабилизация полимеров изопептидными связями
ПРЕВРАЩЕНИЕ ФИБРИНОГЕНА В ФИБРИН Формула фибриногена (A B γ)2 Домены D-E-D Стадии превращения фибриногена в фибрин 1. Отщепление тромбином Nконцевых фибринопептидов – 2 А и 2 В от A - и B - цепей фибриногена; 2. Спонтанная полимеризация фибрин-мономеров 3. Стабилизация полимеров изопептидными связями
 ПОЛИМЕРИЗАЦИЯ ФИБРИНА
ПОЛИМЕРИЗАЦИЯ ФИБРИНА
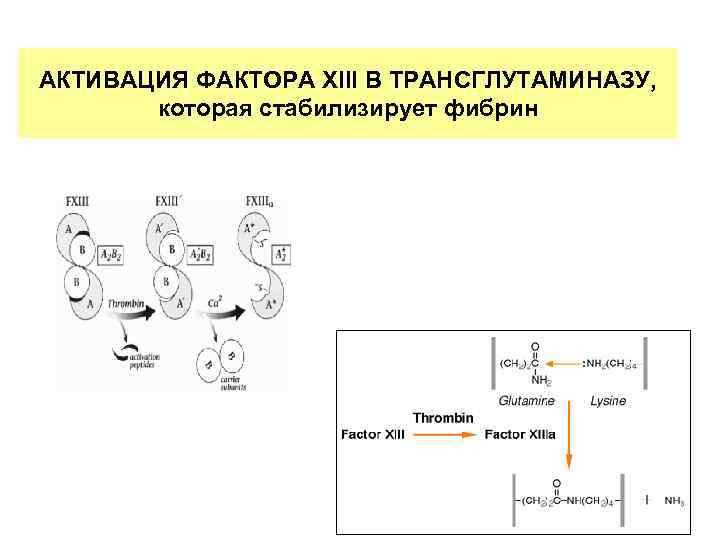 АКТИВАЦИЯ ФАКТОРА XIII В ТРАНСГЛУТАМИНАЗУ, которая стабилизирует фибрин
АКТИВАЦИЯ ФАКТОРА XIII В ТРАНСГЛУТАМИНАЗУ, которая стабилизирует фибрин
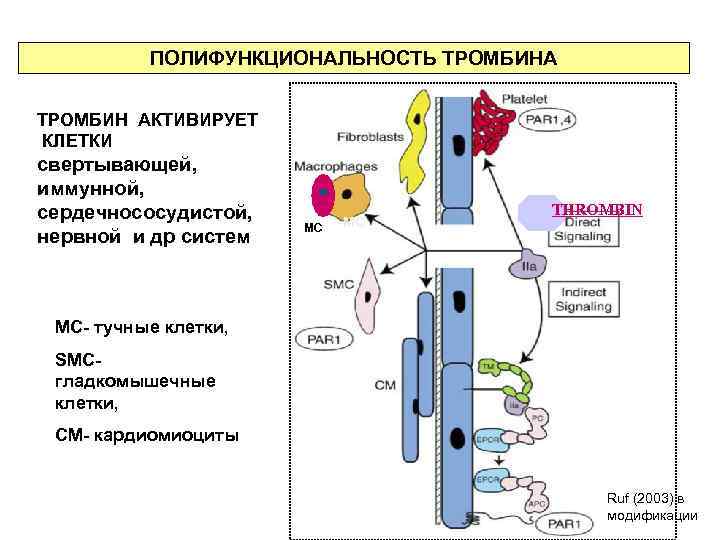 ПОЛИФУНКЦИОНАЛЬНОСТЬ ТРОМБИНА ТРОМБИН АКТИВИРУЕТ КЛЕТКИ свертывающей, иммунной, сердечнососудистой, нервной и др систем MC MC THROMBIN MC- тучные клетки, SMCгладкомышечные клетки, СМ- кардиомиоциты Ruf (2003) в модификации
ПОЛИФУНКЦИОНАЛЬНОСТЬ ТРОМБИНА ТРОМБИН АКТИВИРУЕТ КЛЕТКИ свертывающей, иммунной, сердечнососудистой, нервной и др систем MC MC THROMBIN MC- тучные клетки, SMCгладкомышечные клетки, СМ- кардиомиоциты Ruf (2003) в модификации
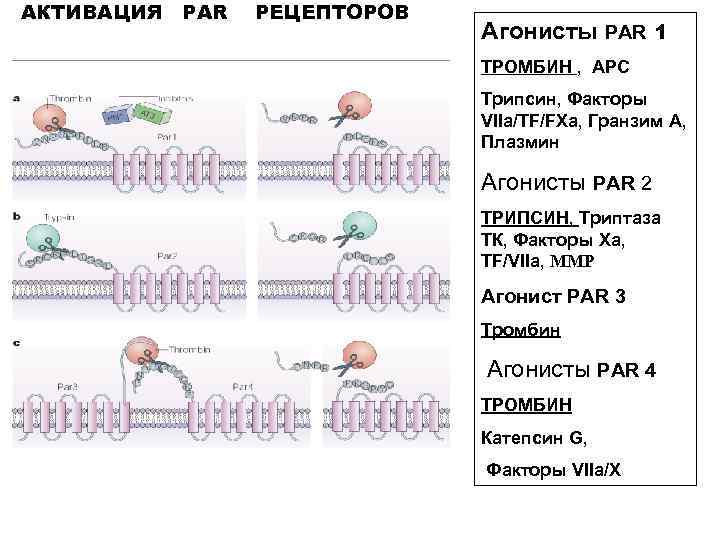 АКТИВАЦИЯ PAR РЕЦЕПТОРОВ Агонисты PAR 1 ТРОМБИН , АРС Трипсин, Факторы VIIa/TF/FXa, Гранзим А, Плазмин Агонисты PAR 2 ТРИПСИН, Триптаза ТК, Факторы Xa, TF/VIIa, ММР Агонист PAR 3 Тромбин Агонисты PAR 4 ТРОМБИН Катепсин G, Факторы VIIa/X
АКТИВАЦИЯ PAR РЕЦЕПТОРОВ Агонисты PAR 1 ТРОМБИН , АРС Трипсин, Факторы VIIa/TF/FXa, Гранзим А, Плазмин Агонисты PAR 2 ТРИПСИН, Триптаза ТК, Факторы Xa, TF/VIIa, ММР Агонист PAR 3 Тромбин Агонисты PAR 4 ТРОМБИН Катепсин G, Факторы VIIa/X
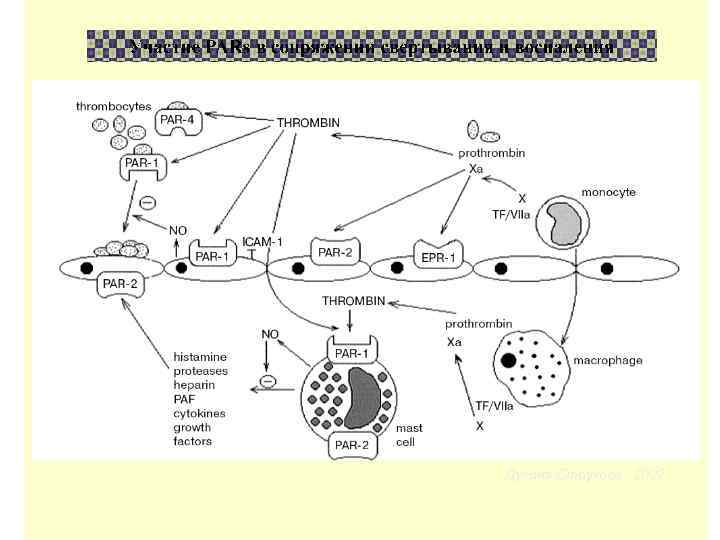 Дугина, Струкова , 2002
Дугина, Струкова , 2002
 Свертывание Воспаление Репарация тканей Протеазы- активаторы ТРОМБИН, Xa, VIIa, АРС Протеазы –ингибиторы Кат С, Плазмин, Эластаза Рецепторы PARs PAR 1, PAR 3, PAR 4 ; PAR 2, ? Корецепторы- TF, GP 1 b, EPR 1 , TM, EPCR, ? ? ? Нейрогенное воспаление, выживание клеток, боль PAR-зависимые СОСУДИСТЫЕ И ВНЕСОСУДИСТЫЕ ЭФФЕКТЫ Протеиназ Гемостаза
Свертывание Воспаление Репарация тканей Протеазы- активаторы ТРОМБИН, Xa, VIIa, АРС Протеазы –ингибиторы Кат С, Плазмин, Эластаза Рецепторы PARs PAR 1, PAR 3, PAR 4 ; PAR 2, ? Корецепторы- TF, GP 1 b, EPR 1 , TM, EPCR, ? ? ? Нейрогенное воспаление, выживание клеток, боль PAR-зависимые СОСУДИСТЫЕ И ВНЕСОСУДИСТЫЕ ЭФФЕКТЫ Протеиназ Гемостаза
 АПОПТОЗ, РОСТ И ПОДВИЖНОСТЬ КЛЕТОК, ИММУННЫЕ ОТВЕТЫ, ВОСПАЛЕНИЕ И НЕЙРОВОСПАЛЕНИЕ, РЕПАРАЦИЮ ТКАНЕЙ
АПОПТОЗ, РОСТ И ПОДВИЖНОСТЬ КЛЕТОК, ИММУННЫЕ ОТВЕТЫ, ВОСПАЛЕНИЕ И НЕЙРОВОСПАЛЕНИЕ, РЕПАРАЦИЮ ТКАНЕЙ
 Функции тромбина и других протеиназ гемостаза в ЦНС FXa Noorbakhsh et al (2003), Kiseleva et al, (2005), Strukova et al(2006), Gorbacheva et al(2007)
Функции тромбина и других протеиназ гемостаза в ЦНС FXa Noorbakhsh et al (2003), Kiseleva et al, (2005), Strukova et al(2006), Gorbacheva et al(2007)
 3. 2. ИНГИБИТОРЫ СВЕРТЫВАНИЯКУНИНЫ И СЕРПИНЫ
3. 2. ИНГИБИТОРЫ СВЕРТЫВАНИЯКУНИНЫ И СЕРПИНЫ
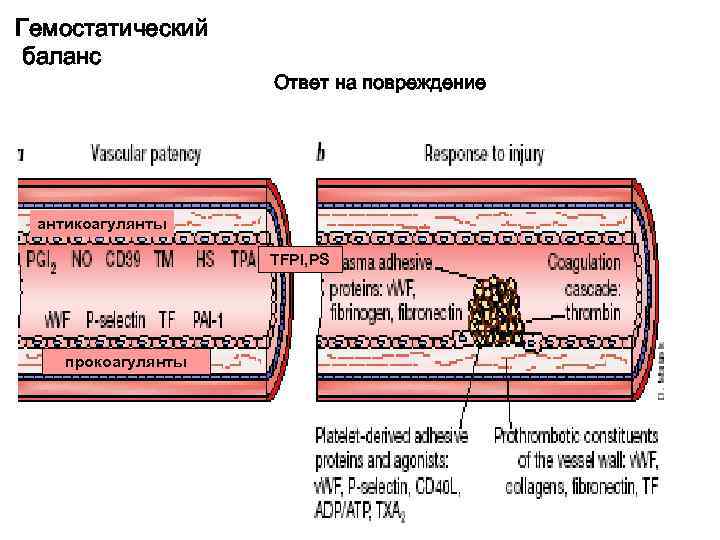 Гемостатический баланс Ответ на повреждение антикоагулянты TFPI, PS прокоагулянты
Гемостатический баланс Ответ на повреждение антикоагулянты TFPI, PS прокоагулянты
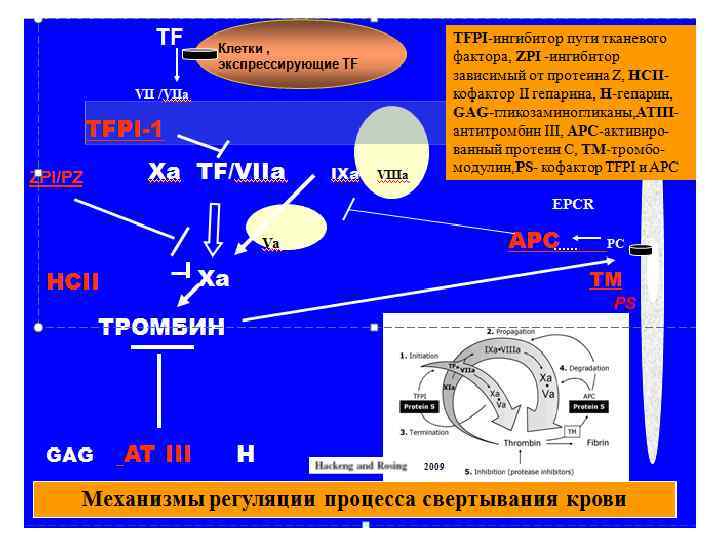
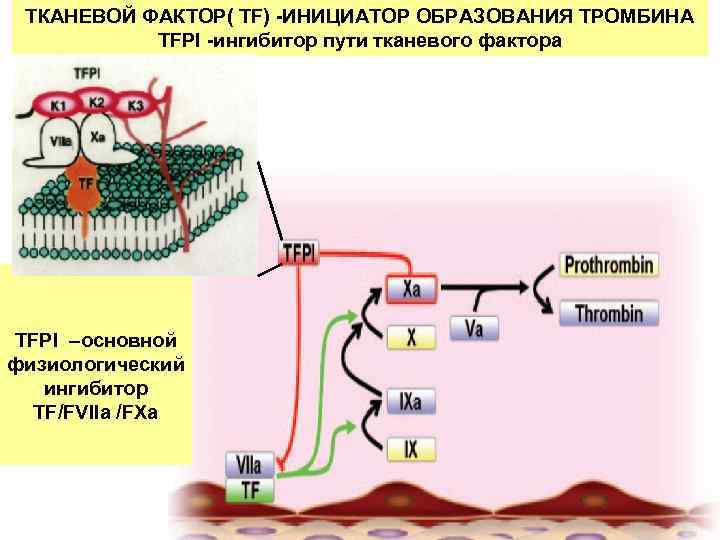 ТКАНЕВОЙ ФАКТОР( TF) -ИНИЦИАТОР ОБРАЗОВАНИЯ ТРОМБИНА TFPI -ингибитор пути тканевого фактора TFPI –основной физиологический ингибитор TF/FVIIa /FXa
ТКАНЕВОЙ ФАКТОР( TF) -ИНИЦИАТОР ОБРАЗОВАНИЯ ТРОМБИНА TFPI -ингибитор пути тканевого фактора TFPI –основной физиологический ингибитор TF/FVIIa /FXa
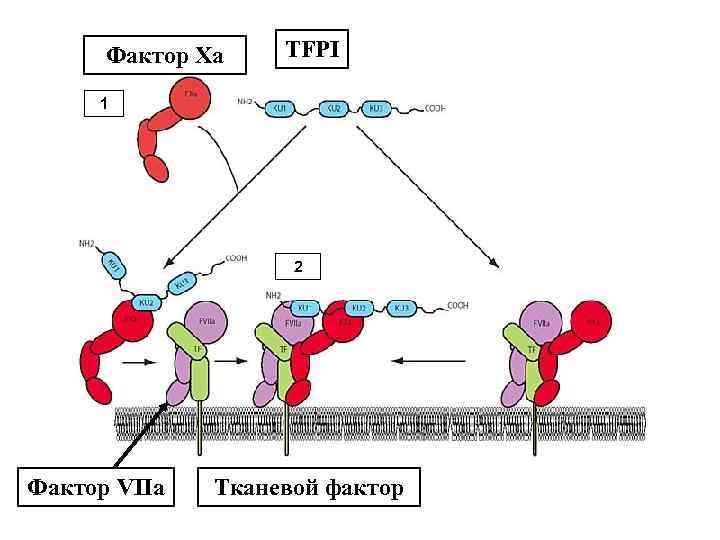 Фактор Xa TFPI 1 2 Фактор VIIa Тканевой фактор
Фактор Xa TFPI 1 2 Фактор VIIa Тканевой фактор
 ХАРАКТЕРИСТИКА ОСНОВНЫХ ИНГИБИТОРОВ СВЕРТЫВАНИЯ
ХАРАКТЕРИСТИКА ОСНОВНЫХ ИНГИБИТОРОВ СВЕРТЫВАНИЯ
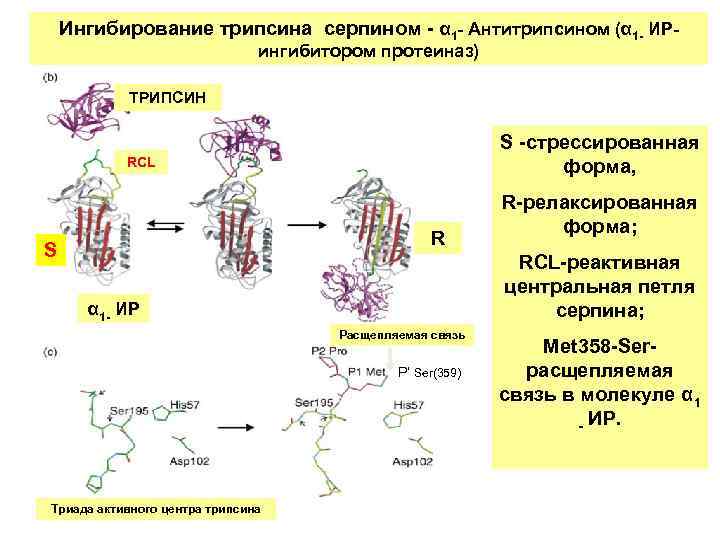 Ингибирование трипсина серпином - α 1 - Антитрипсином (α 1 - ИРингибитором протеиназ) ТРИПСИН S -стрессированная форма, RCL R S RCL-реактивная центральная петля серпина; α 1 - ИР Расщепляемая связь P’ Ser(359) Триада активного центра трипсина R-релаксированная форма; Met 358 -Serрасщепляемая связь в молекуле α 1 - ИР.
Ингибирование трипсина серпином - α 1 - Антитрипсином (α 1 - ИРингибитором протеиназ) ТРИПСИН S -стрессированная форма, RCL R S RCL-реактивная центральная петля серпина; α 1 - ИР Расщепляемая связь P’ Ser(359) Триада активного центра трипсина R-релаксированная форма; Met 358 -Serрасщепляемая связь в молекуле α 1 - ИР.
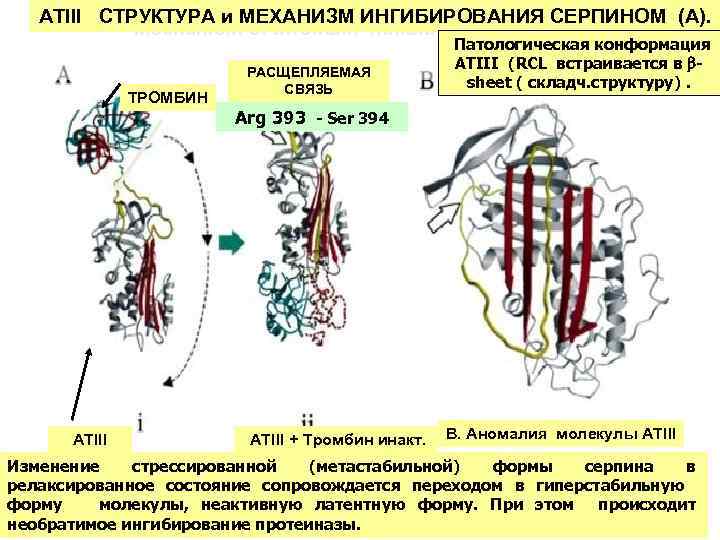 ATIII CТРУКТУРА и МЕХАНИЗМ ИНГИБИРОВАНИЯ СЕРПИНОМ (A). Mechanism of thrombin inhibition by ATIII ТРОМБИН ATIII РАСЩЕПЛЯЕМАЯ СВЯЗЬ Патологическая конформация ATIII (RCL встраивается в sheet ( складч. структуру). Arg 393 - Ser 394 ATIII + Тромбин инакт. B. Аномалия молекулы АТIII Изменение стрессированной (метастабильной) формы серпинаal. 2001 в Carrell 24 et релаксированное состояние сопровождается переходом в гиперстабильную форму молекулы, неактивную латентную форму. При этом происходит необратимое ингибирование протеиназы.
ATIII CТРУКТУРА и МЕХАНИЗМ ИНГИБИРОВАНИЯ СЕРПИНОМ (A). Mechanism of thrombin inhibition by ATIII ТРОМБИН ATIII РАСЩЕПЛЯЕМАЯ СВЯЗЬ Патологическая конформация ATIII (RCL встраивается в sheet ( складч. структуру). Arg 393 - Ser 394 ATIII + Тромбин инакт. B. Аномалия молекулы АТIII Изменение стрессированной (метастабильной) формы серпинаal. 2001 в Carrell 24 et релаксированное состояние сопровождается переходом в гиперстабильную форму молекулы, неактивную латентную форму. При этом происходит необратимое ингибирование протеиназы.
 Локализация реактивного участка АТ в связывающих участках активного центра Тромбина
Локализация реактивного участка АТ в связывающих участках активного центра Тромбина
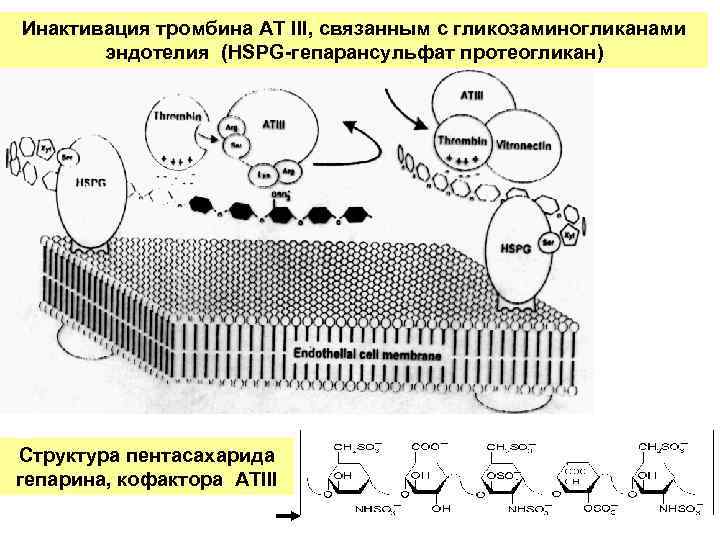 Инактивация тромбина АТ III, связанным с гликозаминогликанами эндотелия (HSPG-гепарансульфат протеогликан) Структура пентасахарида гепарина, кофактора АТIII
Инактивация тромбина АТ III, связанным с гликозаминогликанами эндотелия (HSPG-гепарансульфат протеогликан) Структура пентасахарида гепарина, кофактора АТIII
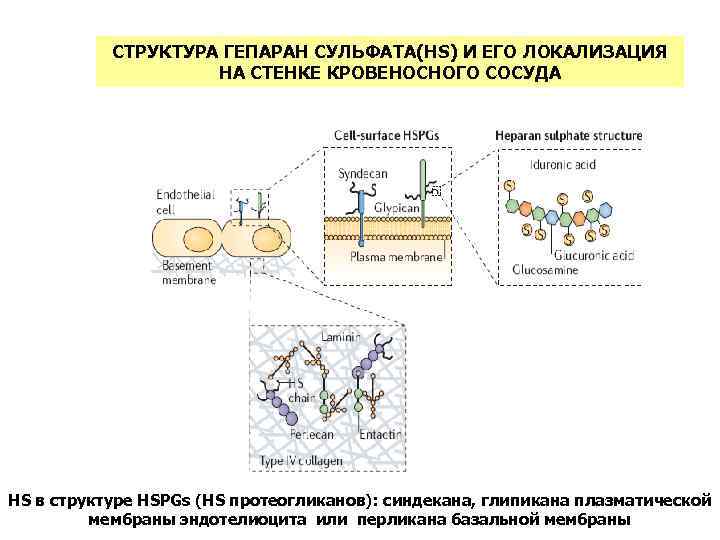 СТРУКТУРА ГЕПАРАН СУЛЬФАТА(HS) И ЕГО ЛОКАЛИЗАЦИЯ НА СТЕНКЕ КРОВЕНОСНОГО СОСУДА HS в структуре HSPGs (HS протеогликанов): синдекана, глипикана плазматической мембраны эндотелиоцита или перликана базальной мембраны
СТРУКТУРА ГЕПАРАН СУЛЬФАТА(HS) И ЕГО ЛОКАЛИЗАЦИЯ НА СТЕНКЕ КРОВЕНОСНОГО СОСУДА HS в структуре HSPGs (HS протеогликанов): синдекана, глипикана плазматической мембраны эндотелиоцита или перликана базальной мембраны
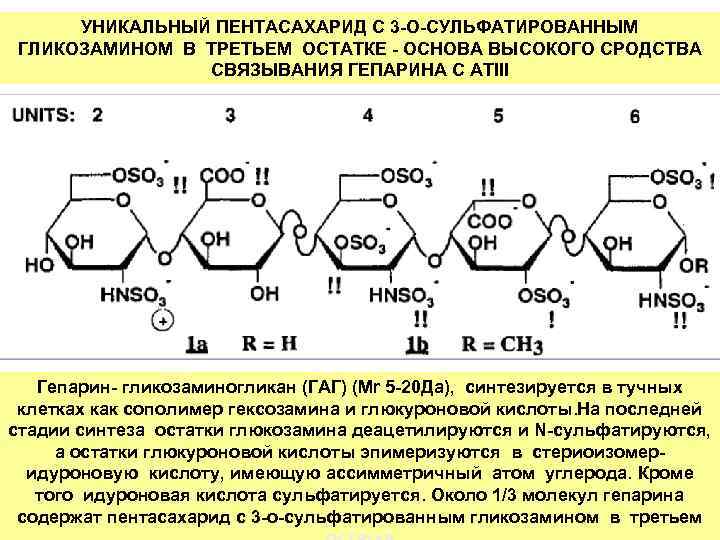 УНИКАЛЬНЫЙ ПЕНТАСАХАРИД С 3 -О-СУЛЬФАТИРОВАННЫМ ГЛИКОЗАМИНОМ В ТРЕТЬЕМ ОСТАТКЕ - ОСНОВА ВЫСОКОГО СРОДСТВА СВЯЗЫВАНИЯ ГЕПАРИНА С АТIII Гепарин- гликозаминогликан (ГАГ) (Мr 5 -20 Дa), синтезируется в тучных клетках как сополимер гексозамина и глюкуроновой кислоты. На последней стадии синтеза остатки глюкозамина деацетилируются и N-сульфатируются, а остатки глюкуроновой кислоты эпимеризуются в стериоизомеридуроновую кислоту, имеющую ассимметричный атом углерода. Кроме того идуроновая кислота сульфатируется. Около 1/3 молекул гепарина содержат пентасахарид с 3 -о-сульфатированным гликозамином в третьем
УНИКАЛЬНЫЙ ПЕНТАСАХАРИД С 3 -О-СУЛЬФАТИРОВАННЫМ ГЛИКОЗАМИНОМ В ТРЕТЬЕМ ОСТАТКЕ - ОСНОВА ВЫСОКОГО СРОДСТВА СВЯЗЫВАНИЯ ГЕПАРИНА С АТIII Гепарин- гликозаминогликан (ГАГ) (Мr 5 -20 Дa), синтезируется в тучных клетках как сополимер гексозамина и глюкуроновой кислоты. На последней стадии синтеза остатки глюкозамина деацетилируются и N-сульфатируются, а остатки глюкуроновой кислоты эпимеризуются в стериоизомеридуроновую кислоту, имеющую ассимметричный атом углерода. Кроме того идуроновая кислота сульфатируется. Около 1/3 молекул гепарина содержат пентасахарид с 3 -о-сульфатированным гликозамином в третьем
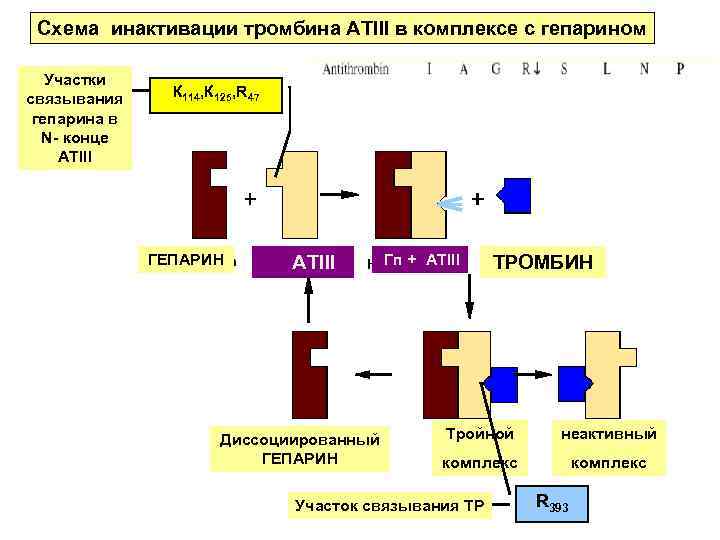 Схема инактивации тромбина АТIII в комплексе с гепарином Участки связывания гепарина в N- конце АТIII К 114, К 125, R 47 ГЕПАРИН ATIII Диссоциированный ГЕПАРИН Гп + ATIII ТРОМБИН Тройной неактивный комплекс Участок связывания ТР R 393
Схема инактивации тромбина АТIII в комплексе с гепарином Участки связывания гепарина в N- конце АТIII К 114, К 125, R 47 ГЕПАРИН ATIII Диссоциированный ГЕПАРИН Гп + ATIII ТРОМБИН Тройной неактивный комплекс Участок связывания ТР R 393
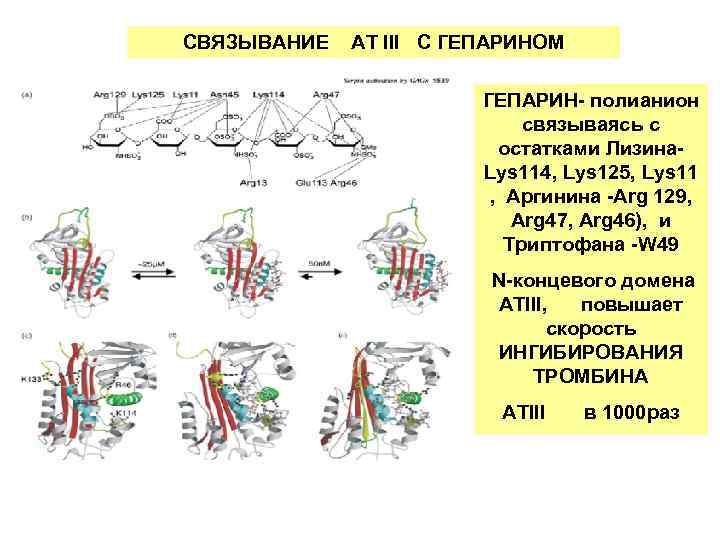 СВЯЗЫВАНИЕ АТ III С ГЕПАРИНОМ ГЕПАРИН- полианион связываясь с остатками Лизина- Lys 114, Lys 125, Lys 11 , Аргинина -Arg 129, Arg 47, Arg 46), и Триптофана -W 49 N-концевого домена АТIII, повышает скорость ИНГИБИРОВАНИЯ ТРОМБИНА АТIII в 1000 раз
СВЯЗЫВАНИЕ АТ III С ГЕПАРИНОМ ГЕПАРИН- полианион связываясь с остатками Лизина- Lys 114, Lys 125, Lys 11 , Аргинина -Arg 129, Arg 47, Arg 46), и Триптофана -W 49 N-концевого домена АТIII, повышает скорость ИНГИБИРОВАНИЯ ТРОМБИНА АТIII в 1000 раз
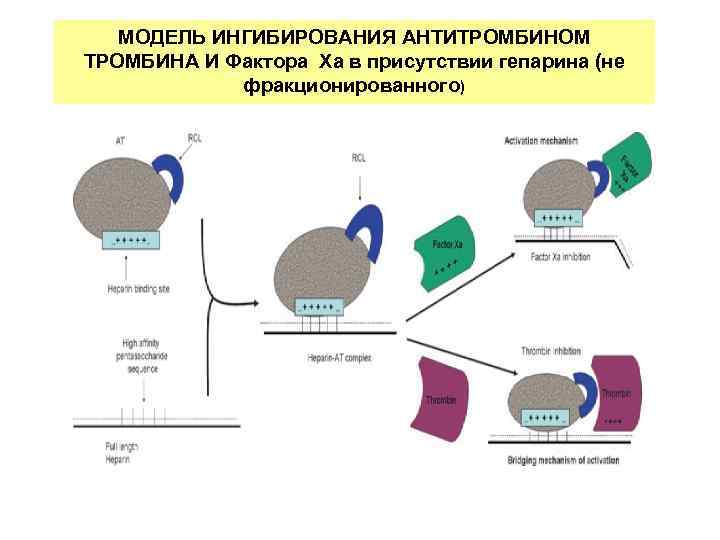 МОДЕЛЬ ИНГИБИРОВАНИЯ AНТИТРОМБИНОМ ТРОМБИНА И Фактора Xа в присутствии гепарина (не фракционированного)
МОДЕЛЬ ИНГИБИРОВАНИЯ AНТИТРОМБИНОМ ТРОМБИНА И Фактора Xа в присутствии гепарина (не фракционированного)
 ТУЧНЫЕ КЛЕТКИ ЛОКАЛИЗОВАНЫ ВДОЛЬ СОСУДОВ ТК подкожной клетчатки интактной крысы(1) ТК подкожной клетчатки крысы после 30 -мин иммобилизации(2) окраска толуидиновым синим. ув 400
ТУЧНЫЕ КЛЕТКИ ЛОКАЛИЗОВАНЫ ВДОЛЬ СОСУДОВ ТК подкожной клетчатки интактной крысы(1) ТК подкожной клетчатки крысы после 30 -мин иммобилизации(2) окраска толуидиновым синим. ув 400
 ТУЧНЫЕ КЛЕТКИ ПОДКОЖНОЙ КЛЕТЧАТКИ ЧЕЛОВЕКА(А) И ПОДСЛИЗИСТОЙ ДУОДЕНУМА(Б) 1 А 2 Тучные клетки из перитонеальной полости крысы 1 -тк интактной крысы 2 - тк крысы с эксперим атеросклерозом Б
ТУЧНЫЕ КЛЕТКИ ПОДКОЖНОЙ КЛЕТЧАТКИ ЧЕЛОВЕКА(А) И ПОДСЛИЗИСТОЙ ДУОДЕНУМА(Б) 1 А 2 Тучные клетки из перитонеальной полости крысы 1 -тк интактной крысы 2 - тк крысы с эксперим атеросклерозом Б
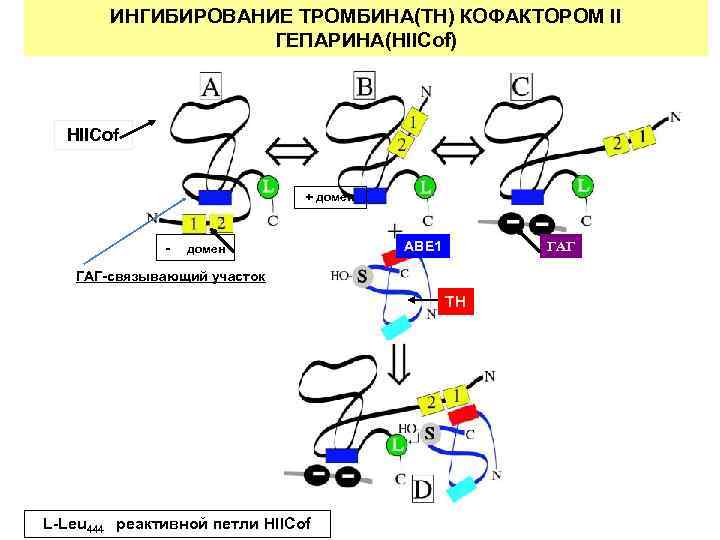 ИНГИБИРОВАНИЕ ТРОМБИНА(TH) КОФАКТОРОМ II ГЕПАРИНА(HIICof) HIICof + домен - домен ABE 1 ГАГ-связывающий участок TH L-Leu 444 реактивной петли HIICof
ИНГИБИРОВАНИЕ ТРОМБИНА(TH) КОФАКТОРОМ II ГЕПАРИНА(HIICof) HIICof + домен - домен ABE 1 ГАГ-связывающий участок TH L-Leu 444 реактивной петли HIICof
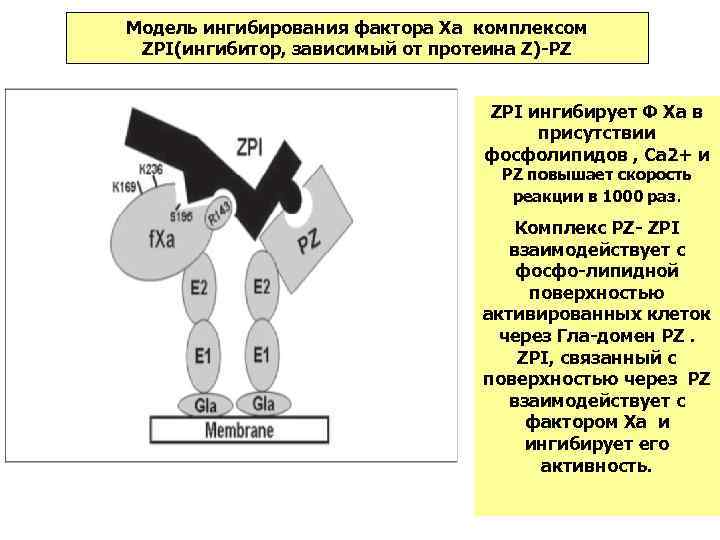 Модель ингибирования фактора Xa комплексом ZPI(ингибитор, зависимый от протеина Z)-PZ ZPI ингибирует Ф Xa в присутствии фосфолипидов , Са 2+ и PZ повышает скорость реакции в 1000 раз. Комплекс РZ- ZPI взаимодействует с фосфо-липидной поверхностью активированных клеток через Гла-домен РZ. ZPI, связанный с поверхностью через PZ взаимодействует с фактором Xa и ингибирует его активность.
Модель ингибирования фактора Xa комплексом ZPI(ингибитор, зависимый от протеина Z)-PZ ZPI ингибирует Ф Xa в присутствии фосфолипидов , Са 2+ и PZ повышает скорость реакции в 1000 раз. Комплекс РZ- ZPI взаимодействует с фосфо-липидной поверхностью активированных клеток через Гла-домен РZ. ZPI, связанный с поверхностью через PZ взаимодействует с фактором Xa и ингибирует его активность.
 СЕРПИНЫ РЕГУЛИРУЮТ ПРОТЕОЛИТИЧЕСКУЮ АКТИВНОСТЬ СЕРИНОВЫХ ПРОТЕАЗ Серпины регулируют свертывание крови, фибринолиз, воспаление, активацию системы комплемента, метастазирование и ремоделирование внеклеточного матрикса.
СЕРПИНЫ РЕГУЛИРУЮТ ПРОТЕОЛИТИЧЕСКУЮ АКТИВНОСТЬ СЕРИНОВЫХ ПРОТЕАЗ Серпины регулируют свертывание крови, фибринолиз, воспаление, активацию системы комплемента, метастазирование и ремоделирование внеклеточного матрикса.


