Копия Коллоидные системы - строение мицеллы.ppt
- Количество слайдов: 35
 Физикохимия дисперсных систем. Коллоидные системы. Дисперсными называют системы, в которых множество раздробленных частиц (дисперсная фаза - ДФ) находятся во взвешенном состоянии в непрерывной дисперсионной среде (ДС).
Физикохимия дисперсных систем. Коллоидные системы. Дисперсными называют системы, в которых множество раздробленных частиц (дисперсная фаза - ДФ) находятся во взвешенном состоянии в непрерывной дисперсионной среде (ДС).
 Классификация дисперсных систем По размеру частиц дисперсной фазы: 1. ГДС – грубодисперсные d ≈ (10 -4 – 10 -7)м Примеры • взмученная глина в воде • эмульсия жира в молоке (10 -5 м) • взвесь крахмала (10 -6 м) • взвесь эритроцитов в крови (7 • 10 -6 м) • взвесь кишечной палочки (3 • 10 -6 м)
Классификация дисперсных систем По размеру частиц дисперсной фазы: 1. ГДС – грубодисперсные d ≈ (10 -4 – 10 -7)м Примеры • взмученная глина в воде • эмульсия жира в молоке (10 -5 м) • взвесь крахмала (10 -6 м) • взвесь эритроцитов в крови (7 • 10 -6 м) • взвесь кишечной палочки (3 • 10 -6 м)
 2. КДС – коллоидно-дисперсные – золи (solution – раствор, золь) d ≈ (10 -7 – 10 -9)м • вирус гриппа (10 -7 м) • вирус ящура (10 -8 м) • гемоглобин крови (10 -9 м) • табачный дым (10 -7 м) • золь золота (10 -8 м)
2. КДС – коллоидно-дисперсные – золи (solution – раствор, золь) d ≈ (10 -7 – 10 -9)м • вирус гриппа (10 -7 м) • вирус ящура (10 -8 м) • гемоглобин крови (10 -9 м) • табачный дым (10 -7 м) • золь золота (10 -8 м)
 3. Молекулярно-ионные (истинные) d < 10 -9 м • неэлектролиты: растворы глюкозы, спирта (частицы - молекулы) • электролиты: растворы кислот, солей, оснований (частицы – молекулы, ионы)
3. Молекулярно-ионные (истинные) d < 10 -9 м • неэлектролиты: растворы глюкозы, спирта (частицы - молекулы) • электролиты: растворы кислот, солей, оснований (частицы – молекулы, ионы)
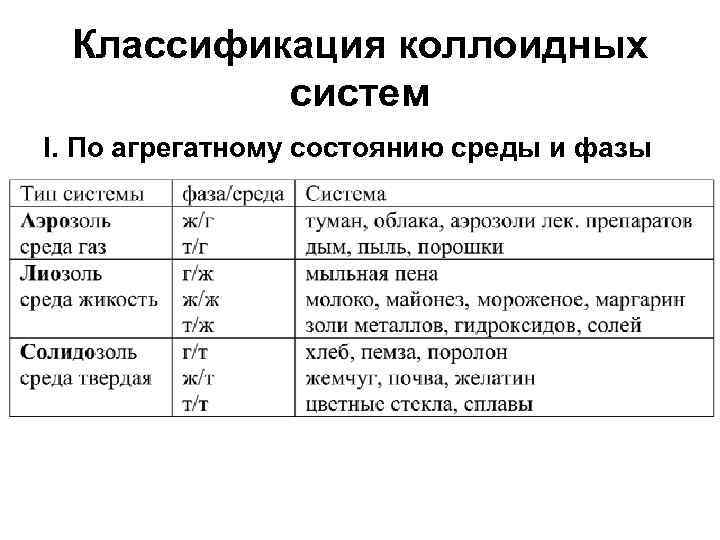 Классификация коллоидных систем I. По агрегатному состоянию среды и фазы
Классификация коллоидных систем I. По агрегатному состоянию среды и фазы
 II. По характеру взаимодействия ДФ и ДС Лиофильные (среда Н 2 О – гидрофильные) Частицы ДФ интенсивно взаимодействуют с ДС Свойства: • образуются самопроизвольно • т/д устойчивые • обратимые Примеры: растворы белков, полисахаридов, нуклеиновых кислот. Лиофобные (среда Н 2 О – гидрофобные) Частицы ДФ слабо или не взаимодействуют с ДС Свойства: • система стремится к произвольному укрупнению частиц • т/д неустойчивые • необратимые Примеры: золи металлов, гидроксидов, солей
II. По характеру взаимодействия ДФ и ДС Лиофильные (среда Н 2 О – гидрофильные) Частицы ДФ интенсивно взаимодействуют с ДС Свойства: • образуются самопроизвольно • т/д устойчивые • обратимые Примеры: растворы белков, полисахаридов, нуклеиновых кислот. Лиофобные (среда Н 2 О – гидрофобные) Частицы ДФ слабо или не взаимодействуют с ДС Свойства: • система стремится к произвольному укрупнению частиц • т/д неустойчивые • необратимые Примеры: золи металлов, гидроксидов, солей
 Характеристика коллоидных растворов Высоко дисперсные d ≈ (10 -7 – 10 -9)м, гетерогенные, гидрофобные системы • имеют большой запас поверхностной энергии Gs • термодинамически неустойчивы, т. к. Gs→Gmin • медленно диффундируют, не оседают на дно • проходят через бумажный фильтр, но задерживаются ультрафильтрами • частицы видны только в ультрамикроскоп В организме в коллоидном состоянии находятся: плазма крови, лимфа, спинномозговая жидкость, нервные клетки, вирусы, гены, протоплазма, мембраны клеток.
Характеристика коллоидных растворов Высоко дисперсные d ≈ (10 -7 – 10 -9)м, гетерогенные, гидрофобные системы • имеют большой запас поверхностной энергии Gs • термодинамически неустойчивы, т. к. Gs→Gmin • медленно диффундируют, не оседают на дно • проходят через бумажный фильтр, но задерживаются ультрафильтрами • частицы видны только в ультрамикроскоп В организме в коллоидном состоянии находятся: плазма крови, лимфа, спинномозговая жидкость, нервные клетки, вирусы, гены, протоплазма, мембраны клеток.
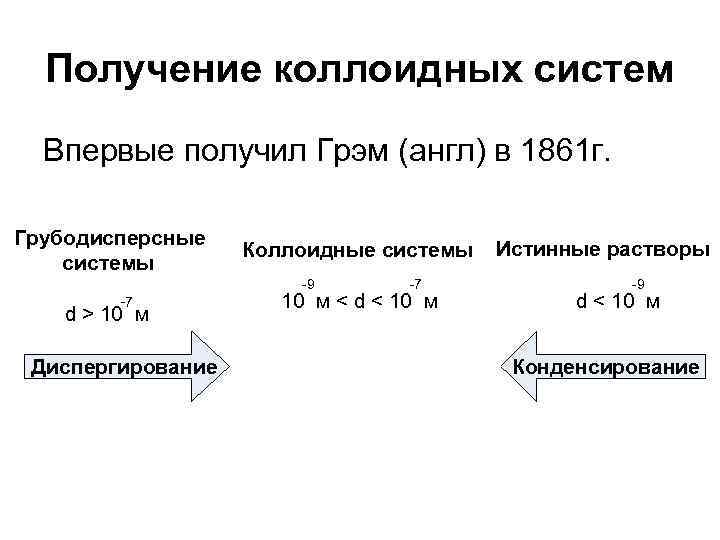 Получение коллоидных систем Впервые получил Грэм (англ) в 1861 г. Грубодисперсные системы Коллоидные системы -9 -7 d > 10 м Диспергирование -7 10 м < d < 10 м Истинные растворы -9 d < 10 м Конденсирование
Получение коллоидных систем Впервые получил Грэм (англ) в 1861 г. Грубодисперсные системы Коллоидные системы -9 -7 d > 10 м Диспергирование -7 10 м < d < 10 м Истинные растворы -9 d < 10 м Конденсирование
 Методы получения коллоидных систем I. Методы диспергирования (измельчения) • механическое дробление в шаровых и коллоидных мельницах, ступках в присутствии жидкой ДС и стабилизатора. примеры: фармацевтические препараты, какао, краски • ультразвуковое диспергирование: действие УЗ колебаний на несмешивающиеся жидкости примеры: графит, сера, краски, каучук, желатин
Методы получения коллоидных систем I. Методы диспергирования (измельчения) • механическое дробление в шаровых и коллоидных мельницах, ступках в присутствии жидкой ДС и стабилизатора. примеры: фармацевтические препараты, какао, краски • ультразвуковое диспергирование: действие УЗ колебаний на несмешивающиеся жидкости примеры: графит, сера, краски, каучук, желатин
 • электрическое диспергирование для получения золей металлов • пептизация – химическое диспергирование, перевод свежего рыхлого осадка в золь под действием пептизатора пример: расщепление сложных белков на более простые под действием пепсина, получение гидрозоля из осадка Fe(OH)3 под действием пептизатора Fe. Cl 3.
• электрическое диспергирование для получения золей металлов • пептизация – химическое диспергирование, перевод свежего рыхлого осадка в золь под действием пептизатора пример: расщепление сложных белков на более простые под действием пепсина, получение гидрозоля из осадка Fe(OH)3 под действием пептизатора Fe. Cl 3.
 II. Методы конденсации (укрупнения) Физические • метод замены растворителя • конденсация – охлаждение паров (туман, облака) Химические (реакции с образованием осадков) гидролиз Fe. Cl 3 + 3 HOH = Fe(OH)3(т) + 3 HCl Fe(OH)3 + HCl = Fe. OCl + 2 H 2 O стабилизатор окисление 2 H 2 S + O 2 = 2 S(т) + 2 H 2 O обмен Ag. NO 3 + KJ = Ag. J(т) + KNO 3
II. Методы конденсации (укрупнения) Физические • метод замены растворителя • конденсация – охлаждение паров (туман, облака) Химические (реакции с образованием осадков) гидролиз Fe. Cl 3 + 3 HOH = Fe(OH)3(т) + 3 HCl Fe(OH)3 + HCl = Fe. OCl + 2 H 2 O стабилизатор окисление 2 H 2 S + O 2 = 2 S(т) + 2 H 2 O обмен Ag. NO 3 + KJ = Ag. J(т) + KNO 3
 Методы очистки коллоидных растворов • Фильтрация – очистка от ГД частиц через обычные фильтры коллоидные частицы проходят, грубодисперсные задерживаются • Диализ – очистка от НМС (низкомолекулярных соединений) Метод основан на свойстве полупроницаемых мембран задерживать коллоидные частицы и пропускать молекулы и ионы НМС в растворитель, циркулирующий в диализаторе. недостаток: малая скорость (недели, месяцы) • Электродиализ – ускоренный диализ с использованием электрического тока (мин, часы)
Методы очистки коллоидных растворов • Фильтрация – очистка от ГД частиц через обычные фильтры коллоидные частицы проходят, грубодисперсные задерживаются • Диализ – очистка от НМС (низкомолекулярных соединений) Метод основан на свойстве полупроницаемых мембран задерживать коллоидные частицы и пропускать молекулы и ионы НМС в растворитель, циркулирующий в диализаторе. недостаток: малая скорость (недели, месяцы) • Электродиализ – ускоренный диализ с использованием электрического тока (мин, часы)
 • Ультрафильтрация – диализ под давлением или при разрежении. применение: очистка воды, белков, нуклеиновых кислот, ферментов, витаминов, для определения размеров вирусов. • Компенсационный диализ или вивидиализ – очистка от части НМС. В диализаторе растворитель заменяется раствором НМС, который необходимо оставить в коллоидном растворе. По принципу компенсационного диализа работает аппарат «искусственная почка» АИП. применение: при острых отравлениях, обширных ожогах, токсикозах, для очистки крови (гемодиализа) от шлаков: мочевины, мочевой кислоты, билирубина. Диализирующий раствор – физиологический раствор (0, 85% Na. Cl).
• Ультрафильтрация – диализ под давлением или при разрежении. применение: очистка воды, белков, нуклеиновых кислот, ферментов, витаминов, для определения размеров вирусов. • Компенсационный диализ или вивидиализ – очистка от части НМС. В диализаторе растворитель заменяется раствором НМС, который необходимо оставить в коллоидном растворе. По принципу компенсационного диализа работает аппарат «искусственная почка» АИП. применение: при острых отравлениях, обширных ожогах, токсикозах, для очистки крови (гемодиализа) от шлаков: мочевины, мочевой кислоты, билирубина. Диализирующий раствор – физиологический раствор (0, 85% Na. Cl).
 Молекулярно-кинетические свойства Броуновское движение – хаотическое тепловое движение коллоидных частиц вследствие ударов о них молекул растворителя. 1 частица испытывает ≈ 1020 ударов в секунду.
Молекулярно-кинетические свойства Броуновское движение – хаотическое тепловое движение коллоидных частиц вследствие ударов о них молекул растворителя. 1 частица испытывает ≈ 1020 ударов в секунду.
 Мера интенсивности броуновского движения (ΔX) – среднее квадратичное проекции смещения частицы (формула Эйнштейна – Смолуховского): КБ – константа Больцмана, 1, 38 • 10 -23 Дж/K; Т – температура, К; t – время, с; ŋ – вязкость, Н • с/м 2; r – радиус частицы, м.
Мера интенсивности броуновского движения (ΔX) – среднее квадратичное проекции смещения частицы (формула Эйнштейна – Смолуховского): КБ – константа Больцмана, 1, 38 • 10 -23 Дж/K; Т – температура, К; t – время, с; ŋ – вязкость, Н • с/м 2; r – радиус частицы, м.
 Диффузия – самопроизвольный процесс выравнивания концентрации частиц во всём объёме раствора или газа. Причина диффузии – броуновское движение Коэффициент диффузии (D м 2/с) рассчитывают по формуле Эйнштейна:
Диффузия – самопроизвольный процесс выравнивания концентрации частиц во всём объёме раствора или газа. Причина диффузии – броуновское движение Коэффициент диффузии (D м 2/с) рассчитывают по формуле Эйнштейна:
 Осмотическое давление Подчиняется закону Вант-Гоффа: n – число частиц в единице объёма; NA – число Авогадро
Осмотическое давление Подчиняется закону Вант-Гоффа: n – число частиц в единице объёма; NA – число Авогадро
 π, атм 0, 9% раствор Na. Cl 7, 7 1% раствор сахара 0, 725 1% раствор золя Au 0, 00045 Чем ↑ размер частиц, тем ↓ π
π, атм 0, 9% раствор Na. Cl 7, 7 1% раствор сахара 0, 725 1% раствор золя Au 0, 00045 Чем ↑ размер частиц, тем ↓ π
 Седиментация – оседание частиц дисперсной фазы в коллоидном растворе под действием силы тяжести. Скорость седиментации определяют по уравнению Стокса: U – скорость седиментации, м/с; g – ускорение силы тяжести, 9, 8 м/с2; r – радиус частицы, м; ρ – плотность дисперсной фазы, кг/м 3; ρ0 – плотность дисперсной среды, кг/м 3; ŋ – вязкость среды, Н • с/м 2. Частицы кварца r = 10 -8 м оседают в воде на 1 см за 359 дней.
Седиментация – оседание частиц дисперсной фазы в коллоидном растворе под действием силы тяжести. Скорость седиментации определяют по уравнению Стокса: U – скорость седиментации, м/с; g – ускорение силы тяжести, 9, 8 м/с2; r – радиус частицы, м; ρ – плотность дисперсной фазы, кг/м 3; ρ0 – плотность дисперсной среды, кг/м 3; ŋ – вязкость среды, Н • с/м 2. Частицы кварца r = 10 -8 м оседают в воде на 1 см за 359 дней.
 Седиментационный анализ применяется: • для определения СОЭ – скорости оседания эритроцитов у женщин в норме СОЭ 3 -12 мм/час у мужчин 2 -6 мм/час • в гравитационной хирургии (способ разделения крови, костного мозга и других жидких сред на фракции центрифугированием) • для анализа белков, ферментов, вирусов, для определения молярной массы белков.
Седиментационный анализ применяется: • для определения СОЭ – скорости оседания эритроцитов у женщин в норме СОЭ 3 -12 мм/час у мужчин 2 -6 мм/час • в гравитационной хирургии (способ разделения крови, костного мозга и других жидких сред на фракции центрифугированием) • для анализа белков, ферментов, вирусов, для определения молярной массы белков.
 Методы Плазмоферез – извлечение плазмы у больных и замена её на новую при красной волчанке, гепатите, воспалении суставов, тяжёлых отравлениях. Цитаферез - метод удаления форменных элементов циркулирующей крови: лимфоцитаферез, тромбоцитаферез, бластоцитаферез (извлечение опухолевых клеток).
Методы Плазмоферез – извлечение плазмы у больных и замена её на новую при красной волчанке, гепатите, воспалении суставов, тяжёлых отравлениях. Цитаферез - метод удаления форменных элементов циркулирующей крови: лимфоцитаферез, тромбоцитаферез, бластоцитаферез (извлечение опухолевых клеток).
 Оптические свойства При прохождении света через дисперсную систему возможны его: преломление, поглощение, отражение, рассеяние. Это зависит от соотношения между длиной волны λ и размером частиц ДФ. Для коллоидных систем характерно светорассеяние. Размеры частиц ДФ соизмеримы с длиной волны падающего света 2 r ≈ λ, поэтому световой луч огибает частицу и меняет своё направление. Происходит дифракционное рассеяние, когда каждая частица становится вторичным источником света.
Оптические свойства При прохождении света через дисперсную систему возможны его: преломление, поглощение, отражение, рассеяние. Это зависит от соотношения между длиной волны λ и размером частиц ДФ. Для коллоидных систем характерно светорассеяние. Размеры частиц ДФ соизмеримы с длиной волны падающего света 2 r ≈ λ, поэтому световой луч огибает частицу и меняет своё направление. Происходит дифракционное рассеяние, когда каждая частица становится вторичным источником света.
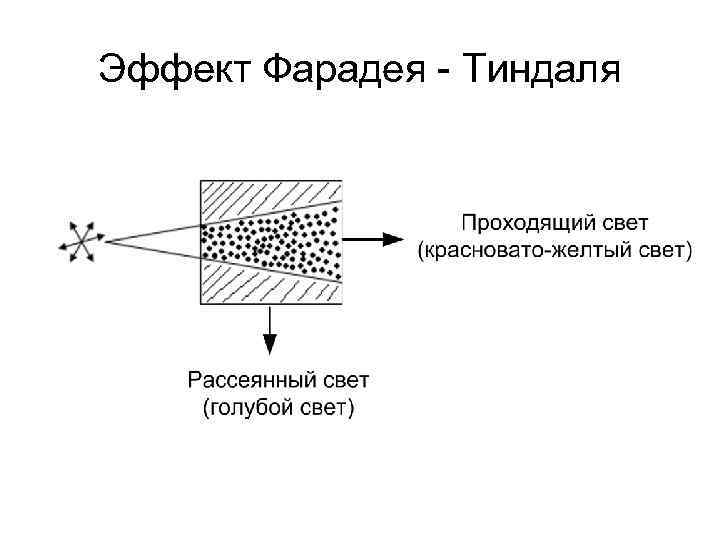 Эффект Фарадея - Тиндаля
Эффект Фарадея - Тиндаля
 Опалесценция – изменение окраски золя в рассеянном и проходящем свете. Интенсивность рассеянного света определяется по уравнению Рэлея: I, I 0 – интенсивность рассеянного и падающего света, Вт/м 2; n – число частиц в единице объёма; V – объём частицы; λ – длина волны падающего света, м; KP – константа Рэлея. На явлении светорассеяния устроен ультрамикроскоп для определения размеров частиц, при исследовании плазмы и сыворотки крови, лимфы, вакцин, для контроля чистоты воды, инъекционных растворов.
Опалесценция – изменение окраски золя в рассеянном и проходящем свете. Интенсивность рассеянного света определяется по уравнению Рэлея: I, I 0 – интенсивность рассеянного и падающего света, Вт/м 2; n – число частиц в единице объёма; V – объём частицы; λ – длина волны падающего света, м; KP – константа Рэлея. На явлении светорассеяния устроен ультрамикроскоп для определения размеров частиц, при исследовании плазмы и сыворотки крови, лимфы, вакцин, для контроля чистоты воды, инъекционных растворов.
 Строение мицеллы Коллоидный раствор состоит из мицелл и интермицеллярной жидкости Мицелла (крупинка) – частица дисперсной фазы ( ДФ), окруженная двойным электрическим слоем ( ДЭС ) Интермицеллярная жидкость – дисперсионная среда ( ДС ), содержащая электролиты, неэлектролиты, ПАВ.
Строение мицеллы Коллоидный раствор состоит из мицелл и интермицеллярной жидкости Мицелла (крупинка) – частица дисперсной фазы ( ДФ), окруженная двойным электрическим слоем ( ДЭС ) Интермицеллярная жидкость – дисперсионная среда ( ДС ), содержащая электролиты, неэлектролиты, ПАВ.
 Строение мицеллы Аg. Cl Условия : 1. Наличие твердой фазы ( Аg. Cl ) 2. Разбавленные растворы исходных веществ (Аg. NO 3 и КCL ) 3. Избыток одного из компонентов ( например, КСl ) Аg. NO 3 + КСl = Аg. Cl (т) + КNO 3 (изб) КСl <=> К+ + Сl–
Строение мицеллы Аg. Cl Условия : 1. Наличие твердой фазы ( Аg. Cl ) 2. Разбавленные растворы исходных веществ (Аg. NO 3 и КCL ) 3. Избыток одного из компонентов ( например, КСl ) Аg. NO 3 + КСl = Аg. Cl (т) + КNO 3 (изб) КСl <=> К+ + Сl–
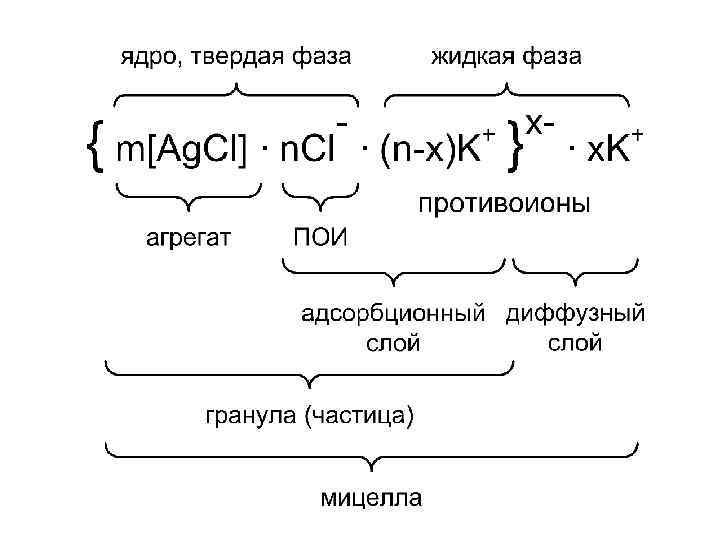
 • Агрегат: сотни молекул твердой фазы, нейтрален, имеет аморфное или кристаллическое строение. • Потенциалопределяющие ионы ( ПОИ ) – ионы стабилизатора, которые адсорбируются полностью по правилу Панета – Фаянса на поверхности агрегата и сообщают ему заряд. • Ядро : агрегат + ПОИ- твердая фаза. • Противоионы: ионы стабилизатора, противоположные по знаку ПОИ располагаются в дисперсионной среде – жидкая фаза.
• Агрегат: сотни молекул твердой фазы, нейтрален, имеет аморфное или кристаллическое строение. • Потенциалопределяющие ионы ( ПОИ ) – ионы стабилизатора, которые адсорбируются полностью по правилу Панета – Фаянса на поверхности агрегата и сообщают ему заряд. • Ядро : агрегат + ПОИ- твердая фаза. • Противоионы: ионы стабилизатора, противоположные по знаку ПОИ располагаются в дисперсионной среде – жидкая фаза.
 • ( n – x ) – часть противоионов стабилизатора связаны с ядром силами адсорбции и электростатического притяжения. • Адсорбционный слой: ПОИ + ( n-x ) противоионов. • Диффузный слой: остальная часть противоионов слабо связаны с ядром (только электростатически) под влиянием диффузии располагаются в жидкой дисперсионной среде. • Гранула: агрегат + адсорбционный слой.
• ( n – x ) – часть противоионов стабилизатора связаны с ядром силами адсорбции и электростатического притяжения. • Адсорбционный слой: ПОИ + ( n-x ) противоионов. • Диффузный слой: остальная часть противоионов слабо связаны с ядром (только электростатически) под влиянием диффузии располагаются в жидкой дисперсионной среде. • Гранула: агрегат + адсорбционный слой.
 • Заряд гранулы равен по величине , но противоположен по знаку заряду ионов диффузного слоя. • Мицелла: гранула + диффузный слой электронейтральна.
• Заряд гранулы равен по величине , но противоположен по знаку заряду ионов диффузного слоя. • Мицелла: гранула + диффузный слой электронейтральна.
 Мицелла Аg. Cl в избытке Аg. NO 3 <=> Аg+ + NO 3– {m[Ag. Cl] · n. Ag+ · (n-x)NO 3–}x+ · x. NO 3– Знак заряда золя определяется по знаку заряда гранулы и ПОИ.
Мицелла Аg. Cl в избытке Аg. NO 3 <=> Аg+ + NO 3– {m[Ag. Cl] · n. Ag+ · (n-x)NO 3–}x+ · x. NO 3– Знак заряда золя определяется по знаку заряда гранулы и ПОИ.
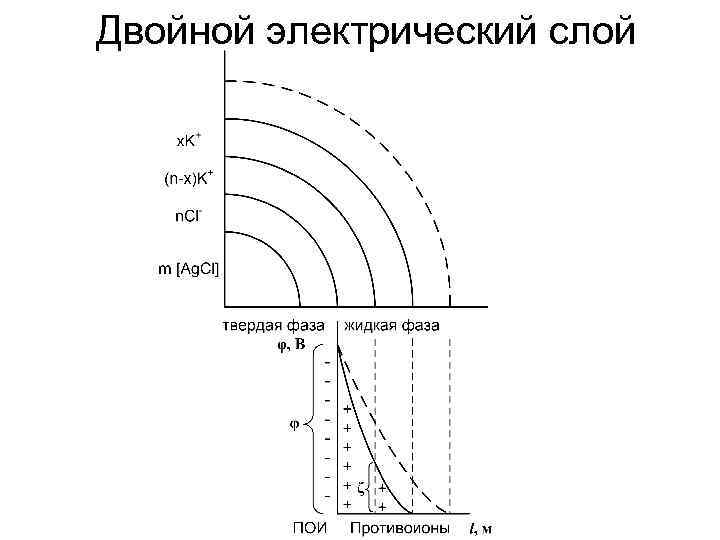 Двойной электрический слой
Двойной электрический слой
 Электрокинетические свойства Электротермодинамический потенциал На границе твердой и жидкой фаз (между ПОИ и противоионами) возникает ДЭС = разность потенциалов – электротермодинамический потенциал (φ). Знак и величина его зависит от ПОИ. По мере удаления от межфазной границы его значение уменьшается.
Электрокинетические свойства Электротермодинамический потенциал На границе твердой и жидкой фаз (между ПОИ и противоионами) возникает ДЭС = разность потенциалов – электротермодинамический потенциал (φ). Знак и величина его зависит от ПОИ. По мере удаления от межфазной границы его значение уменьшается.
 Электрокинетический потенциал В электрическом поле гранула и диффузный слой движутся в противоположных направлениях, поэтому границу между ними называют поверхностью скольжения. На поверхности скольжения возникает ДЭС и электрокинетический потенциал или ζ потенциал (дзета – потенциал).
Электрокинетический потенциал В электрическом поле гранула и диффузный слой движутся в противоположных направлениях, поэтому границу между ними называют поверхностью скольжения. На поверхности скольжения возникает ДЭС и электрокинетический потенциал или ζ потенциал (дзета – потенциал).
 ζ - потенциал это часть термодинамического потенциала φ, имеет одинаковый с ним знак, но всегда меньше его. ζ -потенциал зависит: 1. От толщины диффузного слоя (l): чем ↑l, тем ↑ζ. При коагуляции ζ - потенциал ↓. 2. От температуры. ζ - потенциал – мера устойчивости коллоидного раствора. Чем ↑ζ, тем ↑ устойчивость системы. Если ζ = 0, то система находится в изоэлектрическом состоянии (ИЭС).
ζ - потенциал это часть термодинамического потенциала φ, имеет одинаковый с ним знак, но всегда меньше его. ζ -потенциал зависит: 1. От толщины диффузного слоя (l): чем ↑l, тем ↑ζ. При коагуляции ζ - потенциал ↓. 2. От температуры. ζ - потенциал – мера устойчивости коллоидного раствора. Чем ↑ζ, тем ↑ устойчивость системы. Если ζ = 0, то система находится в изоэлектрическом состоянии (ИЭС).


