01 свойства воды.pptx
- Количество слайдов: 40
 Физико-химические методы водоподготовки
Физико-химические методы водоподготовки
 Вода – это жизнь «Вода есть первопричина всего сущего» . Фалес, древнегреческий философ «Нет такого соединения, которое могло бы сравниться с водой по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества, минерала, горной породы, живого тела, которое бы ее не включало» . Академик В. И. Вернадский «Роль воды в жизни планеты определяющая, потому что все изменения климата, все условия для существования жизни создаются водной средой и кругооборот, который мы наблюдаем, направлен именно на существование и развитие живых существ» . Академик В. И. Вернадский «Вода самое распространенное вещество на Земле и сам человек состоит на 80% из воды и, тем не менее, это не изученное вещество» . Академик П. И. Госьков «Живой организм есть одушевленная вода» . Э. Дюбуа-Реймон, биолог «Вода – это жизнь» (надпись на входе в Музей воды ГУП «Водоканал Санкт Петербурга» ) Физико-химические методы водоподготовки 2
Вода – это жизнь «Вода есть первопричина всего сущего» . Фалес, древнегреческий философ «Нет такого соединения, которое могло бы сравниться с водой по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества, минерала, горной породы, живого тела, которое бы ее не включало» . Академик В. И. Вернадский «Роль воды в жизни планеты определяющая, потому что все изменения климата, все условия для существования жизни создаются водной средой и кругооборот, который мы наблюдаем, направлен именно на существование и развитие живых существ» . Академик В. И. Вернадский «Вода самое распространенное вещество на Земле и сам человек состоит на 80% из воды и, тем не менее, это не изученное вещество» . Академик П. И. Госьков «Живой организм есть одушевленная вода» . Э. Дюбуа-Реймон, биолог «Вода – это жизнь» (надпись на входе в Музей воды ГУП «Водоканал Санкт Петербурга» ) Физико-химические методы водоподготовки 2
 Самое распространенное и самое загадочное вещество Вода в нашей жизни самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Трудно назвать какое либо свойство воды, которое не было бы аномальным. Вода — одно из немногих веществ, которое может в земных условиях находиться во всех трёх физических состояниях: твёрдом, жидком и газообразном. Количество воды на поверхности Земли оценивается в 1, 39*1018 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет 2*104 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2, 4*1016 т, примерно столько же имеется подземных вод, причем только небольшая их часть пресные. В глубинных слоях Земли содержится значительно больше (по видимому, не менее, чем на порядок) воды, чем на поверхности. В атмосфере находится около 1, 3*1013 т воды. Вода входит в состав многих минералов и горных пород (глины, гипс и др. ), присутствует в почве, является обязательным компонентом всех живых организмов. Уникальные и аномальные свойства воды связаны, прежде всего, с ее молекулярной и надмолекулярной структурой Физико-химические методы водоподготовки 3
Самое распространенное и самое загадочное вещество Вода в нашей жизни самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Трудно назвать какое либо свойство воды, которое не было бы аномальным. Вода — одно из немногих веществ, которое может в земных условиях находиться во всех трёх физических состояниях: твёрдом, жидком и газообразном. Количество воды на поверхности Земли оценивается в 1, 39*1018 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет 2*104 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2, 4*1016 т, примерно столько же имеется подземных вод, причем только небольшая их часть пресные. В глубинных слоях Земли содержится значительно больше (по видимому, не менее, чем на порядок) воды, чем на поверхности. В атмосфере находится около 1, 3*1013 т воды. Вода входит в состав многих минералов и горных пород (глины, гипс и др. ), присутствует в почве, является обязательным компонентом всех живых организмов. Уникальные и аномальные свойства воды связаны, прежде всего, с ее молекулярной и надмолекулярной структурой Физико-химические методы водоподготовки 3
 Вода – самое распространенное вещество на Земле. Вода занимает 3/4 земной поверхности. Общее содержание воды на Земле составляет ~ 1, 45 млн. км 3 Суша Вода Молекула Воды состоит из: двух атомов водорода (Н) и одного атома кислорода (О) Химическая формула воды – Н 2 О. Физико-химические методы водоподготовки 4
Вода – самое распространенное вещество на Земле. Вода занимает 3/4 земной поверхности. Общее содержание воды на Земле составляет ~ 1, 45 млн. км 3 Суша Вода Молекула Воды состоит из: двух атомов водорода (Н) и одного атома кислорода (О) Химическая формула воды – Н 2 О. Физико-химические методы водоподготовки 4
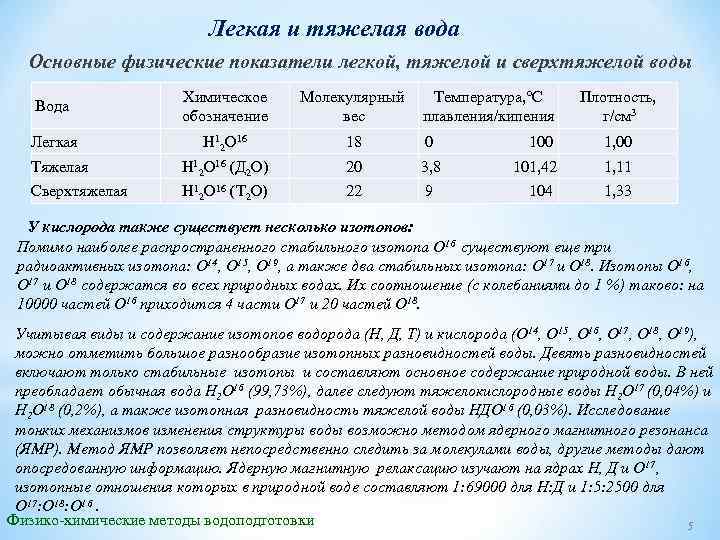 Легкая и тяжелая вода Основные физические показатели легкой, тяжелой и сверхтяжелой воды Вода Химическое обозначение Молекулярный Температура, °С вес плавления/кипения Плотность, г/см 3 Легкая Н 12 О 16 18 0 100 1, 00 Тяжелая Н 12 О 16 (Д 2 О) 20 3, 8 101, 42 1, 11 Сверхтяжелая Н 12 О 16 (Т 2 О) 22 9 104 1, 33 У кислорода также существует несколько изотопов: Помимо наиболее распространенного стабильного изотопа О 16 существуют еще три радиоактивных изотопа: О 14, О 15, О 19, а также два стабильных изотопа: О 17 и О 18. Изотопы О 16, О 17 и О 18 содержатся во всех природных водах. Их соотношение (с колебаниями до 1 %) таково: на 10000 частей О 16 приходится 4 части О 17 и 20 частей О 18. Учитывая виды и содержание изотопов водорода (Н, Д, Т) и кислорода (О 14, О 15, О 16, О 17, О 18, О 19), можно отметить большое разнообразие изотопных разновидностей воды. Девять разновидностей включают только стабильные изотопы и составляют основное содержание природной воды. В ней преобладает обычная вода Н 2 О 16 (99, 73%), далее следуют тяжелокислородные воды Н 2 О 17 (0, 04%) и Н 2 О 18 (0, 2%), а также изотопная разновидность тяжелой воды НДО 16 (0, 03%). Исследование тонких механизмов изменения структуры воды возможно методом ядерного магнитного резонанса (ЯМР). Метод ЯМР позволяет непосредственно следить за молекулами воды, другие методы дают опосредованную информацию. Ядерную магнитную релаксацию изучают на ядрах Н, Д и О 17, изотопные отношения которых в природной воде составляют 1: 69000 для Н: Д и 1: 5: 2500 для О 17: О 18: О 16. Физико-химические методы водоподготовки 5
Легкая и тяжелая вода Основные физические показатели легкой, тяжелой и сверхтяжелой воды Вода Химическое обозначение Молекулярный Температура, °С вес плавления/кипения Плотность, г/см 3 Легкая Н 12 О 16 18 0 100 1, 00 Тяжелая Н 12 О 16 (Д 2 О) 20 3, 8 101, 42 1, 11 Сверхтяжелая Н 12 О 16 (Т 2 О) 22 9 104 1, 33 У кислорода также существует несколько изотопов: Помимо наиболее распространенного стабильного изотопа О 16 существуют еще три радиоактивных изотопа: О 14, О 15, О 19, а также два стабильных изотопа: О 17 и О 18. Изотопы О 16, О 17 и О 18 содержатся во всех природных водах. Их соотношение (с колебаниями до 1 %) таково: на 10000 частей О 16 приходится 4 части О 17 и 20 частей О 18. Учитывая виды и содержание изотопов водорода (Н, Д, Т) и кислорода (О 14, О 15, О 16, О 17, О 18, О 19), можно отметить большое разнообразие изотопных разновидностей воды. Девять разновидностей включают только стабильные изотопы и составляют основное содержание природной воды. В ней преобладает обычная вода Н 2 О 16 (99, 73%), далее следуют тяжелокислородные воды Н 2 О 17 (0, 04%) и Н 2 О 18 (0, 2%), а также изотопная разновидность тяжелой воды НДО 16 (0, 03%). Исследование тонких механизмов изменения структуры воды возможно методом ядерного магнитного резонанса (ЯМР). Метод ЯМР позволяет непосредственно следить за молекулами воды, другие методы дают опосредованную информацию. Ядерную магнитную релаксацию изучают на ядрах Н, Д и О 17, изотопные отношения которых в природной воде составляют 1: 69000 для Н: Д и 1: 5: 2500 для О 17: О 18: О 16. Физико-химические методы водоподготовки 5
 * Вода в природе встречается в трех состояниях: твердом, жидком и газообразном. * Жидкое состояние: моря, океаны, реки, озёра, дожди, роса. * Твердое состояние: снег, лед, град. * Газообразное состояние: пар, туман. 6
* Вода в природе встречается в трех состояниях: твердом, жидком и газообразном. * Жидкое состояние: моря, океаны, реки, озёра, дожди, роса. * Твердое состояние: снег, лед, град. * Газообразное состояние: пар, туман. 6
 7
7
 * Вода – самое ценное и необходимое вещество. * Вода – источник жизни. * Тело человека более, чем на половину состоит из воды. Потеря воды организмом может привести к смерти. * Во всех отраслях промышленности, в земледелии, в энергетике необходима вода. 8
* Вода – самое ценное и необходимое вещество. * Вода – источник жизни. * Тело человека более, чем на половину состоит из воды. Потеря воды организмом может привести к смерти. * Во всех отраслях промышленности, в земледелии, в энергетике необходима вода. 8
 Основные физические свойства воды 9
Основные физические свойства воды 9
 Основные физические свойства воды 10
Основные физические свойства воды 10
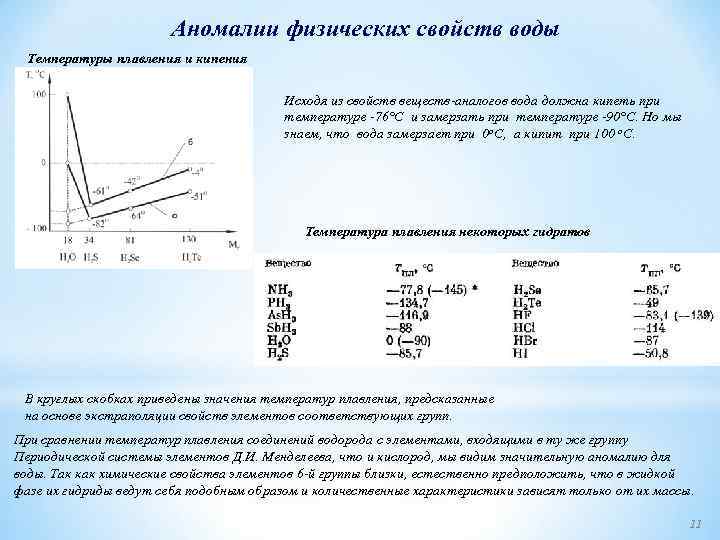 Аномалии физических свойств воды Температуры плавления и кипения Исходя из свойств веществ аналогов вода должна кипеть при температуре 76°С и замерзать при температуре 90°С. Но мы знаем, что вода замерзает при 0 о. С, а кипит при 100 о. С. Температура плавления некоторых гидратов В круглых скобках приведены значения температур плавления, предсказанные на основе экстраполяции свойств элементов соответствующих групп. При сравнении температур плавления соединений водорода с элементами, входящими в ту же группу Периодической системы элементов Д. И. Менделеева, что и кислород, мы видим значительную аномалию для воды. Так как химические свойства элементов 6 й группы близки, естественно предположить, что в жидкой фазе их гидриды ведут себя подобным образом и количественные характеристики зависят только от их массы. 11
Аномалии физических свойств воды Температуры плавления и кипения Исходя из свойств веществ аналогов вода должна кипеть при температуре 76°С и замерзать при температуре 90°С. Но мы знаем, что вода замерзает при 0 о. С, а кипит при 100 о. С. Температура плавления некоторых гидратов В круглых скобках приведены значения температур плавления, предсказанные на основе экстраполяции свойств элементов соответствующих групп. При сравнении температур плавления соединений водорода с элементами, входящими в ту же группу Периодической системы элементов Д. И. Менделеева, что и кислород, мы видим значительную аномалию для воды. Так как химические свойства элементов 6 й группы близки, естественно предположить, что в жидкой фазе их гидриды ведут себя подобным образом и количественные характеристики зависят только от их массы. 11
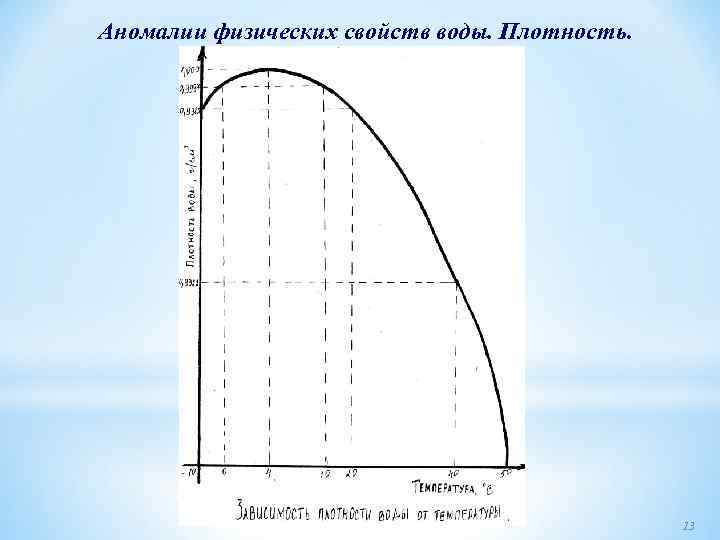
 Аномалии физических свойств воды Аномалия плотности. Существует сразу две аномалии плотности воды. 1. При повышении температуры воды от 0 о. С и до 4 о. С плотность воды увеличивается, проходит через максимум при 4 о. С и только затем уменьшается с ростом температуры. В обычных жидкостях плотность всегда уменьшается с температурой. И это понятно. Чем больше температура, тем больше тепловая скорость молекул, тем сильнее они расталкивают друга, приводя к большей рыхлости вещества. Разумеется, и в воде повышение температуры увеличивает тепловую скорость молекул, но почему то это приводит в ней к понижению плотности только при высоких температурах. 2. Плотность воды больше плотности льда (благодаря этому лед плавает на поверхности воды, вода в реках зимой не вымерзает до дна и т. д. ). Обычно же при плавлении плотность жидкости оказывается меньше, чем у кристалла. Это тоже имеет простое физическое объяснение. В кристаллах молекулы расположены регулярно, обладают пространственной периодичностью это свойство кристаллов всех веществ. Но у обычных веществ молекулы в кристаллах, кроме того, плотно упакованы. После плавления кристалла регулярность в расположении молекул исчезает, и это возможно только при более рыхлой упаковке молекул, то есть плавление обычно сопровождается уменьшением плотности вещества. Такого рода уменьшение плотности очень мало: например, при плавлении металлов она уменьшается на 2 4%. А плотность воды превышает плотность льда сразу на 10%! То есть скачок плотности при плавлении льда аномален не только по знаку, но и по величине. Переохлажденная вода. В последнее время много внимания уделяется изучению свойств переохлажденной воды, то есть остающейся в жидком состоянии ниже точки замерзания 0 о. С. (Переохладить воду можно либо в тонких капиллярах, либо еще лучше в виде эмульсии: маленьких капелек в неполярной среде "масле"). Что же происходит с аномалией плотности при переохлаждении воды? Она ведет себя странно. С одной стороны, плотность воды сильно уменьшается по мере переохлаждения (то есть первая аномалия усиливается), но, с другой стороны, она приближается к плотности льда при понижении температуры (то есть вторая аномалия ослабевает). 12
Аномалии физических свойств воды Аномалия плотности. Существует сразу две аномалии плотности воды. 1. При повышении температуры воды от 0 о. С и до 4 о. С плотность воды увеличивается, проходит через максимум при 4 о. С и только затем уменьшается с ростом температуры. В обычных жидкостях плотность всегда уменьшается с температурой. И это понятно. Чем больше температура, тем больше тепловая скорость молекул, тем сильнее они расталкивают друга, приводя к большей рыхлости вещества. Разумеется, и в воде повышение температуры увеличивает тепловую скорость молекул, но почему то это приводит в ней к понижению плотности только при высоких температурах. 2. Плотность воды больше плотности льда (благодаря этому лед плавает на поверхности воды, вода в реках зимой не вымерзает до дна и т. д. ). Обычно же при плавлении плотность жидкости оказывается меньше, чем у кристалла. Это тоже имеет простое физическое объяснение. В кристаллах молекулы расположены регулярно, обладают пространственной периодичностью это свойство кристаллов всех веществ. Но у обычных веществ молекулы в кристаллах, кроме того, плотно упакованы. После плавления кристалла регулярность в расположении молекул исчезает, и это возможно только при более рыхлой упаковке молекул, то есть плавление обычно сопровождается уменьшением плотности вещества. Такого рода уменьшение плотности очень мало: например, при плавлении металлов она уменьшается на 2 4%. А плотность воды превышает плотность льда сразу на 10%! То есть скачок плотности при плавлении льда аномален не только по знаку, но и по величине. Переохлажденная вода. В последнее время много внимания уделяется изучению свойств переохлажденной воды, то есть остающейся в жидком состоянии ниже точки замерзания 0 о. С. (Переохладить воду можно либо в тонких капиллярах, либо еще лучше в виде эмульсии: маленьких капелек в неполярной среде "масле"). Что же происходит с аномалией плотности при переохлаждении воды? Она ведет себя странно. С одной стороны, плотность воды сильно уменьшается по мере переохлаждения (то есть первая аномалия усиливается), но, с другой стороны, она приближается к плотности льда при понижении температуры (то есть вторая аномалия ослабевает). 12
 Аномалии физических свойств воды. Плотность. 13
Аномалии физических свойств воды. Плотность. 13
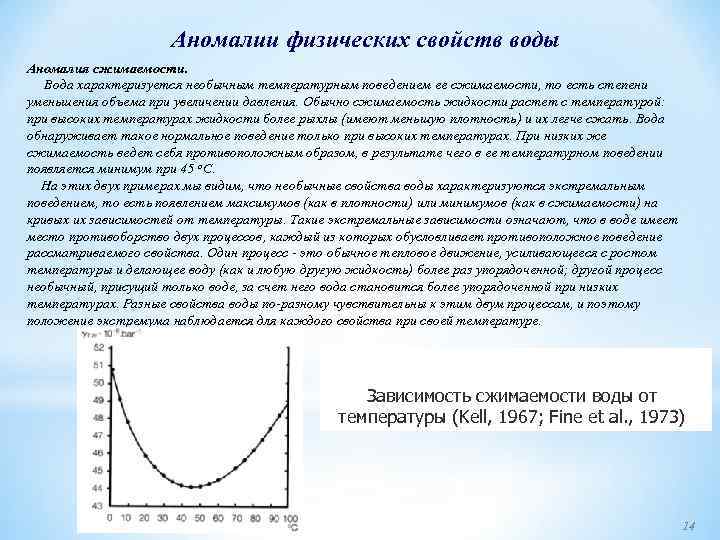 Аномалии физических свойств воды Аномалия сжимаемости. Вода характеризуется необычным температурным поведением ее сжимаемости, то есть степени уменьшения объема при увеличении давления. Обычно сжимаемость жидкости растет с температурой: при высоких температурах жидкости более рыхлы (имеют меньшую плотность) и их легче сжать. Вода обнаруживает такое нормальное поведение только при высоких температурах. При низких же сжимаемость ведет себя противоположным образом, в результате чего в ее температурном поведении появляется минимум при 45 о. С. На этих двух примерах мы видим, что необычные свойства воды характеризуются экстремальным поведением, то есть появлением максимумов (как в плотности) или минимумов (как в сжимаемости) на кривых их зависимостей от температуры. Такие экстремальные зависимости означают, что в воде имеет место противоборство двух процессов, каждый из которых обусловливает противоположное поведение рассматриваемого свойства. Один процесс это обычное тепловое движение, усиливающееся с ростом температуры и делающее воду (как и любую другую жидкость) более раз упорядоченной; другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре. Зависимость сжимаемости воды от температуры (Kell, 1967; Fine et al. , 1973) 14
Аномалии физических свойств воды Аномалия сжимаемости. Вода характеризуется необычным температурным поведением ее сжимаемости, то есть степени уменьшения объема при увеличении давления. Обычно сжимаемость жидкости растет с температурой: при высоких температурах жидкости более рыхлы (имеют меньшую плотность) и их легче сжать. Вода обнаруживает такое нормальное поведение только при высоких температурах. При низких же сжимаемость ведет себя противоположным образом, в результате чего в ее температурном поведении появляется минимум при 45 о. С. На этих двух примерах мы видим, что необычные свойства воды характеризуются экстремальным поведением, то есть появлением максимумов (как в плотности) или минимумов (как в сжимаемости) на кривых их зависимостей от температуры. Такие экстремальные зависимости означают, что в воде имеет место противоборство двух процессов, каждый из которых обусловливает противоположное поведение рассматриваемого свойства. Один процесс это обычное тепловое движение, усиливающееся с ростом температуры и делающее воду (как и любую другую жидкость) более раз упорядоченной; другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре. Зависимость сжимаемости воды от температуры (Kell, 1967; Fine et al. , 1973) 14
 Аномалии физических свойств воды Поверхностное натяжение Вода характеризуется исключительно высоким поверхностным натяжением 0, 073 Н/м (при 20 o. С). Из всех жидкостей более высокое поверхностное натяжение имеет только ртуть. Это свойство проявляется в том, что вода постоянно стремится стянуть, сократить свою поверхность. Вода лишь кажется бесформенной, растекаясь по любой поверхности. Сила поверхностного натяжения заставляет молекулы ее наружного слоя сцепляться, создавая упругую внешнюю пленку. Свойства пленки также определяются замкнутыми и разомкнутыми водородными связями, ассоциатами различной структуры и разной степени упорядоченности. Благодаря пленке некоторые предметы, будучи тяжелее воды, не погружаются в воду (например, осторожно положенная плашмя стальная иголка). Многие насекомые (водомерки, ногохвостки и др. ) не только передвигаются по поверхности воды, но взлетают с нее и садятся, как на твердую опору. Более того, живые существа приспособились использовать даже внутреннюю сторону водной поверхности. Личинки комаров повисают на ней с помощью не смачиваемых щетинок, а маленькие улитки прудовики и катушки ползают по ней в поисках добычи. Высокое поверхностное натяжение позволяет воде принимать шарообразную форму при свободном падении или в состоянии невесомости: такая геометрическая форма имеет минимальную для данного объема поверхность. Струя химически чистой воды сечением 1 см 2 по прочности на разрыв не уступает стали того же сечения. Водную струю как бы цементирует сила поверхностного натяжения. Поведение воды в капиллярах подчиняется и более сложным физическим закономерностям. Сент Дьердьи отмечал, что в узких капиллярах возникают структурно упорядоченные слои воды вблизи твердой поверхности. Структурирование распространяется в глубь жидкой фазы на толщину слоя порядка десятков и сотен молекул (ранее предполагали, что упорядоченность ограничивается лишь мономолекулярным слоем воды, примыкающим к поверхности). Особенности структурирования воды в капиллярных системах позволяют с определенным основанием говорить о капиллярном состоянии воды. В природных условиях это состояние можно наблюдать у так называемой поровой воды. В виде тончайшей пленки она устилает поверхность полостей, пор, трещин пород и минералов земной коры. Развитые межмолекулярные контакты с поверхностью твердых тел, особенности структурной упорядоченности, вероятно, и являются причиной того, что поровая вода замерзает при более низкой температуре, чем обычная свободная вода. Исследования показали, что при замерзании связанной воды проявляются не только изменения ее свойств, иными становятся и свойства тех горных пород, с которыми она непосредственно соприкасается. 15
Аномалии физических свойств воды Поверхностное натяжение Вода характеризуется исключительно высоким поверхностным натяжением 0, 073 Н/м (при 20 o. С). Из всех жидкостей более высокое поверхностное натяжение имеет только ртуть. Это свойство проявляется в том, что вода постоянно стремится стянуть, сократить свою поверхность. Вода лишь кажется бесформенной, растекаясь по любой поверхности. Сила поверхностного натяжения заставляет молекулы ее наружного слоя сцепляться, создавая упругую внешнюю пленку. Свойства пленки также определяются замкнутыми и разомкнутыми водородными связями, ассоциатами различной структуры и разной степени упорядоченности. Благодаря пленке некоторые предметы, будучи тяжелее воды, не погружаются в воду (например, осторожно положенная плашмя стальная иголка). Многие насекомые (водомерки, ногохвостки и др. ) не только передвигаются по поверхности воды, но взлетают с нее и садятся, как на твердую опору. Более того, живые существа приспособились использовать даже внутреннюю сторону водной поверхности. Личинки комаров повисают на ней с помощью не смачиваемых щетинок, а маленькие улитки прудовики и катушки ползают по ней в поисках добычи. Высокое поверхностное натяжение позволяет воде принимать шарообразную форму при свободном падении или в состоянии невесомости: такая геометрическая форма имеет минимальную для данного объема поверхность. Струя химически чистой воды сечением 1 см 2 по прочности на разрыв не уступает стали того же сечения. Водную струю как бы цементирует сила поверхностного натяжения. Поведение воды в капиллярах подчиняется и более сложным физическим закономерностям. Сент Дьердьи отмечал, что в узких капиллярах возникают структурно упорядоченные слои воды вблизи твердой поверхности. Структурирование распространяется в глубь жидкой фазы на толщину слоя порядка десятков и сотен молекул (ранее предполагали, что упорядоченность ограничивается лишь мономолекулярным слоем воды, примыкающим к поверхности). Особенности структурирования воды в капиллярных системах позволяют с определенным основанием говорить о капиллярном состоянии воды. В природных условиях это состояние можно наблюдать у так называемой поровой воды. В виде тончайшей пленки она устилает поверхность полостей, пор, трещин пород и минералов земной коры. Развитые межмолекулярные контакты с поверхностью твердых тел, особенности структурной упорядоченности, вероятно, и являются причиной того, что поровая вода замерзает при более низкой температуре, чем обычная свободная вода. Исследования показали, что при замерзании связанной воды проявляются не только изменения ее свойств, иными становятся и свойства тех горных пород, с которыми она непосредственно соприкасается. 15
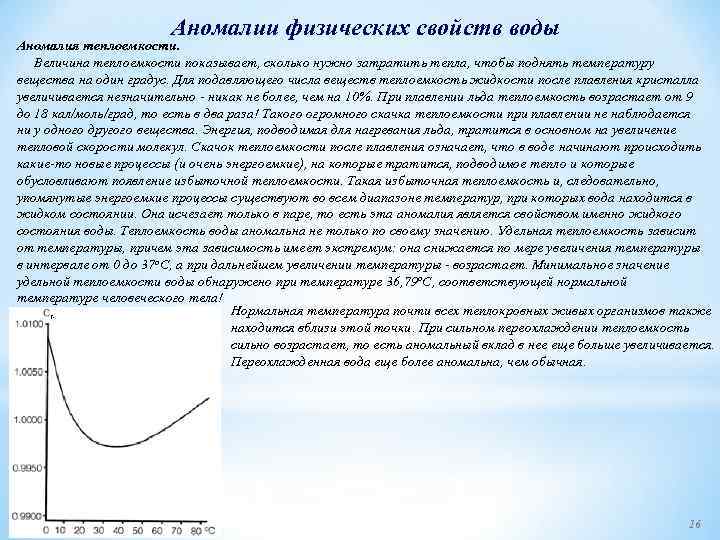 Аномалии физических свойств воды Аномалия теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла увеличивается незначительно никак не более, чем на 10%. При плавлении льда теплоемкость возрастает от 9 до 18 кал/моль/град, то есть в два раза! Такого огромного скачка теплоемкости при плавлении не наблюдается ни у одного другого вещества. Энергия, подводимая для нагревания льда, тратится в основном на увеличение тепловой скорости молекул. Скачок теплоемкости после плавления означает, что в воде начинают происходить какие то новые процессы (и очень энергоемкие), на которые тратится, подводимое тепло и которые обусловливают появление избыточной теплоемкости. Такая избыточная теплоемкость и, следовательно, упомянутые энергоемкие процессы существуют во всем диапазоне температур, при которых вода находится в жидком состоянии. Она исчезает только в паре, то есть эта аномалия является свойством именно жидкого состояния воды. Теплоемкость воды аномальна не только по своему значению. Удельная теплоемкость зависит от температуры, причем эта зависимость имеет экстремум: она снижается по мере увеличения температуры в интервале от 0 до 37 o. С, а при дальнейшем увеличении температуры возрастает. Минимальное значение удельной теплоемкости воды обнаружено при температуре 36, 79 o. С, соответствующей нормальной температуре человеческого тела! Нормальная температура почти всех теплокровных живых организмов также находится вблизи этой точки. При сильном переохлаждении теплоемкость сильно возрастает, то есть аномальный вклад в нее еще больше увеличивается. Переохлажденная вода еще более аномальна, чем обычная. 16
Аномалии физических свойств воды Аномалия теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла увеличивается незначительно никак не более, чем на 10%. При плавлении льда теплоемкость возрастает от 9 до 18 кал/моль/град, то есть в два раза! Такого огромного скачка теплоемкости при плавлении не наблюдается ни у одного другого вещества. Энергия, подводимая для нагревания льда, тратится в основном на увеличение тепловой скорости молекул. Скачок теплоемкости после плавления означает, что в воде начинают происходить какие то новые процессы (и очень энергоемкие), на которые тратится, подводимое тепло и которые обусловливают появление избыточной теплоемкости. Такая избыточная теплоемкость и, следовательно, упомянутые энергоемкие процессы существуют во всем диапазоне температур, при которых вода находится в жидком состоянии. Она исчезает только в паре, то есть эта аномалия является свойством именно жидкого состояния воды. Теплоемкость воды аномальна не только по своему значению. Удельная теплоемкость зависит от температуры, причем эта зависимость имеет экстремум: она снижается по мере увеличения температуры в интервале от 0 до 37 o. С, а при дальнейшем увеличении температуры возрастает. Минимальное значение удельной теплоемкости воды обнаружено при температуре 36, 79 o. С, соответствующей нормальной температуре человеческого тела! Нормальная температура почти всех теплокровных живых организмов также находится вблизи этой точки. При сильном переохлаждении теплоемкость сильно возрастает, то есть аномальный вклад в нее еще больше увеличивается. Переохлажденная вода еще более аномальна, чем обычная. 16
 Аномалии физических свойств воды Структура и формы льда. Вода при охлаждении в нормальных условиях ниже 0 о. С кристаллизируется, образуя лед, плотность которого меньше, а объем почти на 10% больше объема исходной воды. Охлаждаясь, вода ведет себя как многие другие соединения: понемногу уплотняется уменьшает свой удельный объем. Но при 4 о. С ( точнее, при 3, 98 о. С) наступает кризисное состояние: при дальнейшем понижении температуры объем воды уже не уменьшается, а увеличивается. С этого момента начинается упорядочение взаимного расположения молекул, складывается характерная для льда гексагональная кристаллическая структура. Каждая молекула в структуре льда соединена водородными связями с четырьмя другими. Это приводит к тому, что в фазе льда образуется ажурная конструкция с " каналами" между фиксированными молекулами воды. В водных растворах некоторых органических веществ вокруг молекул примесей возникают упорядоченные группы водных молекул своеобразные зоны "жидкого льда", имеющие кубическую структуру, которая отличается большой рыхлостью по сравнению с гексагональной. Появление такого льда вызывает значительное расширение всей замерзшей массы. При появлении льда разрушаются связи не только дальнего, но и ближнего порядка. Так, при 0 о. С 9 15% молекул Н 2 О утрачивают связи с соединениями, в результате увеличивается подвижность части молекул и они погружаются в те полости, которыми богата ажурная структура льда. Этим объясняется сжатие льда при таянии и большая по сравнению с ним плотность образующейся воды. При переходе " лед вода" плотность возрастает примерно на 10%, и можно считать, что эта величина определенным образом характеризует количество молекул Н 2 О, попавших в полости. В твердой воде (лед) атом кислорода каждой молекулы уча ствует в образовании двух водородных связей с соседними молекулами воды согласно схеме, в которой водородные связи показаны пунктиром. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноимен ными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры наименее плотным структурам, в ней существуют пустоты, раз меры которых несколько превышают размеры молекулы H 2 O. 17
Аномалии физических свойств воды Структура и формы льда. Вода при охлаждении в нормальных условиях ниже 0 о. С кристаллизируется, образуя лед, плотность которого меньше, а объем почти на 10% больше объема исходной воды. Охлаждаясь, вода ведет себя как многие другие соединения: понемногу уплотняется уменьшает свой удельный объем. Но при 4 о. С ( точнее, при 3, 98 о. С) наступает кризисное состояние: при дальнейшем понижении температуры объем воды уже не уменьшается, а увеличивается. С этого момента начинается упорядочение взаимного расположения молекул, складывается характерная для льда гексагональная кристаллическая структура. Каждая молекула в структуре льда соединена водородными связями с четырьмя другими. Это приводит к тому, что в фазе льда образуется ажурная конструкция с " каналами" между фиксированными молекулами воды. В водных растворах некоторых органических веществ вокруг молекул примесей возникают упорядоченные группы водных молекул своеобразные зоны "жидкого льда", имеющие кубическую структуру, которая отличается большой рыхлостью по сравнению с гексагональной. Появление такого льда вызывает значительное расширение всей замерзшей массы. При появлении льда разрушаются связи не только дальнего, но и ближнего порядка. Так, при 0 о. С 9 15% молекул Н 2 О утрачивают связи с соединениями, в результате увеличивается подвижность части молекул и они погружаются в те полости, которыми богата ажурная структура льда. Этим объясняется сжатие льда при таянии и большая по сравнению с ним плотность образующейся воды. При переходе " лед вода" плотность возрастает примерно на 10%, и можно считать, что эта величина определенным образом характеризует количество молекул Н 2 О, попавших в полости. В твердой воде (лед) атом кислорода каждой молекулы уча ствует в образовании двух водородных связей с соседними молекулами воды согласно схеме, в которой водородные связи показаны пунктиром. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноимен ными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры наименее плотным структурам, в ней существуют пустоты, раз меры которых несколько превышают размеры молекулы H 2 O. 17
 Аномалии физических свойств воды Структура и формы льда. Характерной особенностью структуры льда является то, что в ней молекулы упакованы рыхло. Если изобразить молекулу шаром, то при плотневшей упаковке шаров вокруг каждого из них будет 12 соседей. Во льду же их всего четыре. Если бы молекулы воды во льду были плотно упакованы, то его плотность составляла бы 2, 0 г/см 3, тогда как на самом деле она равна 0, 92 г/см 3. Казалось бы, рыхлость упаковки частиц, то есть наличие в ней больших объемов не заполненного молекулами пространства, должна приводить к неустойчивости структуры. Например, можно было бы ожидать, что при сжатии льда внешним давлением сетка водородных связей будет разрушаться, пустоты структуры будут с легкостью схлопываться, заполняясь молекулами, вырванными из этой сетки. Но на самом деле сетка водородных связей не разрушается, а перестраивается. При повышении давления обычный гексагональный лед меняет свою структуру. Сейчас известно десять форм льда, устойчивых при высоких давлениях. И у всех сохраняется четырежды координированная сетка водородных связей, то есть каждая молекула воды сохраняет в них все свои четыре водородные связи. I – обычный лед, существующий при давлении до 2200 атм. , при дальнейшем увеличении давления переходит в II; II – лед с уменьшением объема на 18%, тонет в воде, очень неустойчив и легко переходит в III; III – также тяжелее воды и может непосредственно быть получен из льда I; IV – легче воды, существует при небольших давлениях и температуре немного ниже 0° С, неустойчив и легко переходит в лед I; V – может существовать при давлениях от 3600 до 6300 атм. , он плотнее льда III, при повышении давления с треском мгновенно превращается в лед VI; VI – плотнее льда V, при давлении около 21 000 атм. имеет температуру +76° С; может быть получен из воды при температуре +60° С и давлении 16 500 атм. Структура льда, у которой все углы между соседними водородными связями равны тетраэдрическому углу, обладает минимальной плотностью (наибольшей рыхлостью), возможной для четырежды координированных сеток. При деформации такой сетки плотность неизбежно увеличивается, так что, например, для льда III она составляет 1, 15 г/см 3, то есть на 25% больше, чем во льду. Т. о. , при внешних воздействиях (повышении давления) сетка водородных связей во льду не разрушается, а перестраивается, сохраняя свою четверную координацию. Более выгодным оказывается не разорвать некоторые водородные связи, а сохранить их все, лишь деформируя сетку, несколько изменяя углы между связями. Структурная устойчивость представляет важнейшее свойство сеток водородных связей между молекулами 18
Аномалии физических свойств воды Структура и формы льда. Характерной особенностью структуры льда является то, что в ней молекулы упакованы рыхло. Если изобразить молекулу шаром, то при плотневшей упаковке шаров вокруг каждого из них будет 12 соседей. Во льду же их всего четыре. Если бы молекулы воды во льду были плотно упакованы, то его плотность составляла бы 2, 0 г/см 3, тогда как на самом деле она равна 0, 92 г/см 3. Казалось бы, рыхлость упаковки частиц, то есть наличие в ней больших объемов не заполненного молекулами пространства, должна приводить к неустойчивости структуры. Например, можно было бы ожидать, что при сжатии льда внешним давлением сетка водородных связей будет разрушаться, пустоты структуры будут с легкостью схлопываться, заполняясь молекулами, вырванными из этой сетки. Но на самом деле сетка водородных связей не разрушается, а перестраивается. При повышении давления обычный гексагональный лед меняет свою структуру. Сейчас известно десять форм льда, устойчивых при высоких давлениях. И у всех сохраняется четырежды координированная сетка водородных связей, то есть каждая молекула воды сохраняет в них все свои четыре водородные связи. I – обычный лед, существующий при давлении до 2200 атм. , при дальнейшем увеличении давления переходит в II; II – лед с уменьшением объема на 18%, тонет в воде, очень неустойчив и легко переходит в III; III – также тяжелее воды и может непосредственно быть получен из льда I; IV – легче воды, существует при небольших давлениях и температуре немного ниже 0° С, неустойчив и легко переходит в лед I; V – может существовать при давлениях от 3600 до 6300 атм. , он плотнее льда III, при повышении давления с треском мгновенно превращается в лед VI; VI – плотнее льда V, при давлении около 21 000 атм. имеет температуру +76° С; может быть получен из воды при температуре +60° С и давлении 16 500 атм. Структура льда, у которой все углы между соседними водородными связями равны тетраэдрическому углу, обладает минимальной плотностью (наибольшей рыхлостью), возможной для четырежды координированных сеток. При деформации такой сетки плотность неизбежно увеличивается, так что, например, для льда III она составляет 1, 15 г/см 3, то есть на 25% больше, чем во льду. Т. о. , при внешних воздействиях (повышении давления) сетка водородных связей во льду не разрушается, а перестраивается, сохраняя свою четверную координацию. Более выгодным оказывается не разорвать некоторые водородные связи, а сохранить их все, лишь деформируя сетку, несколько изменяя углы между связями. Структурная устойчивость представляет важнейшее свойство сеток водородных связей между молекулами 18
 Аномалии физических свойств воды Структура и перестройка структуры воды. При плавлении льда сетка водородных связей также не разрушается, но кристаллический порядок исчезает. Это означает, что каждая молекула воды и в жидком состоянии сохраняет свои четыре водородные связи, но углы между ними будут отличаться, что и приводит к повышению ее плотности по сравнению со льдом. Структура сетки водородных связей в жидкой воде отличается от структур сеток в формах льда, стабильных при высоких давлениях, отсутствием пространственной периодичности. В отличие от льда в водной сетке невозможно выделить участки в разных ее местах, которые были бы тождественны по структуре. Сетка в воде случайная. В ней углы между связями отклоняются не по какому то определенному закону, как в кристаллах, а случайно. В кристалле вокруг каждой молекулы соседние частицы расположены одинаково, в жидкости же окружение каждой молекулы устроено особым (но случайным) образом. По этой причине структуру случайной сетки невозможно установить рентгеноструктурным анализом, который вскрывает закономерности только единообразно окруженных частиц. Значит, молекулярную структуру воды, то есть конкретное положение всех ее молекул, невозможно определить экспериментально. Здесь нужно использовать другие методы исследования и прежде всего моделирование. При помощи компьютера можно моделировать движения не очень большого ансамбля частиц (около тысячи) и получать информацию о положении каждой молекулы, если сделать определенные (модельные) предположения о законах их взаимодействия. Этой увлекательной задачей занимаются сейчас ученые во всем мире. Все исследователи согласны в том, что основой структуры является сетка водородных связей, охватывающая все молекулы воды; разногласия касаются в основном устройства этой сетки. 19
Аномалии физических свойств воды Структура и перестройка структуры воды. При плавлении льда сетка водородных связей также не разрушается, но кристаллический порядок исчезает. Это означает, что каждая молекула воды и в жидком состоянии сохраняет свои четыре водородные связи, но углы между ними будут отличаться, что и приводит к повышению ее плотности по сравнению со льдом. Структура сетки водородных связей в жидкой воде отличается от структур сеток в формах льда, стабильных при высоких давлениях, отсутствием пространственной периодичности. В отличие от льда в водной сетке невозможно выделить участки в разных ее местах, которые были бы тождественны по структуре. Сетка в воде случайная. В ней углы между связями отклоняются не по какому то определенному закону, как в кристаллах, а случайно. В кристалле вокруг каждой молекулы соседние частицы расположены одинаково, в жидкости же окружение каждой молекулы устроено особым (но случайным) образом. По этой причине структуру случайной сетки невозможно установить рентгеноструктурным анализом, который вскрывает закономерности только единообразно окруженных частиц. Значит, молекулярную структуру воды, то есть конкретное положение всех ее молекул, невозможно определить экспериментально. Здесь нужно использовать другие методы исследования и прежде всего моделирование. При помощи компьютера можно моделировать движения не очень большого ансамбля частиц (около тысячи) и получать информацию о положении каждой молекулы, если сделать определенные (модельные) предположения о законах их взаимодействия. Этой увлекательной задачей занимаются сейчас ученые во всем мире. Все исследователи согласны в том, что основой структуры является сетка водородных связей, охватывающая все молекулы воды; разногласия касаются в основном устройства этой сетки. 19
 Аномалии физических свойств воды Диаграмма состояния воды. Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразной и т. д. ). Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления, они называются диаграммами состояния в координатах Р—Т. На рисунке приведена в схематической форме диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару. Точкам, лежащим на диаграмме состоя ниже или равее кривой ОА, п отвечает область пара. Точкам диаграммы, лежащим выше или левее кривой ОА, отвечает область жидкого состояния. Кривая ОК, отделяющая область жидкой воды от области льда (кривая равновесия твердое состояние — жидкость, или кривая плавления) показывает те пары значений температуры и давления, при которых лед и жид кая вода находятся в равновесии. Направление кривой ОВ аномалия Кривая 0 В — кривая равновесия твердое состояние—пар, или кривая сублимации. Ей отвечают те пары значений температуры к давления, при которых в равновесии находятся лед и водяной пар. Все три кривые пересекаются в точке О. Координаты этой точки—это единственная пара значений температуры и давления, при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки. Справа кривая кипения оканчивается в критической точке. При температуре, отвечающей этой точке, — критической температуре— величины, характеризующие физические свойства жидкости и пара, становятся одинаковыми, так что различие между жидким и парообразным состоянием исчезает. Для воды tкрит= 374, 2 °С 20
Аномалии физических свойств воды Диаграмма состояния воды. Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразной и т. д. ). Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления, они называются диаграммами состояния в координатах Р—Т. На рисунке приведена в схематической форме диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару. Точкам, лежащим на диаграмме состоя ниже или равее кривой ОА, п отвечает область пара. Точкам диаграммы, лежащим выше или левее кривой ОА, отвечает область жидкого состояния. Кривая ОК, отделяющая область жидкой воды от области льда (кривая равновесия твердое состояние — жидкость, или кривая плавления) показывает те пары значений температуры и давления, при которых лед и жид кая вода находятся в равновесии. Направление кривой ОВ аномалия Кривая 0 В — кривая равновесия твердое состояние—пар, или кривая сублимации. Ей отвечают те пары значений температуры к давления, при которых в равновесии находятся лед и водяной пар. Все три кривые пересекаются в точке О. Координаты этой точки—это единственная пара значений температуры и давления, при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки. Справа кривая кипения оканчивается в критической точке. При температуре, отвечающей этой точке, — критической температуре— величины, характеризующие физические свойства жидкости и пара, становятся одинаковыми, так что различие между жидким и парообразным состоянием исчезает. Для воды tкрит= 374, 2 °С 20
 Химические свойства воды Кислотно-основные реакции. Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Ее амфотерные свойства обусловлены способностью воды к самоионизации: 2 Н 2 О(ж. ) = Н 3 О+(водн. ) + ОН-(водн. ) За счет этой способности вода может выступать как акцептором протона: НСl + Н 2 О = Н 3 О+ + Сl- так и донором протона: NH 3 + Н 2 О = NH 4+ + ОНОкисление и восстановление. Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова. Например, в реакции между натрием и водой происходит следующий окислительный процесс: Nа(тв. ) = Na+(водн. ) + епри этом половина атомов водорода восстанавливается до элементарного состояния: 2 Н 2 О(ж. ) + 2 е- = 2 ОН-(водн. ) + Н 2(г. ) Другим примером подобной реакции является взаимодействие между магнием и водяным паром: Мg(тв. ) + Н 20(г. ) = Мg. О(тв. ) + Н 2(г. ) Вода действует как окислитель в процессах коррозии. Например, один из процессов, протекающих при ржавлении железа, заключается в следующем: 3 Fe + 4 H 2 O = 4 H 2 + Fe 3 O 4 (только при нагревании) Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны окисляться водой при высокой температуре: C + H 2 O = H 2 + CO (при сильном нагревании) CH 4 + 2 H 2 O = 4 H 2 + CO 2 (при сильном нагревании) Считается, что вода является восстановителем в биохимических процессах и при восстановлении органических фосфатных соединений при фотосинтезе. В этом случае происходит окисление воды с образованием кислорода: 2 Н 2 О = О 2 + 4 Н+ + 4 е 21
Химические свойства воды Кислотно-основные реакции. Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Ее амфотерные свойства обусловлены способностью воды к самоионизации: 2 Н 2 О(ж. ) = Н 3 О+(водн. ) + ОН-(водн. ) За счет этой способности вода может выступать как акцептором протона: НСl + Н 2 О = Н 3 О+ + Сl- так и донором протона: NH 3 + Н 2 О = NH 4+ + ОНОкисление и восстановление. Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова. Например, в реакции между натрием и водой происходит следующий окислительный процесс: Nа(тв. ) = Na+(водн. ) + епри этом половина атомов водорода восстанавливается до элементарного состояния: 2 Н 2 О(ж. ) + 2 е- = 2 ОН-(водн. ) + Н 2(г. ) Другим примером подобной реакции является взаимодействие между магнием и водяным паром: Мg(тв. ) + Н 20(г. ) = Мg. О(тв. ) + Н 2(г. ) Вода действует как окислитель в процессах коррозии. Например, один из процессов, протекающих при ржавлении железа, заключается в следующем: 3 Fe + 4 H 2 O = 4 H 2 + Fe 3 O 4 (только при нагревании) Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны окисляться водой при высокой температуре: C + H 2 O = H 2 + CO (при сильном нагревании) CH 4 + 2 H 2 O = 4 H 2 + CO 2 (при сильном нагревании) Считается, что вода является восстановителем в биохимических процессах и при восстановлении органических фосфатных соединений при фотосинтезе. В этом случае происходит окисление воды с образованием кислорода: 2 Н 2 О = О 2 + 4 Н+ + 4 е 21
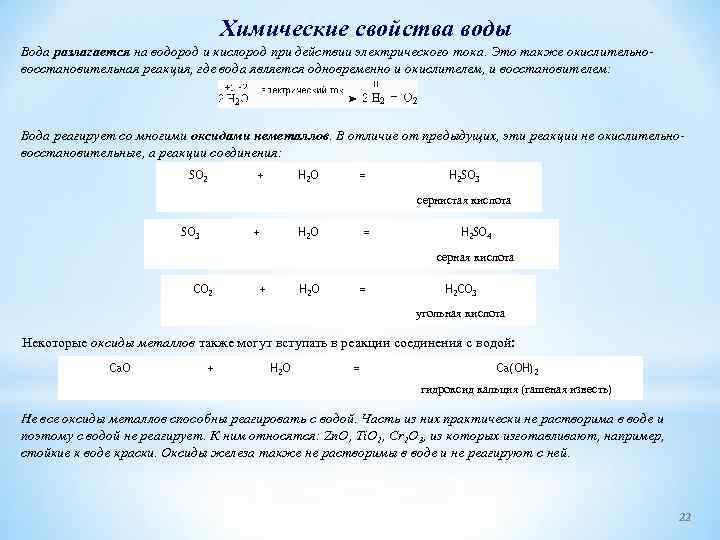 Химические свойства воды Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно восстановительная реакция, где вода является одновременно и окислителем, и восстановителем: Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно восстановительные, а реакции соединения: SO 2 + SO 3 H 2 O + = CO 2 + H 2 O H 2 SO 4 серная кислота = H 2 SO 3 сернистая кислота H 2 O = H 2 CO 3 угольная кислота Некоторые оксиды металлов также могут вступать в реакции соединения с водой: Ca. O + H 2 O = Ca(OH)2 гидроксид кальция (гашеная известь) Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. К ним относятся: Zn. O, Ti. O 2, Cr 2 O 3, из которых изготавливают, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней. 22
Химические свойства воды Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно восстановительная реакция, где вода является одновременно и окислителем, и восстановителем: Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно восстановительные, а реакции соединения: SO 2 + SO 3 H 2 O + = CO 2 + H 2 O H 2 SO 4 серная кислота = H 2 SO 3 сернистая кислота H 2 O = H 2 CO 3 угольная кислота Некоторые оксиды металлов также могут вступать в реакции соединения с водой: Ca. O + H 2 O = Ca(OH)2 гидроксид кальция (гашеная известь) Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. К ним относятся: Zn. O, Ti. O 2, Cr 2 O 3, из которых изготавливают, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней. 22
 Химические свойства воды Гидратация. Выше уже указывалось, что молекулы воды способны сольватировать как катионы, так и анионы. Этот процесс называется гидратацией. Гидратная вода в кристаллах солей называется кристаллизационной водой. Молекулы воды обычно связаны с сольватируемым ими катионом координационными связями. Если гидрат кристаллический, то он называется кристаллогидратом. Например: Cu. SO 4 + вещество белого цвета (безводный сульфат меди) 5 H 2 O = Cu. SO 4. 5 H 2 O кристаллогидрат (медный купорос), синие кристаллы Другие примеры образования гидратов: H 2 SO 4 + H 2 O = H 2 SO 4. H 2 O (гидрат серной кислоты) Na. OH + H 2 O = Na. OH. H 2 O (гидрат едкого натра) Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха. Гидролиз представляет собой реакцию какого либо иона или молекулы с водой. Примером реакций этого типа может быть реакция между хлороводородом и водой с образованием соляной кислоты. Другой пример гидролиз хлорида железа(III): Fе. С 13(водн. ) + ЗН 2 О(ж. ) = Fе(ОН)3(тв. ) + ЗН+(водн. ) + ЗСl-(водн. ) Гидролиз органических соединений также широко распространен. Один из наиболее известных примеров гидролиз этилацетата (этилатаноата, этилового эфира уксусной кислоты): СН 3 СООС 2 Н 5 (Этилацетат) + Н 2 О = СН 3 СООН ( Уксусная кислота) + С 2 Н 5 ОН (Этанол) Особая реакция воды – синтез растениями крахмала (C 6 H 10 O 5)n и других подобных соединений (углеводов), происходящая с выделением кислорода: 6 n CO 2 + 5 n H 2 O = (C 6 H 10 O 5)n + 6 n O 2 (при действии света) 23
Химические свойства воды Гидратация. Выше уже указывалось, что молекулы воды способны сольватировать как катионы, так и анионы. Этот процесс называется гидратацией. Гидратная вода в кристаллах солей называется кристаллизационной водой. Молекулы воды обычно связаны с сольватируемым ими катионом координационными связями. Если гидрат кристаллический, то он называется кристаллогидратом. Например: Cu. SO 4 + вещество белого цвета (безводный сульфат меди) 5 H 2 O = Cu. SO 4. 5 H 2 O кристаллогидрат (медный купорос), синие кристаллы Другие примеры образования гидратов: H 2 SO 4 + H 2 O = H 2 SO 4. H 2 O (гидрат серной кислоты) Na. OH + H 2 O = Na. OH. H 2 O (гидрат едкого натра) Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха. Гидролиз представляет собой реакцию какого либо иона или молекулы с водой. Примером реакций этого типа может быть реакция между хлороводородом и водой с образованием соляной кислоты. Другой пример гидролиз хлорида железа(III): Fе. С 13(водн. ) + ЗН 2 О(ж. ) = Fе(ОН)3(тв. ) + ЗН+(водн. ) + ЗСl-(водн. ) Гидролиз органических соединений также широко распространен. Один из наиболее известных примеров гидролиз этилацетата (этилатаноата, этилового эфира уксусной кислоты): СН 3 СООС 2 Н 5 (Этилацетат) + Н 2 О = СН 3 СООН ( Уксусная кислота) + С 2 Н 5 ОН (Этанол) Особая реакция воды – синтез растениями крахмала (C 6 H 10 O 5)n и других подобных соединений (углеводов), происходящая с выделением кислорода: 6 n CO 2 + 5 n H 2 O = (C 6 H 10 O 5)n + 6 n O 2 (при действии света) 23
 Аномалии физических свойств воды Резкие отклонения от установленной закономерности объясняются тем, что вода является ассоциированной жидкостью. Ассоциированность ее сказывается и на очень высокой теплоте парообразования. Так, для того чтобы испарить 1 г воды, нагретой до 100 о. С, требуется в шесть раз больше тепла, чем для нагрева такого же количества воды от 0 до 80 о. С. Благодаря этому вода является мощнейшим энергоносителем на нашей планете. Важнейшим фактором, определяющим аномальные свойства воды, является ее структура. Рассадкин Юрий Павлович. 1939 года рождения, окончил Московский физико технический институт в 1967 г. , кандидат техниче ских аук, н автор более ста научных работ и двадцати пяти изобретений и патентов. Автор монографии «Вода обыкновенная и необыкновенная» Слесарев Валерий Иванович. Доктор химических наук, профессор, с 1979 г. по 2011 г. заведующий кафедрой химии, автор научного открытия "Явление аквакоммуникации". Зенин Станислав Валентинович. Закончил кафедру биофизики Физического факультета МГУ в 1965 году. Кандидат химических наук (МГУ, 1971), кандидат философских наук (МГУ, 1977), доктор биологических наук (Институт медико биологических проблем РАН, 1999). С 1996 года работает в Федеральном Научном Клинико Экспериментальном Центре Традиционных Методов Диагностики и Лечения Минздрава России, в настоящее время заведующий Проблемной лабораторией научного обоснования ТМДЛ. Предложил и обосновал тетраэдрическую модель воды. Мосин Олег Викторович. Российский исследователь воды, учёный биохимик, кандидат химических наук (1996 г. ). Родился в 1966 г. в г. Калуге. В 1992 году закончил Московский институт тонкой химической технологии им. М. В. Ломоносова. Последнее место работы МГУПБ. 24
Аномалии физических свойств воды Резкие отклонения от установленной закономерности объясняются тем, что вода является ассоциированной жидкостью. Ассоциированность ее сказывается и на очень высокой теплоте парообразования. Так, для того чтобы испарить 1 г воды, нагретой до 100 о. С, требуется в шесть раз больше тепла, чем для нагрева такого же количества воды от 0 до 80 о. С. Благодаря этому вода является мощнейшим энергоносителем на нашей планете. Важнейшим фактором, определяющим аномальные свойства воды, является ее структура. Рассадкин Юрий Павлович. 1939 года рождения, окончил Московский физико технический институт в 1967 г. , кандидат техниче ских аук, н автор более ста научных работ и двадцати пяти изобретений и патентов. Автор монографии «Вода обыкновенная и необыкновенная» Слесарев Валерий Иванович. Доктор химических наук, профессор, с 1979 г. по 2011 г. заведующий кафедрой химии, автор научного открытия "Явление аквакоммуникации". Зенин Станислав Валентинович. Закончил кафедру биофизики Физического факультета МГУ в 1965 году. Кандидат химических наук (МГУ, 1971), кандидат философских наук (МГУ, 1977), доктор биологических наук (Институт медико биологических проблем РАН, 1999). С 1996 года работает в Федеральном Научном Клинико Экспериментальном Центре Традиционных Методов Диагностики и Лечения Минздрава России, в настоящее время заведующий Проблемной лабораторией научного обоснования ТМДЛ. Предложил и обосновал тетраэдрическую модель воды. Мосин Олег Викторович. Российский исследователь воды, учёный биохимик, кандидат химических наук (1996 г. ). Родился в 1966 г. в г. Калуге. В 1992 году закончил Московский институт тонкой химической технологии им. М. В. Ломоносова. Последнее место работы МГУПБ. 24
 Чистой воды не бывает Чистая вода, состоящая только лишь из молекул Н 2 О, не существует; она всегда содержит растворенные вещества, а также она содержит частицы, из которых сама состоит. Это электрически заряженные частицы молекул воды: положительно заряженные ионы воды Н+ и отрицательно заряженные гидрокосильные ионы (ОН) –. В килограмме воды при температуре 22ºС содержится ровно 10– 7 грамм Н+ и одновременно также 10– 7 грамм (ОН)–. Обозначим величину 10– 7 грамм ионов Н+ через символ [Н+]. Молекулярный вес воды, соответствующий одному молю воды, составляет18 грамм. Килограмм воды, таким образом, содержит: Один моль означает количество молекул, соответствующих молекулярному весу вещества. Обозначенное через N 0 количество молекул в одном моле, так называемое число Авогадро, составляет величину N 0 = 6. 06· 1023. Если мы умножим содержащиеся в килограмме воды 10 – 7 грамм ионов Н+ на N 0, мы получим число ионов Н+ в одном моле воды: [Н+] · N 0 = 10– 7 · 6. 06· 1023 = 6. 06· 1016. С другой стороны один литр воды содержит: где 18 грамм – молекулярный вес воды. Если мы умножим 55. 6 на N 0, то получим число молекул воды в одном литре воды: Z(H 2 O) = 55. 6 · 6. 06· 1023 = 336· 1023. Из отношения чисел [Н+] · N 0 и Z(H 2 O) находим: Это отношение показывает, таким образом, что только одна молекула воды на 560 миллионов молекул диссоциирует в соответствии с уравнением: Н 2 О = Н+ + (ОН)–. Таким образом, чистая вода в очень малой части диссоциирует на ионы. Данная величина точно определена и стала очень важной в химии и биологии. Продукт реакции, состоящий из ионов Н + и (ОН)–, называется ионным произведением воды и выражается величиной КW, при 220 С принимающей значение 1· 1014. Данная величина изменяется при увеличении температуры, т. е. повышение температуры способствует диссоциации воды. Константа ионного произведения, формально выраженная, обозначается, таким образом: КW = [Н+]·[ОН–] = 1· 1014 (при 220 С). Из данного уравнения следует, что есть три различных состояния воды в отношении содержания ионов водорода: Первое: Состояния нейтральности, когда наблюдается равенство концентрации ионов: [Н +] = [ОН–]. Второе: Состояние кислотности, представляющее собой неравенство концентрации ионов, а именно более высокую концентрацию ионов Н+: [Н+] > [ОН–]. 25 Третье: Состояние щелочности, когда существует более высокая концентрация ионов (ОН –): [ОН–] > [Н+].
Чистой воды не бывает Чистая вода, состоящая только лишь из молекул Н 2 О, не существует; она всегда содержит растворенные вещества, а также она содержит частицы, из которых сама состоит. Это электрически заряженные частицы молекул воды: положительно заряженные ионы воды Н+ и отрицательно заряженные гидрокосильные ионы (ОН) –. В килограмме воды при температуре 22ºС содержится ровно 10– 7 грамм Н+ и одновременно также 10– 7 грамм (ОН)–. Обозначим величину 10– 7 грамм ионов Н+ через символ [Н+]. Молекулярный вес воды, соответствующий одному молю воды, составляет18 грамм. Килограмм воды, таким образом, содержит: Один моль означает количество молекул, соответствующих молекулярному весу вещества. Обозначенное через N 0 количество молекул в одном моле, так называемое число Авогадро, составляет величину N 0 = 6. 06· 1023. Если мы умножим содержащиеся в килограмме воды 10 – 7 грамм ионов Н+ на N 0, мы получим число ионов Н+ в одном моле воды: [Н+] · N 0 = 10– 7 · 6. 06· 1023 = 6. 06· 1016. С другой стороны один литр воды содержит: где 18 грамм – молекулярный вес воды. Если мы умножим 55. 6 на N 0, то получим число молекул воды в одном литре воды: Z(H 2 O) = 55. 6 · 6. 06· 1023 = 336· 1023. Из отношения чисел [Н+] · N 0 и Z(H 2 O) находим: Это отношение показывает, таким образом, что только одна молекула воды на 560 миллионов молекул диссоциирует в соответствии с уравнением: Н 2 О = Н+ + (ОН)–. Таким образом, чистая вода в очень малой части диссоциирует на ионы. Данная величина точно определена и стала очень важной в химии и биологии. Продукт реакции, состоящий из ионов Н + и (ОН)–, называется ионным произведением воды и выражается величиной КW, при 220 С принимающей значение 1· 1014. Данная величина изменяется при увеличении температуры, т. е. повышение температуры способствует диссоциации воды. Константа ионного произведения, формально выраженная, обозначается, таким образом: КW = [Н+]·[ОН–] = 1· 1014 (при 220 С). Из данного уравнения следует, что есть три различных состояния воды в отношении содержания ионов водорода: Первое: Состояния нейтральности, когда наблюдается равенство концентрации ионов: [Н +] = [ОН–]. Второе: Состояние кислотности, представляющее собой неравенство концентрации ионов, а именно более высокую концентрацию ионов Н+: [Н+] > [ОН–]. 25 Третье: Состояние щелочности, когда существует более высокая концентрация ионов (ОН –): [ОН–] > [Н+].
 Строение молекулы воды Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О— Н близки к 0, 1 нм, расстояние между ядрами атомов водорода равно 0, 15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленные электронные пары. Возможность образования многочисленных короткоживущих водородных связей между соседними атомами водорода в молекуле, а также особые физические свойства. Благоприятные условия для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию. 26
Строение молекулы воды Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О— Н близки к 0, 1 нм, расстояние между ядрами атомов водорода равно 0, 15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленные электронные пары. Возможность образования многочисленных короткоживущих водородных связей между соседними атомами водорода в молекуле, а также особые физические свойства. Благоприятные условия для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию. 26
 Строение молекулы воды с точки зрения метода молекулярных орбиталей Два неспаренных р электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s электронами атомов водорода. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды. Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород кислород не прямой (90°), а немного больше 104, 5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода положительный. Поэтому и вся молекула воды тоже попадает в отряд "химических полярников" веществ, молекулы которых представляют собой электрические диполи. 27
Строение молекулы воды с точки зрения метода молекулярных орбиталей Два неспаренных р электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s электронами атомов водорода. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды. Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород кислород не прямой (90°), а немного больше 104, 5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода положительный. Поэтому и вся молекула воды тоже попадает в отряд "химических полярников" веществ, молекулы которых представляют собой электрические диполи. 27
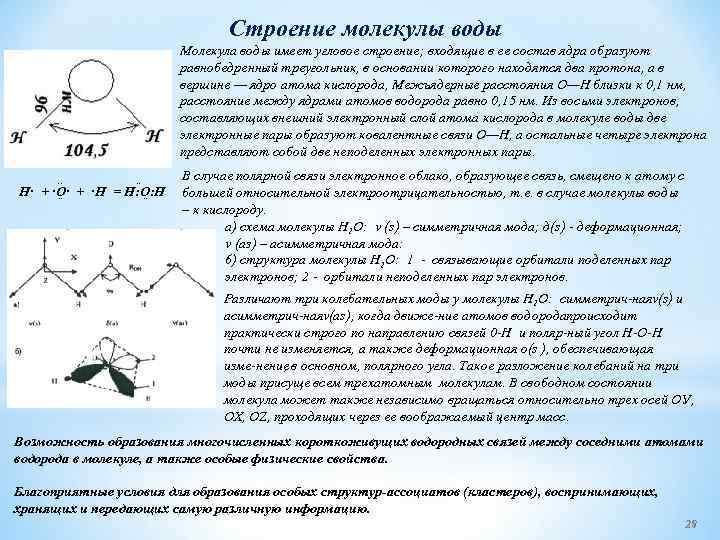 Строение молекулы воды Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О—Н близки к 0, 1 нм, расстояние между ядрами атомов водорода равно 0, 15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленных электронных пары. . . H· + ·O· + ·H = H: O: H ¨ В случае полярной связи электронное облако, образующее связь, смещено к атому с большей относительной электроотрицательностью, т. е. в случае молекулы воды – к кислороду. а) схема молекулы Н 2 О: v (s) – симметричная мода; д(s) деформационная; v (аз) – асимметричная мода: 6) структура молекулы Н 2 О: 1 связывающие орбитали поделенных пар электронов; 2 орбитали неподеленных пар электронов. Различают три колебательных моды у молекулы Н 2 О: симметрич ная (s) и v асимметрич ная (as), когда движе ние атомов водорода роисходит v п практически строго по направлению связей 0 Н и поляр ный угол Н О Н почти не изменяется, а также деформационная о(s ), обеспечивающая изме нение , в основном, полярного угла. Такое разложение колебаний на три моды присуще всем трехатомным молекулам. В свободном состоянии молекула может также независимо вращаться относительно трех осей ОУ, ОХ, OZ, проходящих через ее воображаемый центр масс. Возможность образования многочисленных короткоживущих водородных связей между соседними атомами водорода в молекуле, а также особые физические свойства. Благоприятные условия для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию. 28
Строение молекулы воды Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О—Н близки к 0, 1 нм, расстояние между ядрами атомов водорода равно 0, 15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленных электронных пары. . . H· + ·O· + ·H = H: O: H ¨ В случае полярной связи электронное облако, образующее связь, смещено к атому с большей относительной электроотрицательностью, т. е. в случае молекулы воды – к кислороду. а) схема молекулы Н 2 О: v (s) – симметричная мода; д(s) деформационная; v (аз) – асимметричная мода: 6) структура молекулы Н 2 О: 1 связывающие орбитали поделенных пар электронов; 2 орбитали неподеленных пар электронов. Различают три колебательных моды у молекулы Н 2 О: симметрич ная (s) и v асимметрич ная (as), когда движе ние атомов водорода роисходит v п практически строго по направлению связей 0 Н и поляр ный угол Н О Н почти не изменяется, а также деформационная о(s ), обеспечивающая изме нение , в основном, полярного угла. Такое разложение колебаний на три моды присуще всем трехатомным молекулам. В свободном состоянии молекула может также независимо вращаться относительно трех осей ОУ, ОХ, OZ, проходящих через ее воображаемый центр масс. Возможность образования многочисленных короткоживущих водородных связей между соседними атомами водорода в молекуле, а также особые физические свойства. Благоприятные условия для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию. 28
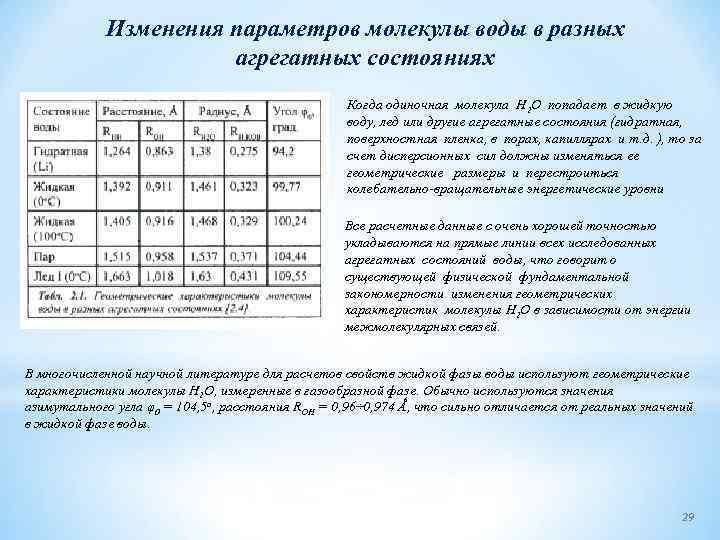 Изменения параметров молекулы воды в разных агрегатных состояниях Когда одиночная молекула Н 2 O попадает в жидкую воду, лед или другие агрегатные состояния (гидратная, поверхностная пленка, в порах, капиллярах и т. д. ), то за счет дисперсионных сил должны изменяться ее геометрические размеры и перестроиться колебательно вращательные энергетические уровни Все расчетные данные с очень хорошей точностью укладываются на прямые линии всех исследованных агрегатных состояний воды, что говорит о существующей физической фундаментальной закономерности изменения геометрических характеристик молекулы Н 2 O в зависимости от энергии межмолекулярных связей. В многочисленной научной литературе для расчетов свойств жидкой фазы воды используют геометрические характеристики молекулы H 2 O, измеренные в газообразной фазе. Обычно используются значения азимутального угла φ0 = 104, 5 о, расстояния ROH = 0, 96÷ 0, 974 Ǻ, что сильно отличается от реальных значений в жидкой фазе воды. 29
Изменения параметров молекулы воды в разных агрегатных состояниях Когда одиночная молекула Н 2 O попадает в жидкую воду, лед или другие агрегатные состояния (гидратная, поверхностная пленка, в порах, капиллярах и т. д. ), то за счет дисперсионных сил должны изменяться ее геометрические размеры и перестроиться колебательно вращательные энергетические уровни Все расчетные данные с очень хорошей точностью укладываются на прямые линии всех исследованных агрегатных состояний воды, что говорит о существующей физической фундаментальной закономерности изменения геометрических характеристик молекулы Н 2 O в зависимости от энергии межмолекулярных связей. В многочисленной научной литературе для расчетов свойств жидкой фазы воды используют геометрические характеристики молекулы H 2 O, измеренные в газообразной фазе. Обычно используются значения азимутального угла φ0 = 104, 5 о, расстояния ROH = 0, 96÷ 0, 974 Ǻ, что сильно отличается от реальных значений в жидкой фазе воды. 29
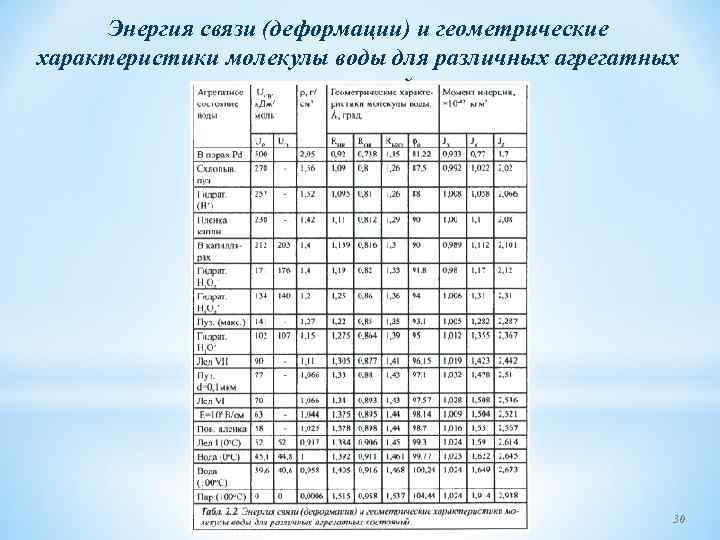 Энергия связи (деформации) и геометрические характеристики молекулы воды для различных агрегатных состояний. 30
Энергия связи (деформации) и геометрические характеристики молекулы воды для различных агрегатных состояний. 30
![Современные модели воды модель Фрэка и Уэна [Frank & Wen, 1957] Водородные связи в Современные модели воды модель Фрэка и Уэна [Frank & Wen, 1957] Водородные связи в](https://present5.com/presentation/225330631_437129270/image-31.jpg) Современные модели воды модель Фрэка и Уэна [Frank & Wen, 1957] Водородные связи в жидкой воде непрерывно образуются и рвутся, причем эти процессы протекают кооперативно в пределах короткоживущих групп молекул воды, названных “мерцающими кластерами”. Их время жизни оценивают в диапазоне от 10 10 до 10 11 с. Такое представление правдоподобно объясняет высокую степень подвижности жидкой воды и ее низкую вязкость. Считается, что благодаря таким свойствам вода служит одним из самых универсальных растворителей. Модель “мерцающих кластеров” не может объяснить множество уже давно известных фактов, и тех, что стали стремительно нарастать в последнее время. Кла стер (англ. cluster — скопление) — объединение нескольких однородных элементов, которое может рассматриваться как самостоятельная единица, обладающая определёнными свойствами. 31
Современные модели воды модель Фрэка и Уэна [Frank & Wen, 1957] Водородные связи в жидкой воде непрерывно образуются и рвутся, причем эти процессы протекают кооперативно в пределах короткоживущих групп молекул воды, названных “мерцающими кластерами”. Их время жизни оценивают в диапазоне от 10 10 до 10 11 с. Такое представление правдоподобно объясняет высокую степень подвижности жидкой воды и ее низкую вязкость. Считается, что благодаря таким свойствам вода служит одним из самых универсальных растворителей. Модель “мерцающих кластеров” не может объяснить множество уже давно известных фактов, и тех, что стали стремительно нарастать в последнее время. Кла стер (англ. cluster — скопление) — объединение нескольких однородных элементов, которое может рассматриваться как самостоятельная единица, обладающая определёнными свойствами. 31
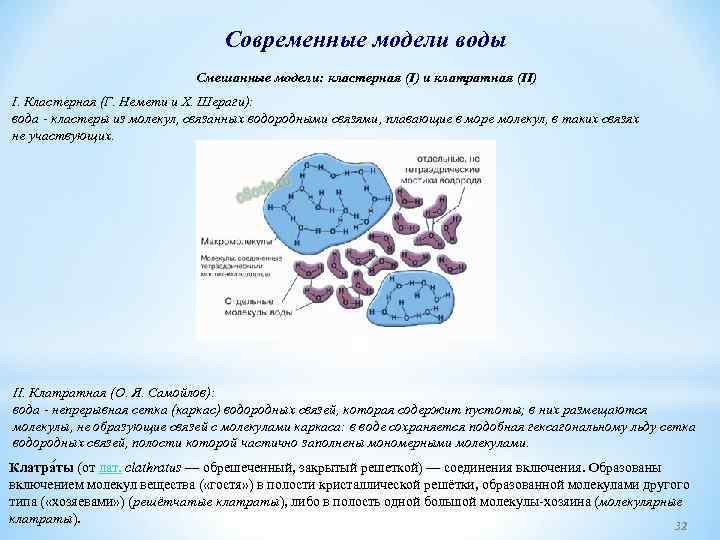 Современные модели воды Смешанные модели: кластерная (I) и клатратная (II) I. Кластерная (Г. Немети и Х. Шераги): вода кластеры из молекул, связанных водородными связями, плавающие в море молекул, в таких связях не участвующих. II. Клатратная (О. Я. Самойлов): вода непрерывная сетка (каркас) водородных связей, которая содержит пустоты; в них размещаются молекулы, не образующие связей с молекулами каркаса: в воде сохраняется подобная гексагональному льду сетка водородных связей, полости которой частично заполнены мономерными молекулами. Клатра ты (от лат. clathratus — обрешеченный, закрытый решеткой) — соединения включения. Образованы включением молекул вещества ( «гостя» ) в полости кристаллической решётки, образованной молекулами другого типа ( «хозяевами» ) (решётчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты). 32
Современные модели воды Смешанные модели: кластерная (I) и клатратная (II) I. Кластерная (Г. Немети и Х. Шераги): вода кластеры из молекул, связанных водородными связями, плавающие в море молекул, в таких связях не участвующих. II. Клатратная (О. Я. Самойлов): вода непрерывная сетка (каркас) водородных связей, которая содержит пустоты; в них размещаются молекулы, не образующие связей с молекулами каркаса: в воде сохраняется подобная гексагональному льду сетка водородных связей, полости которой частично заполнены мономерными молекулами. Клатра ты (от лат. clathratus — обрешеченный, закрытый решеткой) — соединения включения. Образованы включением молекул вещества ( «гостя» ) в полости кристаллической решётки, образованной молекулами другого типа ( «хозяевами» ) (решётчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты). 32
 Современные модели воды Гипотеза о существовании механохимических реакций радикальной диссоциации воды. Л. Полинг в 1959 году создал другой вариант, предположив, что основой структуры может служить сетка связей, присущая некоторым кристаллогидратам. В течение второй половины 60 х годов и начала 70 х наблюдается сближение всех этих взглядов. Появлялись варианты кластерных моделей, в которых в обеих микрофазах молекулы соединены водородными связями. Сторонники клатратных моделей стали допускать образование водородных связей между пустотными и каркасными молекулами. Г. А. Домрачев, Д. А. Селивановский, 1990 г. Жидкая вода представляет собой динамически нестабильную полимерную систему т. е. по аналогии с механохимическими реакциями в полимерах при механических воздействиях на воду поглощенная водой энергия, необходимая для разрыва Н-ОН, локализуется в микромасштабной области структуры жидкой воды. Тогда реакцию разрыва Н-ОН связи можно записать как: (Н 2 О)n(Н 2 О. . . H-|-OH) (Н 2 О)m + E (Н 2 О)n+E(H ) + (OH) (Н 2 О)m, где E - неспаренный электрон, m – означает молекулярную форму. Поскольку диссоциация молекул воды и реакции с участием радикалов H и OH происходит в ассоциированном состоянии жидкой воды, радика лы могут иметь громадные (десятки секунд и более) продолжительности жизни до гибели в результате реакций рекомбинации [Blough et al. , 1990]. Существуют достаточно убедительные свидетельства в пользу того, что в жидкой воде присутствуют весьма устойчивые полимерные структуры 33
Современные модели воды Гипотеза о существовании механохимических реакций радикальной диссоциации воды. Л. Полинг в 1959 году создал другой вариант, предположив, что основой структуры может служить сетка связей, присущая некоторым кристаллогидратам. В течение второй половины 60 х годов и начала 70 х наблюдается сближение всех этих взглядов. Появлялись варианты кластерных моделей, в которых в обеих микрофазах молекулы соединены водородными связями. Сторонники клатратных моделей стали допускать образование водородных связей между пустотными и каркасными молекулами. Г. А. Домрачев, Д. А. Селивановский, 1990 г. Жидкая вода представляет собой динамически нестабильную полимерную систему т. е. по аналогии с механохимическими реакциями в полимерах при механических воздействиях на воду поглощенная водой энергия, необходимая для разрыва Н-ОН, локализуется в микромасштабной области структуры жидкой воды. Тогда реакцию разрыва Н-ОН связи можно записать как: (Н 2 О)n(Н 2 О. . . H-|-OH) (Н 2 О)m + E (Н 2 О)n+E(H ) + (OH) (Н 2 О)m, где E - неспаренный электрон, m – означает молекулярную форму. Поскольку диссоциация молекул воды и реакции с участием радикалов H и OH происходит в ассоциированном состоянии жидкой воды, радика лы могут иметь громадные (десятки секунд и более) продолжительности жизни до гибели в результате реакций рекомбинации [Blough et al. , 1990]. Существуют достаточно убедительные свидетельства в пользу того, что в жидкой воде присутствуют весьма устойчивые полимерные структуры 33
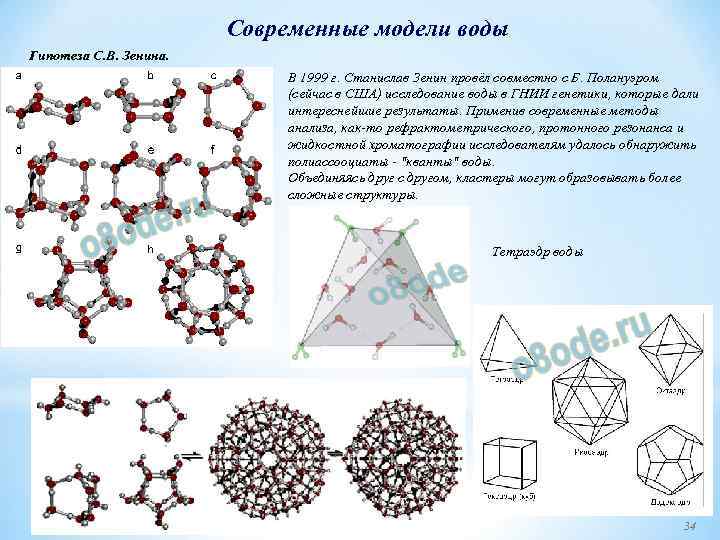 Современные модели воды Гипотеза С. В. Зенина. В 1999 г. Станислав Зенин провёл совместно с Б. Полануэром (сейчас в США) исследование воды в ГНИИ генетики, которые дали интереснейшие результаты. Применив современные методы анализа, как то рефрактометрического, протонного резонанса и жидкостной хроматографии исследователям удалось обнаружить полиассооциаты "кванты" воды. Объединяясь друг с другом, кластеры могут образовывать более сложные структуры. Тетраэдр воды 34
Современные модели воды Гипотеза С. В. Зенина. В 1999 г. Станислав Зенин провёл совместно с Б. Полануэром (сейчас в США) исследование воды в ГНИИ генетики, которые дали интереснейшие результаты. Применив современные методы анализа, как то рефрактометрического, протонного резонанса и жидкостной хроматографии исследователям удалось обнаружить полиассооциаты "кванты" воды. Объединяясь друг с другом, кластеры могут образовывать более сложные структуры. Тетраэдр воды 34
 Современные модели воды Гипотеза С. В. Зенина. Согласно гипотезе С. В. Зенина вода представляет собой иерархию правильных объемных структур "ассоциатов" (clathrates), в основе которых лежит кристаллоподобный "квант воды", состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12 гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% кванты тетраэдры и 3% классические молекулы Н 2 О. Формирование кластера из 20 молекулы воды Элементарной ячейкой воды являются тетраэдры, содержащие связанные между собой водородными связями четыре (простой тетраэдр) или пять молекул Н 2 О (объемно центрированный тетраэдр). При этом у каждой из молекул воды в простых тетраэдрах сохраняется способность образовывать водородные связи. За счет их простые тетраэдры могут объединяться между собой вершинами, ребрами или гранями, образуя различные кластеры со сложной структурой, например, в форме додекаэдра. 35
Современные модели воды Гипотеза С. В. Зенина. Согласно гипотезе С. В. Зенина вода представляет собой иерархию правильных объемных структур "ассоциатов" (clathrates), в основе которых лежит кристаллоподобный "квант воды", состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12 гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% кванты тетраэдры и 3% классические молекулы Н 2 О. Формирование кластера из 20 молекулы воды Элементарной ячейкой воды являются тетраэдры, содержащие связанные между собой водородными связями четыре (простой тетраэдр) или пять молекул Н 2 О (объемно центрированный тетраэдр). При этом у каждой из молекул воды в простых тетраэдрах сохраняется способность образовывать водородные связи. За счет их простые тетраэдры могут объединяться между собой вершинами, ребрами или гранями, образуя различные кластеры со сложной структурой, например, в форме додекаэдра. 35
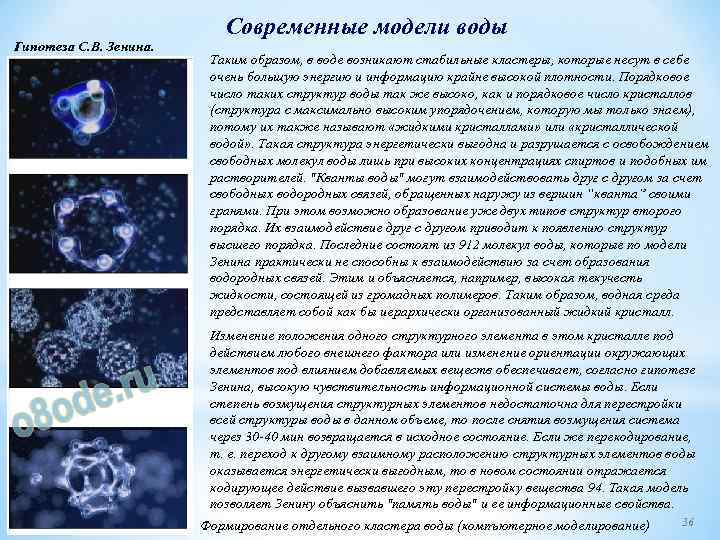 Гипотеза С. В. Зенина. Современные модели воды Таким образом, в воде возникают стабильные кластеры, которые несут в себе очень большую энергию и информацию крайне высокой плотности. Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с максимально высоким упорядочением, которую мы только знаем), потому их также называют «жидкими кристаллами» или «кристаллической водой» . Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей. "Кванты воды" могут взаимодействовать друг с другом за счет свободных водородных связей, обращенных наружу из вершин “кванта” своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей. Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл. Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30 40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества 94. Такая модель позволяет Зенину объяснить "память воды" и ее информационные свойства. Формирование отдельного кластера воды (компъютерное моделирование) 36
Гипотеза С. В. Зенина. Современные модели воды Таким образом, в воде возникают стабильные кластеры, которые несут в себе очень большую энергию и информацию крайне высокой плотности. Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с максимально высоким упорядочением, которую мы только знаем), потому их также называют «жидкими кристаллами» или «кристаллической водой» . Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей. "Кванты воды" могут взаимодействовать друг с другом за счет свободных водородных связей, обращенных наружу из вершин “кванта” своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей. Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл. Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30 40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества 94. Такая модель позволяет Зенину объяснить "память воды" и ее информационные свойства. Формирование отдельного кластера воды (компъютерное моделирование) 36
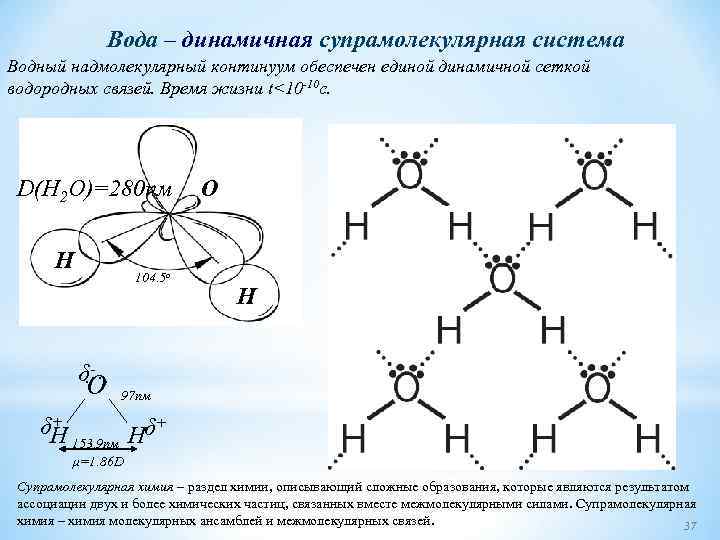 Вода – динамичная супрамолекулярная система Водный надмолекулярный континуум обеспечен единой динамичной сеткой водородных связей. Время жизни t<10 10 c. D(H 2 O)=280 пм H 104. 5 о δ. . O O H 97 пм + δH δ+ 153. 9 пм H μ=1. 86 D Супрамолекулярная химия – раздел химии, описывающий сложные образования, которые являются результатом ассоциации двух и более химических частиц, связанных вместе межмолекулярными силами. Супрамолекулярная химия – химия молекулярных ансамблей и межмолекулярных связей. 37
Вода – динамичная супрамолекулярная система Водный надмолекулярный континуум обеспечен единой динамичной сеткой водородных связей. Время жизни t<10 10 c. D(H 2 O)=280 пм H 104. 5 о δ. . O O H 97 пм + δH δ+ 153. 9 пм H μ=1. 86 D Супрамолекулярная химия – раздел химии, описывающий сложные образования, которые являются результатом ассоциации двух и более химических частиц, связанных вместе межмолекулярными силами. Супрамолекулярная химия – химия молекулярных ансамблей и межмолекулярных связей. 37
 Выводы из теории С. В. Зенина В дистиллированной воде кластеры практически электронейтральны. Однако Зенин обнаружил, что их электропроводность можно изменить. Если помешать магнитной мешалкой, связи между элементами кластеров будут разрушены и вода превратится в мертвое, неупорядоченное месиво. Если поместить в воду предельно малое количество другого вещества (хоть одну молекулу) кластеры начнут "перенимать" его электромагнитные свойства. Это свойство объясняет чрезвычайно лабильный, подвижный характер их взаимодействия. Его природа обусловлена дальними кулоновскими силами, определяющими новый вид зарядово-комплементарной связи. Именно за счет этого вида взаимодействий осуществляется построение структурных элементов воды в ячейки (клатраты) размером до 0, 5 1 микрон. Их можно непосредственно наблюдать при помощи контрастно фазового микроскопа. Структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру. Опираясь на подобные представления о структуре воды, учёные выяснили интересные подробности. Российские исследователи Высоцкий и Корнилова, развивая идеи Ю. И. Наберухина, провели расчет энергетических характеристик, необходимых для перехода свободных молекул воды из несвязанного состояния в полость клатрата и обратно. С помощью этих расчетов они показали, что структурой воды количеством свободных молекул воды в полостях клатратов и вне их, можно управлять с помощью давления, температуры, магнитного поля и т. д. Причем вода может использоваться для медицинских целей, как самостоятельно, так и в качестве "упаковки" для молекул лекарственных веществ. Такой гипотетической "упаковкой", способной донести лекарства до внутренних органов больного, не растратив их по пути, служат клатраты, в полостях которых могут быть размещены лекарственные молекулы при определенных режимах их приготовления. 38
Выводы из теории С. В. Зенина В дистиллированной воде кластеры практически электронейтральны. Однако Зенин обнаружил, что их электропроводность можно изменить. Если помешать магнитной мешалкой, связи между элементами кластеров будут разрушены и вода превратится в мертвое, неупорядоченное месиво. Если поместить в воду предельно малое количество другого вещества (хоть одну молекулу) кластеры начнут "перенимать" его электромагнитные свойства. Это свойство объясняет чрезвычайно лабильный, подвижный характер их взаимодействия. Его природа обусловлена дальними кулоновскими силами, определяющими новый вид зарядово-комплементарной связи. Именно за счет этого вида взаимодействий осуществляется построение структурных элементов воды в ячейки (клатраты) размером до 0, 5 1 микрон. Их можно непосредственно наблюдать при помощи контрастно фазового микроскопа. Структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру. Опираясь на подобные представления о структуре воды, учёные выяснили интересные подробности. Российские исследователи Высоцкий и Корнилова, развивая идеи Ю. И. Наберухина, провели расчет энергетических характеристик, необходимых для перехода свободных молекул воды из несвязанного состояния в полость клатрата и обратно. С помощью этих расчетов они показали, что структурой воды количеством свободных молекул воды в полостях клатратов и вне их, можно управлять с помощью давления, температуры, магнитного поля и т. д. Причем вода может использоваться для медицинских целей, как самостоятельно, так и в качестве "упаковки" для молекул лекарственных веществ. Такой гипотетической "упаковкой", способной донести лекарства до внутренних органов больного, не растратив их по пути, служат клатраты, в полостях которых могут быть размещены лекарственные молекулы при определенных режимах их приготовления. 38
 Современные модели воды Другие современные модели воды. Профессор Мартин Чаплин из Лондонского университета (Martin Chaplin Professor of Applied Science Water and Aqueous Systems Research of the London South Bank University) рассчитал и предположил иную структуру воды, в основе которой лежит икосаэдр. Согласно этой модели вода состоит из 1820 молекул воды это в два раза больше, чем в модели Зенина. Гигантский икосаэдр в свою очередь состоит из 13 более мелких структурных элементов. Причем, так же как и у Зенина, структура гигантского ассоциата базируется на более мелких образованиях. Д р Анджелос Микаелидес (Angelos Michaelides) из Центра нанотехнологий в Лондоне и профессор Карина Моргенштерн (Karina Morgenstern) из университета им. Лейбница в Ганновере опубликовали в журнале Nature Materials работу, посвященную изучению свойств кристаллической воды на наноуровне. Ученые охлаждали водяной пар над поверхностью металлической пластины, находящейся при температуре 5 градусов Кельвина. Вскоре с помощью сканирующего туннельного микроскопа на пластине удалось наблюдать гексамер (шесть соединенных между собой молекул воды) мельчайшую снежинку. Это самый маленький из возможных кластеров льда. Ученые наблюдали также кластеры, содержащие семь, восемь и девять молекул. 39
Современные модели воды Другие современные модели воды. Профессор Мартин Чаплин из Лондонского университета (Martin Chaplin Professor of Applied Science Water and Aqueous Systems Research of the London South Bank University) рассчитал и предположил иную структуру воды, в основе которой лежит икосаэдр. Согласно этой модели вода состоит из 1820 молекул воды это в два раза больше, чем в модели Зенина. Гигантский икосаэдр в свою очередь состоит из 13 более мелких структурных элементов. Причем, так же как и у Зенина, структура гигантского ассоциата базируется на более мелких образованиях. Д р Анджелос Микаелидес (Angelos Michaelides) из Центра нанотехнологий в Лондоне и профессор Карина Моргенштерн (Karina Morgenstern) из университета им. Лейбница в Ганновере опубликовали в журнале Nature Materials работу, посвященную изучению свойств кристаллической воды на наноуровне. Ученые охлаждали водяной пар над поверхностью металлической пластины, находящейся при температуре 5 градусов Кельвина. Вскоре с помощью сканирующего туннельного микроскопа на пластине удалось наблюдать гексамер (шесть соединенных между собой молекул воды) мельчайшую снежинку. Это самый маленький из возможных кластеров льда. Ученые наблюдали также кластеры, содержащие семь, восемь и девять молекул. 39
 Жизнь – это форма существования воды? ! Если все процессы регистрации, накопления и переноса информации обусловлены различными состояниями воды, то тогда можно предположить, что Все живые организмы, в том числе и человек, являются формами существования воды 40
Жизнь – это форма существования воды? ! Если все процессы регистрации, накопления и переноса информации обусловлены различными состояниями воды, то тогда можно предположить, что Все живые организмы, в том числе и человек, являются формами существования воды 40


