Физики пласта ч 3 Газ.ppt
- Количество слайдов: 36
 ФИЗИЧЕСКОЕ СОСТОЯНИЕ ГАЗА ПРИ РАЗЛИЧНЫХ УСЛОВИЯХ В ЗАЛЕЖИ газовые, содержащие только газ; газоконденсатные, содержащие газ с конденсатом; нефтегазоконденсатные, содержащие нефть, газ и конденсат; газогидратные, залежи природного газа в твердом состоянии 1
ФИЗИЧЕСКОЕ СОСТОЯНИЕ ГАЗА ПРИ РАЗЛИЧНЫХ УСЛОВИЯХ В ЗАЛЕЖИ газовые, содержащие только газ; газоконденсатные, содержащие газ с конденсатом; нефтегазоконденсатные, содержащие нефть, газ и конденсат; газогидратные, залежи природного газа в твердом состоянии 1
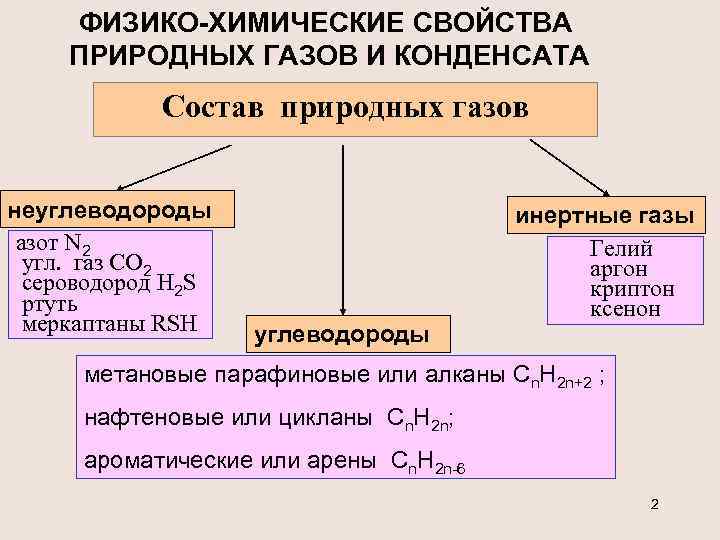 ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ И КОНДЕНСАТА Состав природных газов неуглеводороды азот N 2 угл. газ СО 2 сероводород Н 2 S ртуть меркаптаны RSH углеводороды инертные газы Гелий аргон криптон ксенон метановые парафиновые или алканы Cn. H 2 n+2 ; нафтеновые или цикланы Cn. H 2 n; ароматические или арены Cn. H 2 n-6 2
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ И КОНДЕНСАТА Состав природных газов неуглеводороды азот N 2 угл. газ СО 2 сероводород Н 2 S ртуть меркаптаны RSH углеводороды инертные газы Гелий аргон криптон ксенон метановые парафиновые или алканы Cn. H 2 n+2 ; нафтеновые или цикланы Cn. H 2 n; ароматические или арены Cn. H 2 n-6 2
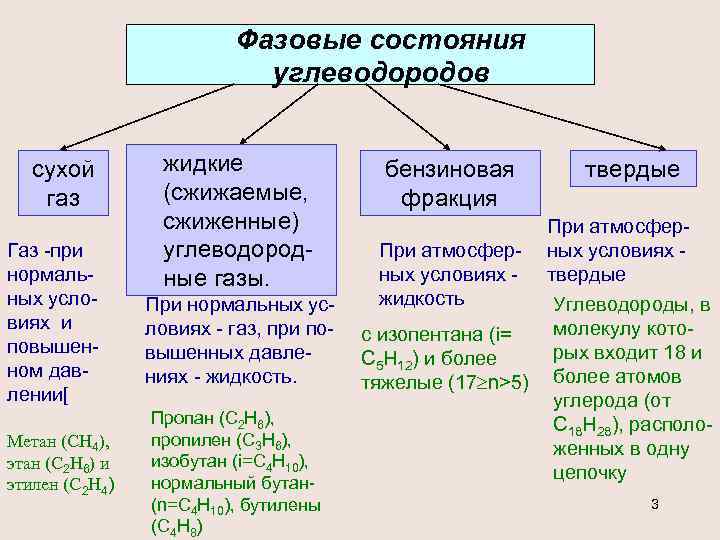 Фазовые состояния углеводородов сухой газ Газ -при нормальных условиях и повышенном давлении[ Метан (СН 4), этан (С 2 Н 6) и этилен (С 2 Н 4) жидкие (сжижаемые, сжиженные) углеводородные газы. При нормальных условиях - газ, при повышенных давлениях - жидкость. Пропан (С 2 Н 6), пропилен (С 3 Н 6), изобутан (i=С 4 Н 10), нормальный бутан(n=С 4 Н 10), бутилены (С 4 Н 8) бензиновая фракция твердые При атмосфер- ных условиях - твердые жидкость Углеводороды, в молекулу котос изопентана (i= рых входит 18 и С 5 Н 12) и более тяжелые (17 n>5) более атомов углерода (от С 18 Н 28), расположенных в одну цепочку 3
Фазовые состояния углеводородов сухой газ Газ -при нормальных условиях и повышенном давлении[ Метан (СН 4), этан (С 2 Н 6) и этилен (С 2 Н 4) жидкие (сжижаемые, сжиженные) углеводородные газы. При нормальных условиях - газ, при повышенных давлениях - жидкость. Пропан (С 2 Н 6), пропилен (С 3 Н 6), изобутан (i=С 4 Н 10), нормальный бутан(n=С 4 Н 10), бутилены (С 4 Н 8) бензиновая фракция твердые При атмосфер- ных условиях - твердые жидкость Углеводороды, в молекулу котос изопентана (i= рых входит 18 и С 5 Н 12) и более тяжелые (17 n>5) более атомов углерода (от С 18 Н 28), расположенных в одну цепочку 3
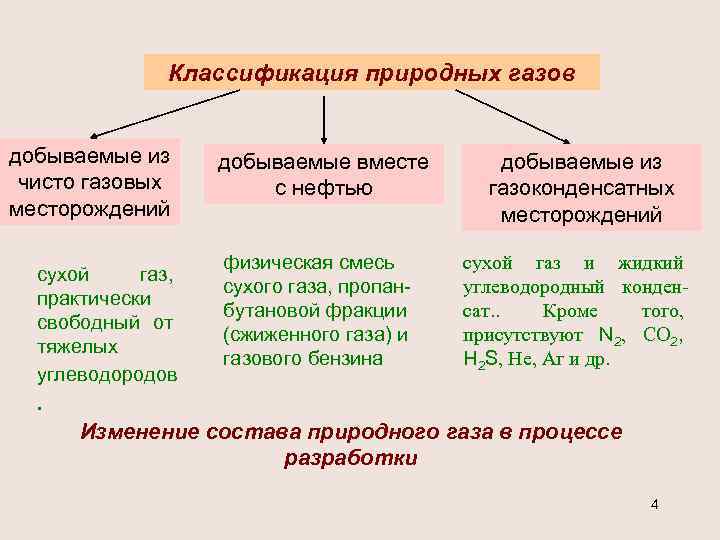 Классификация природных газов добываемые из чисто газовых месторождений сухой газ, практически свободный от тяжелых углеводородов добываемые вместе с нефтью физическая смесь сухого газа, пропанбутановой фракции (сжиженного газа) и газового бензина добываемые из газоконденсатных месторождений сухой газ и жидкий углеводородный конденсат. . Кроме того, присутствуют N 2, СО 2, H 2 S, Не, Аг и др. . Изменение состава природного газа в процессе разработки 4
Классификация природных газов добываемые из чисто газовых месторождений сухой газ, практически свободный от тяжелых углеводородов добываемые вместе с нефтью физическая смесь сухого газа, пропанбутановой фракции (сжиженного газа) и газового бензина добываемые из газоконденсатных месторождений сухой газ и жидкий углеводородный конденсат. . Кроме того, присутствуют N 2, СО 2, H 2 S, Не, Аг и др. . Изменение состава природного газа в процессе разработки 4
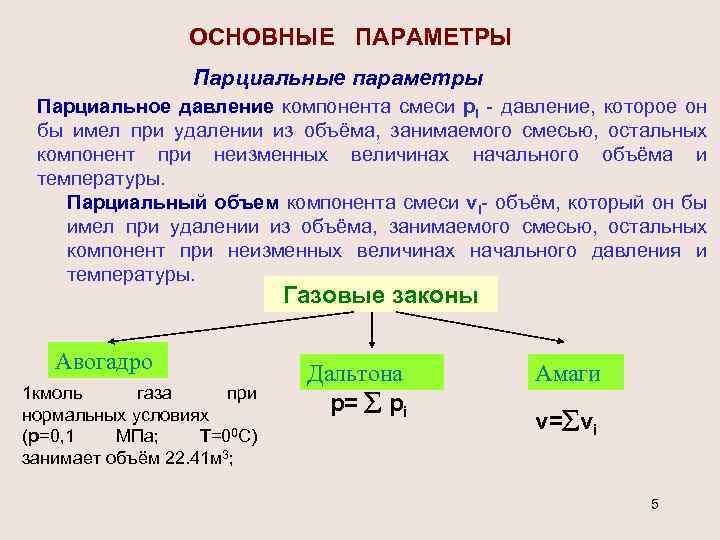 ОСНОВНЫЕ ПАРАМЕТРЫ Парциальные параметры Парциальное давление компонента смеси pi - давление, которое он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального объёма и температуры. Парциальный объем компонента смеси vi- объём, который он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального давления и температуры. Газовые законы Авогадро 1 кмоль газа при нормальных условиях (р=0, 1 МПа; Т=00 С) занимает объём 22. 41 м 3; Дальтона р= рi Амаги v= vi 5
ОСНОВНЫЕ ПАРАМЕТРЫ Парциальные параметры Парциальное давление компонента смеси pi - давление, которое он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального объёма и температуры. Парциальный объем компонента смеси vi- объём, который он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального давления и температуры. Газовые законы Авогадро 1 кмоль газа при нормальных условиях (р=0, 1 МПа; Т=00 С) занимает объём 22. 41 м 3; Дальтона р= рi Амаги v= vi 5
 Параметры газовых смесей плотность газа в нормальных условиях ст = М/22. 41, кг/м 3 ; относительная плотность - - плотность, отнесённая к плотности воздуха в при тех же значениях давления и температуры; концентрации компонент - массовые gi=Gi /G; молярные yi=mi /m; объёмные xi=vi /v Определение средних параметров через парциальные давление р=pi /xi ; объём v=vi /xi; молекулярная масса M= (xi Мi)/100=100/ (gi /Mi) ; плотность =100/ (gi / i)=100 M/ (xi Mi)/ i = (xi i). (плотности воздуха: 0= 1, 293 кг/м 3, 20= 1, 205 кг/м 3); концентрации связаны между собой соотношениями gi=xi Mi /M; yi=xi. 6
Параметры газовых смесей плотность газа в нормальных условиях ст = М/22. 41, кг/м 3 ; относительная плотность - - плотность, отнесённая к плотности воздуха в при тех же значениях давления и температуры; концентрации компонент - массовые gi=Gi /G; молярные yi=mi /m; объёмные xi=vi /v Определение средних параметров через парциальные давление р=pi /xi ; объём v=vi /xi; молекулярная масса M= (xi Мi)/100=100/ (gi /Mi) ; плотность =100/ (gi / i)=100 M/ (xi Mi)/ i = (xi i). (плотности воздуха: 0= 1, 293 кг/м 3, 20= 1, 205 кг/м 3); концентрации связаны между собой соотношениями gi=xi Mi /M; yi=xi. 6
 Критические и приведённые термодинамические параметры Критическим состоянием называется такое состояние вещества, при котором плотность вещества и его насыщенного пара равны другу. Параметры, соответствующие этому состоянию, называются критическими параметрами. Критической Ткр называется такая температура, выше которой газ под действием давления любого значения не может быть превращён в жидкость. Критическое давление ркр, - зто давление, необходимое для сжижения газа при критической температуре. Критическим объёмом vкр называют объём, равный объёму одного моля газа при критических значениях давления и температуры. 7
Критические и приведённые термодинамические параметры Критическим состоянием называется такое состояние вещества, при котором плотность вещества и его насыщенного пара равны другу. Параметры, соответствующие этому состоянию, называются критическими параметрами. Критической Ткр называется такая температура, выше которой газ под действием давления любого значения не может быть превращён в жидкость. Критическое давление ркр, - зто давление, необходимое для сжижения газа при критической температуре. Критическим объёмом vкр называют объём, равный объёму одного моля газа при критических значениях давления и температуры. 7
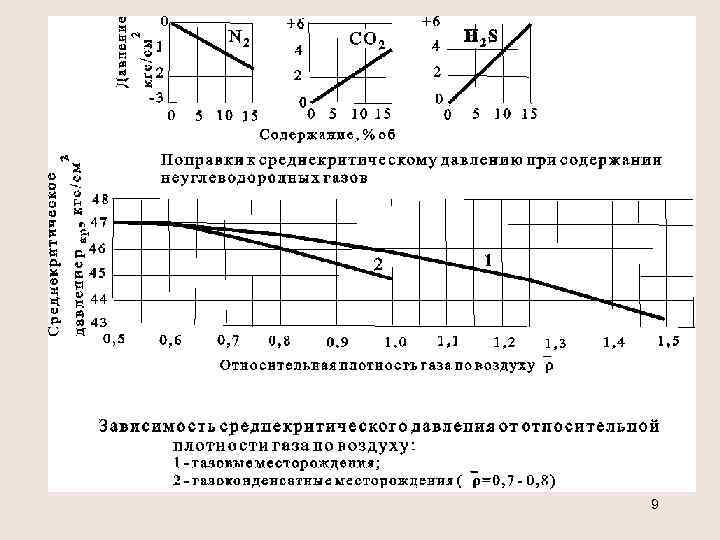
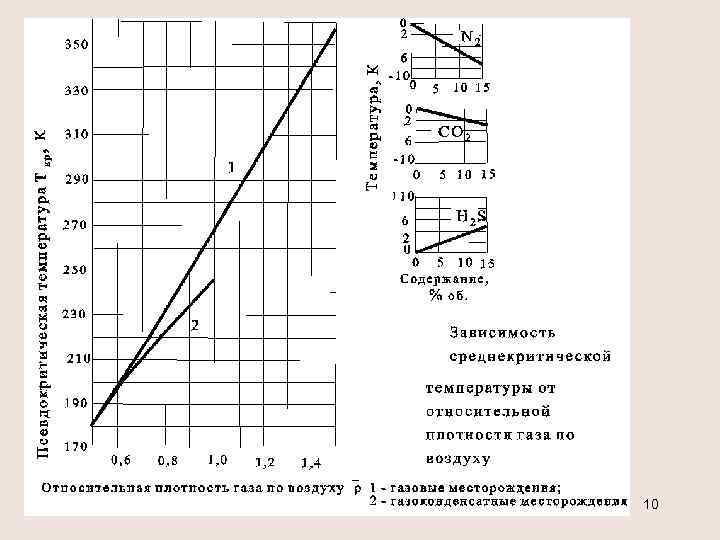
 Приведённые параметры Приведенным давлением рпр называется отношение давления газа р к его критическому давлению ркр : pпр=p/ pкр. Приведенной температурой Тпр называется отношение абсолютной температуры газа Т к её критическому значению Ткр: Тпр=Т/Ткр. Определение критических параметров смеси х. С 5+<10% или содержание N 2, СО 2, Н 2 S превышает 15% pкр= (Pкрi xi) , Ткр = (Tкрi xi) от 0, 5 до 0, 9 давление в кгс/см 2 - (газовые месторождения) температура в К - 8
Приведённые параметры Приведенным давлением рпр называется отношение давления газа р к его критическому давлению ркр : pпр=p/ pкр. Приведенной температурой Тпр называется отношение абсолютной температуры газа Т к её критическому значению Ткр: Тпр=Т/Ткр. Определение критических параметров смеси х. С 5+<10% или содержание N 2, СО 2, Н 2 S превышает 15% pкр= (Pкрi xi) , Ткр = (Tкрi xi) от 0, 5 до 0, 9 давление в кгс/см 2 - (газовые месторождения) температура в К - 8
 9
9
 10
10
 Уравнения состояния природных газов Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описывающими поведение вещества. Идеальный газ - это газ, в котором можно пренебречь объёмом молекул и молекулярным взаимодействием их между собой. Уравнение состояние идеального газа р= R T (до 10 МПА) Обобщенное уравнение состояния р=z R T Многопараметрические зависимости p=f(a 1, …, an, v, T) 11
Уравнения состояния природных газов Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описывающими поведение вещества. Идеальный газ - это газ, в котором можно пренебречь объёмом молекул и молекулярным взаимодействием их между собой. Уравнение состояние идеального газа р= R T (до 10 МПА) Обобщенное уравнение состояния р=z R T Многопараметрические зависимости p=f(a 1, …, an, v, T) 11
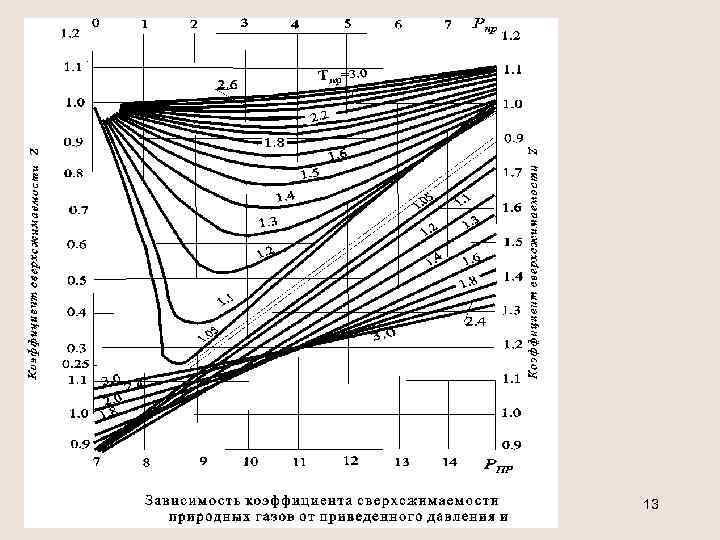
 Обобщенное уравнение состояния р=z R T Коэффициент сверхсжимаемости z является функцией приведенных значений давления рпр, температуры Тпр и для тяжелых углеводородов С 5+ - ацентрического фактора . Ацентрический фактор - учитывает нецентричность сил притяжения Формула Эдмистера: = 3/7[ lg(pкр /pст)/(Tкр /Tкип-1)]-1 Формула Гуревича (до С 7, включительно): Для смесей газов = (yi i), 0< i < 0, 4 12
Обобщенное уравнение состояния р=z R T Коэффициент сверхсжимаемости z является функцией приведенных значений давления рпр, температуры Тпр и для тяжелых углеводородов С 5+ - ацентрического фактора . Ацентрический фактор - учитывает нецентричность сил притяжения Формула Эдмистера: = 3/7[ lg(pкр /pст)/(Tкр /Tкип-1)]-1 Формула Гуревича (до С 7, включительно): Для смесей газов = (yi i), 0< i < 0, 4 12
 13
13
 Многопараметрические зависимости p=f(a 1, …, an, v, T) Впервые предложена Ван-дер- Вальсом Зависимость - Редлиха Квонга р=R Т/(v-b)-a/[T 0. 5 v (v+b)], где a=0. 4275 R 2 T 2, 5 кр /ркр; в=0. 08664 R Tкр/ркр. Область действия - сухие газы в докритической области. Уравнение Пенга- Робинсона p= RT/(v-b)-a(T)/[v(v+b)+b(v-b)]. Здесь: а(T)=akp (Tпр, ); akp=0. 45724 R 2 Tkp 2/Pkp; b=0. 0778 R Tkp /Pkp; ={1+m (1 -Tпр0. 5)}2; m=0. 37464+1. 54226 -0. 26992 2. Для многокомпонентных смесей а= (yi ai); b= (yi bi). Область действия газоконденсатных смесей. критическая область; для 14
Многопараметрические зависимости p=f(a 1, …, an, v, T) Впервые предложена Ван-дер- Вальсом Зависимость - Редлиха Квонга р=R Т/(v-b)-a/[T 0. 5 v (v+b)], где a=0. 4275 R 2 T 2, 5 кр /ркр; в=0. 08664 R Tкр/ркр. Область действия - сухие газы в докритической области. Уравнение Пенга- Робинсона p= RT/(v-b)-a(T)/[v(v+b)+b(v-b)]. Здесь: а(T)=akp (Tпр, ); akp=0. 45724 R 2 Tkp 2/Pkp; b=0. 0778 R Tkp /Pkp; ={1+m (1 -Tпр0. 5)}2; m=0. 37464+1. 54226 -0. 26992 2. Для многокомпонентных смесей а= (yi ai); b= (yi bi). Область действия газоконденсатных смесей. критическая область; для 14
 Расчетные методы определения коэффициента сверхсжимаемости Из уравнения состояния Пенга-Робинсона где А=а(Т) р/(R 2 T 2); B=p b/(R T). Область использования: р<50 МПа; х. С 5+<40 моль%; пары воды. Выбор z: z газовой фазы соответствует наименьший положительный корень уравнения, а z жидкой фазы наибольший положительный корень. 15
Расчетные методы определения коэффициента сверхсжимаемости Из уравнения состояния Пенга-Робинсона где А=а(Т) р/(R 2 T 2); B=p b/(R T). Область использования: р<50 МПа; х. С 5+<40 моль%; пары воды. Выбор z: z газовой фазы соответствует наименьший положительный корень уравнения, а z жидкой фазы наибольший положительный корень. 15
 Аппроксимация Платонова-Гуревича Формулы Хенкинсона, Томаса и Филлипса Область использования - р<40 МПа; х. С 5+<10 моль%. Погрешность формулы: меньше 1% при p< 25 МПа; 3% при p= 25 - 35 МПа и 5% - от 35 до 40 МПа. 16
Аппроксимация Платонова-Гуревича Формулы Хенкинсона, Томаса и Филлипса Область использования - р<40 МПа; х. С 5+<10 моль%. Погрешность формулы: меньше 1% при p< 25 МПа; 3% при p= 25 - 35 МПа и 5% - от 35 до 40 МПа. 16
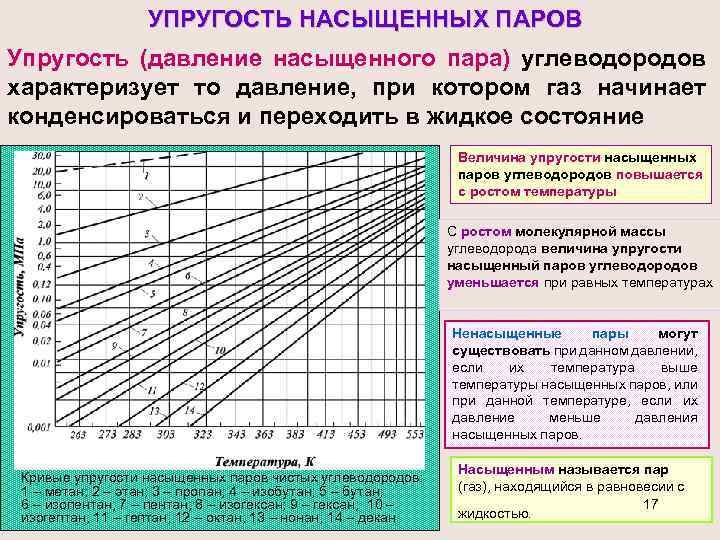 УПРУГОСТЬ НАСЫЩЕННЫХ ПАРОВ Упругость (давление насыщенного пара) углеводородов характеризует то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние Величина упругости насыщенных паров углеводородов повышается с ростом температуры C ростом молекулярной массы углеводорода величина упругости насыщенный паров углеводородов уменьшается при равных температурах Ненасыщенные пары могут существовать при данном давлении, если их температура выше температуры насыщенных паров, или при данной температуре, если их давление меньше давления насыщенных паров. Кривые упругости насыщенных паров чистых углеводородов: 1 – метан; 2 – этан; 3 – пропан; 4 – изобутан; 5 – бутан; 6 – изопентан; 7 – пентан; 8 – изогексан; 9 – гексан; 10 – изогептан; 11 – гептан; 12 – октан; 13 – нонан; 14 – декан Насыщенным называется пар (газ), находящийся в равновесии с 17 жидкостью.
УПРУГОСТЬ НАСЫЩЕННЫХ ПАРОВ Упругость (давление насыщенного пара) углеводородов характеризует то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние Величина упругости насыщенных паров углеводородов повышается с ростом температуры C ростом молекулярной массы углеводорода величина упругости насыщенный паров углеводородов уменьшается при равных температурах Ненасыщенные пары могут существовать при данном давлении, если их температура выше температуры насыщенных паров, или при данной температуре, если их давление меньше давления насыщенных паров. Кривые упругости насыщенных паров чистых углеводородов: 1 – метан; 2 – этан; 3 – пропан; 4 – изобутан; 5 – бутан; 6 – изопентан; 7 – пентан; 8 – изогексан; 9 – гексан; 10 – изогептан; 11 – гептан; 12 – октан; 13 – нонан; 14 – декан Насыщенным называется пар (газ), находящийся в равновесии с 17 жидкостью.
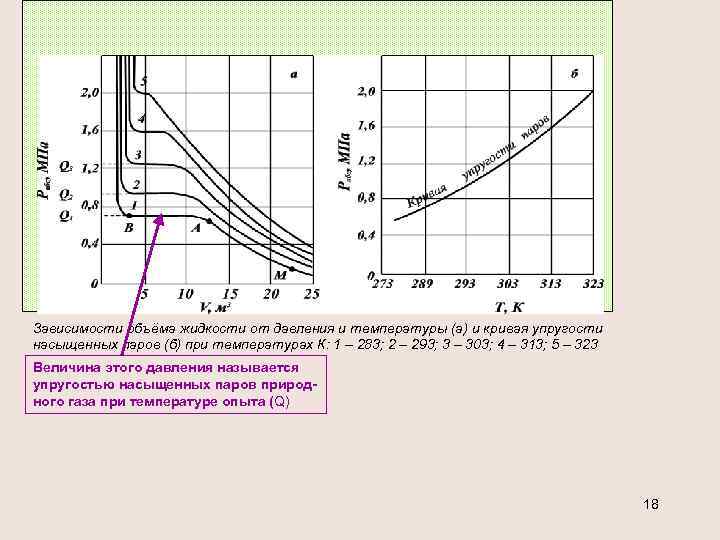 Зависимости объёма жидкости от давления и температуры (а) и кривая упругости насыщенных паров (б) при температурах К: 1 – 283; 2 – 293; 3 – 303; 4 – 313; 5 – 323 Величина этого давления называется упругостью насыщенных паров природного газа при температуре опыта (Q) 18
Зависимости объёма жидкости от давления и температуры (а) и кривая упругости насыщенных паров (б) при температурах К: 1 – 283; 2 – 293; 3 – 303; 4 – 313; 5 – 323 Величина этого давления называется упругостью насыщенных паров природного газа при температуре опыта (Q) 18
 Физико-химические и теплофизические свойства природных газов 19
Физико-химические и теплофизические свойства природных газов 19
 Вязкость - свойство жидкостей и газов, характеризующих сопротивляемость скольжению или сдвигу одной их части относительно другой Коэффициент динамической вязкости характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении. Единицы дин. вязкости: СИ - Па*с, СГС техническая система (ТС) - сантипуаз (с. П). пуаз (П), 1 с. П = 0, 01 П= 0, 001 Па*с. Коэффициент кинематической вязкости равен абсолютной вязкости, деленной на плотность газа: . Единицы кинем. вязкости: СИ - м 2/с; СГС - стокс (Ст); ТС - сантистокс (с. Ст) 1 Ст = 10 -4 м 2/с; 1 с. Ст = 10 -6 м 2/с = 1 мм 2/с. 20
Вязкость - свойство жидкостей и газов, характеризующих сопротивляемость скольжению или сдвигу одной их части относительно другой Коэффициент динамической вязкости характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении. Единицы дин. вязкости: СИ - Па*с, СГС техническая система (ТС) - сантипуаз (с. П). пуаз (П), 1 с. П = 0, 01 П= 0, 001 Па*с. Коэффициент кинематической вязкости равен абсолютной вязкости, деленной на плотность газа: . Единицы кинем. вязкости: СИ - м 2/с; СГС - стокс (Ст); ТС - сантистокс (с. Ст) 1 Ст = 10 -4 м 2/с; 1 с. Ст = 10 -6 м 2/с = 1 мм 2/с. 20
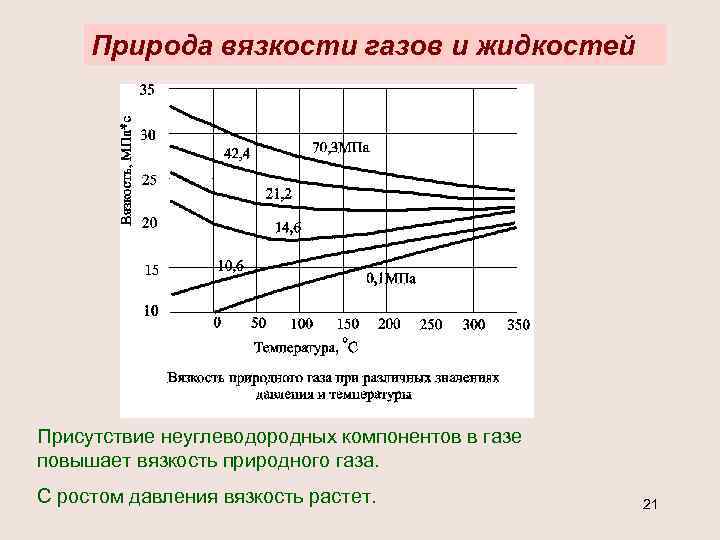 Природа вязкости газов и жидкостей Присутствие неуглеводородных компонентов в газе повышает вязкость природного газа. С ростом давления вязкость растет. 21
Природа вязкости газов и жидкостей Присутствие неуглеводородных компонентов в газе повышает вязкость природного газа. С ростом давления вязкость растет. 21
 Теплоёмкость Теплоемкость С - это количество теплоты, необходимое для нагревания единицы массы или объема вещества на 1° С. Удельная теплоемкость - отношение теплоёмкости к единице количества газа. Газы: СР и СV; СР>CV. Для идеальных газов: Сp = Сv + R, где R — газовая постоянная Для смеси газов теплоемкость определяется по сумме теплоемкости входящих компонентов по формуле: 22
Теплоёмкость Теплоемкость С - это количество теплоты, необходимое для нагревания единицы массы или объема вещества на 1° С. Удельная теплоемкость - отношение теплоёмкости к единице количества газа. Газы: СР и СV; СР>CV. Для идеальных газов: Сp = Сv + R, где R — газовая постоянная Для смеси газов теплоемкость определяется по сумме теплоемкости входящих компонентов по формуле: 22
 При изобарическом процессе молярная теплоёмкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоёмкости углеводорода с одинаковой молекулярной массой при одной и той же температуре. Массовая теплоёмкость равна отношению молярной теплоёмкости к молекулярной массе газа Мi , т. е массе киломоля i-го компонента, кг/моль. 23
При изобарическом процессе молярная теплоёмкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоёмкости углеводорода с одинаковой молекулярной массой при одной и той же температуре. Массовая теплоёмкость равна отношению молярной теплоёмкости к молекулярной массе газа Мi , т. е массе киломоля i-го компонента, кг/моль. 23
 Дросселирование газа. Коэффициент Джоуля-Томсона Дросселирование - расширение газа при прохождении через дроссель - местное сопротивление (вентиль, кран и т. д. ), сопровождающее изменением температуры. Отношение изменения температуры газа в результате его изоэнтальпийного расширения (дросселирования) к изменению давления называется дроссельным эффектом или эффектом Джоуля - Томсона. Изменение температуры при снижении давления на 1 ата (0, 1 Мпа) называется коэффициентом Джоуля - Томсона. Этот коэффициент изменяется в широких пределах и может иметь положительный или отрицательный знак. 24
Дросселирование газа. Коэффициент Джоуля-Томсона Дросселирование - расширение газа при прохождении через дроссель - местное сопротивление (вентиль, кран и т. д. ), сопровождающее изменением температуры. Отношение изменения температуры газа в результате его изоэнтальпийного расширения (дросселирования) к изменению давления называется дроссельным эффектом или эффектом Джоуля - Томсона. Изменение температуры при снижении давления на 1 ата (0, 1 Мпа) называется коэффициентом Джоуля - Томсона. Этот коэффициент изменяется в широких пределах и может иметь положительный или отрицательный знак. 24
 Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель-эффектом. Интегральный коэффициент Джоуля-Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчетов среднее значение коэффициента Джоуля-Томсона можно принять равным 3 К/МПа. 25
Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель-эффектом. Интегральный коэффициент Джоуля-Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчетов среднее значение коэффициента Джоуля-Томсона можно принять равным 3 К/МПа. 25
 Поверхностные явления при движении жидкой и паровой фаз в пористой среде. Причиной возникновения на границах контакта фаз поверхностных явлений является значительное различие в физико-химических свойствах фаз. Среди поверхностных явлений, протекающих на границах раздела фаз, особое влияние на эффективность разработки газовых залежей оказывают: • поверхностное натяжение, • капиллярное давление, • смачиваемость, • капиллярная пропитка, 26 • адсорбция.
Поверхностные явления при движении жидкой и паровой фаз в пористой среде. Причиной возникновения на границах контакта фаз поверхностных явлений является значительное различие в физико-химических свойствах фаз. Среди поверхностных явлений, протекающих на границах раздела фаз, особое влияние на эффективность разработки газовых залежей оказывают: • поверхностное натяжение, • капиллярное давление, • смачиваемость, • капиллярная пропитка, 26 • адсорбция.
 Работа обратимого, изотермического образования единицы новой поверхности раздела фаз при постоянстве давления называется поверхностным натяжением (ПН) . Единица измерения поверхностного натяжения: СИ Дж/м 2 или Н/м. Поверхностное натяжение нефти и воды на границе с газом обычно составляет от 5 до 70 м. Н/м. ПН уменьшается с ростом давления и температуры. Коэффициент поверхностного межфазного натяжения равен нулю при критических значениях давления и температуры. 27
Работа обратимого, изотермического образования единицы новой поверхности раздела фаз при постоянстве давления называется поверхностным натяжением (ПН) . Единица измерения поверхностного натяжения: СИ Дж/м 2 или Н/м. Поверхностное натяжение нефти и воды на границе с газом обычно составляет от 5 до 70 м. Н/м. ПН уменьшается с ростом давления и температуры. Коэффициент поверхностного межфазного натяжения равен нулю при критических значениях давления и температуры. 27
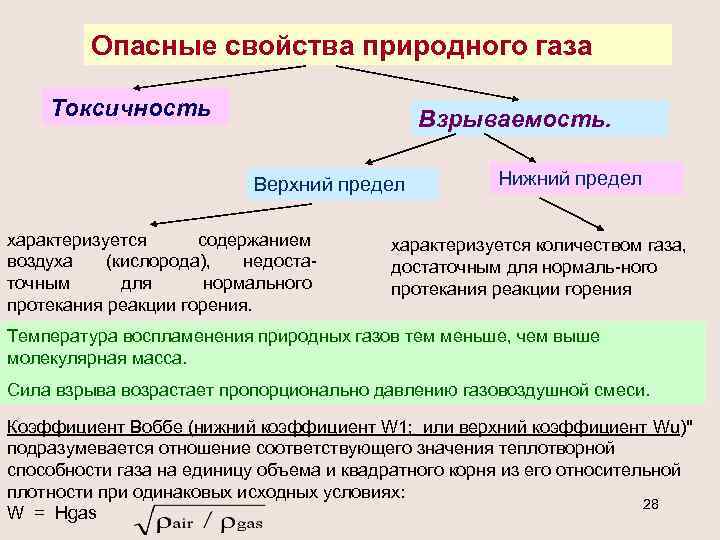 Опасные свойства природного газа Токсичность Взрываемость. Верхний предел характеризуется содержанием воздуха (кислорода), недостаточным для нормального протекания реакции горения. Нижний предел характеризуется количеством газа, достаточным для нормаль-ного протекания реакции горения Температура воспламенения природных газов тем меньше, чем выше молекулярная масса. Сила взрыва возрастает пропорционально давлению газовоздушной смеси. Коэффициент Воббе (нижний коэффициент W 1; или верхний коэффициент Wu)" подразумевается отношение соответствующего значения теплотворной способности газа на единицу объема и квадратного корня из его относительной плотности при одинаковых исходных условиях: 28 W = Hgas
Опасные свойства природного газа Токсичность Взрываемость. Верхний предел характеризуется содержанием воздуха (кислорода), недостаточным для нормального протекания реакции горения. Нижний предел характеризуется количеством газа, достаточным для нормаль-ного протекания реакции горения Температура воспламенения природных газов тем меньше, чем выше молекулярная масса. Сила взрыва возрастает пропорционально давлению газовоздушной смеси. Коэффициент Воббе (нижний коэффициент W 1; или верхний коэффициент Wu)" подразумевается отношение соответствующего значения теплотворной способности газа на единицу объема и квадратного корня из его относительной плотности при одинаковых исходных условиях: 28 W = Hgas
 С повышением давления смеси значительно возрастают пределы ее взрываемости. При содержании инертных газов (азот и др. ) пределы воспламеняемости смесей возрастают. Сила взрыва максимальна, когда содержание воздуха в смеси приближается к количеству, теоретически необходимому для полного сгорания. Струя газовой смеси с концентрацией газа выше верхнего предела воспламенения, поступая в объем воздуха и смешиваясь с ним, сгорает спокойным пламенем. 29
С повышением давления смеси значительно возрастают пределы ее взрываемости. При содержании инертных газов (азот и др. ) пределы воспламеняемости смесей возрастают. Сила взрыва максимальна, когда содержание воздуха в смеси приближается к количеству, теоретически необходимому для полного сгорания. Струя газовой смеси с концентрацией газа выше верхнего предела воспламенения, поступая в объем воздуха и смешиваясь с ним, сгорает спокойным пламенем. 29
 Гидратообразование Гидраты - твердые соединения углеводородов с водой Влияние неуглеводородных компонент и свойств природного газа на гидратообразование Сероводород и углекислый газ повышают равновесную температуру гидратообразования и понижают равновесное давления. Содержание азота понижает температуру гидратообразования. Для образования гидратов в жидких углеводородных газах требуются более высокое давление и более низкие температуры 30
Гидратообразование Гидраты - твердые соединения углеводородов с водой Влияние неуглеводородных компонент и свойств природного газа на гидратообразование Сероводород и углекислый газ повышают равновесную температуру гидратообразования и понижают равновесное давления. Содержание азота понижает температуру гидратообразования. Для образования гидратов в жидких углеводородных газах требуются более высокое давление и более низкие температуры 30
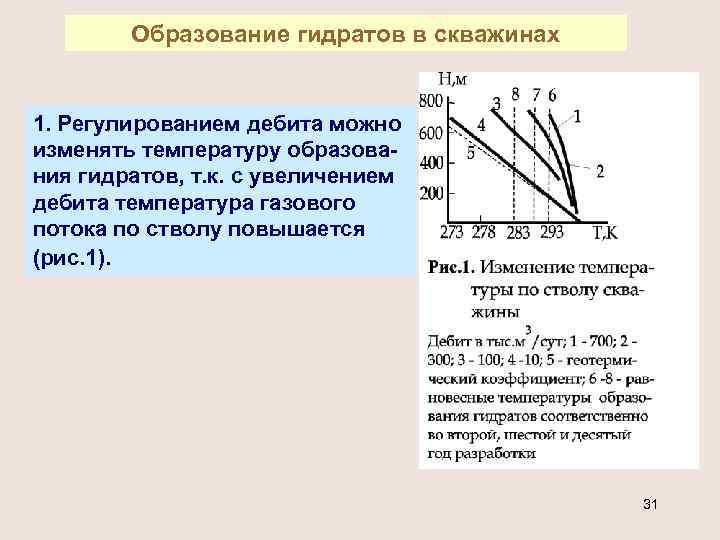 Образование гидратов в скважинах 1. Регулированием дебита можно изменять температуру образования гидратов, т. к. с увеличением дебита температура газового потока по стволу повышается (рис. 1). 31
Образование гидратов в скважинах 1. Регулированием дебита можно изменять температуру образования гидратов, т. к. с увеличением дебита температура газового потока по стволу повышается (рис. 1). 31
 Давление на устье р, температура газа на устье Т и равновесная температура образования гидратов изменяются в зависимости от дебита Q скважины (рис. 2). Для рассматриваемых условий режим безгидратной эксплуатации обеспечивается при дебитах от 1 млн. до 7 млн. м 3/сут. Оптимальный дебит, обеспечивающий максимальный запас температуры, равен примерно 3 млн. м 3/сут. Существует такой дебит, при котором температура газа на устье максимальна и дальнейшее повышение дебита приводит к понижению температуры. В данном случае создаются условия, благоприятные для образования гидратов. 32
Давление на устье р, температура газа на устье Т и равновесная температура образования гидратов изменяются в зависимости от дебита Q скважины (рис. 2). Для рассматриваемых условий режим безгидратной эксплуатации обеспечивается при дебитах от 1 млн. до 7 млн. м 3/сут. Оптимальный дебит, обеспечивающий максимальный запас температуры, равен примерно 3 млн. м 3/сут. Существует такой дебит, при котором температура газа на устье максимальна и дальнейшее повышение дебита приводит к понижению температуры. В данном случае создаются условия, благоприятные для образования гидратов. 32
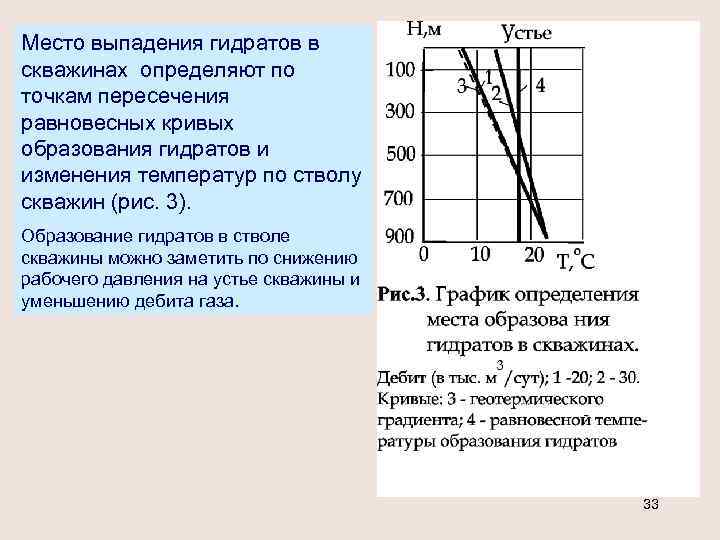 Место выпадения гидратов в скважинах определяют по точкам пересечения равновесных кривых образования гидратов и изменения температур по стволу скважин (рис. 3). Образование гидратов в стволе скважины можно заметить по снижению рабочего давления на устье скважины и уменьшению дебита газа. 33
Место выпадения гидратов в скважинах определяют по точкам пересечения равновесных кривых образования гидратов и изменения температур по стволу скважин (рис. 3). Образование гидратов в стволе скважины можно заметить по снижению рабочего давления на устье скважины и уменьшению дебита газа. 33
 Распределение температуры в месторождениях 34
Распределение температуры в месторождениях 34
 Изменение температуры по глубине горных пород Характерные температурные слои, их толщина и изменение температуры по этим слоям (исключая районы вечной мерзлоты): 1. Суточный слой толщина h. C (1 2 м); постоянная суточная температура. 2. Нейтральный слой толщиной h. H = 19. 1. h. C; температура на глубине нейтрального слоя примерно 1 -2 о выше среднегодовой температуры воздуха данного региона. 3. Слой линейного изменения температуры Тх= Тн + Г ( х - lн ), где Тн температура на глубине нейтрального слоя, К; lн глубина нейтрального слоя, м; Г геотермический градиент, К/м (изменяется в пределах 0. 015 0. 09). 35
Изменение температуры по глубине горных пород Характерные температурные слои, их толщина и изменение температуры по этим слоям (исключая районы вечной мерзлоты): 1. Суточный слой толщина h. C (1 2 м); постоянная суточная температура. 2. Нейтральный слой толщиной h. H = 19. 1. h. C; температура на глубине нейтрального слоя примерно 1 -2 о выше среднегодовой температуры воздуха данного региона. 3. Слой линейного изменения температуры Тх= Тн + Г ( х - lн ), где Тн температура на глубине нейтрального слоя, К; lн глубина нейтрального слоя, м; Г геотермический градиент, К/м (изменяется в пределах 0. 015 0. 09). 35
 Многолетняя мерзлота: 1. Слой сезонного оттаивания и промерзания ( h до 5 м). Изменение температур от плюсовых (среднелетних) до наиболее низких минусовых (среднезимних). Отличается сезонными пучениями и осадками грунтов. 2. Слой годовых колебаний температур (hн до 30 м). Особенность: максимальная (по сравнению с нижележащими породами) льдистость, постоянные отрицательные температуры в нижней части (минус 4 -5 о. С) и сезонные колебания отрицательных температур в основной части (от 0 о. С до среднезимних). 3. Вечная мерзлота – по мощности составляет наибольшую часть разреза многолетней мерзлоты. Температура пород - отрицательна, не зависит от сезонных колебаний температур на поверхности и повышается от кровли к подошве (обычно от минус 4 -5 о. С в верхней части до отрицательной, среднегодовой дневной поверхности на подошве). В основании многомерзлой толщи при наличии минерализованных подмерзлотных вод обычно выделяется “морозная зона” с мощностью большей частью превышающей мощность многолетнемерзлой толщи и температурой от 0 о до минус 2 о. С. Горизонты мерзлых пород могут встречаться и непосредственно среди многолетнемерзлой толщи при наличии в ней минерализованной воды 36
Многолетняя мерзлота: 1. Слой сезонного оттаивания и промерзания ( h до 5 м). Изменение температур от плюсовых (среднелетних) до наиболее низких минусовых (среднезимних). Отличается сезонными пучениями и осадками грунтов. 2. Слой годовых колебаний температур (hн до 30 м). Особенность: максимальная (по сравнению с нижележащими породами) льдистость, постоянные отрицательные температуры в нижней части (минус 4 -5 о. С) и сезонные колебания отрицательных температур в основной части (от 0 о. С до среднезимних). 3. Вечная мерзлота – по мощности составляет наибольшую часть разреза многолетней мерзлоты. Температура пород - отрицательна, не зависит от сезонных колебаний температур на поверхности и повышается от кровли к подошве (обычно от минус 4 -5 о. С в верхней части до отрицательной, среднегодовой дневной поверхности на подошве). В основании многомерзлой толщи при наличии минерализованных подмерзлотных вод обычно выделяется “морозная зона” с мощностью большей частью превышающей мощность многолетнемерзлой толщи и температурой от 0 о до минус 2 о. С. Горизонты мерзлых пород могут встречаться и непосредственно среди многолетнемерзлой толщи при наличии в ней минерализованной воды 36


