10_Lect_2013_10_08_mol spectr2.pptx
- Количество слайдов: 26
 Физическое материаловедение Молекулярная спектроскопия
Физическое материаловедение Молекулярная спектроскопия
 Свойства электронных состояний молекул и химическая связь Рассмотрим состояния двухатомных молекул Для характеристики электронных состояний важны: 1) Свойства симметрии; 2) Зависимость электронной энергии от межъядерного расстояния, т. е. потенциальные кривые. Два подхода, использующиеся при характеристике электронных состояний молекул Рассмотрение состояний молекулы в целом Определение молекулярных термов из состояний отдельных атомов
Свойства электронных состояний молекул и химическая связь Рассмотрим состояния двухатомных молекул Для характеристики электронных состояний важны: 1) Свойства симметрии; 2) Зависимость электронной энергии от межъядерного расстояния, т. е. потенциальные кривые. Два подхода, использующиеся при характеристике электронных состояний молекул Рассмотрение состояний молекулы в целом Определение молекулярных термов из состояний отдельных атомов
 Классификация электронных состояний двухатомной молекулы Классификация электронных состояний двухатомных молекул определяется, прежде всего, наличием аксиальной симметрии – оси симметрии бесконечного порядка C∞ , проходящей через ядра молекулы. Такой осью обладает любая линейная молекула. Линейные молекулы могут относиться к 2 точечным группам симметрии 1) C∞v и 2) D ∞h 1) Молекула обладает осью симметрии C∞ и бесконечным числом плоскостей симметрии σv , проходящих через эту ось. (HCl, CO, NO, CH, HCN, etc. ) 2) Молекула дополнительно обладает центром симметрии i и плоскостью симметрии σh, проходящей через центр симметрии, перепендикулярно к оси молекулы. (H 2, N 2, O 2… C 2, H 2 и линейные многоатомные молекулы, содержащие пары симметрчно расположенных одинаковых ядер СO 2, C 2 H 2, C 4 H 2 etc. )
Классификация электронных состояний двухатомной молекулы Классификация электронных состояний двухатомных молекул определяется, прежде всего, наличием аксиальной симметрии – оси симметрии бесконечного порядка C∞ , проходящей через ядра молекулы. Такой осью обладает любая линейная молекула. Линейные молекулы могут относиться к 2 точечным группам симметрии 1) C∞v и 2) D ∞h 1) Молекула обладает осью симметрии C∞ и бесконечным числом плоскостей симметрии σv , проходящих через эту ось. (HCl, CO, NO, CH, HCN, etc. ) 2) Молекула дополнительно обладает центром симметрии i и плоскостью симметрии σh, проходящей через центр симметрии, перепендикулярно к оси молекулы. (H 2, N 2, O 2… C 2, H 2 и линейные многоатомные молекулы, содержащие пары симметрчно расположенных одинаковых ядер СO 2, C 2 H 2, C 4 H 2 etc. )
 Классификация электронных состояний двухатомной молекулы Классификация электронных состояний линейных молекул основана на квантовании проекции момента количества движения В молекуле существуют электростатические и магнитные взаимодействия между электронами, что приводит к векторному сложению моментов количества движения. В отличие от атома, в линейной молекуле имеется не сферически симметричное (как в атоме), а аксиально симметричное электрическое поле. Аксиально симметричное электрическое поле действует на полный орбитальный момент, вызывая его прецессию вокруг оси поля (молекулы). В результате сохраняется лишь квантование проекции Lz на ось молекулы Lz = m. L = 0, ± 1, ± 2… Абсолютную величину проекции полного орбитального момента принято обозначать Λ = │ m. L │ = 0, 1, 2… Λ= 0 Σ 1 Π 2 Δ 3 Φ 4 Γ
Классификация электронных состояний двухатомной молекулы Классификация электронных состояний линейных молекул основана на квантовании проекции момента количества движения В молекуле существуют электростатические и магнитные взаимодействия между электронами, что приводит к векторному сложению моментов количества движения. В отличие от атома, в линейной молекуле имеется не сферически симметричное (как в атоме), а аксиально симметричное электрическое поле. Аксиально симметричное электрическое поле действует на полный орбитальный момент, вызывая его прецессию вокруг оси поля (молекулы). В результате сохраняется лишь квантование проекции Lz на ось молекулы Lz = m. L = 0, ± 1, ± 2… Абсолютную величину проекции полного орбитального момента принято обозначать Λ = │ m. L │ = 0, 1, 2… Λ= 0 Σ 1 Π 2 Δ 3 Φ 4 Γ
 Мультиплетность В отличие от полного орбитального момента полный спиновый момент, на который аксиально симметрчное электрическое поле не действует, обычно приближенно сохраняется и квантуется обычным образом. Молекула характеризуется спиновым квантовым числом S. χ = 2 S+1, S – полный спиновый момент 1Σ, 1Π … - синглеты 2Σ, 2Π… - дублеты 3Σ, 3Π… - триплеты Наряду с квантовым числом Λ важную роль играют характеристики, связанные с наличием плоскостей симметрии σv и центра симметрии По отношению к отражению в плоскости симметрии σv , проходящей через ось молекулы, электронные состояния разделяются на положительные + и отрицательные – Для линейных молекул, принадлежащих к группе D ∞h , электронные состояния делятся на четные и нечетные по отношению к отражению в центре симметрии Σg + , Σg Σu + , Σu -
Мультиплетность В отличие от полного орбитального момента полный спиновый момент, на который аксиально симметрчное электрическое поле не действует, обычно приближенно сохраняется и квантуется обычным образом. Молекула характеризуется спиновым квантовым числом S. χ = 2 S+1, S – полный спиновый момент 1Σ, 1Π … - синглеты 2Σ, 2Π… - дублеты 3Σ, 3Π… - триплеты Наряду с квантовым числом Λ важную роль играют характеристики, связанные с наличием плоскостей симметрии σv и центра симметрии По отношению к отражению в плоскости симметрии σv , проходящей через ось молекулы, электронные состояния разделяются на положительные + и отрицательные – Для линейных молекул, принадлежащих к группе D ∞h , электронные состояния делятся на четные и нечетные по отношению к отражению в центре симметрии Σg + , Σg Σu + , Σu -
 Соответствие между электронными состояниями молекулы и образующих ее атомов Два взаимодействующих атома можно представить как молекулу, на ось которой проектируются моменты L 1 и L 2 m. L 1 = L 1, L 1 – 1, … – L 1 m. L 2 = L 2, L 2 – 1, … – L 2 Полная проекция равна m. L 1 + m. L 2 , а ее абсолютное значение равно Λ = │ m. L 1 + m. L 2 │ При этом Λ принимает значения от 0 до L 1 + L 2 Σ состояния получаются столько раз , сколько сумма m. L 1 + m. L 2 оказывается равной 0 Π состояния получаются столько раз , сколько сумма m. L 1 + m. L 2 оказывается равной +1 и – 1
Соответствие между электронными состояниями молекулы и образующих ее атомов Два взаимодействующих атома можно представить как молекулу, на ось которой проектируются моменты L 1 и L 2 m. L 1 = L 1, L 1 – 1, … – L 1 m. L 2 = L 2, L 2 – 1, … – L 2 Полная проекция равна m. L 1 + m. L 2 , а ее абсолютное значение равно Λ = │ m. L 1 + m. L 2 │ При этом Λ принимает значения от 0 до L 1 + L 2 Σ состояния получаются столько раз , сколько сумма m. L 1 + m. L 2 оказывается равной 0 Π состояния получаются столько раз , сколько сумма m. L 1 + m. L 2 оказывается равной +1 и – 1

 Спиновые моменты S 1 и S 2 атомов векторно складываются в полный спин молекулы S = S 1 + S 2. При этом возможные значения спинового квантового числа молекулы будут S = S 1 + S 2. , S 1 + S 2. – 1, │S 1 - S 2│, и мультиплетность χ состояния молекулы будет принимать значения χ = χ1 + χ2 – 1, χ1 + χ2 – 3, … │ χ1 - χ2 │ +1
Спиновые моменты S 1 и S 2 атомов векторно складываются в полный спин молекулы S = S 1 + S 2. При этом возможные значения спинового квантового числа молекулы будут S = S 1 + S 2. , S 1 + S 2. – 1, │S 1 - S 2│, и мультиплетность χ состояния молекулы будет принимать значения χ = χ1 + χ2 – 1, χ1 + χ2 – 3, … │ χ1 - χ2 │ +1
 Если атомы находятся в одинаковых состояниях, напрмер S или P, то Состояния молекулы будут S+S P+P Σg+ при χ = 1, 5 Σg+ , Σu-, Πg, Πu, Δg при χ = 1, 5 Σu+ при χ = 3, 7 Σu+ , Σg-, Πg, Πu, Δu при χ = 3, 7 H 2 Два атома водорода в состоянии 2 S образуют молекулу в состояниях χ = 1, 3 1Σ + , 3Σ + g u
Если атомы находятся в одинаковых состояниях, напрмер S или P, то Состояния молекулы будут S+S P+P Σg+ при χ = 1, 5 Σg+ , Σu-, Πg, Πu, Δg при χ = 1, 5 Σu+ при χ = 3, 7 Σu+ , Σg-, Πg, Πu, Δu при χ = 3, 7 H 2 Два атома водорода в состоянии 2 S образуют молекулу в состояниях χ = 1, 3 1Σ + , 3Σ + g u
 N 2 Атомы азота в состоянии 4 S Возможные значения спинового квантового числа молекулы N 2 S=S 1+S 2, S 1+S 2 -1, … |S 1 -S 2| χ= χ1+ χ2 -1, χ1+ χ2 -3…| χ1 - χ2|+1 при χ = 1, 3, 5, 7 1Σ + 3Σ + 5Σ + 7Σ + g u
N 2 Атомы азота в состоянии 4 S Возможные значения спинового квантового числа молекулы N 2 S=S 1+S 2, S 1+S 2 -1, … |S 1 -S 2| χ= χ1+ χ2 -1, χ1+ χ2 -3…| χ1 - χ2|+1 при χ = 1, 3, 5, 7 1Σ + 3Σ + 5Σ + 7Σ + g u
 Характеристика электронов в молекуле и молекулярные электронные оболочки В двухатомной молекуле или линейной многоатомной молекуле можно приближенно считать, что электрон движется в аксиально симметричном поле ядер и остальных электронов. Основной характеристикой одноэлектронных состояний служит квантовое число λ, определяющее абсолютную величину проекции орбитального момента электрона на ось молекулы. Величина этой проекции равна l z = ml ml = 0, ± 1, ± 2, … λ = │ ml │ = 0, 1, 2, 3, … Энергия электрона в молекуле зависит только от абсолютной величины проекции, так как на электрон в молекуле действует электрическое поле. Состояния с обозначаются λ 0 σ 1 π 2 δ 3 φ
Характеристика электронов в молекуле и молекулярные электронные оболочки В двухатомной молекуле или линейной многоатомной молекуле можно приближенно считать, что электрон движется в аксиально симметричном поле ядер и остальных электронов. Основной характеристикой одноэлектронных состояний служит квантовое число λ, определяющее абсолютную величину проекции орбитального момента электрона на ось молекулы. Величина этой проекции равна l z = ml ml = 0, ± 1, ± 2, … λ = │ ml │ = 0, 1, 2, 3, … Энергия электрона в молекуле зависит только от абсолютной величины проекции, так как на электрон в молекуле действует электрическое поле. Состояния с обозначаются λ 0 σ 1 π 2 δ 3 φ
 Согласно принципу Паули в молекуле не может быть двух электронов в одинаковых квантовых состояниях. σ-электроны могут отличаться величиной проекции спина на ось молекулы (ms = ½ и ms = - ½ ). Молекулярная оболочка σ2 заполнена 2 электронами. π –электроны могут отличаться знаком проекции орбитального момента и знаком проекции спина на ось молекулы (ml=λ, ms=1/2; ml=λ, ms=-1/2; ml=-λ, ms=-1/2). Молекулярная оболочка π4 может быть заполнена 4 электронами. Сначала заполняется σ оболочка, а затем π.
Согласно принципу Паули в молекуле не может быть двух электронов в одинаковых квантовых состояниях. σ-электроны могут отличаться величиной проекции спина на ось молекулы (ms = ½ и ms = - ½ ). Молекулярная оболочка σ2 заполнена 2 электронами. π –электроны могут отличаться знаком проекции орбитального момента и знаком проекции спина на ось молекулы (ml=λ, ms=1/2; ml=λ, ms=-1/2; ml=-λ, ms=-1/2). Молекулярная оболочка π4 может быть заполнена 4 электронами. Сначала заполняется σ оболочка, а затем π.
 Для линейных молекул, обладающих центром симметрии, одноэлектронные состояния можно разделить на четные (g) и нечетные (u) σg πg δg φg σu πu δu φu Для σu-электронов плотность электронного облака обращается в нуль в средней плоскости, проходящей через центр молекулы и перпендикулярной к ее оси. Для σg –электронов она не равна нулю. σg –электроны – связывающие; σu – электроны – антисвязывающие; πg –электроны – антисвязывающие; πu –электроны – связывающие.
Для линейных молекул, обладающих центром симметрии, одноэлектронные состояния можно разделить на четные (g) и нечетные (u) σg πg δg φg σu πu δu φu Для σu-электронов плотность электронного облака обращается в нуль в средней плоскости, проходящей через центр молекулы и перпендикулярной к ее оси. Для σg –электронов она не равна нулю. σg –электроны – связывающие; σu – электроны – антисвязывающие; πg –электроны – антисвязывающие; πu –электроны – связывающие.
 Распределение зарядовой плотности в молекуле H 2 De = 4, 48 e. V Распределение зарядовой плотности в молекуле He 2
Распределение зарядовой плотности в молекуле H 2 De = 4, 48 e. V Распределение зарядовой плотности в молекуле He 2
 Распределение заряда в стабильных двухатомных молекулах Элемент Li 2 B 2 C 2 N 2 O 2 F 2 De 1, 14 2, 71 3, 6 9, 76 5, 08 2, 8 e. V Общее распределение заряда
Распределение заряда в стабильных двухатомных молекулах Элемент Li 2 B 2 C 2 N 2 O 2 F 2 De 1, 14 2, 71 3, 6 9, 76 5, 08 2, 8 e. V Общее распределение заряда
 Молекула лития Число электронов 6 Электронная конфигурация 1 sg 21 su 2 2 sg 2 Порядок связи ½(4 -2)=1, σ - связь 4 электрона в связывающих орбиталях, 2 электрона – в антисвязывающих De = 1, 14 э. В Chemistry: The Central Science, Eleventh Edition, by Theodore E. Brown, H. Eugene Le. May, and Bruce E. Bursten, Catherine Murphy, and Patrick Woodward. Published by Prentice Hall.
Молекула лития Число электронов 6 Электронная конфигурация 1 sg 21 su 2 2 sg 2 Порядок связи ½(4 -2)=1, σ - связь 4 электрона в связывающих орбиталях, 2 электрона – в антисвязывающих De = 1, 14 э. В Chemistry: The Central Science, Eleventh Edition, by Theodore E. Brown, H. Eugene Le. May, and Bruce E. Bursten, Catherine Murphy, and Patrick Woodward. Published by Prentice Hall.
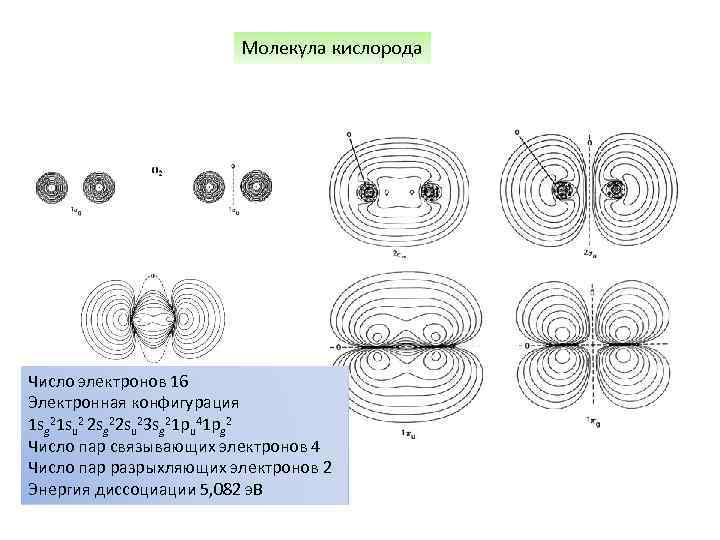 Молекула кислорода Число электронов 16 Электронная конфигурация 1 sg 21 su 2 2 sg 22 su 23 sg 21 pu 41 pg 2 Число пар связывающих электронов 4 Число пар разрыхляющих электронов 2 Энергия диссоциации 5, 082 э. В
Молекула кислорода Число электронов 16 Электронная конфигурация 1 sg 21 su 2 2 sg 22 su 23 sg 21 pu 41 pg 2 Число пар связывающих электронов 4 Число пар разрыхляющих электронов 2 Энергия диссоциации 5, 082 э. В
 Молекулярные орбитали гетероядерных молекул Atomic Configurations Molecular Configurations Li 1 s 22 s 1 Li. H 1 s 22 s 2 C 1 s 22 p 2 CH 1 s 22 s 23 s 21 p 1 F 1 s 22 p 5 HF 1 s 22 s 23 s 21 p 4 Li. H Molecule De, e. V Li. H 2, 5 CH 3, 47 HF 6, 4 В гидридах связь промежуточного типа: Li. H – атом Li является донором, а H акцептором; HF – атом H донор, а F акцептор. CH HF
Молекулярные орбитали гетероядерных молекул Atomic Configurations Molecular Configurations Li 1 s 22 s 1 Li. H 1 s 22 s 2 C 1 s 22 p 2 CH 1 s 22 s 23 s 21 p 1 F 1 s 22 p 5 HF 1 s 22 s 23 s 21 p 4 Li. H Molecule De, e. V Li. H 2, 5 CH 3, 47 HF 6, 4 В гидридах связь промежуточного типа: Li. H – атом Li является донором, а H акцептором; HF – атом H донор, а F акцептор. CH HF
 Возможные состояния молекулы с заданной электронной конфигурацией Электронная конфигурация молекулы определяется заданием для каждого вида эквивалентных электронов их числа ki и квантового числа λ (aσ)k 1 (bσ)k 2 (cπ)k 3 … Для заданной конфигурации молекулы можно найти значения Λ и S определить мультиплетные термы Λ = │±λ 1 ±λ 2 ±λ 3│ Сложение спиновых моментов si дает целый или полуцелый спин В случае неэквивалентных электронов принцип Паули автоматически удовлетворяется, в случае эквивалентных электронов его нужно учитывать.
Возможные состояния молекулы с заданной электронной конфигурацией Электронная конфигурация молекулы определяется заданием для каждого вида эквивалентных электронов их числа ki и квантового числа λ (aσ)k 1 (bσ)k 2 (cπ)k 3 … Для заданной конфигурации молекулы можно найти значения Λ и S определить мультиплетные термы Λ = │±λ 1 ±λ 2 ±λ 3│ Сложение спиновых моментов si дает целый или полуцелый спин В случае неэквивалентных электронов принцип Паули автоматически удовлетворяется, в случае эквивалентных электронов его нужно учитывать.
 Для двух эквивалентных электронов Λ = λ 1 + λ 2 и Λ = │λ 1 - λ 2│ При λ 1 = λ 2 = λ, Λ = λ 1 + λ 2 =2 λ и два состояния с Λ = 0 (Σ состояния: Σ+ и Σ-) Для заполненной оболочки результирующее состояние 1Σ+
Для двух эквивалентных электронов Λ = λ 1 + λ 2 и Λ = │λ 1 - λ 2│ При λ 1 = λ 2 = λ, Λ = λ 1 + λ 2 =2 λ и два состояния с Λ = 0 (Σ состояния: Σ+ и Σ-) Для заполненной оболочки результирующее состояние 1Σ+
 М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
 М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
 М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
 М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
 М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва, 1962
 Литература: 1. М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат 2. 3. Гиз, Москва, 1962. Г. Герцберг Спектры и строение двухатомных молекул, Издательство иностранной литературы, Москва, 1949. Н. Ф. Степанов Химическая связь в простых двухатомных молекулах, Химия, Соросовский образовательный журнал № 10, 1998, с. 37
Литература: 1. М. А. Ельяшевич Атомная и молекулярная спектроскопия, Физ-мат 2. 3. Гиз, Москва, 1962. Г. Герцберг Спектры и строение двухатомных молекул, Издательство иностранной литературы, Москва, 1949. Н. Ф. Степанов Химическая связь в простых двухатомных молекулах, Химия, Соросовский образовательный журнал № 10, 1998, с. 37


