nevodn-lectures.ppt
- Количество слайдов: 131
 ФИЗИЧЕСКАЯ ХИМИЯ НЕВОДНЫХ РАСТВОРОВ Мчедлов-Петросян Николай Отарович кафедра физической химии 1
ФИЗИЧЕСКАЯ ХИМИЯ НЕВОДНЫХ РАСТВОРОВ Мчедлов-Петросян Николай Отарович кафедра физической химии 1
 2
2
 Аристотель: Ta hygra meikta malista ton somaton (есть прежде всего жидкости, которые реагируют) Corpora non agunt nisi fluida (вещества не реагируют, если они не жидки) 3
Аристотель: Ta hygra meikta malista ton somaton (есть прежде всего жидкости, которые реагируют) Corpora non agunt nisi fluida (вещества не реагируют, если они не жидки) 3
 4
4
 5
5
 6
6
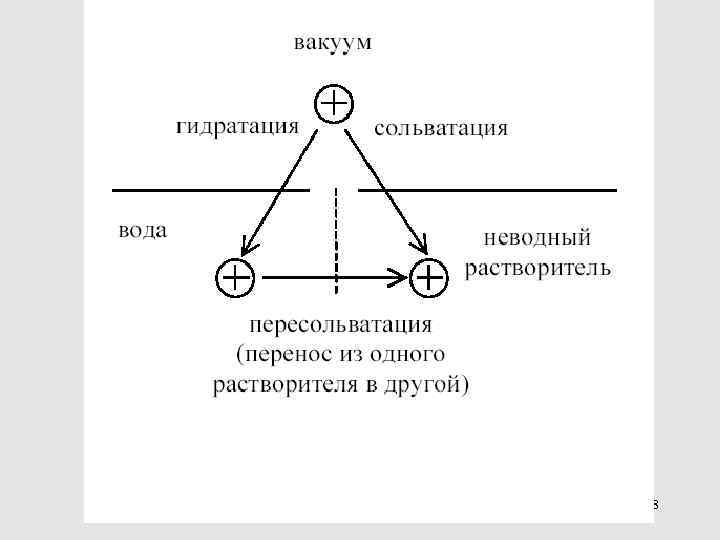
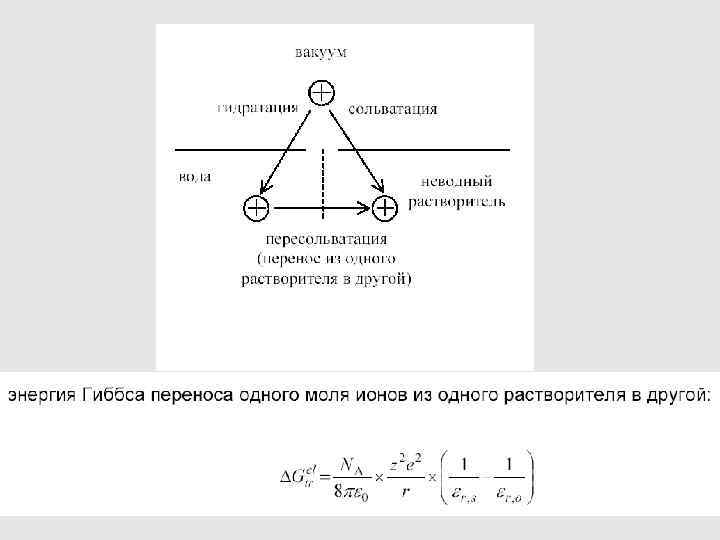
 Г. А. КРЕСТОВ: «Под сольватацией понимается вся сумма энергетических и структурных изменений, происходящих в системе в процессе перехода при заданных условиях атомно-молекулярных частиц (атомов, молекул, ионов, радикалов) [из вакуума] в жидкую фазу растворителя, приводящих к образованию раствора определенной химической структуры и заданного состава (исключения составляют изменения, сопровождающиеся разрывом химических связей в самих атомно-молекулярных объектах и молекулах растворителя)» . 7
Г. А. КРЕСТОВ: «Под сольватацией понимается вся сумма энергетических и структурных изменений, происходящих в системе в процессе перехода при заданных условиях атомно-молекулярных частиц (атомов, молекул, ионов, радикалов) [из вакуума] в жидкую фазу растворителя, приводящих к образованию раствора определенной химической структуры и заданного состава (исключения составляют изменения, сопровождающиеся разрывом химических связей в самих атомно-молекулярных объектах и молекулах растворителя)» . 7
 Термодинамика растворения и сольватации различных соединений в органических растворителях, закономерности влияния природы растворителя на равновесия и кинетику реакций начали исследоваться более столетия тому назад многими учеными. Внесли свой вклад в эту область знаний и харьковские химики, работавшие в Императорском Харьковском университете в XIX и в первые послереволюционные годы (П. Д. Хрущов, В. Ф. Тимофеев, И. П. Осипов, Г. Е. Тимофеев, Г. Е. Мухин и другие). Эти традиции были продолжены и развиты Н. А. Измайловым (1907– 1961), который создал всемирно известную школу физико-химии неводных растворов. Отдельные направления исследований были в дальнейшем развиты учениками Н. А. Измайлова – А. М. Шкодиным, В. В. Александровым, В. Д. Безуглым, Е. Ф. Ивановой и другими. 8
Термодинамика растворения и сольватации различных соединений в органических растворителях, закономерности влияния природы растворителя на равновесия и кинетику реакций начали исследоваться более столетия тому назад многими учеными. Внесли свой вклад в эту область знаний и харьковские химики, работавшие в Императорском Харьковском университете в XIX и в первые послереволюционные годы (П. Д. Хрущов, В. Ф. Тимофеев, И. П. Осипов, Г. Е. Тимофеев, Г. Е. Мухин и другие). Эти традиции были продолжены и развиты Н. А. Измайловым (1907– 1961), который создал всемирно известную школу физико-химии неводных растворов. Отдельные направления исследований были в дальнейшем развиты учениками Н. А. Измайлова – А. М. Шкодиным, В. В. Александровым, В. Д. Безуглым, Е. Ф. Ивановой и другими. 8
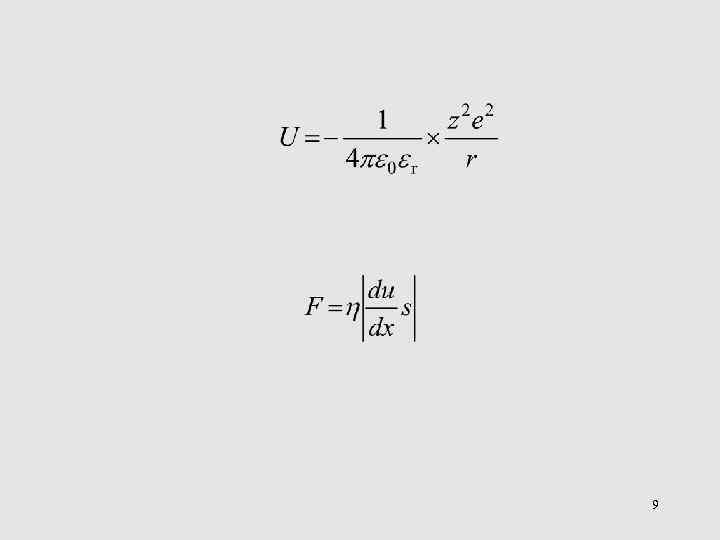 9
9
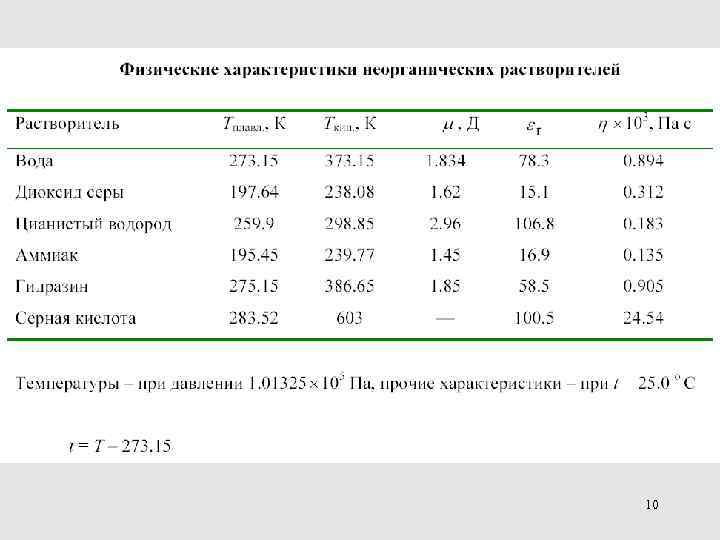 10
10
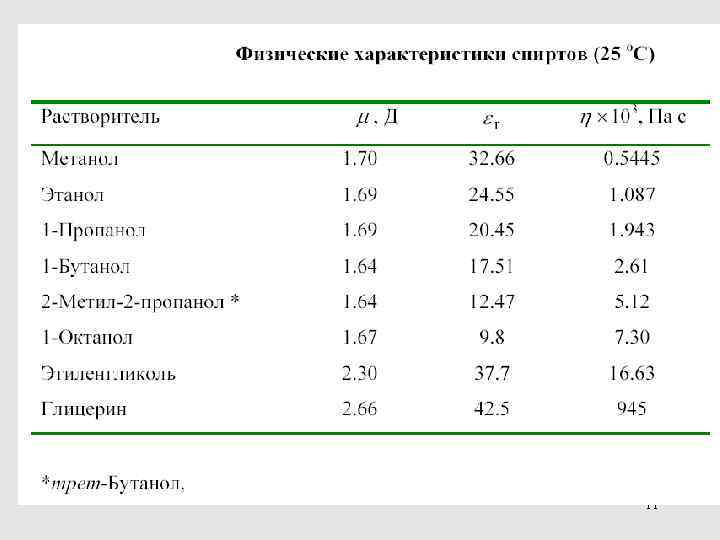 11
11
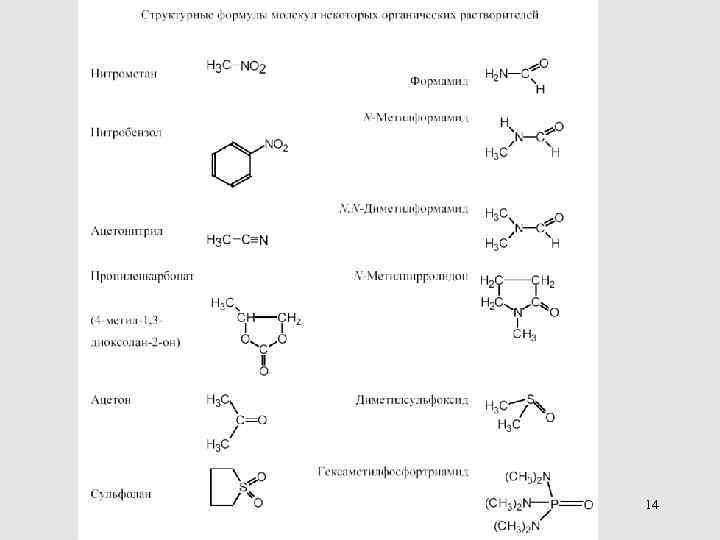
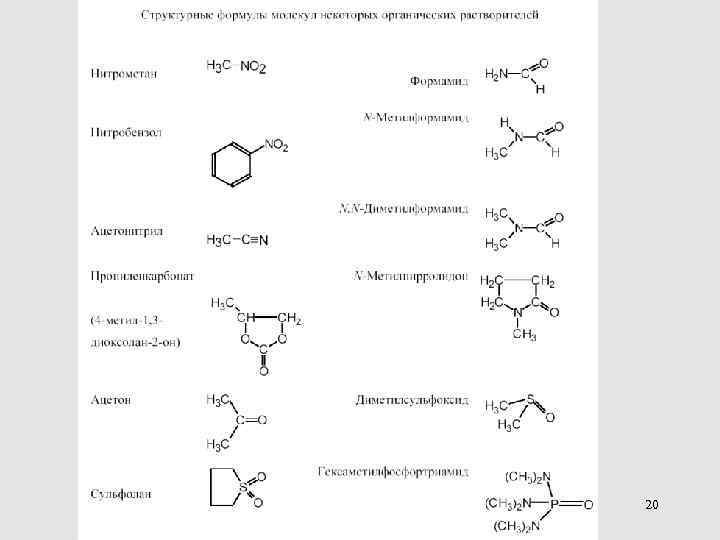
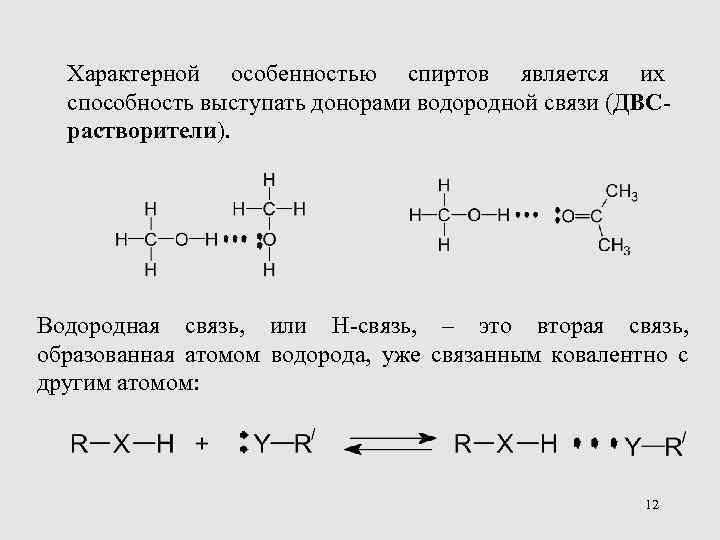 Характерной особенностью спиртов является их способность выступать донорами водородной связи (ДВСрастворители). Водородная связь, или H-связь, – это вторая связь, образованная атомом водорода, уже связанным ковалентно с другим атомом: 12
Характерной особенностью спиртов является их способность выступать донорами водородной связи (ДВСрастворители). Водородная связь, или H-связь, – это вторая связь, образованная атомом водорода, уже связанным ковалентно с другим атомом: 12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ЭЛЕКТРОННЫЕ СПЕКТРЫ ПОГЛОЩЕНИЯ. СОЛЬВАТОХРОМИЯ. ПАРАМЕТР РАЙХАРДТА Поглощение кванта света есть внутримолекулярный процесс Принцип Франка (1926) – Кондона (1928): время вибраций молекул составляет порядка 10– 12 с, а время, необходимое для электронного перехода: порядка 10– 15 с. 23
ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ЭЛЕКТРОННЫЕ СПЕКТРЫ ПОГЛОЩЕНИЯ. СОЛЬВАТОХРОМИЯ. ПАРАМЕТР РАЙХАРДТА Поглощение кванта света есть внутримолекулярный процесс Принцип Франка (1926) – Кондона (1928): время вибраций молекул составляет порядка 10– 12 с, а время, необходимое для электронного перехода: порядка 10– 15 с. 23
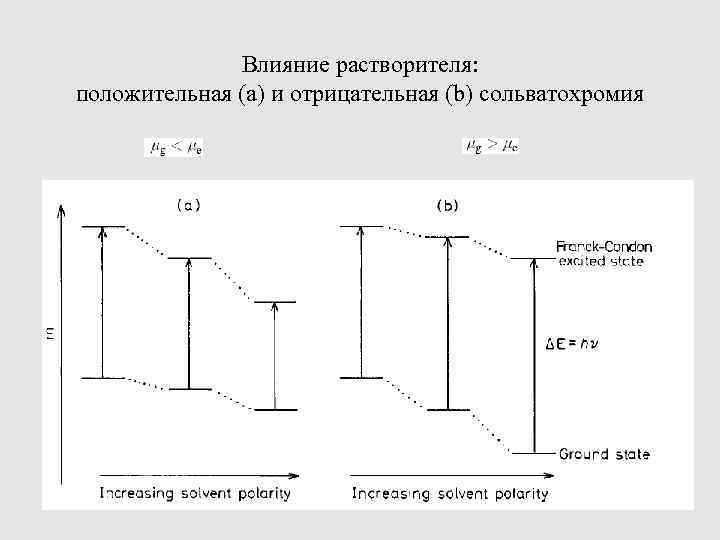 Влияние растворителя: положительная (a) и отрицательная (b) сольватохромия 24
Влияние растворителя: положительная (a) и отрицательная (b) сольватохромия 24
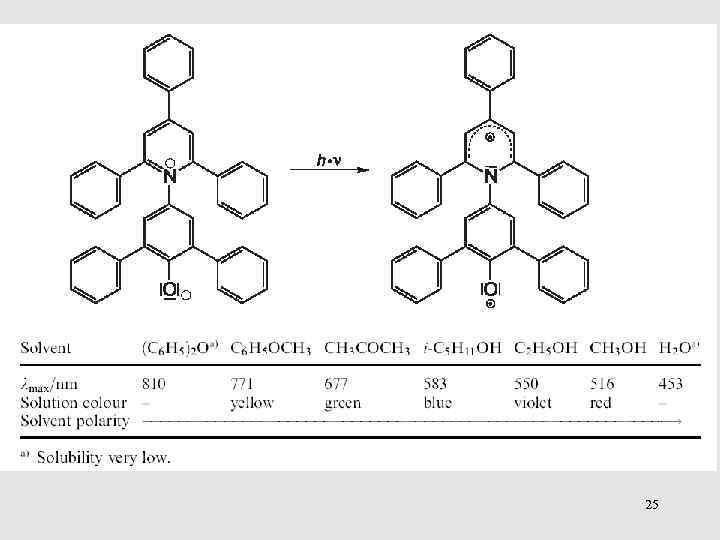 25
25
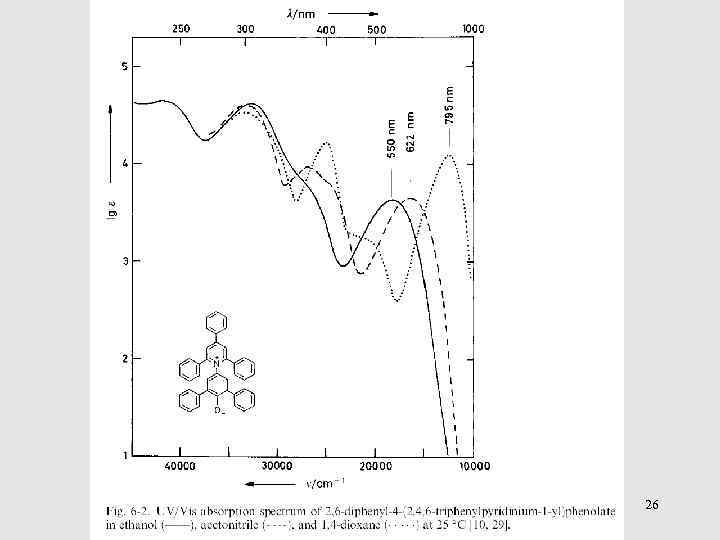 26
26
 27
27
 28
28
 Полярность растворителя определяется его сольватационной способностью по отношению к реагентам и активированным комплексам, а также молекулам в их основном и возбужденном состояниях. Это, в свою очередь, зависит от всех возможных, как специфических, так и неспецифических межмолекулярных взаимодействий между молекулами растворителя и растворенного вещества (за исключением протонирования, редокс-реакций, комплексообразования и других химических процессов). 29
Полярность растворителя определяется его сольватационной способностью по отношению к реагентам и активированным комплексам, а также молекулам в их основном и возбужденном состояниях. Это, в свою очередь, зависит от всех возможных, как специфических, так и неспецифических межмолекулярных взаимодействий между молекулами растворителя и растворенного вещества (за исключением протонирования, редокс-реакций, комплексообразования и других химических процессов). 29
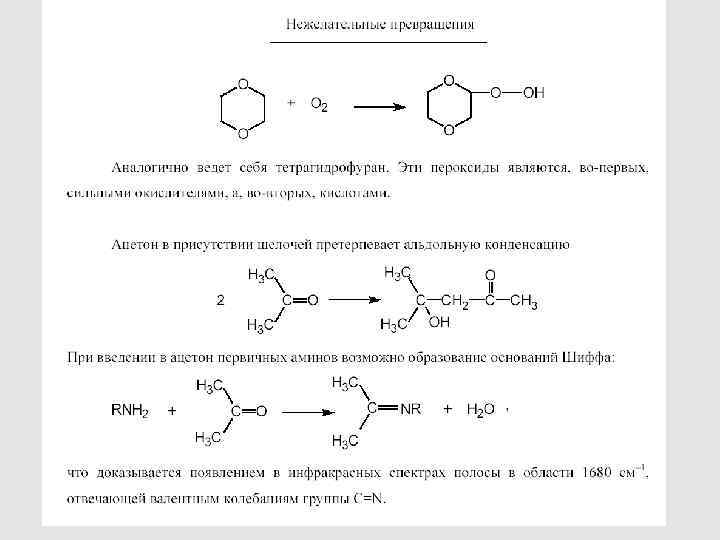
 ОЧИСТКА РАСТВОРИТЕЛЕЙ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С НИМИ 30
ОЧИСТКА РАСТВОРИТЕЛЕЙ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С НИМИ 30
 31
31
 32
32
 33
33
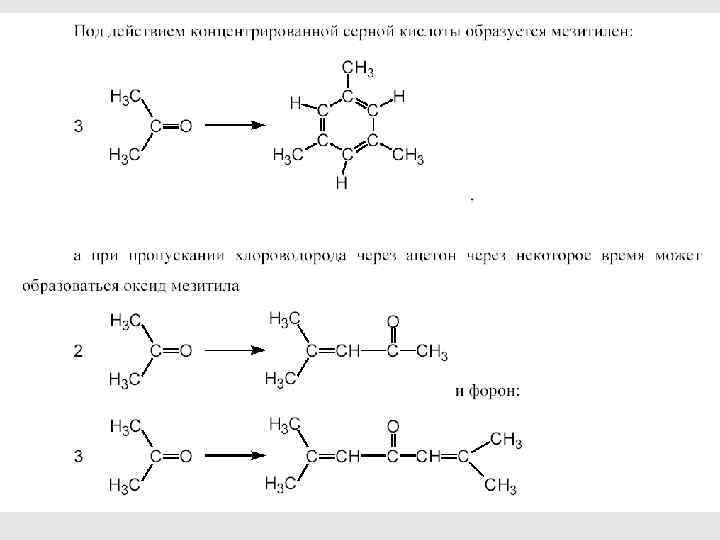 34
34
 ЭЛЕКТРОЛИТЫ В РАСТВОРАХ Электролитами принято называть химические соединения, растворы которых проводят электрический ток. Теория электролитической диссоциации (Аррениус, 1883 год) (Кольрауш) (Оствальд) 35
ЭЛЕКТРОЛИТЫ В РАСТВОРАХ Электролитами принято называть химические соединения, растворы которых проводят электрический ток. Теория электролитической диссоциации (Аррениус, 1883 год) (Кольрауш) (Оствальд) 35
 Деление электролитов на «сильные» и «слабые» как результат исследований в водных растворах. Исследование электролитов в неводных растворах и ограниченность представлений о «сильных» электролитах (Вальден, Краус и Фуосс, Измайлов) Более правильная классификация электролитов: ИОНОФОРЫ, или истинные электролиты – соединения, состоящие из ионов и без контакта с растворителем (прежде всего это соли, как неорганические, так и органические) ИОНОГЕНЫ, или псевдоэлектролиты – соединения, образующие ионы лишь в растворе (напр. , HCl, CH 3 COOH) 36
Деление электролитов на «сильные» и «слабые» как результат исследований в водных растворах. Исследование электролитов в неводных растворах и ограниченность представлений о «сильных» электролитах (Вальден, Краус и Фуосс, Измайлов) Более правильная классификация электролитов: ИОНОФОРЫ, или истинные электролиты – соединения, состоящие из ионов и без контакта с растворителем (прежде всего это соли, как неорганические, так и органические) ИОНОГЕНЫ, или псевдоэлектролиты – соединения, образующие ионы лишь в растворе (напр. , HCl, CH 3 COOH) 36
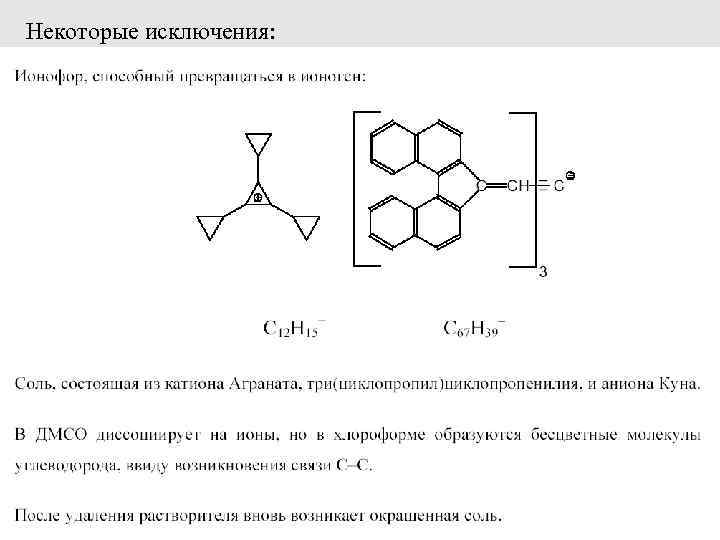 Некоторые исключения: 37
Некоторые исключения: 37
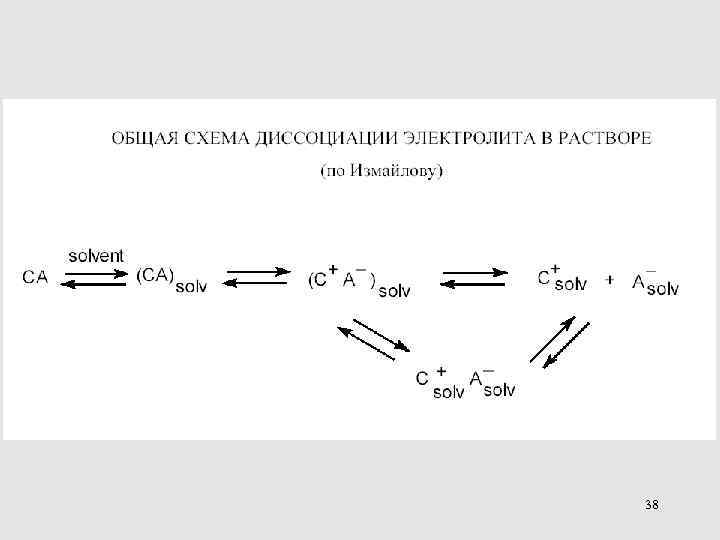 38
38
 39
39
 40
40
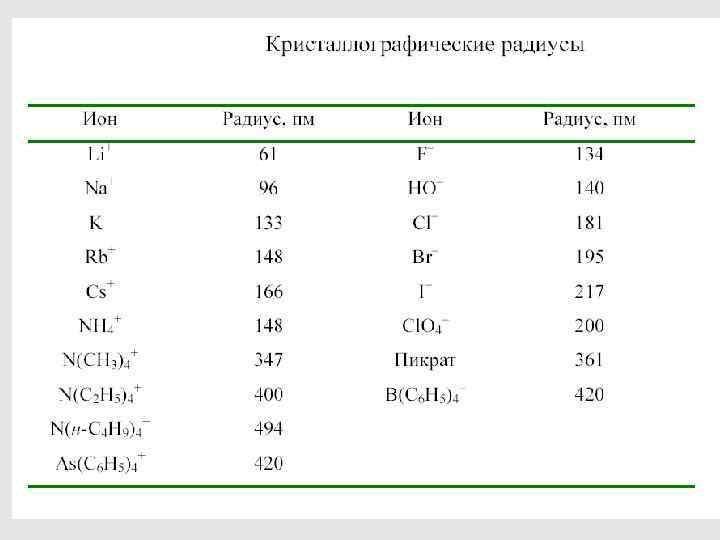 41
41
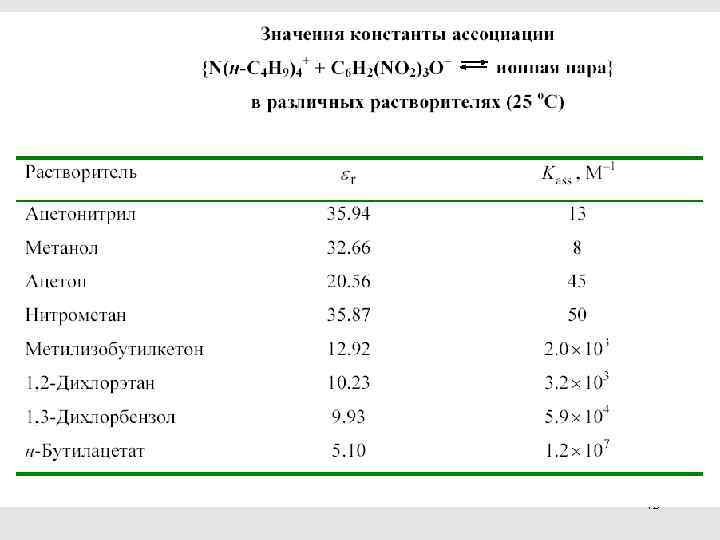 42
42
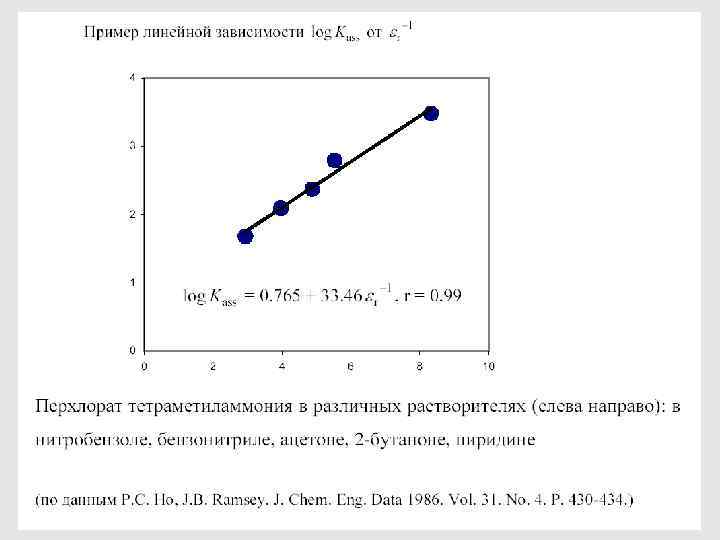 43
43
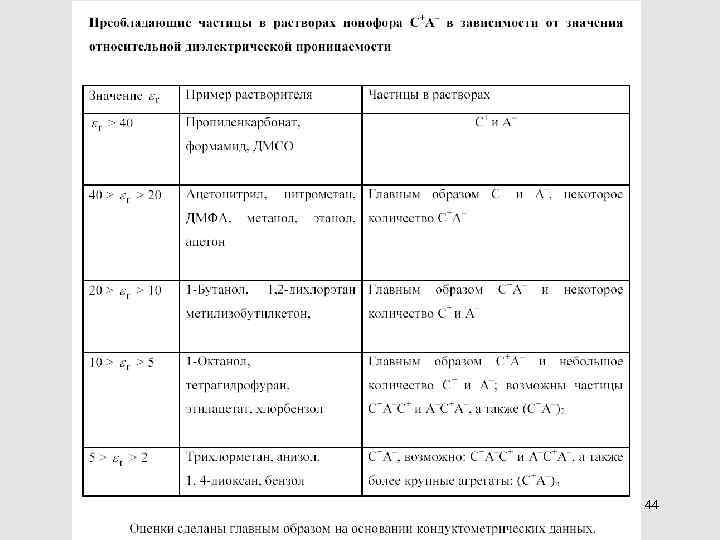 44
44
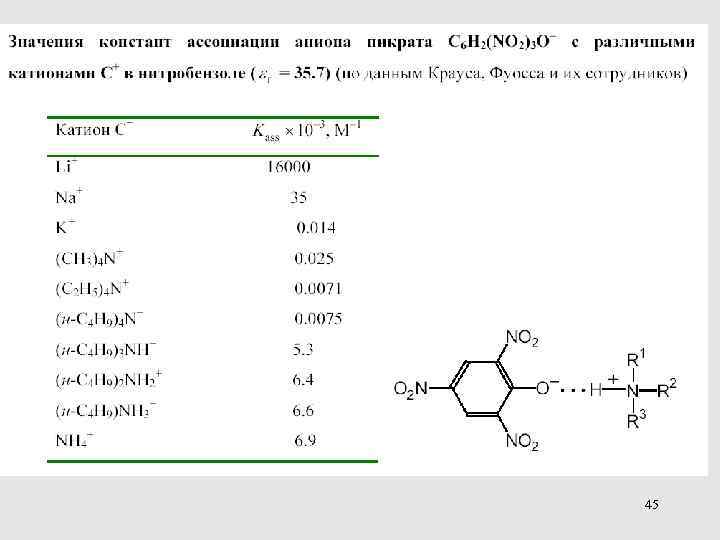 45
45
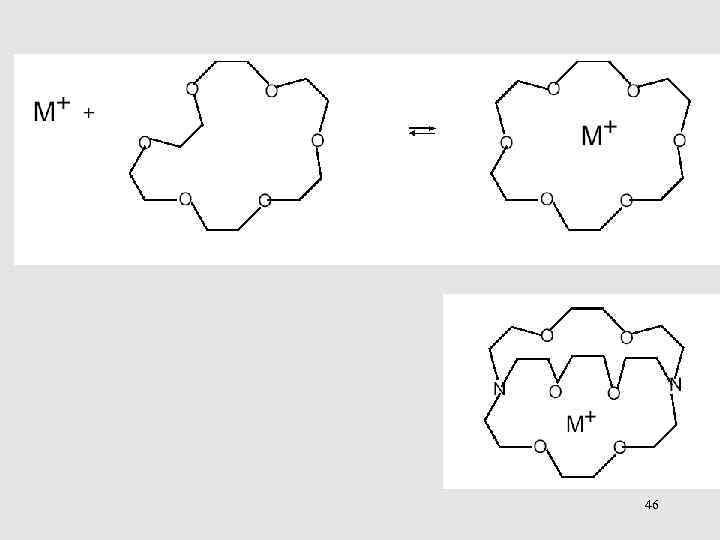 46
46
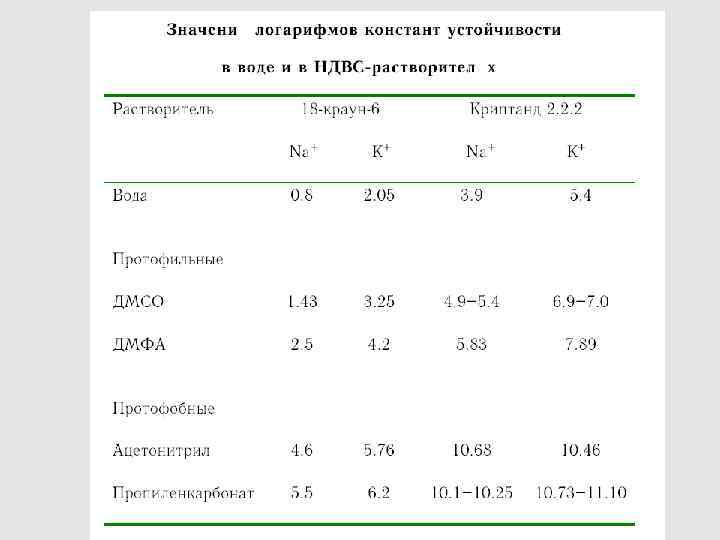 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
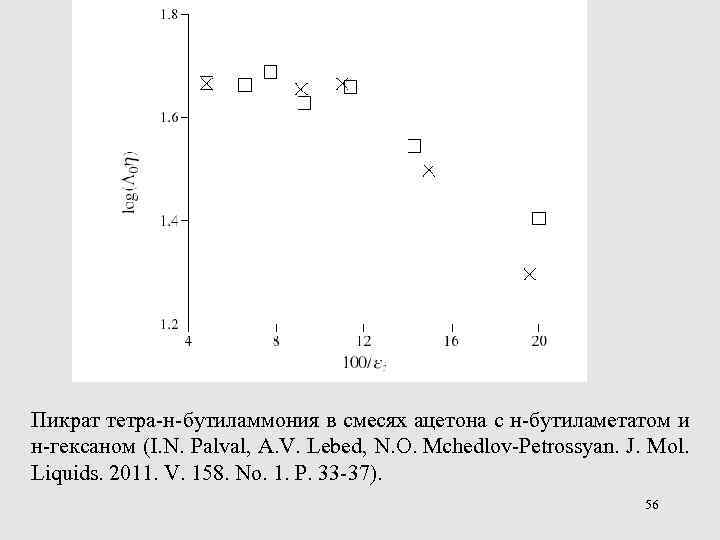 Пикрат тетра-н-бутиламмония в смесях ацетона с н-бутиламетатом и н-гексаном (I. N. Palval, A. V. Lebed, N. O. Mchedlov-Petrossyan. J. Mol. Liquids. 2011. V. 158. No. 1. P. 33 -37). 56
Пикрат тетра-н-бутиламмония в смесях ацетона с н-бутиламетатом и н-гексаном (I. N. Palval, A. V. Lebed, N. O. Mchedlov-Petrossyan. J. Mol. Liquids. 2011. V. 158. No. 1. P. 33 -37). 56
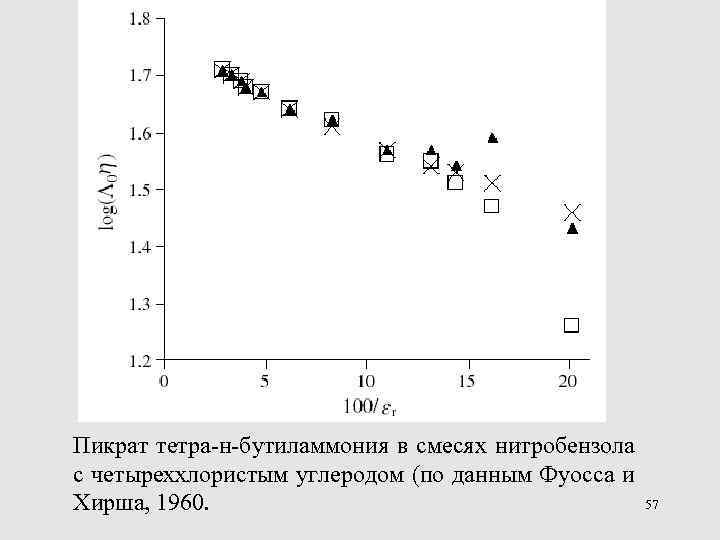 Пикрат тетра-н-бутиламмония в смесях нитробензола с четыреххлористым углеродом (по данным Фуосса и 57 Хирша, 1960.
Пикрат тетра-н-бутиламмония в смесях нитробензола с четыреххлористым углеродом (по данным Фуосса и 57 Хирша, 1960.
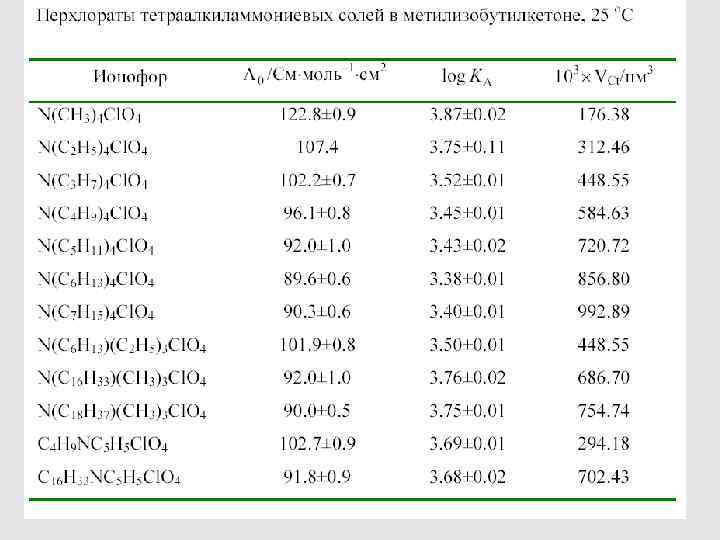
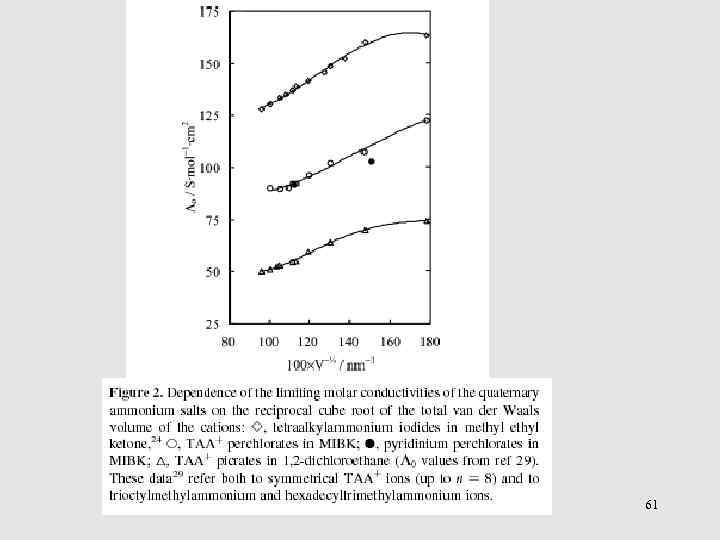
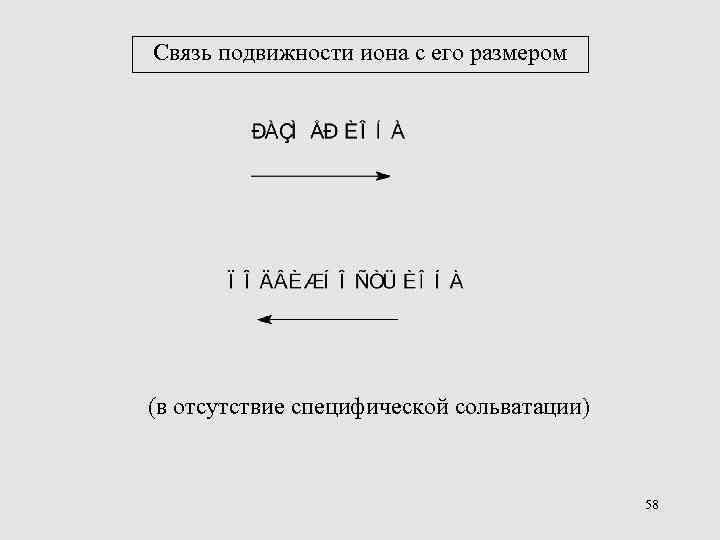 Связь подвижности иона с его размером (в отсутствие специфической сольватации) 58
Связь подвижности иона с его размером (в отсутствие специфической сольватации) 58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
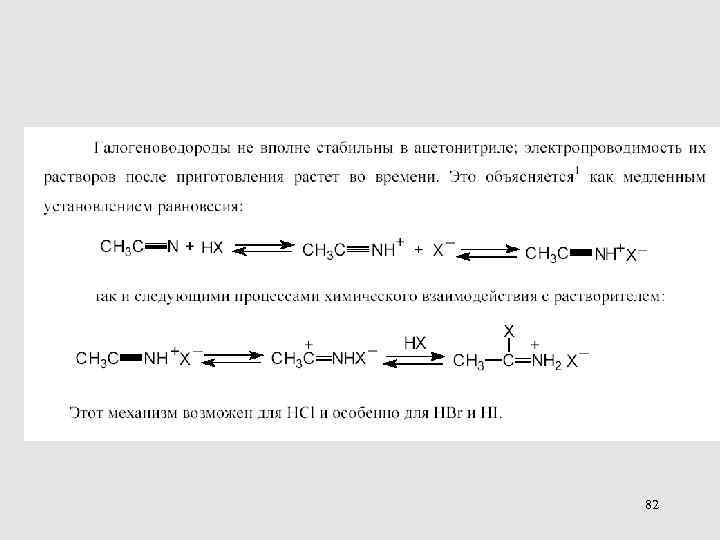
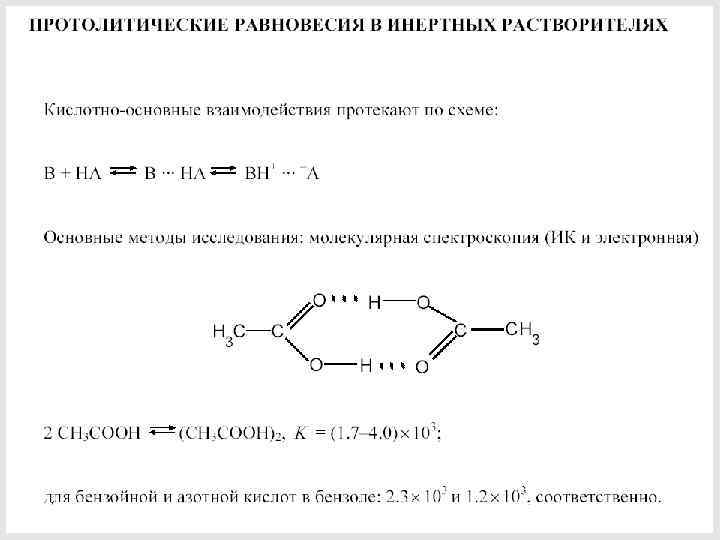
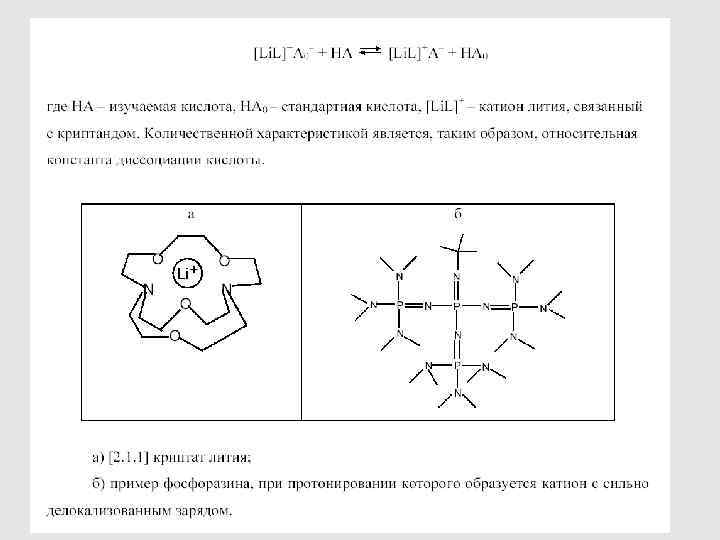
 ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ 65
ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ 65
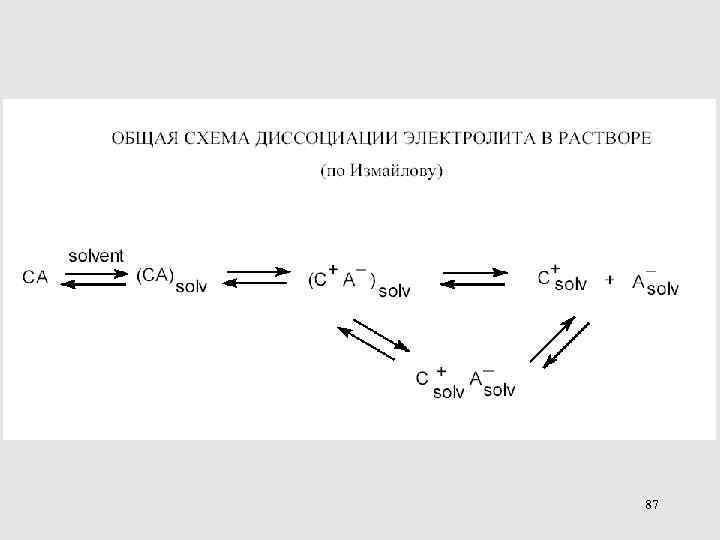
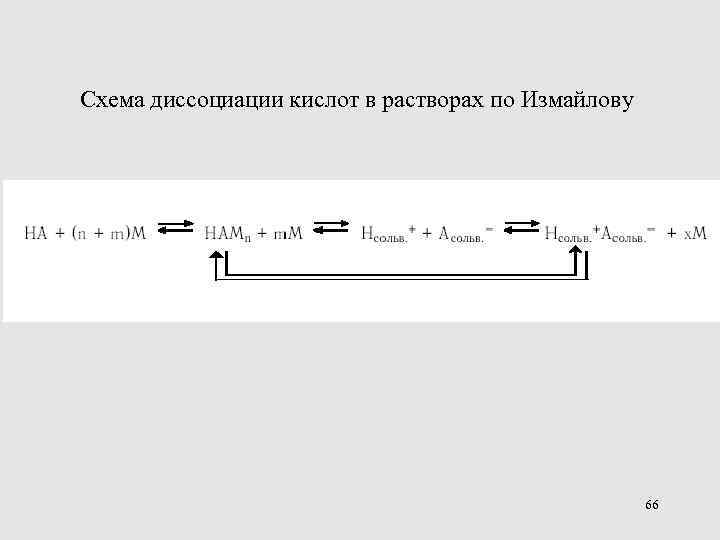 Схема диссоциации кислот в растворах по Измайлову 66
Схема диссоциации кислот в растворах по Измайлову 66
 67
67
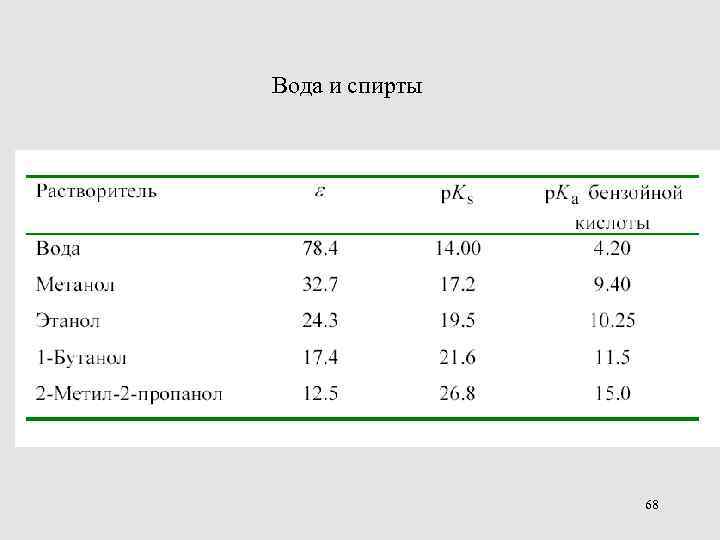 Вода и спирты 68
Вода и спирты 68
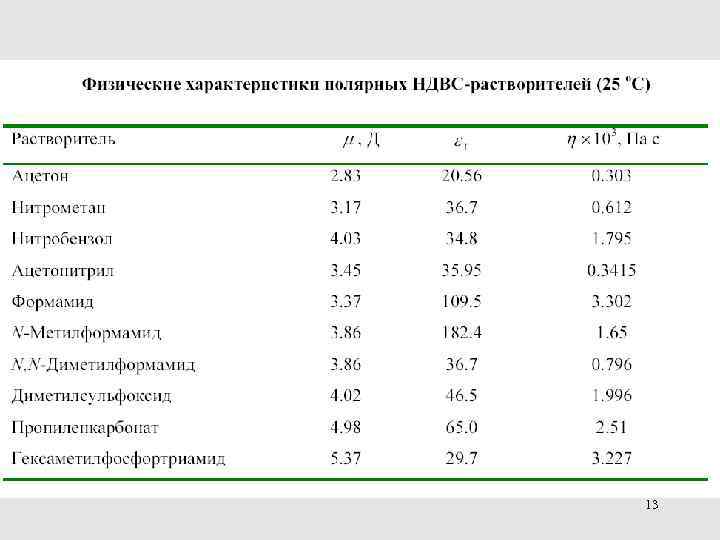
 Полярные НДВС-растворители 69
Полярные НДВС-растворители 69
 70
70
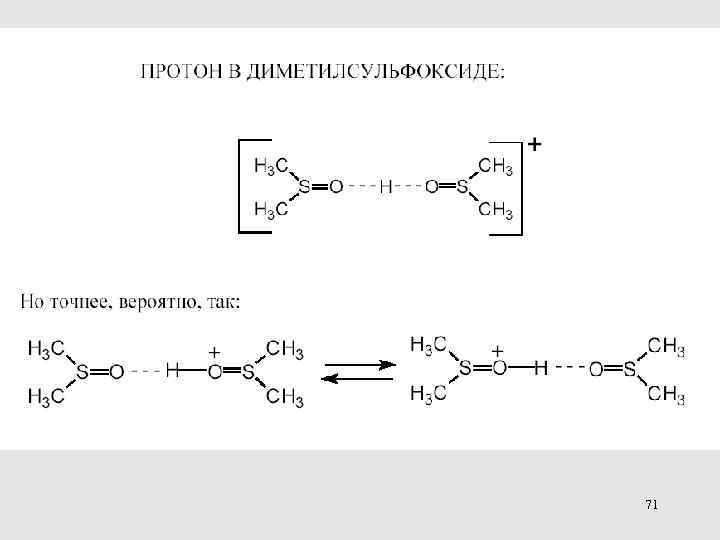 71
71
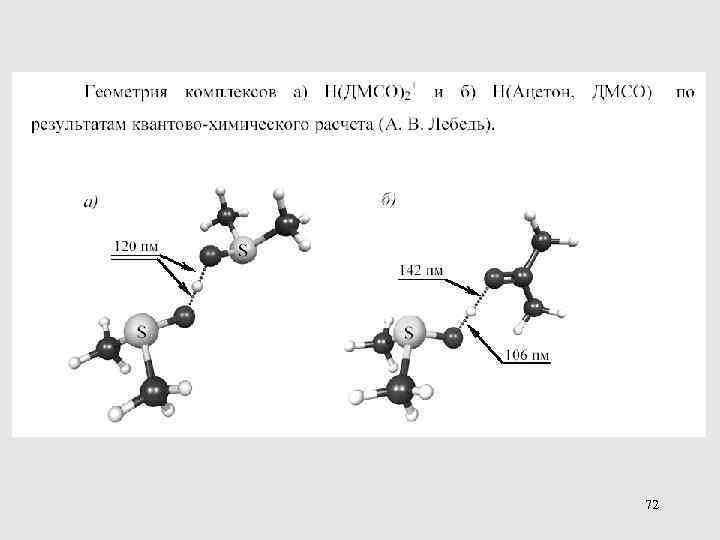 72
72
 73
73
 74
74
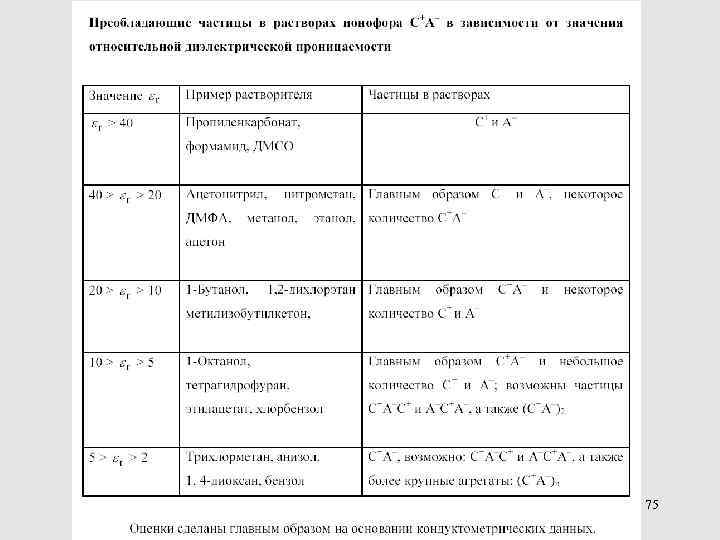 75
75
 76
76
 77
77
 78
78
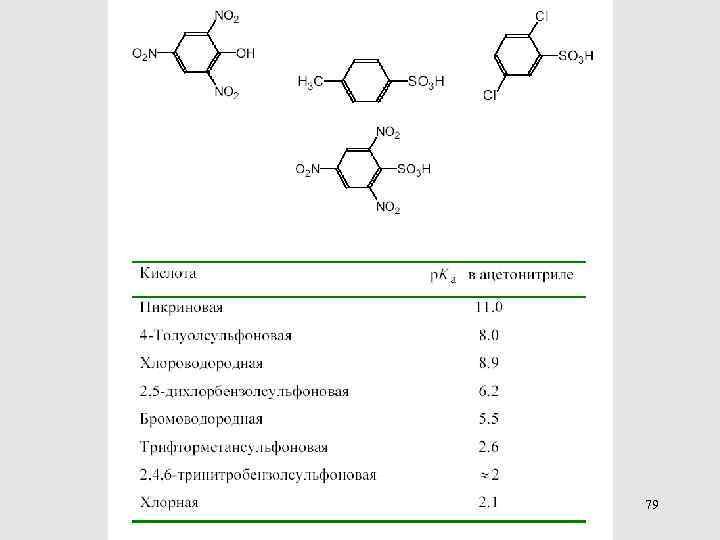 79
79
 80
80
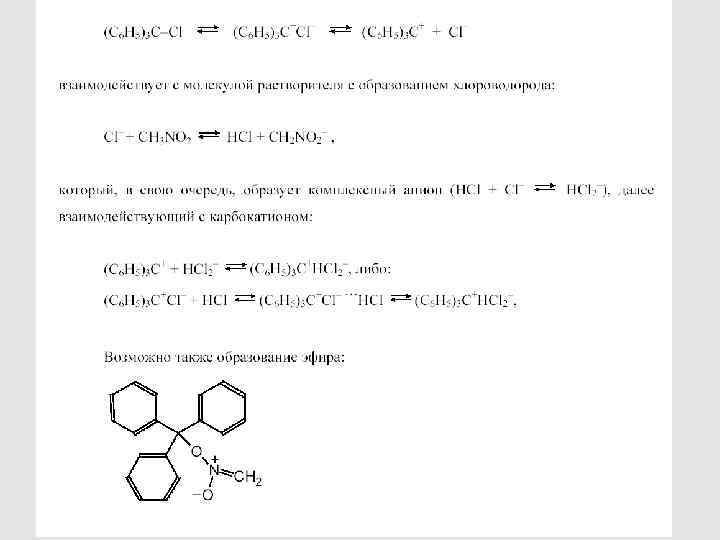 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
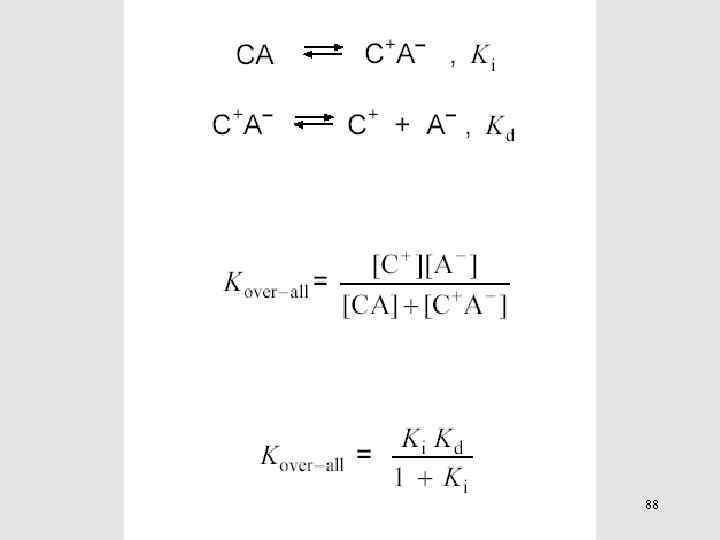 88
88
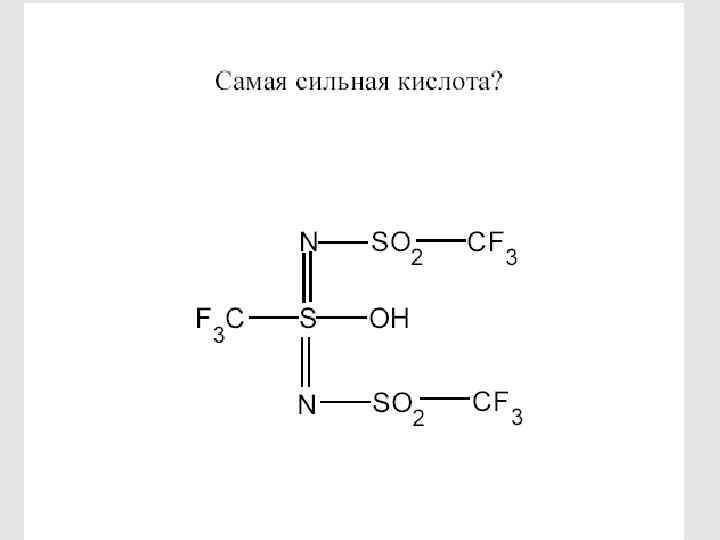 89
89
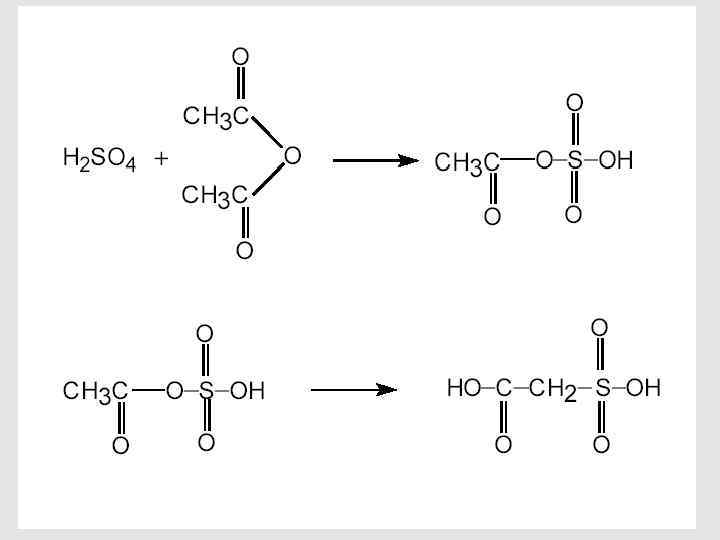 90
90
 91
91
 92
92
 93
93
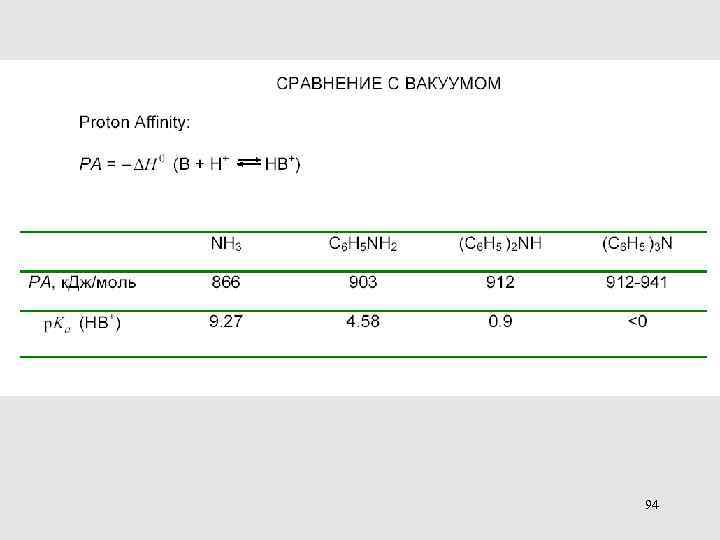 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
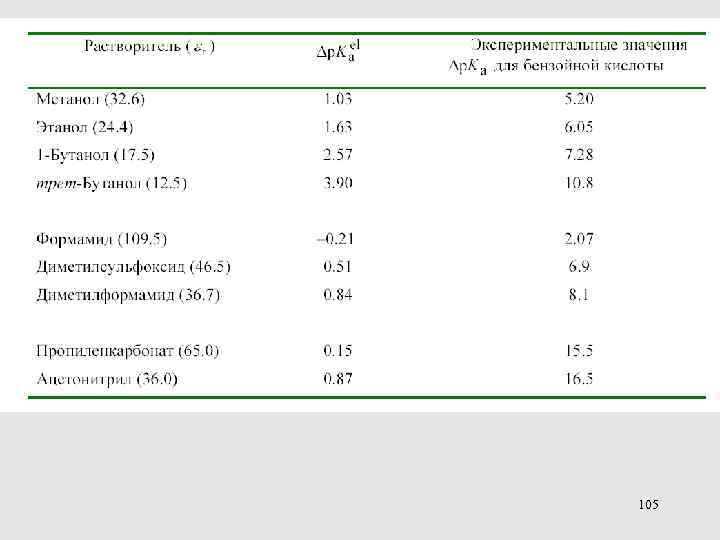
 ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ДИССОЦИАЦИЮ КИСЛОТ Проверка электростатической модели 104
ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ДИССОЦИАЦИЮ КИСЛОТ Проверка электростатической модели 104
 105
105
 106
106
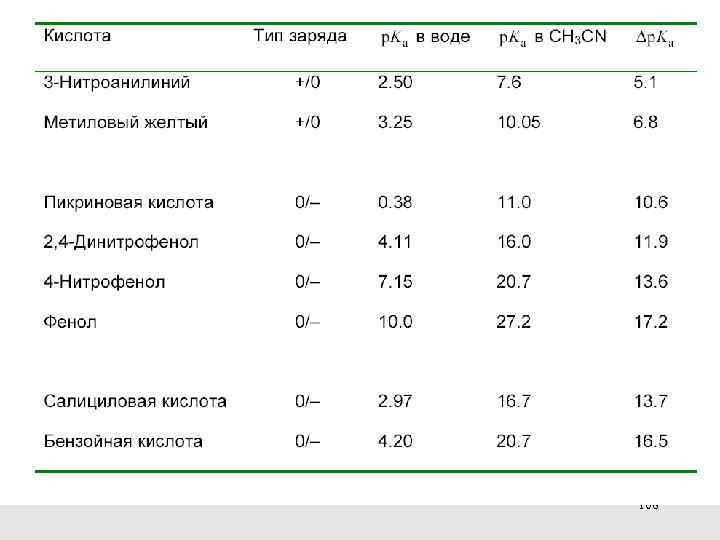
 Дифференцирующее действие органических растворителей 1. Тип заряда кислотно-основной пары 2. Природа ионизирующейся группы 107
Дифференцирующее действие органических растворителей 1. Тип заряда кислотно-основной пары 2. Природа ионизирующейся группы 107
 108
108
 109
109
 110
110
 111
111
 112
112
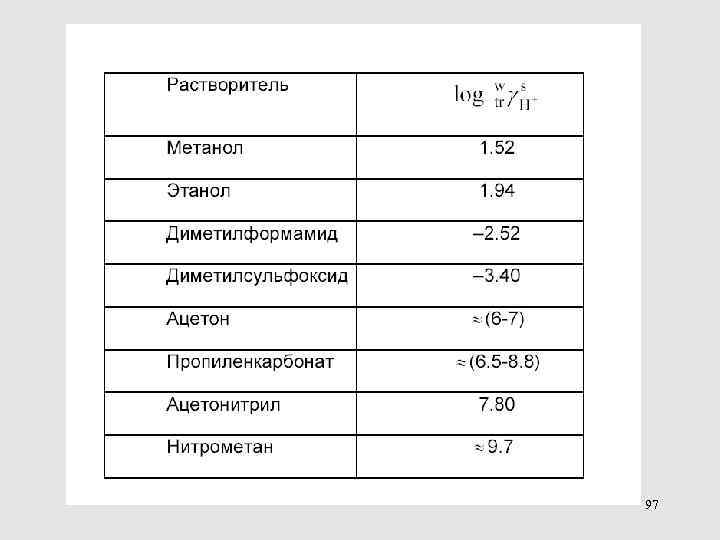
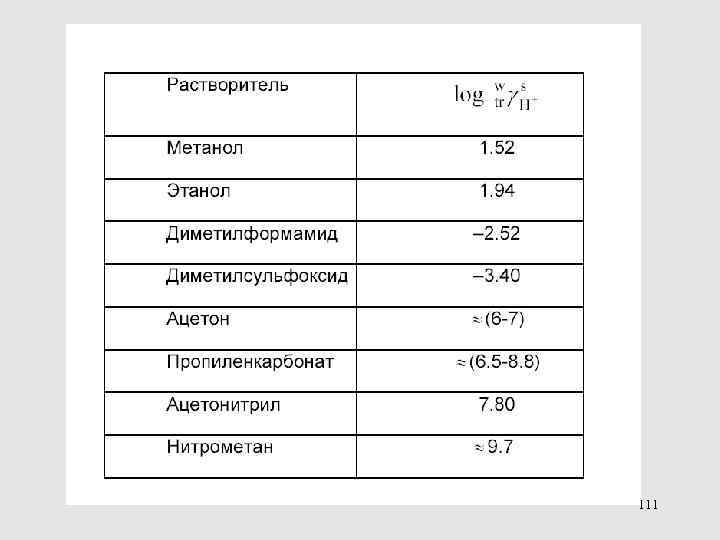
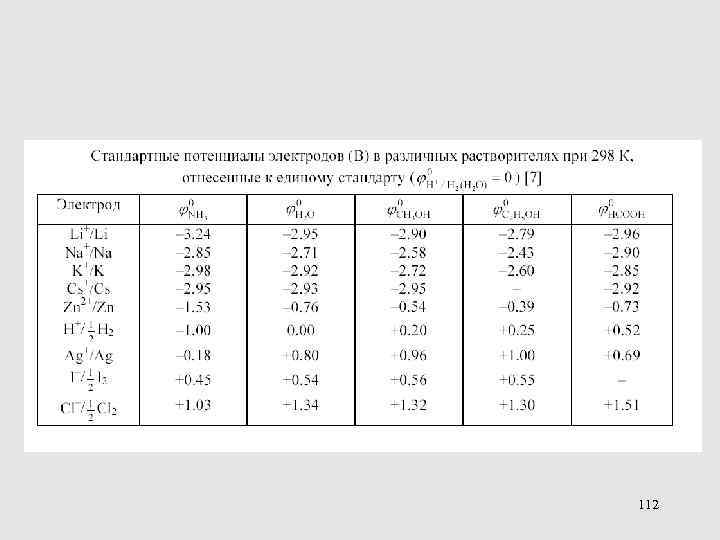
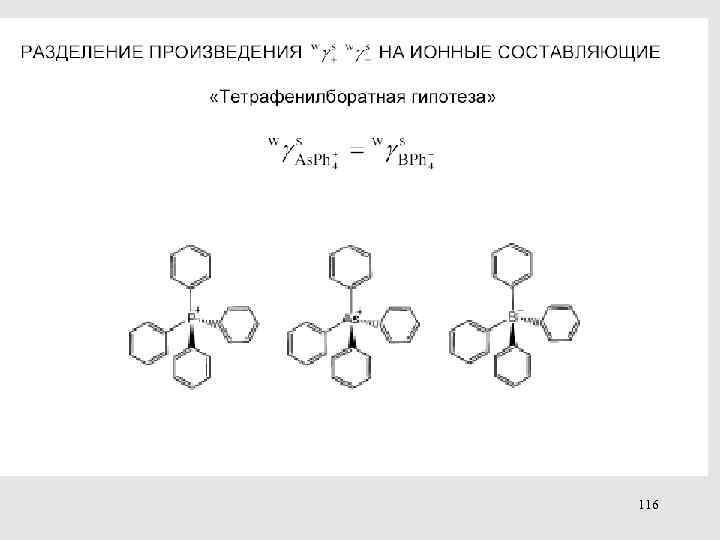
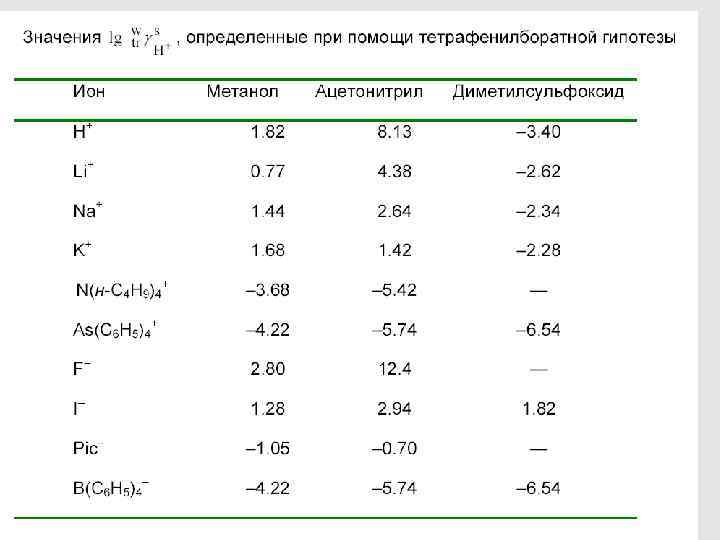
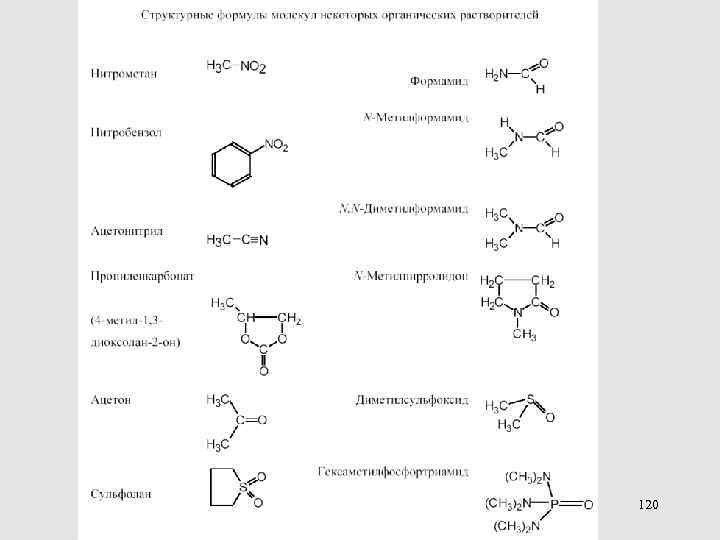
 МЕТОДЫ ОПРЕДЕЛЕНИЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ ПЕРЕНОСА 113
МЕТОДЫ ОПРЕДЕЛЕНИЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ ПЕРЕНОСА 113
 114
114
 ? 115
? 115
 116
116
 117
117
 118
118
 119
119
 120
120
 СТАНДАРТИЗАЦИЯ p. H В НЕВОДНЫХ СРЕДАХ 121
СТАНДАРТИЗАЦИЯ p. H В НЕВОДНЫХ СРЕДАХ 121
 122
122
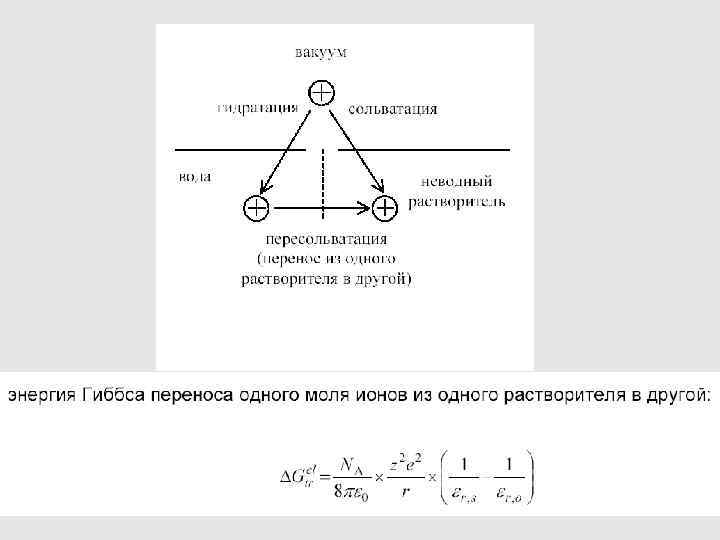
 Это – значения порядка нескольких единиц или десятков к. Дж/моль Энергии сольватации – на 1 -2 порядка больше по абсолютной величине и при этом всегда отрицательные 123
Это – значения порядка нескольких единиц или десятков к. Дж/моль Энергии сольватации – на 1 -2 порядка больше по абсолютной величине и при этом всегда отрицательные 123
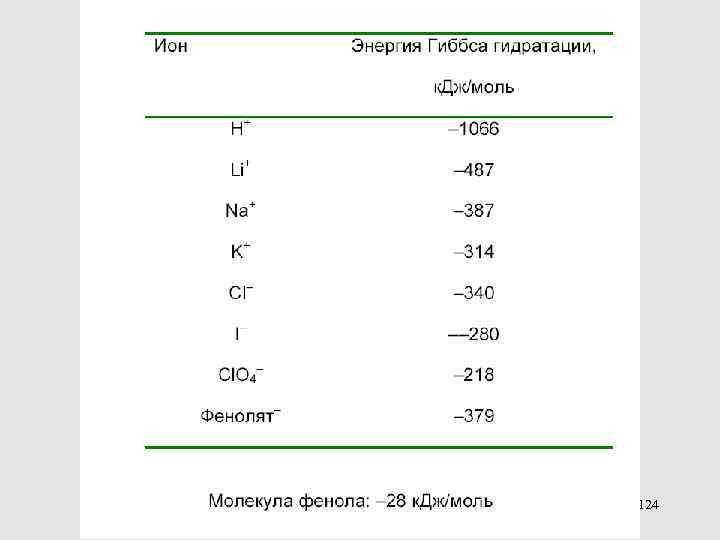 124
124
 125
125
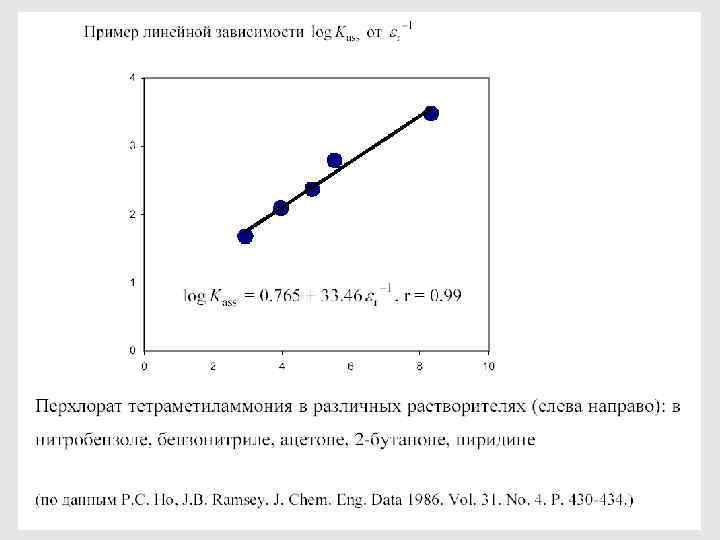
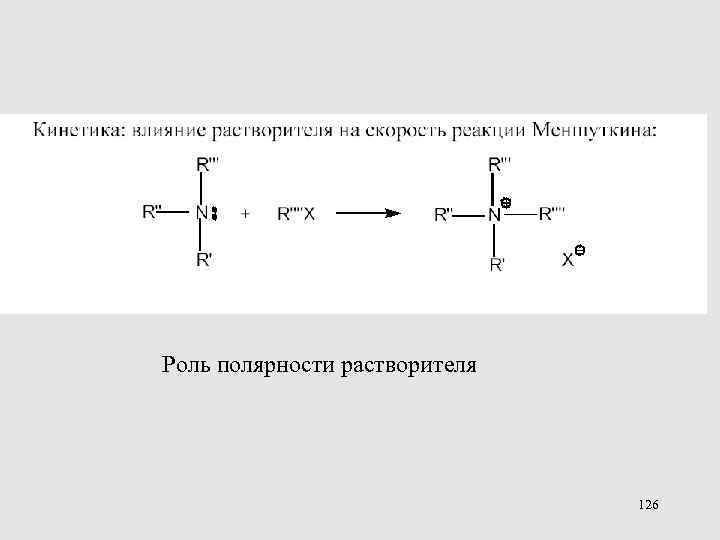 Роль полярности растворителя 126
Роль полярности растворителя 126
 127
127
 Правила Хьюза-Ингольда: Уравнение Скэтчарда: 128
Правила Хьюза-Ингольда: Уравнение Скэтчарда: 128
 129
129
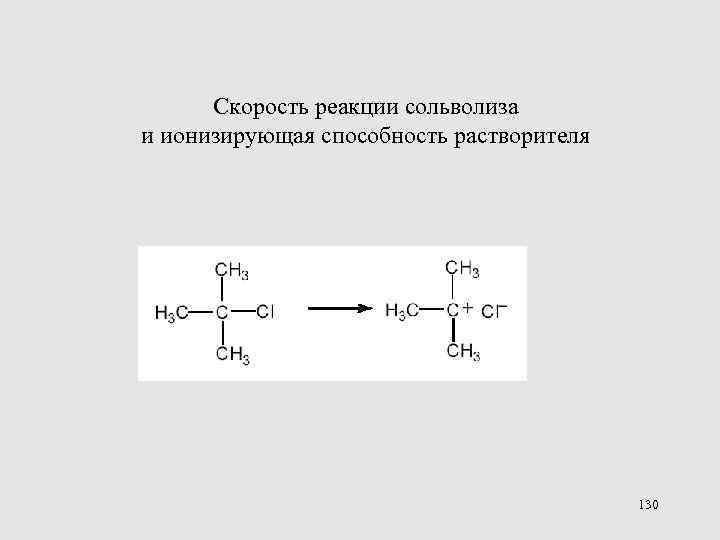 Скорость реакции сольволиза и ионизирующая способность растворителя 130
Скорость реакции сольволиза и ионизирующая способность растворителя 130
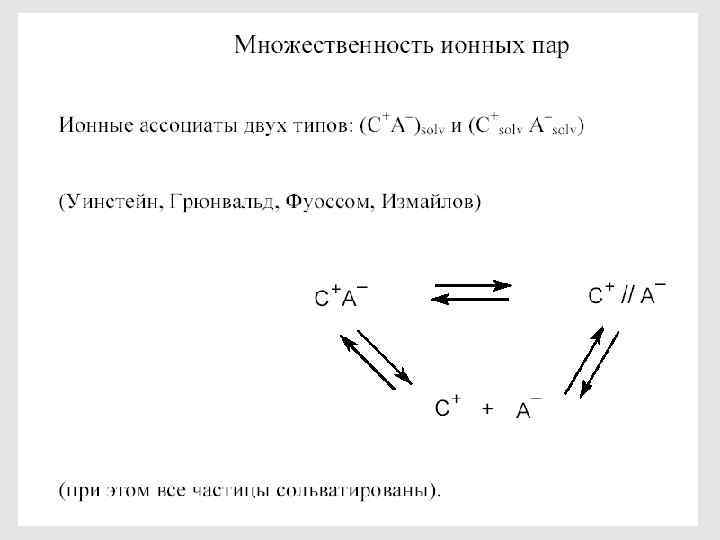
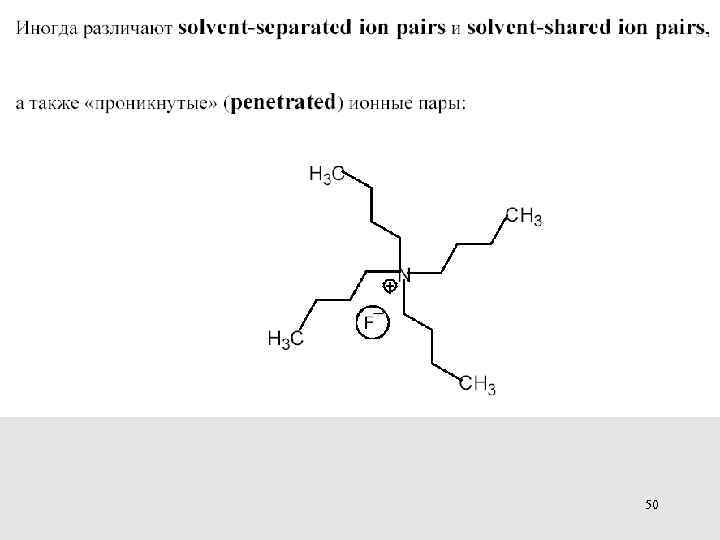
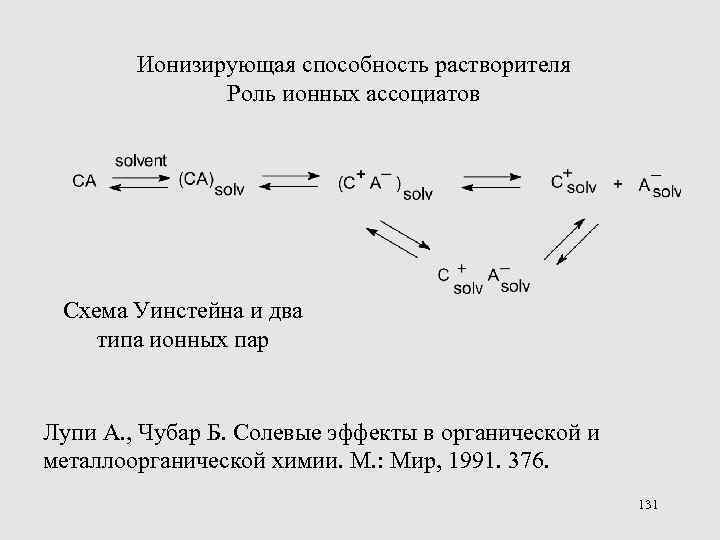 Ионизирующая способность растворителя Роль ионных ассоциатов Схема Уинстейна и два типа ионных пар Лупи А. , Чубар Б. Солевые эффекты в органической и металлоорганической химии. М. : Мир, 1991. 376. 131
Ионизирующая способность растворителя Роль ионных ассоциатов Схема Уинстейна и два типа ионных пар Лупи А. , Чубар Б. Солевые эффекты в органической и металлоорганической химии. М. : Мир, 1991. 376. 131


