 ФИЗИЧЕСКАЯ ХИМИЯ (курс лекций)
ФИЗИЧЕСКАЯ ХИМИЯ (курс лекций)
 • Д. х. н. , профессор, заведующий кафедрой • физической химии РХТУ им. Д. И. Менделеева • Конюхов Валерий Юрьевич • volkon_1@mail. ru • vkontakte. ru
• Д. х. н. , профессор, заведующий кафедрой • физической химии РХТУ им. Д. И. Менделеева • Конюхов Валерий Юрьевич • volkon_1@mail. ru • vkontakte. ru
 Литература • Вишняков А. В. , Кизим Н. Ф. Физическая химия. М. : Химия, 2012 • Физическая химия//Под ред. К. С. Краснова. М. : Высшая школа, 2001 • Стромберг А. Г. , Семченко Д. П. Физическая химия. М. : Высшая школа, 1999. • Основы физической химии. Теория и задачи: Учеб. Пособие для вузов/В. В. Еремин и др. М. : 2005.
Литература • Вишняков А. В. , Кизим Н. Ф. Физическая химия. М. : Химия, 2012 • Физическая химия//Под ред. К. С. Краснова. М. : Высшая школа, 2001 • Стромберг А. Г. , Семченко Д. П. Физическая химия. М. : Высшая школа, 1999. • Основы физической химии. Теория и задачи: Учеб. Пособие для вузов/В. В. Еремин и др. М. : 2005.
 Литература • Эткинс П. Физическая химия. М. : Мир. 1980. • Карапетьянц М. Х. Химическая термодинамика. М. : Химия, 1975.
Литература • Эткинс П. Физическая химия. М. : Мир. 1980. • Карапетьянц М. Х. Химическая термодинамика. М. : Химия, 1975.
 Ссылки в Интернете • http: //physchem. distant. ru/pchtest. html • http: //www. pxty. net
Ссылки в Интернете • http: //physchem. distant. ru/pchtest. html • http: //www. pxty. net
 ВВЕДЕНИЕ
ВВЕДЕНИЕ
 • Впервые курс лекций по физической химии прочитал своим ученикам в 1752 г. великий российский учёный М. В. Ломоносов.
• Впервые курс лекций по физической химии прочитал своим ученикам в 1752 г. великий российский учёный М. В. Ломоносов.

 • ЛОМОНОСОВ Михаил Васильевич (1711 -65), первый русский ученый-естествоиспытатель мирового значения, поэт, заложивший основы современного русского литературного языка, художник, историк, поборник развития отечественного просвещения, науки и экономики. • Родился 8(19) ноября в д. Денисовка (ныне с. Ломоносово) в семье помора. В 19 лет ушел учиться (с 1731 в Славяно-греко-латинской академии в Москве, с 1735 в Академическом университете в Санкт- Петербурге, в 1736 -41 в Германии). С 1742 адъюнкт, с 1745 академик Петербургской АН.
• ЛОМОНОСОВ Михаил Васильевич (1711 -65), первый русский ученый-естествоиспытатель мирового значения, поэт, заложивший основы современного русского литературного языка, художник, историк, поборник развития отечественного просвещения, науки и экономики. • Родился 8(19) ноября в д. Денисовка (ныне с. Ломоносово) в семье помора. В 19 лет ушел учиться (с 1731 в Славяно-греко-латинской академии в Москве, с 1735 в Академическом университете в Санкт- Петербурге, в 1736 -41 в Германии). С 1742 адъюнкт, с 1745 академик Петербургской АН.
 • В 1748 основал при АН первую в России химическую лабораторию. По инициативе Ломоносова основан Московский университет (1755). Развивал атомно-молекулярные представления о строении вещества. В период господства теории теплорода утверждал, что теплота обусловлена движением корпускул. Сформулировал принцип сохранения материи и движения. Исключил флогистон из числа химических агентов. Заложил основы физической химии.
• В 1748 основал при АН первую в России химическую лабораторию. По инициативе Ломоносова основан Московский университет (1755). Развивал атомно-молекулярные представления о строении вещества. В период господства теории теплорода утверждал, что теплота обусловлена движением корпускул. Сформулировал принцип сохранения материи и движения. Исключил флогистон из числа химических агентов. Заложил основы физической химии.
 • Исследовал атмосферное электричество и силу тяжести. Выдвинул учение о цвете. Создал ряд оптических приборов. Открыл атмосферу на Венере. Описал строение Земли, объяснил происхождение многих полезных ископаемых и минералов. Опубликовал руководство по металлургии. Подчеркивал важность исследования Северного морского пути, освоения Сибири. Возродил искусство мозаики и производство смальты, создал с учениками мозаичные картины. Член Академии художеств (1763). Похоронен в Санкт- Петербурге в Некрополе 18 в.
• Исследовал атмосферное электричество и силу тяжести. Выдвинул учение о цвете. Создал ряд оптических приборов. Открыл атмосферу на Венере. Описал строение Земли, объяснил происхождение многих полезных ископаемых и минералов. Опубликовал руководство по металлургии. Подчеркивал важность исследования Северного морского пути, освоения Сибири. Возродил искусство мозаики и производство смальты, создал с учениками мозаичные картины. Член Академии художеств (1763). Похоронен в Санкт- Петербурге в Некрополе 18 в.
 Определение Ломоносова: • «Физическая химия – наука, изучающая на основании положений и опытов физики то, что происходит в сложных телах при химических операциях…. Физическая химия может быть названа химической философией» .
Определение Ломоносова: • «Физическая химия – наука, изучающая на основании положений и опытов физики то, что происходит в сложных телах при химических операциях…. Физическая химия может быть названа химической философией» .
 А в Европе?
А в Европе?
 • В Западной Европе принято считать годом создания физической химии 1888 г. , когда В. Оствальд стал читать этот курс, сопровождаемый практическими занятиями, и начал издавать журнал «Zeitschtift fur physikalische Chemie”. • В этом же году была организована кафедра физической химии в Лейпцигском университете под руководством В. Оствальда.
• В Западной Европе принято считать годом создания физической химии 1888 г. , когда В. Оствальд стал читать этот курс, сопровождаемый практическими занятиями, и начал издавать журнал «Zeitschtift fur physikalische Chemie”. • В этом же году была организована кафедра физической химии в Лейпцигском университете под руководством В. Оствальда.
 Вильгельм Оствальд
Вильгельм Оствальд
 • Родился и долго жил в Российской империи, в 35 лет поменял российское гражданство на немецкое. • В Лейпциге, он провел большую часть своей жизни, там его называли «российским профессором» . • В 25 лет защитил докторскую диссертацию на тему «Объемно-химические и оптикохимические исследования» .
• Родился и долго жил в Российской империи, в 35 лет поменял российское гражданство на немецкое. • В Лейпциге, он провел большую часть своей жизни, там его называли «российским профессором» . • В 25 лет защитил докторскую диссертацию на тему «Объемно-химические и оптикохимические исследования» .
 • В 1887 г. принял предложение переехать в Лейпциг, там он основывает при университете Физико-химический институт, руководит которым до 1905 г. • В 1888 г. он занимает очень престижную кафедру физической и неорганической химии Лейпцигского университета. В этой должности он проработал 12 лет.
• В 1887 г. принял предложение переехать в Лейпциг, там он основывает при университете Физико-химический институт, руководит которым до 1905 г. • В 1888 г. он занимает очень престижную кафедру физической и неорганической химии Лейпцигского университета. В этой должности он проработал 12 лет.
 • Из «Лейпцигской школы» В. Оствальда вышли: нобелевские лауреаты С. Аррениус, Я. Вант-Гофф, В. Нернст, известные физикохимики Г. Тамман и Ф. Доннан, химикорганик Й. Вислиценс, знаменитый американский химик Г. Н. Льюис. • В разные годы у Оствальда стажировались российские химии: И. А. Каблуков, В. А. Кистяковский, Л. В. Писаржевский, А. В. Раковский, Н. А. Шилов и другие.
• Из «Лейпцигской школы» В. Оствальда вышли: нобелевские лауреаты С. Аррениус, Я. Вант-Гофф, В. Нернст, известные физикохимики Г. Тамман и Ф. Доннан, химикорганик Й. Вислиценс, знаменитый американский химик Г. Н. Льюис. • В разные годы у Оствальда стажировались российские химии: И. А. Каблуков, В. А. Кистяковский, Л. В. Писаржевский, А. В. Раковский, Н. А. Шилов и другие.
 • Одна из уникальных особенностей Оствальда заключалась в многолетнем активном непризнании атомно-молекулярной теории (хотя им предложен термин «моль» ). • «Химик не видит никаких атомов. — Он исследует лишь простые и понятные законы, которым подчиняются массовые и объемные соотношения реагентов» .
• Одна из уникальных особенностей Оствальда заключалась в многолетнем активном непризнании атомно-молекулярной теории (хотя им предложен термин «моль» ). • «Химик не видит никаких атомов. — Он исследует лишь простые и понятные законы, которым подчиняются массовые и объемные соотношения реагентов» .
 • В. Оствальд исхитрился написать объемистый учебник химии, в котором слово «атом» ни разу не упоминается. • Выступая 19 апреля 1904 г в Лондоне с большим докладом перед членами Химического общества, Оствальд пытался доказать, что атомов не существует, а «то, что мы называем материей, является лишь совокупностью энергий, собранной воедино в данном месте» .
• В. Оствальд исхитрился написать объемистый учебник химии, в котором слово «атом» ни разу не упоминается. • Выступая 19 апреля 1904 г в Лондоне с большим докладом перед членами Химического общества, Оствальд пытался доказать, что атомов не существует, а «то, что мы называем материей, является лишь совокупностью энергий, собранной воедино в данном месте» .
 В честь В. Оствальда на территории Тартуского университета установлена мемориальная доска с надписью на эстонском, немецком и английском языках
В честь В. Оствальда на территории Тартуского университета установлена мемориальная доска с надписью на эстонском, немецком и английском языках
 Современное определение физической химии как науки
Современное определение физической химии как науки
 • физическая химия изучает взаимосвязь химических процессов и физических явлений, которые их сопровождают.
• физическая химия изучает взаимосвязь химических процессов и физических явлений, которые их сопровождают.
 Основные цели и задачи физической химии
Основные цели и задачи физической химии
 • предсказать: • может ли реакция протекать самопроизвольно; • если реакция протекает, то как глубоко (каковы равновесные концентрации продуктов реакции); • если реакция идет, то с какой скоростью.
• предсказать: • может ли реакция протекать самопроизвольно; • если реакция протекает, то как глубоко (каковы равновесные концентрации продуктов реакции); • если реакция идет, то с какой скоростью.
 • ДВА ПОДХОДА К ИЗУЧЕНИЮ ПРОЦЕССОВ: • Термодинамический • Кинетический
• ДВА ПОДХОДА К ИЗУЧЕНИЮ ПРОЦЕССОВ: • Термодинамический • Кинетический
 Два «кита» – два подхода к исследованию процессов, совершающихся в системах:
Два «кита» – два подхода к исследованию процессов, совершающихся в системах:
 Разделы физической химии
Разделы физической химии
 • 1. СТРОЕНИЕ ВЕЩЕСТВА • В этом разделе на основании квантовой механики (уравнения Шрёдингера) объясняется строение атомов и молекул (электронных орбиталей атомов и молекул), кристаллических решеток твёрдых тел и т. п. , рассматриваются агрегатные состояния вещества.
• 1. СТРОЕНИЕ ВЕЩЕСТВА • В этом разделе на основании квантовой механики (уравнения Шрёдингера) объясняется строение атомов и молекул (электронных орбиталей атомов и молекул), кристаллических решеток твёрдых тел и т. п. , рассматриваются агрегатные состояния вещества.
 • 2. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА • на базе законов (начал) термодинамики позволяет: • вычислить тепловые эффекты химических реакций и физико-химических процессов, • предсказать направление химических реакций, • рассчитать равновесные концентрации реагентов и продуктов реакции.
• 2. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА • на базе законов (начал) термодинамики позволяет: • вычислить тепловые эффекты химических реакций и физико-химических процессов, • предсказать направление химических реакций, • рассчитать равновесные концентрации реагентов и продуктов реакции.
 • 3. ТЕРМОДИНАМИКА ФАЗОВЫХ РАВНОВЕСИЙ • Изучает закономерности фазовых переходов в однокомпонентных и многокомпонентных (растворах) системах. • Её основной целью является построение диаграмм фазового равновесия указанных систем.
• 3. ТЕРМОДИНАМИКА ФАЗОВЫХ РАВНОВЕСИЙ • Изучает закономерности фазовых переходов в однокомпонентных и многокомпонентных (растворах) системах. • Её основной целью является построение диаграмм фазового равновесия указанных систем.
 Диаграмма фазового равновесия однокомпонентной системы (Н 2 О)
Диаграмма фазового равновесия однокомпонентной системы (Н 2 О)
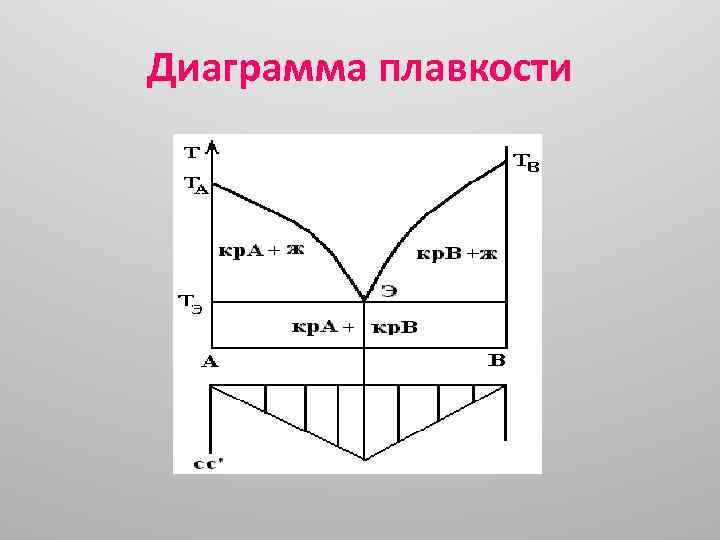 Диаграмма плавкости
Диаграмма плавкости
 • 4. ЭЛЕКТРОХИМИЯ • Изучает свойства растворов электролитов, особенности их поведения по сравнению с молекулярными растворами, исследует закономерности взаимопревращения энергии химических реакций и электрической энергии, при работе электрохимических (гальванических) элементов и электролизёров.
• 4. ЭЛЕКТРОХИМИЯ • Изучает свойства растворов электролитов, особенности их поведения по сравнению с молекулярными растворами, исследует закономерности взаимопревращения энергии химических реакций и электрической энергии, при работе электрохимических (гальванических) элементов и электролизёров.
 • 5. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ • Занимается изучением закономерностей протекания химических реакций во времени, исследует влияние на скорость и механизм реакций термодинамических параметров (давления, температуры и т. п. ), присутствия катализаторов и ингибиторов.
• 5. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ • Занимается изучением закономерностей протекания химических реакций во времени, исследует влияние на скорость и механизм реакций термодинамических параметров (давления, температуры и т. п. ), присутствия катализаторов и ингибиторов.
 • В отдельную науку КОЛЛОИДНУЮ ХИМИЮ выделяют раздел физической химии – физическую химию поверхностных явлений и дисперсных систем.
• В отдельную науку КОЛЛОИДНУЮ ХИМИЮ выделяют раздел физической химии – физическую химию поверхностных явлений и дисперсных систем.
 Глава 1. Химическая термодинамика
Глава 1. Химическая термодинамика
 • Классическая термодинамика является разделом теоретической физики и изучает закономерности взаимопревращений различных видов энергии и переходов энергии между системами в форме теплоты и работы • (termo – тепло, dynamo – движение).
• Классическая термодинамика является разделом теоретической физики и изучает закономерности взаимопревращений различных видов энергии и переходов энергии между системами в форме теплоты и работы • (termo – тепло, dynamo – движение).
 • Термодинамика абстрагируется от причин, вызывающих какой-либо процесс, и времени, в течение которого этот процесс происходит, а лишь оперирует с исходными и конечными параметрами системы, участвующей в любом физико-химическом процессе. • Не учитываются свойства отдельных молекул, а используются усреднённые характеристики систем, состоящих из множества молекул.
• Термодинамика абстрагируется от причин, вызывающих какой-либо процесс, и времени, в течение которого этот процесс происходит, а лишь оперирует с исходными и конечными параметрами системы, участвующей в любом физико-химическом процессе. • Не учитываются свойства отдельных молекул, а используются усреднённые характеристики систем, состоящих из множества молекул.
 А что такое химическая термодинамика?
А что такое химическая термодинамика?
 • Химическая термодинамика – это приложение законов термодинамики к химическим и физико-химическим процессам.
• Химическая термодинамика – это приложение законов термодинамики к химическим и физико-химическим процессам.
 Задачами химической термодинамики являются: • измерение и вычисление тепловых эффектов химических реакций и физико-химических процессов, • предсказание направления и глубины протекания реакций, • анализ химических и фазовых равновесий и т. д.
Задачами химической термодинамики являются: • измерение и вычисление тепловых эффектов химических реакций и физико-химических процессов, • предсказание направления и глубины протекания реакций, • анализ химических и фазовых равновесий и т. д.
 1. 1. Основные понятия и определения ТД • В термодинамике все интересующие нас процессы протекают в термодинамических системах. • Система – тело или группа тел, фактически или мысленно выделенные наблюдателем в окружающей среде.
1. 1. Основные понятия и определения ТД • В термодинамике все интересующие нас процессы протекают в термодинамических системах. • Система – тело или группа тел, фактически или мысленно выделенные наблюдателем в окружающей среде.
 • Система – это часть окружающего мира, которая нас особенно интересует. • Всё остальное во вселенной – окружающая среда (окружение). • Принято считать, что окружающая среда так велика (имеет бесконечный объём), что обмен с термодинамической системой энергией не изменяет её температуры.
• Система – это часть окружающего мира, которая нас особенно интересует. • Всё остальное во вселенной – окружающая среда (окружение). • Принято считать, что окружающая среда так велика (имеет бесконечный объём), что обмен с термодинамической системой энергией не изменяет её температуры.
 • По характеру обмена с окружающей средой энергией и веществом системы классифицируют: • изолированные - не могут обмениваться ни веществом, ни энергией; • закрытые - могут обмениваться энергией, но не могут - веществом; • открытые - могут обмениваться и веществом, и энергией.
• По характеру обмена с окружающей средой энергией и веществом системы классифицируют: • изолированные - не могут обмениваться ни веществом, ни энергией; • закрытые - могут обмениваться энергией, но не могут - веществом; • открытые - могут обмениваться и веществом, и энергией.
 • По числу фаз системы подразделяются на: • гомогенные – состоят из одной фазы (раствор Na. Cl в воде); • гетерогенные – в состав системы входит несколько фаз, отдельных друг от друга поверхностями раздела. • Примером гетерогенных систем может служить лёд, плавающий в воде, молоко (капельки жира – одна фаза, водная среда – другая).
• По числу фаз системы подразделяются на: • гомогенные – состоят из одной фазы (раствор Na. Cl в воде); • гетерогенные – в состав системы входит несколько фаз, отдельных друг от друга поверхностями раздела. • Примером гетерогенных систем может служить лёд, плавающий в воде, молоко (капельки жира – одна фаза, водная среда – другая).
 • Фаза совокупность гомогенных частей системы, имеющих одинаковые химические и физические свойства, и отделённых от других частей системы поверхностями раздела фаз. • Каждая фаза – гомогенная часть гетерогенной системы
• Фаза совокупность гомогенных частей системы, имеющих одинаковые химические и физические свойства, и отделённых от других частей системы поверхностями раздела фаз. • Каждая фаза – гомогенная часть гетерогенной системы
 • По числу компонентов системы подразделяют: • на одно- двух-, трехкомпонентные и многокомпонентные. • Компонентами называют индивидуальные химические вещества, составляющие систему, которые могут быть выделены из системы и существовать вне её.
• По числу компонентов системы подразделяют: • на одно- двух-, трехкомпонентные и многокомпонентные. • Компонентами называют индивидуальные химические вещества, составляющие систему, которые могут быть выделены из системы и существовать вне её.
 • Любая термодинамическая система может быть охарактеризована совокупностью огромного числа физических и химических свойств, принимающих определенные значения: температура, давление, теплопроводность, теплоемкость, концентрации компонентов, диэлектрическая проницаемость и т. д.
• Любая термодинамическая система может быть охарактеризована совокупностью огромного числа физических и химических свойств, принимающих определенные значения: температура, давление, теплопроводность, теплоемкость, концентрации компонентов, диэлектрическая проницаемость и т. д.
 • В химической термодинамике имеют дело с теми свойствами, которые могут быть однозначно выражены как функции температуры, давления, объёма или концентраций веществ системы. • Эти свойства называют термодинамическими свойствами.
• В химической термодинамике имеют дело с теми свойствами, которые могут быть однозначно выражены как функции температуры, давления, объёма или концентраций веществ системы. • Эти свойства называют термодинамическими свойствами.
 Как задать состояние ТД системы?
Как задать состояние ТД системы?
 • Состояние термодинамической системы считается заданным, если указаны её химический состав, фазовый состав и значения независимых термодинамических параметров. • К независимым параметрам относят: давление (P), объем (V), температуру (T), количество вещества n в виде числа моль или в виде концентраций (С). Их называют параметрами состояния.
• Состояние термодинамической системы считается заданным, если указаны её химический состав, фазовый состав и значения независимых термодинамических параметров. • К независимым параметрам относят: давление (P), объем (V), температуру (T), количество вещества n в виде числа моль или в виде концентраций (С). Их называют параметрами состояния.
 • Согласно действующей системе единиц (СИ), основные термодинамические параметры задаются в следующих единицах: [м 3] (объём); [Па] (давление); [моль] (n); [K] (температура). • В порядке исключения в химической термодинамике разрешено использовать внесистемную единицу давления нормальную физическую атмосферу (атм), равную 101. 325 к. Па
• Согласно действующей системе единиц (СИ), основные термодинамические параметры задаются в следующих единицах: [м 3] (объём); [Па] (давление); [моль] (n); [K] (температура). • В порядке исключения в химической термодинамике разрешено использовать внесистемную единицу давления нормальную физическую атмосферу (атм), равную 101. 325 к. Па
 • Термодинамические параметры и свойства могут быть: • Интенсивными – они не зависят от массы (объема) системы. Это – температура, давление, химический потенциал и т. п. • Экстенсивными – они зависят от массы (объема) системы. Это – энергия, энтропия, энтальпия и т. п. • При формировании сложной системы интенсивные свойства выравниваются, а экстенсивные суммируются.
• Термодинамические параметры и свойства могут быть: • Интенсивными – они не зависят от массы (объема) системы. Это – температура, давление, химический потенциал и т. п. • Экстенсивными – они зависят от массы (объема) системы. Это – энергия, энтропия, энтальпия и т. п. • При формировании сложной системы интенсивные свойства выравниваются, а экстенсивные суммируются.
 Термодинамический процесс и термодинамическое равновесие
Термодинамический процесс и термодинамическое равновесие
 • Всякое изменение, происходящее в системе и сопровождающееся изменением хотя бы одного термодинамического параметра состояния (свойства системы), называют термодинамическим процессом. • Если протекании процесса происходит изменение химического состава системы, то такой процесс называют химической реакцией.
• Всякое изменение, происходящее в системе и сопровождающееся изменением хотя бы одного термодинамического параметра состояния (свойства системы), называют термодинамическим процессом. • Если протекании процесса происходит изменение химического состава системы, то такой процесс называют химической реакцией.
 Ох уж эти процессы!!! Какие они?
Ох уж эти процессы!!! Какие они?
 • Обычно при протекании процесса какой-либо один (или несколько) параметр поддерживают постоянным. Соответственно различают: • изотермический процесс при постоянной температуре (Т = const); • изобарный процесс - при постоянном давлении (Р = const); • изохорный процесс - при постоянном объёме (V = const); • адиабатический процесс при отсутствии теплообмена с окружением (Q = 0).
• Обычно при протекании процесса какой-либо один (или несколько) параметр поддерживают постоянным. Соответственно различают: • изотермический процесс при постоянной температуре (Т = const); • изобарный процесс - при постоянном давлении (Р = const); • изохорный процесс - при постоянном объёме (V = const); • адиабатический процесс при отсутствии теплообмена с окружением (Q = 0).
 • При протекании процессов в неизолированных системах могут происходить поглощение или выделение теплоты. • В соответствии с этим признаком процессы подразделяют на экзотермические (происходит выделение теплоты) • эндотермические (теплота поглощается).
• При протекании процессов в неизолированных системах могут происходить поглощение или выделение теплоты. • В соответствии с этим признаком процессы подразделяют на экзотермические (происходит выделение теплоты) • эндотермические (теплота поглощается).
 Всякий процесс заканчивается равновесием!!
Всякий процесс заканчивается равновесием!!
 • В ходе процесса система переходит из одного равновесного состояния в другое равновесное состояние • Термодинамическим равновесным называют состояние системы, при котором наблюдается тепловое, механическое и химическое (электрохимическое) равновесие с окружающей средой и между фазами системы.
• В ходе процесса система переходит из одного равновесного состояния в другое равновесное состояние • Термодинамическим равновесным называют состояние системы, при котором наблюдается тепловое, механическое и химическое (электрохимическое) равновесие с окружающей средой и между фазами системы.
 • • Равновесные состояния бывают: устойчивые; метастабильные. Процесс называют равновесным (квазистатическим), если он бесконечно медленно проходит через непрерывную последовательность равновесных состояний системы.
• • Равновесные состояния бывают: устойчивые; метастабильные. Процесс называют равновесным (квазистатическим), если он бесконечно медленно проходит через непрерывную последовательность равновесных состояний системы.
 Обратимые и циклические процессы
Обратимые и циклические процессы
 Самопроизвольные и несамопроизвольные процессы
Самопроизвольные и несамопроизвольные процессы
 • Процессы, происходящие сами по себе и не требующие для своего осуществления энергии извне называют самопроизвольными (положительными) процессами. • когда на осуществление процесса из окружающей среды извлекается энергия, т. е. совершается работа над системой, то процесс называют несамопроизвольным (отрицательным).
• Процессы, происходящие сами по себе и не требующие для своего осуществления энергии извне называют самопроизвольными (положительными) процессами. • когда на осуществление процесса из окружающей среды извлекается энергия, т. е. совершается работа над системой, то процесс называют несамопроизвольным (отрицательным).
 Функции состояния и функции процесса
Функции состояния и функции процесса
 Функции состояния • Функции состояния – это свойства системы (внутренняя энергия U, энтальпия H, энтропия S и т. д. ), они характеризуют данное состояние системы. • Их изменения в ходе процесса не зависят от его пути и определяются только начальным и конечным состояниями системы.
Функции состояния • Функции состояния – это свойства системы (внутренняя энергия U, энтальпия H, энтропия S и т. д. ), они характеризуют данное состояние системы. • Их изменения в ходе процесса не зависят от его пути и определяются только начальным и конечным состояниями системы.
 Все термодинамические функции подразделяются на функции состояния и функции процесса (перехода).
Все термодинамические функции подразделяются на функции состояния и функции процесса (перехода).
 Бесконечно малое изменение данной функции является полным дифференциалом d. U, d. S и т. д. :
Бесконечно малое изменение данной функции является полным дифференциалом d. U, d. S и т. д. :
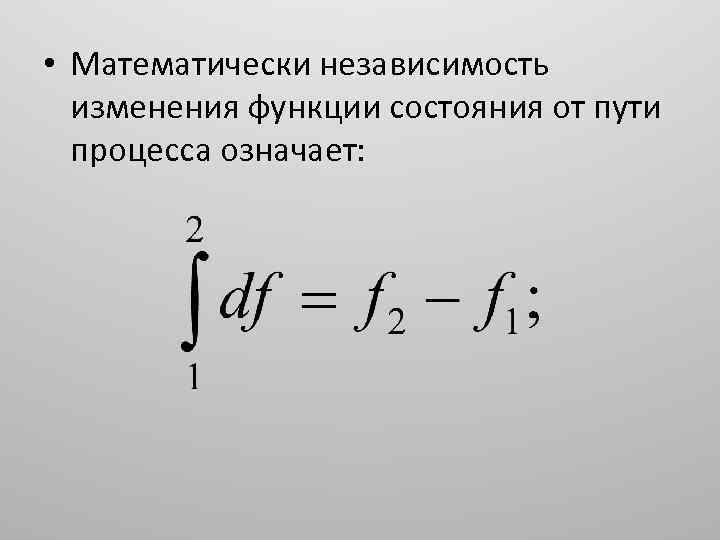 • Математически независимость изменения функции состояния от пути процесса означает:
• Математически независимость изменения функции состояния от пути процесса означает:

 Функции процесса (перехода) • Функции процесса (теплота Q, работа W) – они не являются свойствами системы (их нет в системе), они возникают в ходе процесса, в котором участвует система.
Функции процесса (перехода) • Функции процесса (теплота Q, работа W) – они не являются свойствами системы (их нет в системе), они возникают в ходе процесса, в котором участвует система.
 Если теплоты и работы нет в системе, то бессмысленно говорить об их изменении, речь может идти только об их количестве Q или W в том или ином процессе. • Их количества зависят от пути осуществления процесса. • Бесконечно малые количества обозначают Q, W.
Если теплоты и работы нет в системе, то бессмысленно говорить об их изменении, речь может идти только об их количестве Q или W в том или ином процессе. • Их количества зависят от пути осуществления процесса. • Бесконечно малые количества обозначают Q, W.
 Энергия, теплота и работа
Энергия, теплота и работа
 • Движение – атрибут материи. • Мерой движения, т. е. количественной и качественной характеристикой является энергия. • Энергия – функция состояния системы. Её изменение в том или ином процессе не зависит от пути процесса и определяется только начальным и конечным состояниями системы.
• Движение – атрибут материи. • Мерой движения, т. е. количественной и качественной характеристикой является энергия. • Энергия – функция состояния системы. Её изменение в том или ином процессе не зависит от пути процесса и определяется только начальным и конечным состояниями системы.
 • Известно множество различных видов энергии: механическая, электрическая, химическая и т. п. , но от системы к системе энергия может переходить лишь в двух формах: в форме теплоты или работы.
• Известно множество различных видов энергии: механическая, электрическая, химическая и т. п. , но от системы к системе энергия может переходить лишь в двух формах: в форме теплоты или работы.
 • Теплота (Q) – форма передачи энергии от системы к системе за счёт хаотического движения частиц (молекул, атомов, ионов и т. п. ) контактирующих систем.
• Теплота (Q) – форма передачи энергии от системы к системе за счёт хаотического движения частиц (молекул, атомов, ионов и т. п. ) контактирующих систем.
 • В термодинамике теплота, подведённая к системе, принимается положительной (Например, теплота эндотермической реакции), а теплота, отведённая от системы – отрицательной (теплота экзотермической реакции). • В термохимии всё наоборот.
• В термодинамике теплота, подведённая к системе, принимается положительной (Например, теплота эндотермической реакции), а теплота, отведённая от системы – отрицательной (теплота экзотермической реакции). • В термохимии всё наоборот.
 • Работа – форма передачи энергии от системы к системе за счёт направленного движения микро- или макротел. • В литературе работу обозначают либо W (от англ. “work”), либо A (от нем. «arbait”).
• Работа – форма передачи энергии от системы к системе за счёт направленного движения микро- или макротел. • В литературе работу обозначают либо W (от англ. “work”), либо A (от нем. «arbait”).
 • Существуют разные виды работы: механическая, электрическая, магнитная, изменения поверхности и др. • Бесконечно малую работу любого вида можно представить как произведение обобщенной силы на изменение обобщенной координаты, например:
• Существуют разные виды работы: механическая, электрическая, магнитная, изменения поверхности и др. • Бесконечно малую работу любого вида можно представить как произведение обобщенной силы на изменение обобщенной координаты, например:

 • Сумму всех видов работ за исключением работы против сил внешнего давления P - работы расширения – сжатия называют полезной работой W’:
• Сумму всех видов работ за исключением работы против сил внешнего давления P - работы расширения – сжатия называют полезной работой W’:
 Работа расширения-сжатия (против сил внешнего давления)
Работа расширения-сжатия (против сил внешнего давления)
 С учетом работы против сил внешнего давления общее выражение для работы процесса имеет вид:
С учетом работы против сил внешнего давления общее выражение для работы процесса имеет вид:
 • В термодинамике работа считается положительной, если её совершает сама система и отрицательной, если она совершается над системой. • Согласно рекомендациям ИЮПАК, принято считать положительной работу, совершенную над системой ( «эгоистический» принцип – положительно то, что увеличивает внутреннюю энергию)
• В термодинамике работа считается положительной, если её совершает сама система и отрицательной, если она совершается над системой. • Согласно рекомендациям ИЮПАК, принято считать положительной работу, совершенную над системой ( «эгоистический» принцип – положительно то, что увеличивает внутреннюю энергию)

 Работа расширения идеального газа в различных процессах • 1. Расширение в вакуум: • W = 0. • 2. Изохорное обратимое расширение: • d. V = 0 W = 0
Работа расширения идеального газа в различных процессах • 1. Расширение в вакуум: • W = 0. • 2. Изохорное обратимое расширение: • d. V = 0 W = 0

 3. Изобарное обратимое расширение
3. Изобарное обратимое расширение
 4. Изотермическое обратимое расширение
4. Изотермическое обратимое расширение

 5. Адиабатическое обратимое расширение
5. Адиабатическое обратимое расширение

 Постулаты и законы ТД
Постулаты и законы ТД
 • Выводы и соотношения термодинамики формулируют на основании двух постулатов и трех законов. • Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти (первый постулат) • Т. е. термодинамика не описывает системы астрономического масштаба и микросистемы с малым числом частиц (<1018)
• Выводы и соотношения термодинамики формулируют на основании двух постулатов и трех законов. • Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти (первый постулат) • Т. е. термодинамика не описывает системы астрономического масштаба и микросистемы с малым числом частиц (<1018)
 • Самопроизвольный переход из неравновесного состояния в равновесное называют релаксацией. • Т. е равновесное состояние обязательно будет достигнуто, но длительность такого процесса не определена, в т. д. нет понятия времени.
• Самопроизвольный переход из неравновесного состояния в равновесное называют релаксацией. • Т. е равновесное состояние обязательно будет достигнуто, но длительность такого процесса не определена, в т. д. нет понятия времени.
 Второй постулат • Если система А находится в тепловом равновесии с системой В, а та – с системой С, то и системы А и С также находятся в тепловом равновесии
Второй постулат • Если система А находится в тепловом равновесии с системой В, а та – с системой С, то и системы А и С также находятся в тепловом равновесии
 1. 2. Первый закон термодинамики
1. 2. Первый закон термодинамики
 1. 2. 1. Внутренняя энергия. Формулировки первого закона термодинамики
1. 2. 1. Внутренняя энергия. Формулировки первого закона термодинамики
 Внутренняя энергия любой термодинамической системы U складывается из кинетической (энергия движения) и потенциальной (энергия взаимодействия) энергий всех частиц (молекул, ядер, электронов, кварков и т. д. ), составляющих систему, включая и неизвестные виды энергии.
Внутренняя энергия любой термодинамической системы U складывается из кинетической (энергия движения) и потенциальной (энергия взаимодействия) энергий всех частиц (молекул, ядер, электронов, кварков и т. д. ), составляющих систему, включая и неизвестные виды энергии.
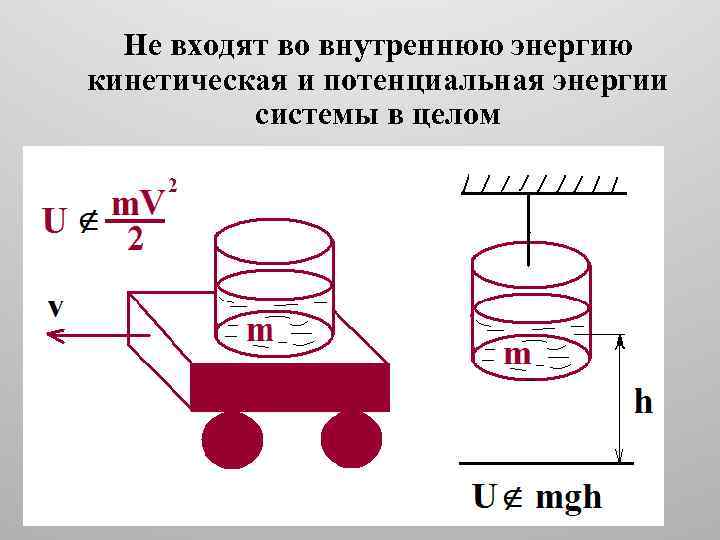 Не входят во внутреннюю энергию кинетическая и потенциальная энергии системы в целом
Не входят во внутреннюю энергию кинетическая и потенциальная энергии системы в целом
 • Внутренняя энергия системы зависит от её массы (экстенсивное свойство), от природы вещества системы и термодинамических параметров: • U = f(V, T) или U = (P, T) • измеряется в Дж/моль или Дж/кг. • U – функция состояния, поэтому U не зависит от пути процесса, а определяется начальным и конечным состоянием системы. • d. U – полный дифференциал.
• Внутренняя энергия системы зависит от её массы (экстенсивное свойство), от природы вещества системы и термодинамических параметров: • U = f(V, T) или U = (P, T) • измеряется в Дж/моль или Дж/кг. • U – функция состояния, поэтому U не зависит от пути процесса, а определяется начальным и конечным состоянием системы. • d. U – полный дифференциал.
 • Внутренняя энергия системы может изменяться в результате обмена энергией с окружением только в форме теплоты или работы.
• Внутренняя энергия системы может изменяться в результате обмена энергией с окружением только в форме теплоты или работы.
 • Этот факт, являющийся обобщением практического опыта человечества, передаёт первый закон (начало) термодинамики: • U = Q – W • В дифференциальной форме (для бесконечно малой части процесса): • d. U = Q W
• Этот факт, являющийся обобщением практического опыта человечества, передаёт первый закон (начало) термодинамики: • U = Q – W • В дифференциальной форме (для бесконечно малой части процесса): • d. U = Q W
 • Здесь Q и W – бесконечно малые количества теплоты и работы процесса. • d. U – полный дифференциал U (бесконечно малое изменение внутренней энергии). • Обычно выражение записывают в форме: • Q = U + W
• Здесь Q и W – бесконечно малые количества теплоты и работы процесса. • d. U – полный дифференциал U (бесконечно малое изменение внутренней энергии). • Обычно выражение записывают в форме: • Q = U + W
 Формулировки первого закона термодинамики
Формулировки первого закона термодинамики
 • «Теплота, подведённая к системе, идёт на увеличение внутренней энергии системы и совершение системой работы» .
• «Теплота, подведённая к системе, идёт на увеличение внутренней энергии системы и совершение системой работы» .
 • Для изолированной системы • Q = 0 и W = 0, т. е. U = 0 и • U = const. • Внутренняя энергия изолированной системы постоянна
• Для изолированной системы • Q = 0 и W = 0, т. е. U = 0 и • U = const. • Внутренняя энергия изолированной системы постоянна
 • В формулировке Клаузиуса: «Энергия мира постоянна» . • Вечный двигатель первого рода (перпетум мобиле) невозможен. • Разные формы энергии переходят друг в друга в строго эквивалентных количествах. • Энергия не возникает и не уничтожается, а лишь переходит от системы к системе.
• В формулировке Клаузиуса: «Энергия мира постоянна» . • Вечный двигатель первого рода (перпетум мобиле) невозможен. • Разные формы энергии переходят друг в друга в строго эквивалентных количествах. • Энергия не возникает и не уничтожается, а лишь переходит от системы к системе.
 • Функция U аддитивна. Это означает, что если две системы, характеризующиеся значениями U 1 и U 2 объединяются в одну единую систему, то результирующая внутренняя энергия U 1+2 будет равна сумме энергий составляющих ее частей: • U 1+2 = U 1 + U 2
• Функция U аддитивна. Это означает, что если две системы, характеризующиеся значениями U 1 и U 2 объединяются в одну единую систему, то результирующая внутренняя энергия U 1+2 будет равна сумме энергий составляющих ее частей: • U 1+2 = U 1 + U 2
 1. 2. 2. Теплота изохорного и изобарного процессов. Закон Гесса
1. 2. 2. Теплота изохорного и изобарного процессов. Закон Гесса
 • В общем случае теплота Q - есть функция процесса, т. е. её количество зависит от пути протекания процесса, но в двух важных для практики случаях теплота приобретает свойства функции состояния, т. е. величина Q перестаёт зависеть от пути процесса, а определяется только начальным и конечным состояниями системы.
• В общем случае теплота Q - есть функция процесса, т. е. её количество зависит от пути протекания процесса, но в двух важных для практики случаях теплота приобретает свойства функции состояния, т. е. величина Q перестаёт зависеть от пути процесса, а определяется только начальным и конечным состояниями системы.
 1. Изохорный процесс, V = const
1. Изохорный процесс, V = const
 • Будем считать, что в ходе процесса может совершаться только работа против сил внешнего давления, а полезная работа W = 0: • Q = d. U + P d. V, • а так как V = const, то P d. V = 0: QV = d. U • или в интегральной форме: • QV = Uк – Uн
• Будем считать, что в ходе процесса может совершаться только работа против сил внешнего давления, а полезная работа W = 0: • Q = d. U + P d. V, • а так как V = const, то P d. V = 0: QV = d. U • или в интегральной форме: • QV = Uк – Uн
 2. Теплота изобарного процесса P = const
2. Теплота изобарного процесса P = const
 • Снова будем считать, что полезная работа W = 0, тогда: Q = d. U + P d. V, • Так как Р = const, то можно записать: QР = d. U + d(РV), QР = d(U + P V). Обозначим: Н U + P V (энтальпия) • QР = d. H или: • QP = Hк – Hн
• Снова будем считать, что полезная работа W = 0, тогда: Q = d. U + P d. V, • Так как Р = const, то можно записать: QР = d. U + d(РV), QР = d(U + P V). Обозначим: Н U + P V (энтальпия) • QР = d. H или: • QP = Hк – Hн
 • Таким образом, тепловой эффект химической реакции приобретает свойства функцией состояния • при P = const: • QP = H; • при V = const: • QV = U.
• Таким образом, тепловой эффект химической реакции приобретает свойства функцией состояния • при P = const: • QP = H; • при V = const: • QV = U.
 • Так как химические реакции и физикохимические процессы чаще осуществляют при постоянном давления (на открытом воздухе, т. е. при Р = const = 1 атм), то на практике для расчётов чаще используют понятие энтальпии, а не внутренней энергии. • Иногда слово «теплота» процесса заменяют без дополнительных объяснений «энтальпией» , и наоборот. • Например, говорят «теплота образования» , а пишут f. Н.
• Так как химические реакции и физикохимические процессы чаще осуществляют при постоянном давления (на открытом воздухе, т. е. при Р = const = 1 атм), то на практике для расчётов чаще используют понятие энтальпии, а не внутренней энергии. • Иногда слово «теплота» процесса заменяют без дополнительных объяснений «энтальпией» , и наоборот. • Например, говорят «теплота образования» , а пишут f. Н.
 Но если интересующий нас процесс протекает при V = const (в автоклаве), то следует использовать выражение: QV = U.
Но если интересующий нас процесс протекает при V = const (в автоклаве), то следует использовать выражение: QV = U.
 Связь Н и U
Связь Н и U
 • Продифференцируем выражение: • Н = U + P V • d. H = d. U + Pd. V + Vd. P, • при постоянном давлении V d. P = 0 и • d. H = d. U + P d. V • В интегральной форме: • Н = U + Р V
• Продифференцируем выражение: • Н = U + P V • d. H = d. U + Pd. V + Vd. P, • при постоянном давлении V d. P = 0 и • d. H = d. U + P d. V • В интегральной форме: • Н = U + Р V
 • Для идеального газа справедливо уравнение Клапейрона-Менделеева: • Р V = n R T, • где n – число моль газа, R 8, 314 Дж/моль К – универсальная газовая постоянная. • Тогда (при Т = const) P V = n R T. Окончательно имеем: • Н = U + n R T • n – изменение числа моль газообразных веществ в ходе реакции.
• Для идеального газа справедливо уравнение Клапейрона-Менделеева: • Р V = n R T, • где n – число моль газа, R 8, 314 Дж/моль К – универсальная газовая постоянная. • Тогда (при Т = const) P V = n R T. Окончательно имеем: • Н = U + n R T • n – изменение числа моль газообразных веществ в ходе реакции.
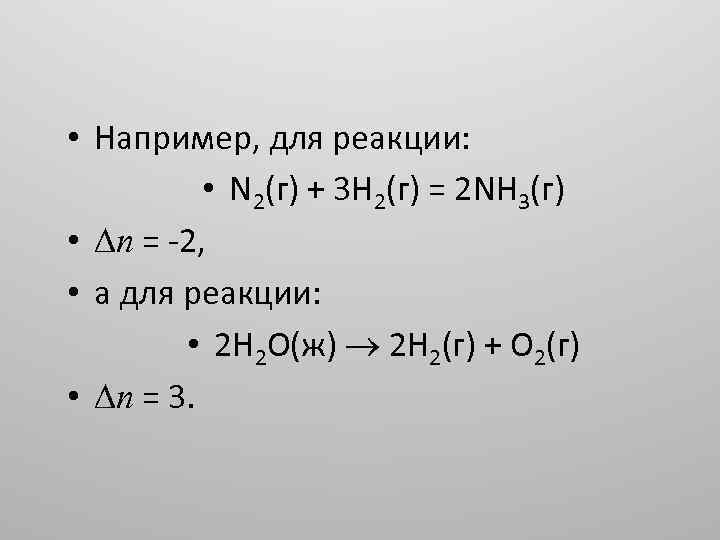 • Например, для реакции: • N 2(г) + 3 H 2(г) = 2 NH 3(г) • n = -2, • а для реакции: • 2 Н 2 О(ж) 2 Н 2(г) + О 2(г) • n = 3.
• Например, для реакции: • N 2(г) + 3 H 2(г) = 2 NH 3(г) • n = -2, • а для реакции: • 2 Н 2 О(ж) 2 Н 2(г) + О 2(г) • n = 3.
 Различия между QV и QP существенны только при участии в реакции газообразных веществ. Если таковых нет, или если n = 0, то QV = QP.
Различия между QV и QP существенны только при участии в реакции газообразных веществ. Если таковых нет, или если n = 0, то QV = QP.
 • Тепловые эффекты химических реакций и физико-химических процессов изучает наука термохимия
• Тепловые эффекты химических реакций и физико-химических процессов изучает наука термохимия
 • Под тепловым эффектом реакции понимают количество энергии, выделенное или поглощенное в ходе реакции в форме теплоты при условии: • что P = const или V = const; • что температура исходных веществ равна температуре продуктов реакции; • что в системе не совершается никакой иной работы (полезной), кроме работы расширениясжатия.
• Под тепловым эффектом реакции понимают количество энергии, выделенное или поглощенное в ходе реакции в форме теплоты при условии: • что P = const или V = const; • что температура исходных веществ равна температуре продуктов реакции; • что в системе не совершается никакой иной работы (полезной), кроме работы расширениясжатия.

 Изменение энтальпии в ходе различных процессов Процесс Условия измерения Hо, к. Дж/моль C 2 H 6 O(ж) + 3 O 2(г)→ 2 СO 2(г) + 3 H 2 O(ж) P = 1 атм T = 298 K − 1 370. 68 Теплота диссоциации: H 2 O(ж) → H+ + OH- P = 1 атм T = 298 K +57. 26 Теплота нейтрализации: H+ + OH- → H 2 O (ж) P = 1 атм T = 298 K − 57. 26 Теплота испарения: H 2 O(ж) → H 2 O(г) P = 1 атм T = 373 K +40. 67 Теплота плавления: H 2 O(кр) → H 2 O(ж) P = 1 атм T = 273 K +6. 02
Изменение энтальпии в ходе различных процессов Процесс Условия измерения Hо, к. Дж/моль C 2 H 6 O(ж) + 3 O 2(г)→ 2 СO 2(г) + 3 H 2 O(ж) P = 1 атм T = 298 K − 1 370. 68 Теплота диссоциации: H 2 O(ж) → H+ + OH- P = 1 атм T = 298 K +57. 26 Теплота нейтрализации: H+ + OH- → H 2 O (ж) P = 1 атм T = 298 K − 57. 26 Теплота испарения: H 2 O(ж) → H 2 O(г) P = 1 атм T = 373 K +40. 67 Теплота плавления: H 2 O(кр) → H 2 O(ж) P = 1 атм T = 273 K +6. 02
 Закон Гесса
Закон Гесса
 • Факт постоянства QV или QP, задолго до оформления химической термодинамики как науки, опытным путем установил Г. И. Гесс (закон постоянства сумм тепла или закон Гесса): • Тепловой эффект химической реакции зависит от вида и состояния исходных веществ и продуктов реакции и не зависит от пути их превращения друг в друга.
• Факт постоянства QV или QP, задолго до оформления химической термодинамики как науки, опытным путем установил Г. И. Гесс (закон постоянства сумм тепла или закон Гесса): • Тепловой эффект химической реакции зависит от вида и состояния исходных веществ и продуктов реакции и не зависит от пути их превращения друг в друга.
 • Герман Иванович Гесс (1802 – 1850) – один из крупнейших русских учёных, профессор Технологического института в Петербурге. Родился в Женеве, а воспитывался с ранних лет в Петербурге. Получил медицинское образование в Юрьеве, после окончания университета работал в Стокгольме у Я. Берцелиуса. • Гесс пытался в своих экспериментах установить закон кратных тепловых отношений (аналогичный закону кратных отношений Д. Дальтона). Этого ему не удалось (такого закона нет в природе), но в результате экспериментальных исследованиях Гесс вывел закон постоянства сумм тепла (закон Гесса). Работа эта, опубликованная в 1842 г. , является предвосхищением первого закона термодинамики.
• Герман Иванович Гесс (1802 – 1850) – один из крупнейших русских учёных, профессор Технологического института в Петербурге. Родился в Женеве, а воспитывался с ранних лет в Петербурге. Получил медицинское образование в Юрьеве, после окончания университета работал в Стокгольме у Я. Берцелиуса. • Гесс пытался в своих экспериментах установить закон кратных тепловых отношений (аналогичный закону кратных отношений Д. Дальтона). Этого ему не удалось (такого закона нет в природе), но в результате экспериментальных исследованиях Гесс вывел закон постоянства сумм тепла (закон Гесса). Работа эта, опубликованная в 1842 г. , является предвосхищением первого закона термодинамики.
 Н 1 = Н 2 + Н 3 = Н 4 + Н 5 + Н 6
Н 1 = Н 2 + Н 3 = Н 4 + Н 5 + Н 6
 Применение закона Гесса
Применение закона Гесса
 Непосредственное применение
Непосредственное применение
 Вычисление трудно измеряемых тепловых эффектов
Вычисление трудно измеряемых тепловых эффектов
 CO 2 C + O 2 = CO 2 CO + 1/2 O 2 = CO 2 C + 1/2 O 2 = CO H 2 H 1 C CO H 3 H 1 = H 2 + H 3
CO 2 C + O 2 = CO 2 CO + 1/2 O 2 = CO 2 C + 1/2 O 2 = CO H 2 H 1 C CO H 3 H 1 = H 2 + H 3
 Вычисление тепловых эффектов с помощью теплот (энтальпий) образования и сгорания веществ
Вычисление тепловых эффектов с помощью теплот (энтальпий) образования и сгорания веществ
 • Теплота образования – тепловой эффект образования 1 моль данного вещества из простых веществ: f. H. • Простыми называют вещества, состоящие из атомов одного вида. Это, например, - азот N 2, кислород О 2, графит С и т. п.
• Теплота образования – тепловой эффект образования 1 моль данного вещества из простых веществ: f. H. • Простыми называют вещества, состоящие из атомов одного вида. Это, например, - азот N 2, кислород О 2, графит С и т. п.
 • Из определения следует, что теплота образования воды равна по величине тепловому эффекту реакции: • Н 2 + 1/2 О 2 = Н 2 О QP = f. Н
• Из определения следует, что теплота образования воды равна по величине тепловому эффекту реакции: • Н 2 + 1/2 О 2 = Н 2 О QP = f. Н
 • Если реакцию осуществить при • Р = 1 атм, то измеренная теплота реакции будет равна f. Нo - стандартной теплоте образования воды. • Обычно величины f. Нo табулированы при 298 К практически для всех веществ, применяющихся в практической деятельности: f. Нo 298(Н 2 О).
• Если реакцию осуществить при • Р = 1 атм, то измеренная теплота реакции будет равна f. Нo - стандартной теплоте образования воды. • Обычно величины f. Нo табулированы при 298 К практически для всех веществ, применяющихся в практической деятельности: f. Нo 298(Н 2 О).
 Первое следствие из закона Гесса
Первое следствие из закона Гесса
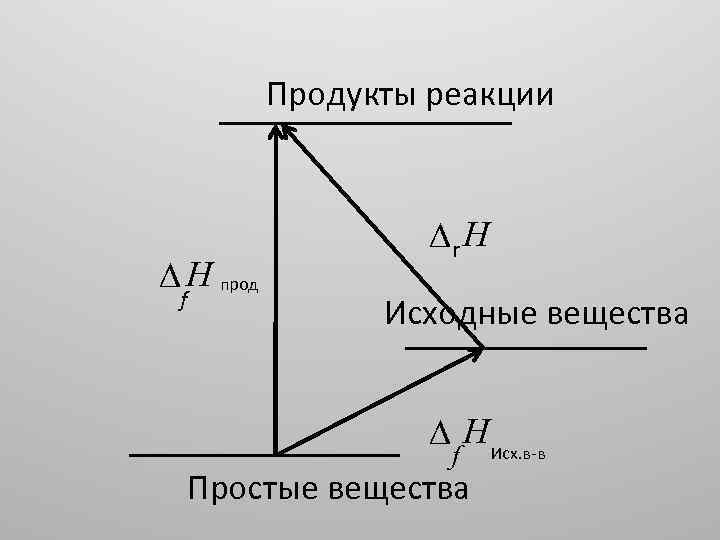 Продукты реакции H прод f r Н Исходные вещества H Исх. в-в f Простые вещества
Продукты реакции H прод f r Н Исходные вещества H Исх. в-в f Простые вещества
 • Тепловой эффект химической реакции: • a 1 A 1 + a 2 A 2 + = b 1 B 1 +b 2 B 2 + • равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ (с учётом стехиометрических коэффициентов аi и bj):
• Тепловой эффект химической реакции: • a 1 A 1 + a 2 A 2 + = b 1 B 1 +b 2 B 2 + • равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ (с учётом стехиометрических коэффициентов аi и bj):
 • Пример 1: Вычислить тепловой эффект реакции гидрирования паров бензола (эту реакцию осуществляют на поверхности гетерогенных катализаторов – платиновых металлов): • С 6 Н 6 + 3 Н 2 = С 6 Н 12 • при 298 К и Р = 1 атм:
• Пример 1: Вычислить тепловой эффект реакции гидрирования паров бензола (эту реакцию осуществляют на поверхности гетерогенных катализаторов – платиновых металлов): • С 6 Н 6 + 3 Н 2 = С 6 Н 12 • при 298 К и Р = 1 атм:
 С 6 Н 6(г) f. Ho 298, к. Дж/моль 82, 93 С 6 Н 6(ж) 49, 04 С 6 Н 12(г) Н 2 -123, 10 0 Вещество r. Н 0298 = -123, 10 – (82, 93 +3 0) =-206, 03 к. Дж r. Н 0298 = -123, 10–(49, 04 + 3 0) = -72, 14 к. Дж исп. Н 0 = 82, 93 – 49, 04 = +33, 89 к. Дж/моль
С 6 Н 6(г) f. Ho 298, к. Дж/моль 82, 93 С 6 Н 6(ж) 49, 04 С 6 Н 12(г) Н 2 -123, 10 0 Вещество r. Н 0298 = -123, 10 – (82, 93 +3 0) =-206, 03 к. Дж r. Н 0298 = -123, 10–(49, 04 + 3 0) = -72, 14 к. Дж исп. Н 0 = 82, 93 – 49, 04 = +33, 89 к. Дж/моль
 Теплоты сгорания
Теплоты сгорания
 • Теплота сгорания – это тепловой эффект реакции глубокого окисления (сгорания) вещества (до высших оксидов). • В случае углеводородов высшими оксидами являются Н 2 О(ж) и СО 2. • В таком случае теплота сгорания, например, метана равна тепловому эффекту реакции: • СН 4 + 2 О 2 = СО 2 + 2 Н 2 О(ж) • QP = ox. H
• Теплота сгорания – это тепловой эффект реакции глубокого окисления (сгорания) вещества (до высших оксидов). • В случае углеводородов высшими оксидами являются Н 2 О(ж) и СО 2. • В таком случае теплота сгорания, например, метана равна тепловому эффекту реакции: • СН 4 + 2 О 2 = СО 2 + 2 Н 2 О(ж) • QP = ox. H
 • Величины ox. Ho 298 называют стандартными теплотами сгорания, они табулированы при 298 К. • Здесь индекс «о» указывает на то, что теплоты определены при стандартном состоянии (Р = 1 атм), • индекс «ох» происходит от английского - oxidation – окисление.
• Величины ox. Ho 298 называют стандартными теплотами сгорания, они табулированы при 298 К. • Здесь индекс «о» указывает на то, что теплоты определены при стандартном состоянии (Р = 1 атм), • индекс «ох» происходит от английского - oxidation – окисление.
 Второе следствие из закона Гесса
Второе следствие из закона Гесса
 Продукты сгорания (СО 2, Н 2 О) ох. H Исх. в-в ох. Н прод Продукты реакции r. H Исходные вещества
Продукты сгорания (СО 2, Н 2 О) ох. H Исх. в-в ох. Н прод Продукты реакции r. H Исходные вещества
 • Тепловой эффект химической реакции: • a 1 A 1 + a 2 A 2 + = b 1 B 1 +b 2 B 2 + • равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учётом стехиометрических коэффициентов аi и bj):
• Тепловой эффект химической реакции: • a 1 A 1 + a 2 A 2 + = b 1 B 1 +b 2 B 2 + • равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учётом стехиометрических коэффициентов аi и bj):
 • Пример 2: Используя теплоты сгорания веществ, рассчитать тепловой эффект реакции получения этанола (винного спирта) путём брожения глюкозы. • С 6 Н 12 О 6 = 2 С 2 Н 5 ОН + 2 СО 2 • r. Н 0298 = 2815, 8 – 2 1366, 91 2∙ 0 = 81, 98 к. Дж • Теплота сгорания СО 2 равна нулю.
• Пример 2: Используя теплоты сгорания веществ, рассчитать тепловой эффект реакции получения этанола (винного спирта) путём брожения глюкозы. • С 6 Н 12 О 6 = 2 С 2 Н 5 ОН + 2 СО 2 • r. Н 0298 = 2815, 8 – 2 1366, 91 2∙ 0 = 81, 98 к. Дж • Теплота сгорания СО 2 равна нулю.
 1. 2. 3. Зависимость теплового эффекта от температуры
1. 2. 3. Зависимость теплового эффекта от температуры
 Теплоемкость
Теплоемкость
 • Теплоемкость – это мера инертности системы к нагреванию (или охлаждению), она численно равна количеству теплоты, которое необходимо подвести (или отвести) к (от) системе, чтобы изменить её температуру на один градус.
• Теплоемкость – это мера инертности системы к нагреванию (или охлаждению), она численно равна количеству теплоты, которое необходимо подвести (или отвести) к (от) системе, чтобы изменить её температуру на один градус.
 • Теплоемкость зависит от температуры. Поэтому различают среднюю и истинную теплоёмкости. • Средняя теплоемкость системы в интервале температур Т 1 – Т 2 равна отношению количеству теплоты, подведенной к системе Q, к величине этого интервала:
• Теплоемкость зависит от температуры. Поэтому различают среднюю и истинную теплоёмкости. • Средняя теплоемкость системы в интервале температур Т 1 – Т 2 равна отношению количеству теплоты, подведенной к системе Q, к величине этого интервала:
 • Истинная теплоёмкость определяется по уравнению: • Зависимость между истинной и средней теплоемкостями выражается уравнением:
• Истинная теплоёмкость определяется по уравнению: • Зависимость между истинной и средней теплоемкостями выражается уравнением:
 • Теплоемкость системы зависит от её массы (или количества вещества), т. е. это экстенсивное свойство системы. • Если теплоемкость отнести к единице массы, то получается интенсивная величина – удельная теплоемкость суд [Дж/кг К]. • Если же отнести С к количеству вещества системы, получается мольная теплоемкость сm [Дж/моль К].
• Теплоемкость системы зависит от её массы (или количества вещества), т. е. это экстенсивное свойство системы. • Если теплоемкость отнести к единице массы, то получается интенсивная величина – удельная теплоемкость суд [Дж/кг К]. • Если же отнести С к количеству вещества системы, получается мольная теплоемкость сm [Дж/моль К].
 • Различают: • теплоемкость при постоянном давлении Ср • теплоемкость при постоянном объеме Сv. • В случае идеального газа указанные теплоемкости связаны между собой уравнением: • Ср = С v + R
• Различают: • теплоемкость при постоянном давлении Ср • теплоемкость при постоянном объеме Сv. • В случае идеального газа указанные теплоемкости связаны между собой уравнением: • Ср = С v + R

 • Молярная теплоемкость идеального одноатомного газа равна: • СV = 3/2 R CP = 5/2 R • двухатомного газа: • СV = 5/2 R CP = 7/2 R
• Молярная теплоемкость идеального одноатомного газа равна: • СV = 3/2 R CP = 5/2 R • двухатомного газа: • СV = 5/2 R CP = 7/2 R
 • Для оценки теплоемкости твёрдых веществ применяют правило Дюлонга и Пти: «атомная теплоемкость при • V = const для любого твердого простого вещества равна 25 Дж/моль К» .
• Для оценки теплоемкости твёрдых веществ применяют правило Дюлонга и Пти: «атомная теплоемкость при • V = const для любого твердого простого вещества равна 25 Дж/моль К» .
 • Для вычисления теплоемкости сложных веществ используют правило Неймана-Коппа (правило аддитивности): • Теплоемкость сложного вещества равна сумме теплоемкостей образующих его простых веществ.
• Для вычисления теплоемкости сложных веществ используют правило Неймана-Коппа (правило аддитивности): • Теплоемкость сложного вещества равна сумме теплоемкостей образующих его простых веществ.
 • • • Эл-т С H B O F Со. Р: 7, 53 9, 62 11, 3 16, 74 20, 92 Для остальных элементов СР = 25, 94 Дж/моль К Для большинства веществ СР измерены или вычислены и табулированы.
• • • Эл-т С H B O F Со. Р: 7, 53 9, 62 11, 3 16, 74 20, 92 Для остальных элементов СР = 25, 94 Дж/моль К Для большинства веществ СР измерены или вычислены и табулированы.
 Зависимость теплоемкости от температуры. Температурные ряды
Зависимость теплоемкости от температуры. Температурные ряды
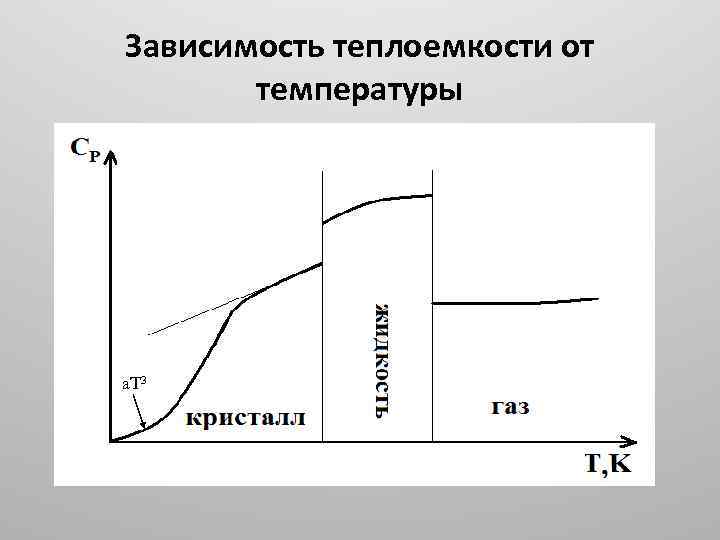
 • Теплоемкость веществ зависит от температуры. • Например, теплоемкость льда изменяется от 34. 70 Дж/моль К при 250 К до 37. 78 Дж/моль К при 273 К. • Для твердых тел Дебай вывел уравнение, которое для температур, близких к 0 К, дает: • СV= a T 3 (закон Т-кубов Дебая), • а для высоких: СV=3 R.
• Теплоемкость веществ зависит от температуры. • Например, теплоемкость льда изменяется от 34. 70 Дж/моль К при 250 К до 37. 78 Дж/моль К при 273 К. • Для твердых тел Дебай вывел уравнение, которое для температур, близких к 0 К, дает: • СV= a T 3 (закон Т-кубов Дебая), • а для высоких: СV=3 R.
 • Обычно зависимость теплоемкости от температуры передают с помощью эмпирических уравнений вида: где a, b и c - const, они приведены в справочниках физико-химических свойств веществ.
• Обычно зависимость теплоемкости от температуры передают с помощью эмпирических уравнений вида: где a, b и c - const, они приведены в справочниках физико-химических свойств веществ.
 Зависимость теплоемкости от температуры а. Т 3
Зависимость теплоемкости от температуры а. Т 3
 Уравнение (закон) Кирхгоффа
Уравнение (закон) Кирхгоффа
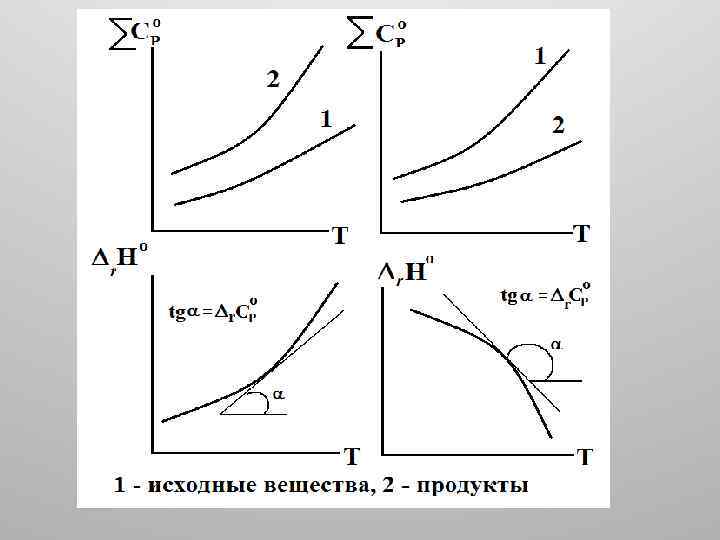
 • Для реакции: • a 1 A 1 + a 2 A 2 + =b 1 B 1 +b 2 B 2 + Изменение энтальпии равно: • r. Ho = bj. Ho(Bj) ai. Ho(Ai) • Продифференцируем полученное выражение:
• Для реакции: • a 1 A 1 + a 2 A 2 + =b 1 B 1 +b 2 B 2 + Изменение энтальпии равно: • r. Ho = bj. Ho(Bj) ai. Ho(Ai) • Продифференцируем полученное выражение:
 Учитывая, что: получаем:
Учитывая, что: получаем:
 • Здесь r. Со. Р – изменение стандартной теплоемкости системы при полном протекании реакции, равное разности сумм стандартных молярных теплоемкостей продуктов и исходных веществ с учетом их стехиометрических коэффициентов.
• Здесь r. Со. Р – изменение стандартной теплоемкости системы при полном протекании реакции, равное разности сумм стандартных молярных теплоемкостей продуктов и исходных веществ с учетом их стехиометрических коэффициентов.
 • Уравнение • называют законом Кирхгофа в дифференциальной форме
• Уравнение • называют законом Кирхгофа в дифференциальной форме
 Некоторые случаи зависимости теплового эффекта реакции от температуры
Некоторые случаи зависимости теплового эффекта реакции от температуры

 Зависимость теплового эффекта химической реакции от температуры при V = const
Зависимость теплового эффекта химической реакции от температуры при V = const
 • Таким же путем можно получить уравнения для процессов, протекающих при постоянном объеме: Окончательно :
• Таким же путем можно получить уравнения для процессов, протекающих при постоянном объеме: Окончательно :
 Интегрирование уравнения Кирхгоффа
Интегрирование уравнения Кирхгоффа
 • Интегрирование уравнения Кирхгофа от Т 1 до Т 2 дает: • Обычно Т 1 = 298 К:
• Интегрирование уравнения Кирхгофа от Т 1 до Т 2 дает: • Обычно Т 1 = 298 К:
 Варианты интегрирования
Варианты интегрирования
 1. Для оценочных расчетов r. Н 0 Т предполагают, что o = const, тогда: C Pi
1. Для оценочных расчетов r. Н 0 Т предполагают, что o = const, тогда: C Pi
 С учётом зависимости СР от температуры: CP = a + b. T + c. T 2 CP = a + b. T + c /T 2 результат интегрирования уравнения:
С учётом зависимости СР от температуры: CP = a + b. T + c. T 2 CP = a + b. T + c /T 2 результат интегрирования уравнения:
 Имеет вид:
Имеет вид:
 Здесь: уравнений:
Здесь: уравнений:
 • Если математическая зависимость r. СР от Т неизвестна, но имеются опытные значения теплоемкости участников реакции при различных температурах, то строят график в координатах • r. Сo. Р = f(T) и графически вычисляют площадь под кривой в пределах 298 – Т 2, она равна интегралу:
• Если математическая зависимость r. СР от Т неизвестна, но имеются опытные значения теплоемкости участников реакции при различных температурах, то строят график в координатах • r. Сo. Р = f(T) и графически вычисляют площадь под кривой в пределах 298 – Т 2, она равна интегралу:
 • Если в рассматриваемом температурном интервале происходит один или несколько фазовых переходов, то следует учитывать их тепловые эффекты при вычислении r. H:
• Если в рассматриваемом температурном интервале происходит один или несколько фазовых переходов, то следует учитывать их тепловые эффекты при вычислении r. H:
 • Схема вычислений r. Н реакций при произвольной температуре Т следующая. • Сначала по стандартным теплотам образования или теплотам сгорания веществ вычисляют r. Н 298 реакции (так, как это описано выше). • Далее по уравнению Кирхгоффа рассчитывают тепловой эффект при любой температуре Т:
• Схема вычислений r. Н реакций при произвольной температуре Т следующая. • Сначала по стандартным теплотам образования или теплотам сгорания веществ вычисляют r. Н 298 реакции (так, как это описано выше). • Далее по уравнению Кирхгоффа рассчитывают тепловой эффект при любой температуре Т:
![Вычисления тепловых эффектов через высокотемпературные составляющие [H(T) – H(0)] Вычисления тепловых эффектов через высокотемпературные составляющие [H(T) – H(0)]](https://present5.com/presentation/27815645_132244663/image-189.jpg) Вычисления тепловых эффектов через высокотемпературные составляющие [H(T) – H(0)]
Вычисления тепловых эффектов через высокотемпературные составляющие [H(T) – H(0)]
 • В таблицах практически для всех веществ приведены стандартные теплоты (энтальпии) образования f. Ho 0 при 0 К и величины: • [H(T) – H(0)] • при температуре Т (они даны с интервалом 100 К).
• В таблицах практически для всех веществ приведены стандартные теплоты (энтальпии) образования f. Ho 0 при 0 К и величины: • [H(T) – H(0)] • при температуре Т (они даны с интервалом 100 К).
 • Тепловой эффект химической реакции вычисляют по уравнению: • r. H 0 T = r. H 00 + [H 0 T – H 00]
• Тепловой эффект химической реакции вычисляют по уравнению: • r. H 0 T = r. H 00 + [H 0 T – H 00]
 • r. H 00 вычисляют также, как и r. H 0298 т. е. как разность сумм теплот образования продуктов и исходных веществ (но при 0 К):
• r. H 00 вычисляют также, как и r. H 0298 т. е. как разность сумм теплот образования продуктов и исходных веществ (но при 0 К):
![• Величины [H 0 T – H 00] вычисляют: • [H 0 T • Величины [H 0 T – H 00] вычисляют: • [H 0 T](https://present5.com/presentation/27815645_132244663/image-193.jpg) • Величины [H 0 T – H 00] вычисляют: • [H 0 T – H 00] = [H 0 T – H 00]прод • [H 0 T – H 00]исх. в-в • с учётом стехиометрических коэффициентов реакции.
• Величины [H 0 T – H 00] вычисляют: • [H 0 T – H 00] = [H 0 T – H 00]прод • [H 0 T – H 00]исх. в-в • с учётом стехиометрических коэффициентов реакции.


