1a80190559ea47024a129625ddc8472a.ppt
- Количество слайдов: 70

Физическая химия Красноярск 2009

УДК ББК 544(075) 24. 5 я 73 Ф 48 Авторы: Н. С. Кудряшева, Е. В. Немцева, В. А. Кратасюк, Е. Н. Есимбекова, Л. Г. Бондарева, В. А. Гавричков, Г. А. Выдрякова, И. В. Свидерская Электронный учебно-методический комплекс по дисциплине «Физическая химия» подготовлен в рамках реализации Программы развития федерального государственного образовательного учреждения высшего профессионального образования «Сибирский федеральный университет» (СФУ) на 2007– 2010 гг. Рецензенты: Красноярский краевой фонд науки; Экспертная комиссия СФУ по подготовке учебно-методических комплексов дисциплин Ф 48 Физическая химия. Презентационные материалы [Электронный ресурс] : наглядное пособие / Н. С. Кудряшева, Е. В. Немцева, В. А. Кратасюк, и др. – Электрон. дан. (3 Мб). – Красноярск : ИПК СФУ, 2009. – (Физическая химия : УМКД № 144 -2007 / рук. творч. коллектива Н. С. Кудряшева). – 1 электрон. опт. диск (DVD). – Систем. требования : Intel Pentium (или аналогичный процессор других производителей) 1 ГГц ; 512 Мб оперативной памяти ; 3 Мб свободного дискового пространства ; привод DVD ; операционная система Microsoft Windows XP SP 2 / Vista (32 бит) ; Microsoft Power. Point 2003 или выше. ISBN 978 -5 -7638 -1636 -5 (комплекса) ISBN 978 -5 -7638 -1637 -2 (пособия) Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320902460 (комплекса) Номер гос. регистрации в ФГУП НТЦ «Информрегистр» 0320902461 (пособия) Настоящее издание является частью электронного учебно-методического комплекса по дисциплине «Физическая химия» , включающего учебную программу дисциплины, учебное пособие, методические указания по самостоятельной работе, методические указания к семинарским занятиям, контрольноизмерительные материалы «Физическая химия. Банк тестовых заданий» . Электронные презентационные материалы в виде набора слайдов структурированы по темам и разделам теоретического курса. Являются независимым средством наглядного сопровождения изложения теоретического курса дисциплины. Оформление каждого слайда преследует краткое и гармоничное представление теоретических сведений и соответствует принципам эффективного восприятия информации с экранов. Использование в слайдах специальным образом оформленного набора текстовых и графических элементов позволяет доступно и кратко сформулировать сущность излагаемой информации. Интерактивное оглавление и набор гиперссылок в структуре презентационных материалов позволяют оперативно получить доступ к слайдам, относящимся к нужному разделу или теме. Предназначено для студентов направления подготовки специалистов 010700. 62 «Физика» укрупненной группы 010000 «Физико-математические науки и фундаментальная информатика» . © Сибирский федеральный университет, 2009 Рекомендовано к изданию Инновационно-методическим управлением СФУ Редактор Я. Н. Лысь Разработка и оформление электронного образовательного ресурса: Центр технологий электронного обучения Информационно-телекоммуникационного комплекса СФУ; лаборатория по разработке мультимедийных электронных образовательных ресурсов при Кр. ЦНИТ Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта запрещается. Встречающиеся названия программного обеспечения, изделий, устройств или систем могут являться зарегистрированными товарными знаками тех или иных фирм. Подп. к использованию 30. 11. 2009 Объем 3 Мб Красноярск: СФУ, 660041, Красноярск, пр. Свободный, 79

Оглавление 1. 2. 3. 4. 5. 6. 7. 8. Химическая термодинамика Понятие о фазовых равновесиях Химическое равновесие Термодинамика растворов Электрохимические процессы Кинетика химических реакций Коллоидные системы Библиографический список Физическая химия 3

Химическая термодинамика – наука, которая изучает Химическая термодинамика закономерности превращения энергии в химических и физико-химических процессах (химические реакции, фазовые переходы, растворение, кристаллизация, адсорбция и т. д. ) Химическая термодинамика: • количественно определяет тепловые эффекты различных процессов (химических реакций, растворения, плавления и т. п. ) • выясняет принципиальную возможность самопроизвольного течения химических реакций • определяет условия, при которых химические реакции могут находиться в состоянии равновесия Оглавление Химическая термодинамика 4

Классификация термодинамических систем 1. Если система не обменивается со средой ни энергией, ни веществом, то эта система называется изолированной В качестве примера можно привести жидкость в термосе 2. Система называется закрытой (замкнутой), если между ней закрытой и окружающей средой возможен обмен энергией в виде теплоты и/или работы, но не возможен обмен веществом. Пример – закрытый сосуд с веществом 3. Открытой является система, которая обменивается Открытой с окружающей средой и веществом и энергией. Примеры – живые организмы по отношению к окружающей среде, клетка по отношению ко всему организму в целом Оглавление Химическая термодинамика 5

В идеальном газе отсутствует взаимодействие между идеальном газе молекулами, а сами молекулы принимаются за материальные точки с нулевым объемом. Реальные газы подчиняются законам идеальных газов Реальные газы при низких давлениях и высоких температурах Оглавление Химическая термодинамика 6
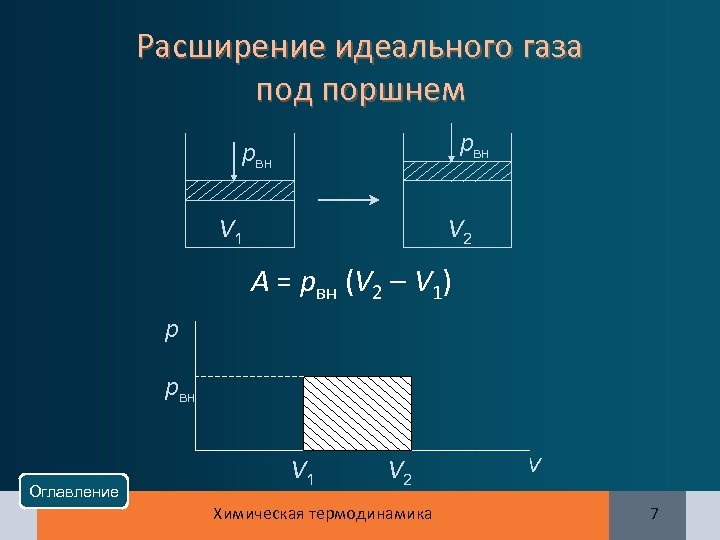
Расширение идеального газа под поршнем рвн V 2 V 1 А = рвн (V 2 – V 1) р рвн Оглавление V 1 V 2 Химическая термодинамика V 7

Первый закон термодинамики Формулировка 1 -го закона термодинамики Изменение внутренней энергии системы может происходить только в результате подвода (отвода) энергии из окружающей среды в форме теплоты или работы Математическое выражение 1 -го закона термодинамики: U = Q ± А Математическое выражение 1 -го закона термодинамики для бесконечно малых изменений в системе: d. U = Q ± A Оглавление Химическая термодинамика 8
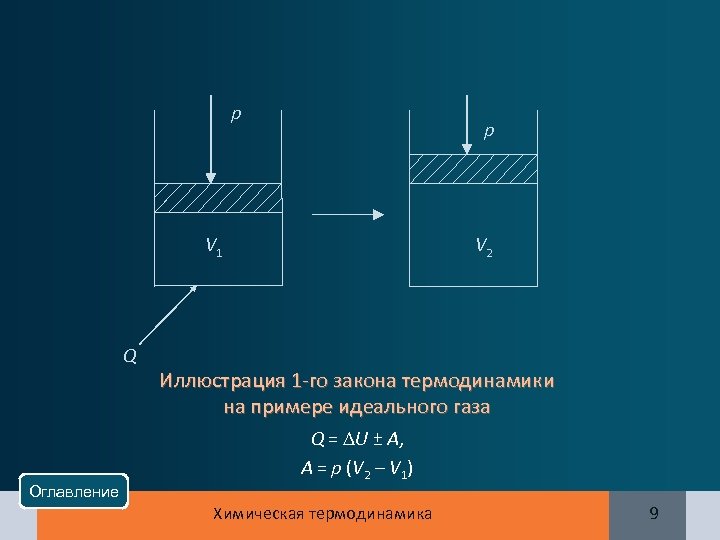
р р V 2 V 1 Q Иллюстрация 1 -го закона термодинамики на примере идеального газа Q = U ± А, А = р (V 2 – V 1) Оглавление Химическая термодинамика 9

Формулировка закона Гесса Тепловой эффект химической реакции определяется только природой и состоянием исходных веществ и продуктов и не зависит от промежуточных химических реакций, т. е. от способа перехода от исходного состояния к конечному Оглавление Химическая термодинамика 10
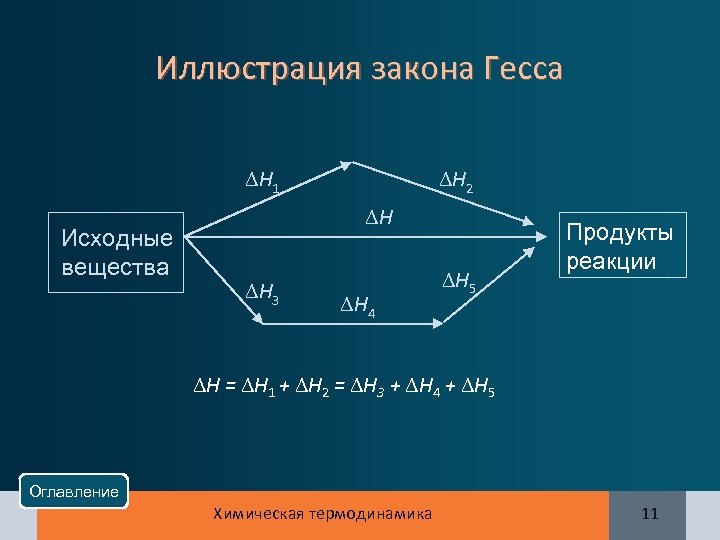
Иллюстрация закона Гесса Н 1 Исходные вещества Н 2 Н Н 3 Н 4 Н 5 Продукты реакции Н = Н 1 + Н 2 = Н 3 + Н 4 + Н 5 Оглавление Химическая термодинамика 11

Теплота (энтальпия) образования соединения Это количество теплоты, выделяемое или поглощаемое при образовании 1 моля этого соединения из простых веществ, находящихся в наиболее устойчивом состоянии при данных условиях. Например, теплота образования карбоната кальция равна тепловому эффекту реакции образования одного моля кристаллического карбоната кальция из металлического кальция, углерода в виде графита и газообразного кислорода: Са (кр) + С (графит) + 3/2 О 2 (г) = Са. СО 3 (кр) Оглавление Химическая термодинамика 12

1 -е следствие из закона Гесса Тепловой эффект реакции равен разности между теплотами (энтальпиями) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов: Оглавление Химическая термодинамика 13
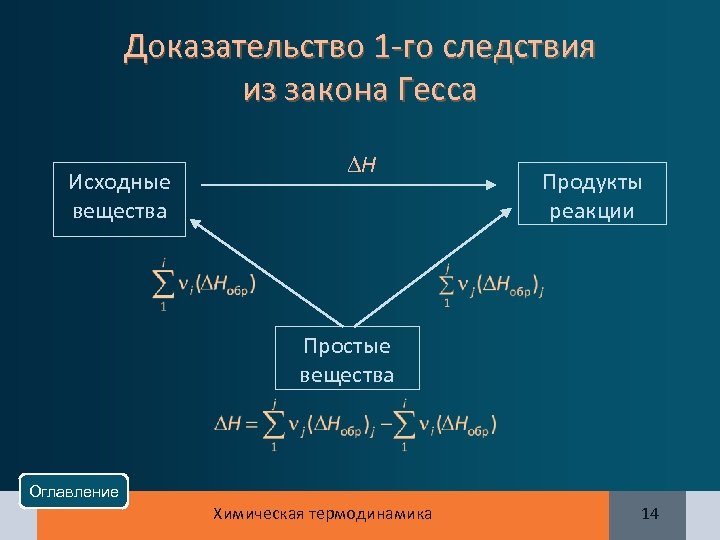
Доказательство 1 -го следствия из закона Гесса Исходные вещества Н Продукты реакции Простые вещества Оглавление Химическая термодинамика 14

Теплотой (энтальпией) сгорания соединения называется Теплотой (энтальпией) сгорания теплота, выделяющаяся при полном сгорании (т. е. до высших оксидов) одного моля вещества в кислороде. Для органических соединений это будет тепловой эффект полного сгорания одного моля данного соединения до диоксида углерода, воды и высших оксидов других элементов Например, теплота сгорания метилового спирта – это тепловой эффект следующей реакции: СН 3 ОН + 3/2 О 2 = СО 2 + 2 Н 2 О Оглавление Химическая термодинамика 15

2 -е следствие из закона Гесса Тепловой эффект химической реакции равен разности между Тепловой эффект химической реакции теплотами (энтальпиями) сгорания исходных веществ и продуктов с учетом стехиометрических коэффициентов: Оглавление Химическая термодинамика 16
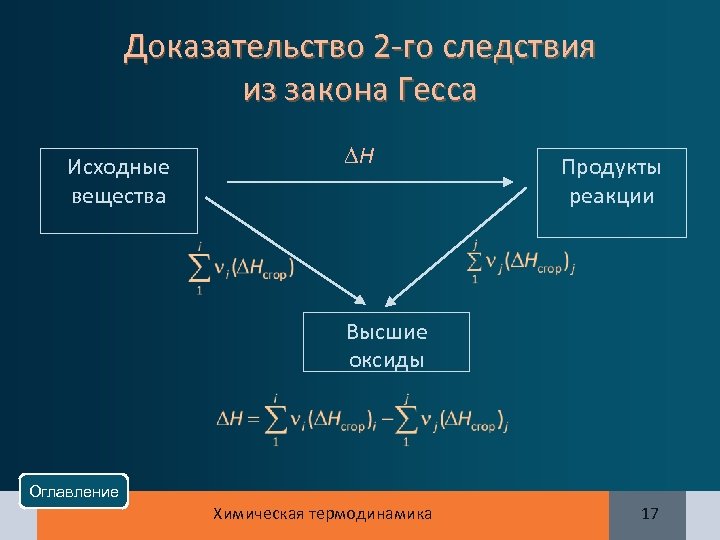
Доказательство 2 -го следствия из закона Гесса Исходные вещества Н Продукты реакции Высшие оксиды Оглавление Химическая термодинамика 17

Зависимость теплового эффекта реакции от температуры Уравнение Кирхгофа в дифференциальном виде: ( Н)/ T = ср, где ср = (c·ср(C) + d·ср(D)) − (a·ср(A) + b ср (B)) для реакции: a. A + b. В = c. C + d. D Оглавление Химическая термодинамика 18
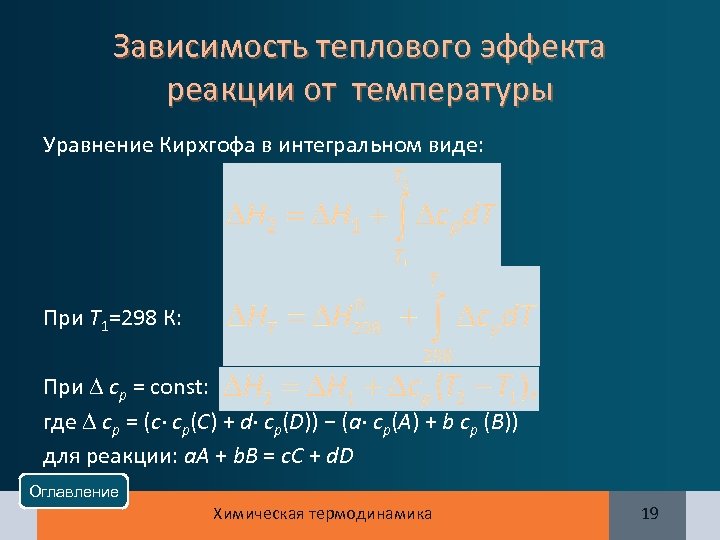
Зависимость теплового эффекта реакции от температуры Уравнение Кирхгофа в интегральном виде: При Т 1=298 К: При ср = const: где ср = (c· ср(C) + d· ср(D)) − (a· ср(A) + b ср (B)) для реакции: a. A + b. В = c. C + d. D Оглавление Химическая термодинамика 19

Второй закон термодинамики. Энтропия Существует такая термодинамическая функция, которая является функцией состояния и изменение которой для обратимого изотермического перехода теплоты равно приведенной теплоте процесса Энтропия – функция термодинамической вероятности Энтропия системы W: S = kln. W Оглавление Химическая термодинамика 20

Абсолютное значение энтропии. Постулат Планка (третий закон термодинамики) Энтропия совершенного кристалла при 0 К равна нулю. Расчет абсолютной энтропии твердого, жидкого и газообразного веществ: Оглавление Химическая термодинамика 21
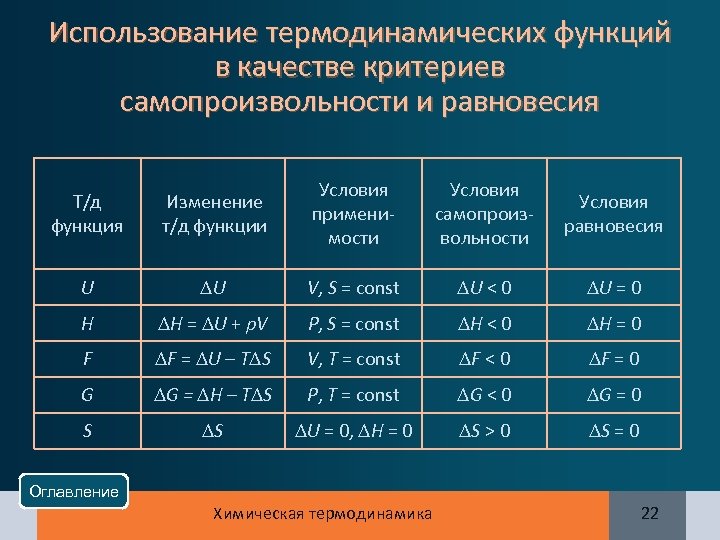
Использование термодинамических функций в качестве критериев самопроизвольности и равновесия Т/д функция Изменение т/д функции Условия применимости Условия cамопроизвольности Условия равновесия U U V, S = const U < 0 U = 0 H H = U + p. V P, S = const H < 0 H = 0 F F = U – T S V, T = const F < 0 F = 0 G G = H – T S P, T = const G < 0 G = 0 S S U = 0, H = 0 S > 0 S = 0 Оглавление Химическая термодинамика 22

Два способа расчета изменения энергии Гиббса в химических реакциях: Оглавление Химическая термодинамика 23

Расчет изменения энергии Гиббса в химических реакциях при температурах, отличающихся от стандартных: Оглавление Химическая термодинамика 24

Изотерма химической реакции (Уравнение Вант-Гоффа) Оглавление Химическая термодинамика 25

Правило фаз Гиббса Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов kн минус число фаз (Ф) плюс 2: С = kн – Ф + 2 Оглавление Химическая термодинамика 26
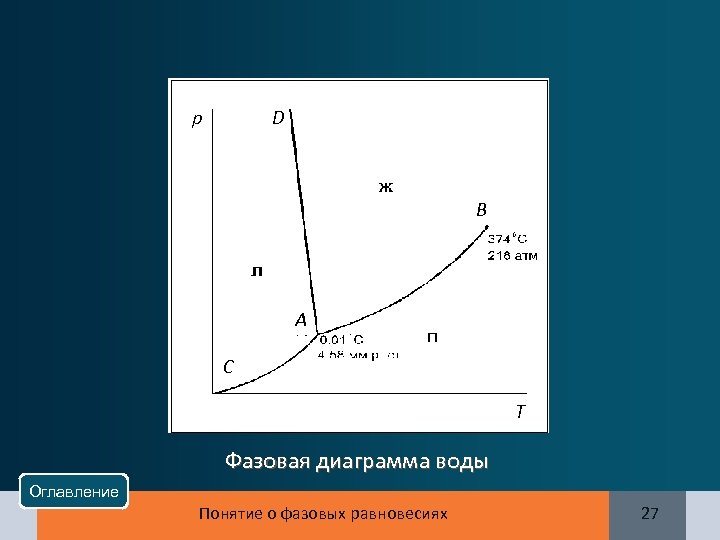
p D B A C T Фазовая диаграмма воды Оглавление Понятие о фазовых равновесиях 27
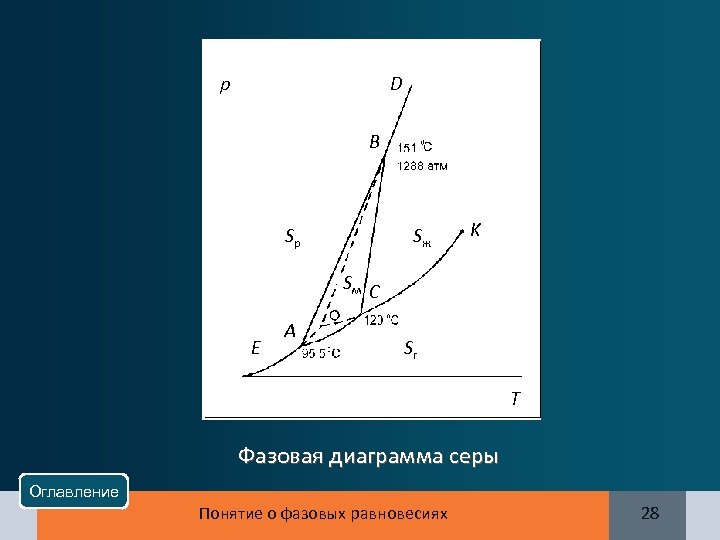
p D B Sр Sж K Sм C E A Sг T Фазовая диаграмма серы Оглавление Понятие о фазовых равновесиях 28

Уравнение Клаузиуса – Клапейрона Устанавливает зависимость температуры фазового перехода от давления: где Hфп – изменение энтальпии при фазовом переходе, Vфп – изменение мольного объема при переходе, Тфп – температура, при которой происходит переход Оглавление Понятие о фазовых равновесиях 29

Химическое равновесие Термодинамическим равновесием называется такое Термодинамическим равновесием состояние системы, характеристики которого (температура, давление, объем, концентрации) не изменяются во времени при постоянстве внешних условий. Химическое равновесие – частный случай Химическое равновесие термодинамического равновесия. При химическом равновесии концентрации всех реагирующих веществ не меняются во времени. При химическом равновесии скорость прямой и обратной реакций равны Оглавление Химическое равновесие 30

Закон действия масс. Константы равновесия Для реакции a. A + b. В = c. C + d. D Оглавление Химическое равновесие 31

Изотерма химической реакции (уравнение Вант-Гоффа) Оглавление Химическое равновесие 32

Зависимость константы равновесия от температуры Изобара химической реакции: Изохора химической реакции: Оглавление Химическое равновесие 33
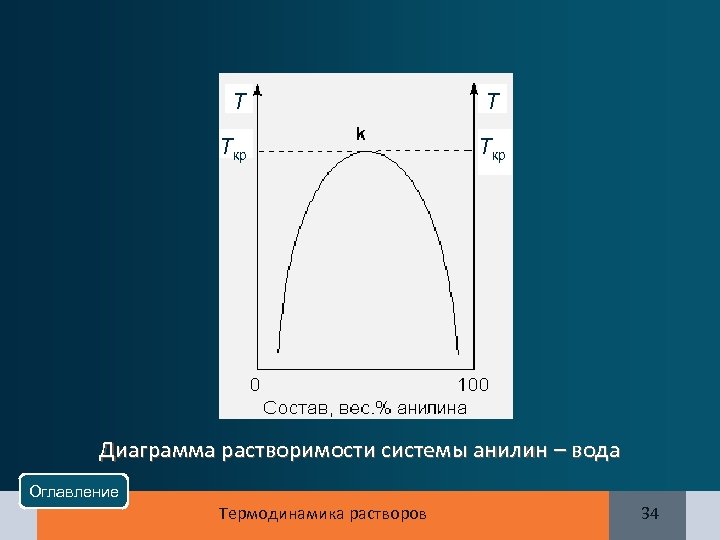
T T Tкр Диаграмма растворимости системы анилин – вода Оглавление Термодинамика растворов 34
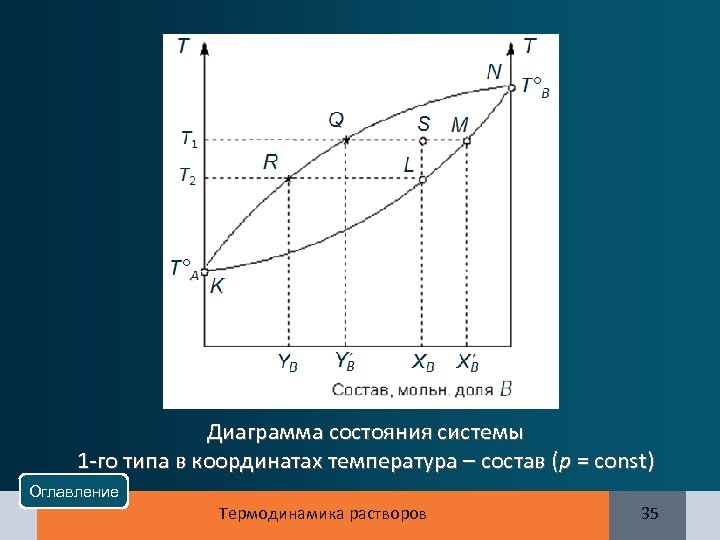
Диаграмма состояния системы 1 -го типа в координатах температура – состав (р = const) Оглавление Термодинамика растворов 35
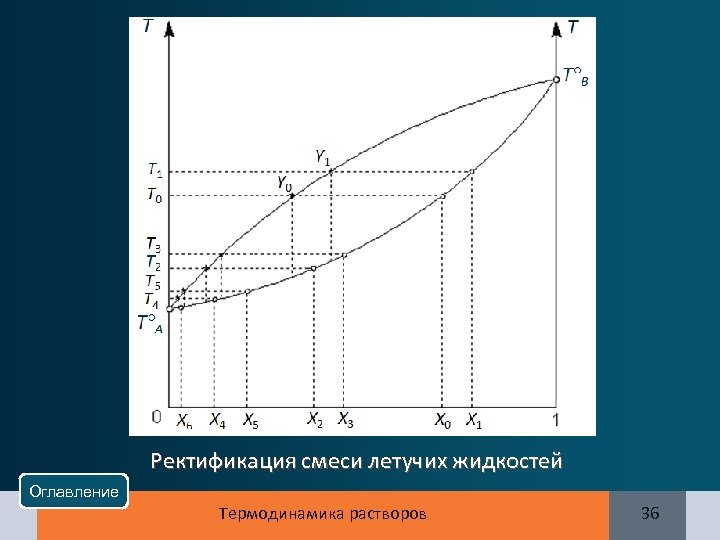
Ректификация смеси летучих жидкостей Оглавление Термодинамика растворов 36
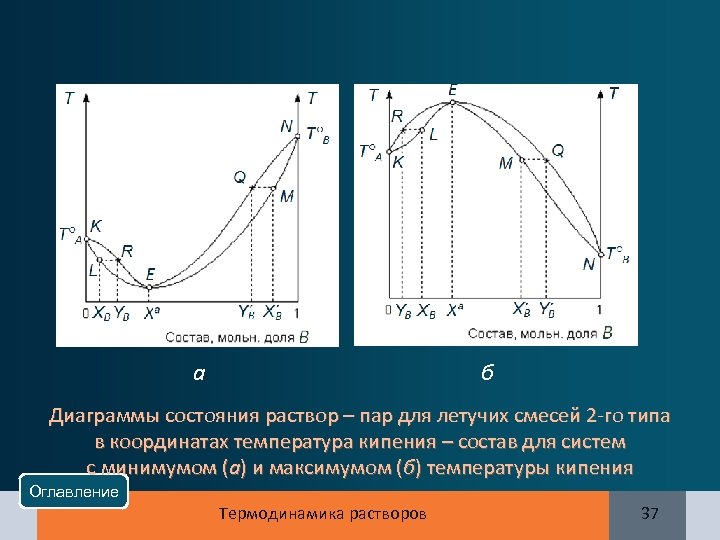
T°B а б Диаграммы состояния раствор – пар для летучих смесей 2 -го типа в координатах температура кипения – состав для систем с минимумом (а) и максимумом (б) температуры кипения Оглавление Термодинамика растворов 37

Р Р Р°B Р°А B (XB) Зависимость парциальных и общего давлений пара идеального раствора от концентрации раствора, Т = const Оглавление Термодинамика растворов 38
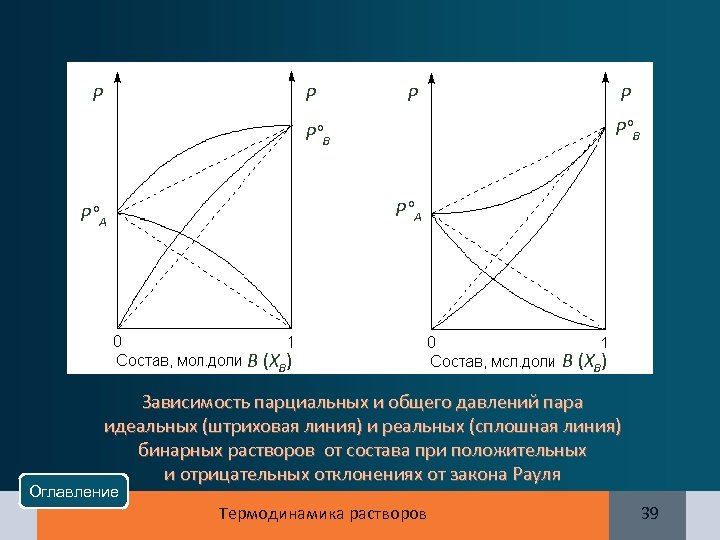
Р Р Р°B Р°А B (XB) Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных и отрицательных отклонениях от закона Рауля Оглавление Термодинамика растворов 39
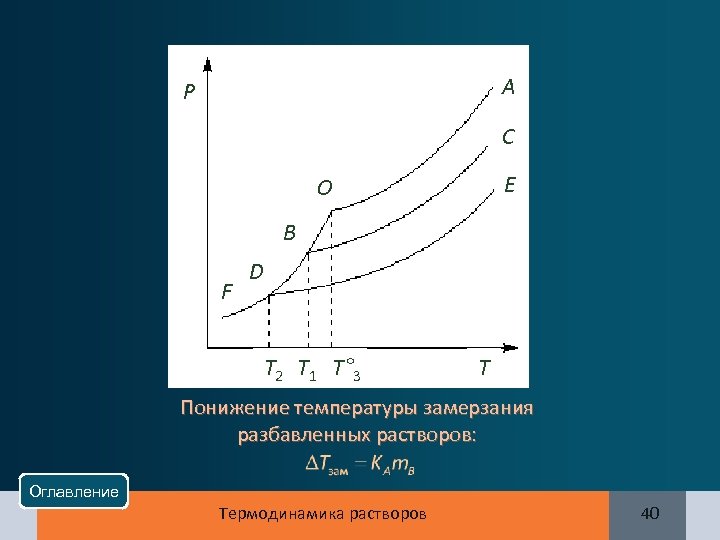
A Р C E O B F D T 2 T 1 T° 3 T Понижение температуры замерзания разбавленных растворов: Оглавление Термодинамика растворов 40
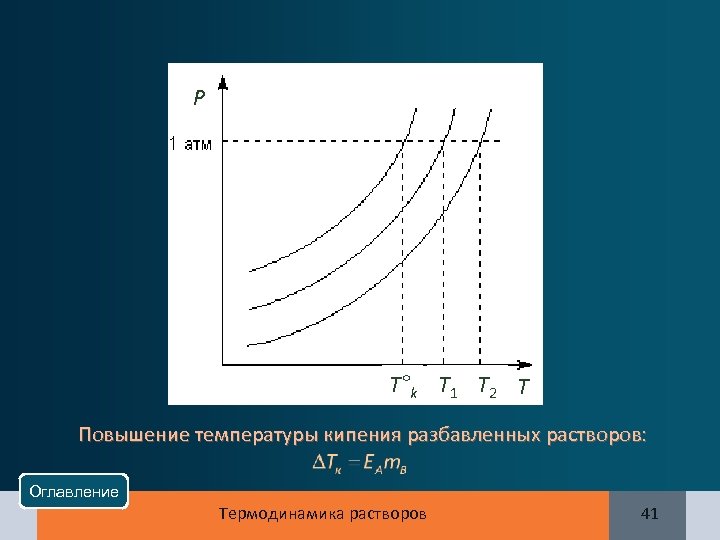
Р T°k T 1 T 2 T Повышение температуры кипения разбавленных растворов: Оглавление Термодинамика растворов 41
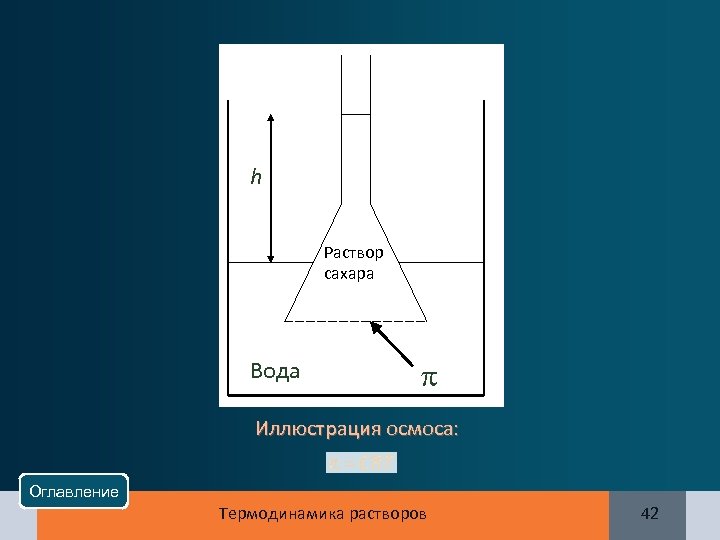
h Раствор сахара Вода Иллюстрация осмоса: Оглавление Термодинамика растворов 42

Растворы электролитов Степень диссоциации электролита в растворе: Константа диссоциации слабого электролита Аa. Вb: Аa. Вb = a. Аx– + b. Вy+; Оглавление Термодинамика растворов 43

Коллигативные свойства растворов зависят только от концентрации растворенных частиц и не зависят от их природы: 1) понижение давления пара: 2) повышение температуры кипения – эбулиоскопия: 3) понижение температуры замерзания – криоскопия: 4) осмотическое давление: Оглавление Термодинамика растворов 44

Электрохимические процессы Схема двойного электрического слоя на границе электрод – раствор Оглавление Электрохимические процессы 45

Гальванический элемент Zn / Zn 2+ // Cu 2+ / Cu Zn 0 ––> Zn 2+ + 2 е– (окисление) Сu 2+ + 2 е– ––> Сu 0 (восстановление) Сu 2+ + Zn 0 ––> Сu 0 + Zn 2+ Оглавление Электрохимические процессы 46

Уравнение Нернста Оглавление Электрохимические процессы 47

Скорость химической реакции – изменение концентрации Скорость химической реакции реагирующих веществ в единицу времени: C B A t Кинетические кривые для исходных веществ (А) и продуктов реакции (В) Оглавление Кинетика химических реакций 48
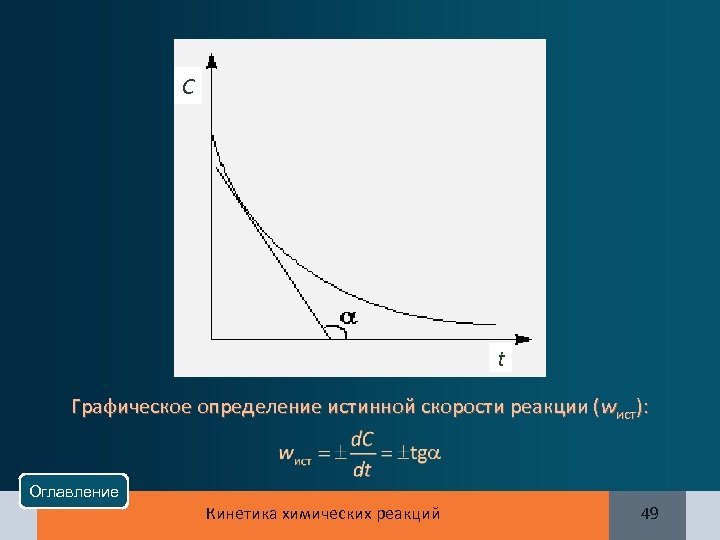
C t Графическое определение истинной скорости реакции (wист): Оглавление Кинетика химических реакций 49

Основной постулат химической кинетики (закон действия масс в химической кинетике) Скорость химической реакции прямо пропорциональна Скорость химической реакции произведению концентраций реагирующих веществ, взятых в некоторых степенях: а. А + b. В +. . . ––> продукты Порядок реакции – сумма показателей степени в этом Порядок реакции уравнении (n = x + y +. . ), k – константа скорости реакции Оглавление Кинетика химических реакций 50
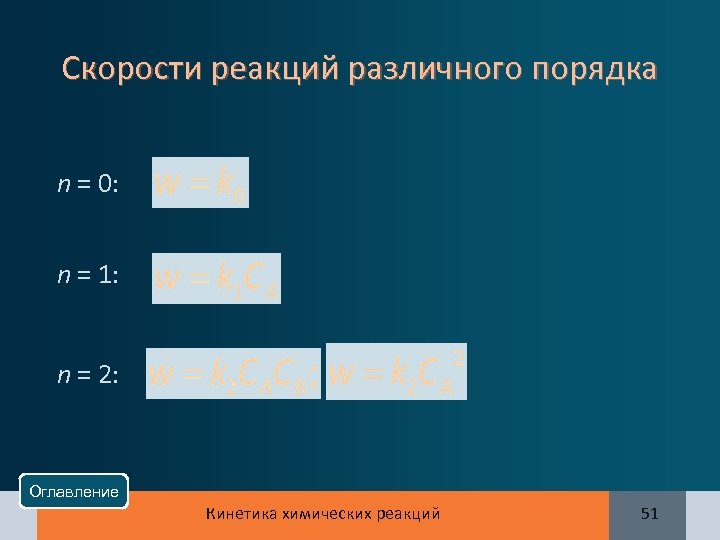
Скорости реакций различного порядка n = 0: n = 1: n = 2: Оглавление Кинетика химических реакций 51
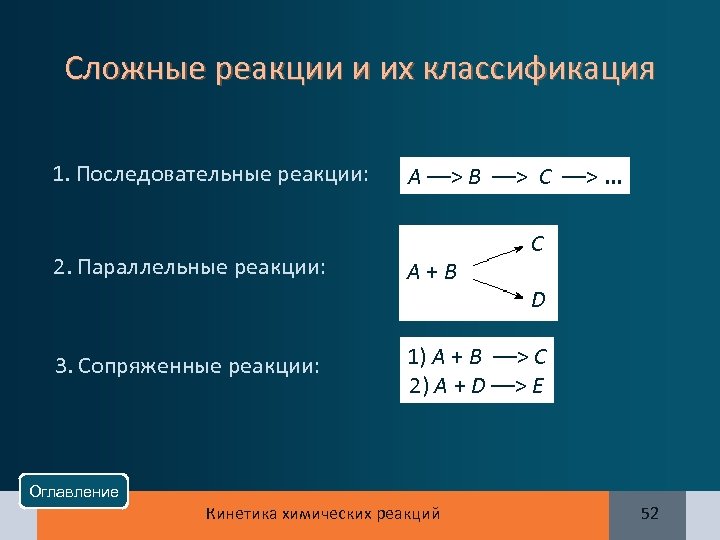
Сложные реакции и их классификация 1. Последовательные реакции: 2. Параллельные реакции: 3. Сопряженные реакции: А ––> В ––> С ––>. . . А + В С D 1) А + В ––> С 2) А + D ––> Е Оглавление Кинетика химических реакций 52

Сложные реакции и их классификация Цепные реакции состоят из ряда взаимосвязанных стадий. Цепные реакции Частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Стадии цепных реакций: 1. Зарождение цепи (инициация): Сl 2 + hν ––> 2 Сl • 2. Развитие цепи: Н 2 + Сl • ––> НСl + Н • + Сl 2 ––> НСl + Сl • 3. Обрыв цепи (рекомбинация): Н • + Н • ––> Н 2 Сl • + Сl • ––> Сl 2 Н • + Сl • ––> НСl Оглавление Кинетика химических реакций 53
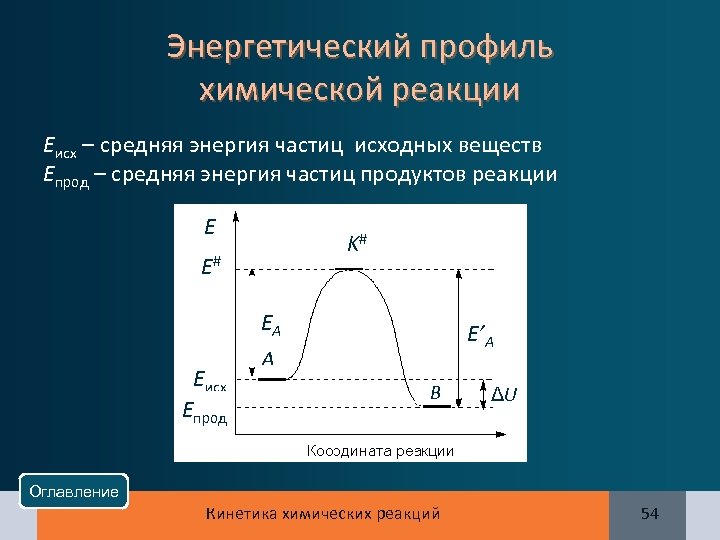
Энергетический профиль химической реакции Eисх – средняя энергия частиц исходных веществ Eпрод – средняя энергия частиц продуктов реакции E K# E# EA Eисх Eпрод E’A A B ΔU Оглавление Кинетика химических реакций 54

Распределение частиц по энергии NЕ/N – доля частиц, обладающих энергией E E 1 – средняя энергия частиц при температуре T 1 E 2 – средняя энергия частиц при температуре T 2 E 3 – средняя энергия частиц при температуре T 3 n. E (T 1 < T 2 <T 3) N E 1 E 2 E 3 E Оглавление Кинетика химических реакций 55
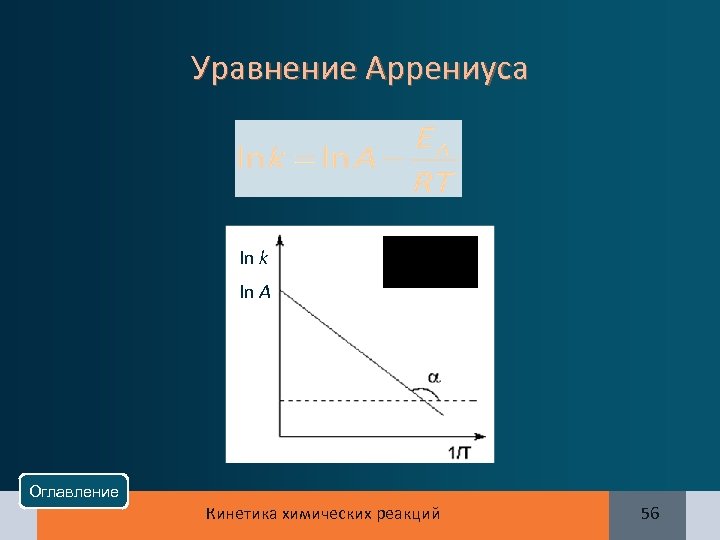
Уравнение Аррениуса In k In A Оглавление Кинетика химических реакций 56
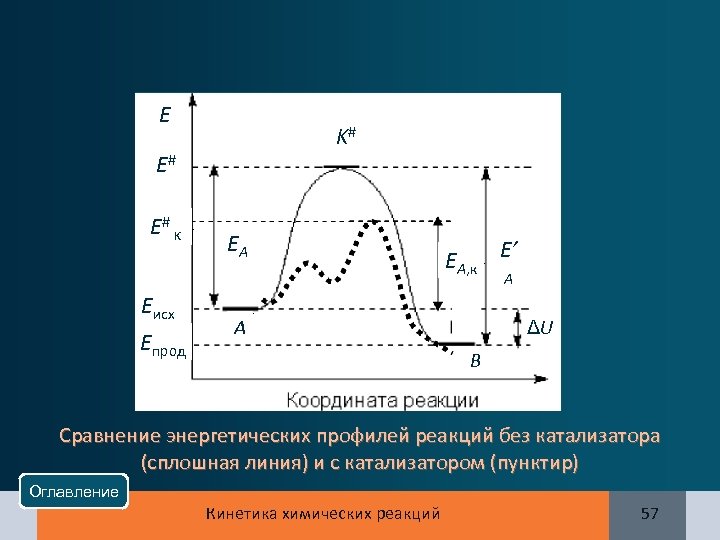
E K# E# E# к EA EA, к E’ A Eисх Eпрод A ΔU B Сравнение энергетических профилей реакций без катализатора (сплошная линия) и с катализатором (пунктир) Оглавление Кинетика химических реакций 57

E K# E# E# ф EA Eисх Eпрод A EA, ф Ea. ДС E’ A ΔU B Сравнение энергетических профилей некаталитического (сплошная) и ферментативного (пунктир) процессов Оглавление Кинетика химических реакций 58
![w wmax 0, 5 wma x KM [S] Зависимость скорости ферментативной реакции w от w wmax 0, 5 wma x KM [S] Зависимость скорости ферментативной реакции w от](https://present5.com/presentation/1a80190559ea47024a129625ddc8472a/image-59.jpg)
w wmax 0, 5 wma x KM [S] Зависимость скорости ферментативной реакции w от концентрации субстрата [S] Оглавление Кинетика химических реакций 59

Коллоидные системы Коллоидная химия – раздел физической химии, изучающий Коллоидная химия двух- или многофазные системы, в которых хотя бы одна из фаз находится в высокодисперсном состоянии Коллоидная химия – физхимия поверхностных явлений Коллоидная химия Дисперсность (S) – удельная поверхность дисперсной фазы: ) S = S 1, 2 /V, где S 1, 2 – площадь поверхности раздела между дисперсной фазой (1) и дисперсионной средой (2), V – объем дисперсной фазы Оглавление Коллоидные системы 60
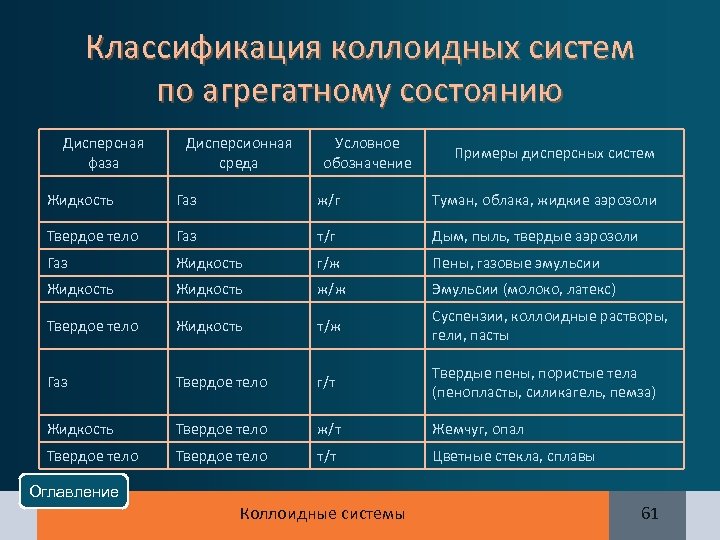
Классификация коллоидных систем по агрегатному состоянию Дисперсная фаза Дисперсионная среда Условное обозначение Примеры дисперсных систем Жидкость Газ ж/г Туман, облака, жидкие аэрозоли Твердое тело Газ т/г Дым, пыль, твердые аэрозоли Газ Жидкость г/ж Пены, газовые эмульсии Жидкость ж/ж Эмульсии (молоко, латекс) Твердое тело Жидкость т/ж Суспензии, коллоидные растворы, гели, пасты Газ Твердое тело г/т Твердые пены, пористые тела (пенопласты, силикагель, пемза) Жидкость Твердое тело ж/т Жемчуг, опал Твердое тело т/т Цветные стекла, сплавы Оглавление Коллоидные системы 61

Силы поверхностного натяжения F’ направлены от поверхности внутрь фазы перпендикулярно касательной к поверхности Поверхностное натяжение – сила F’, действующая на единицу длины поверхностного слоя: Оглавление Коллоидные системы 62

Поверхностное натяжение – избыток энергии на единицу площади раздела фаз. Представляет собой частные производные термодинамических потенциалов по площади раздела фаз S 1, 2: Поверхностное натяжение – работа W, необходимая для увеличения площади раздела фаз S 1, 2 на единицу: Оглавление Коллоидные системы 63

Адсорбция молекул ПАВ на поверхности воды при малых концентрациях ПАВ (а) и концентрациях, близких критической концентрации мицеллообразования (б) Оглавление Коллоидные системы 64
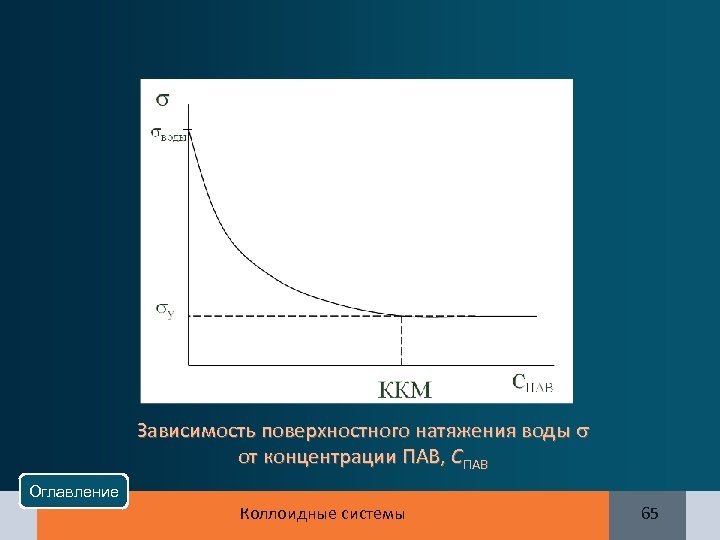
Зависимость поверхностного натяжения воды от концентрации ПАВ, СПАВ Оглавление Коллоидные системы 65
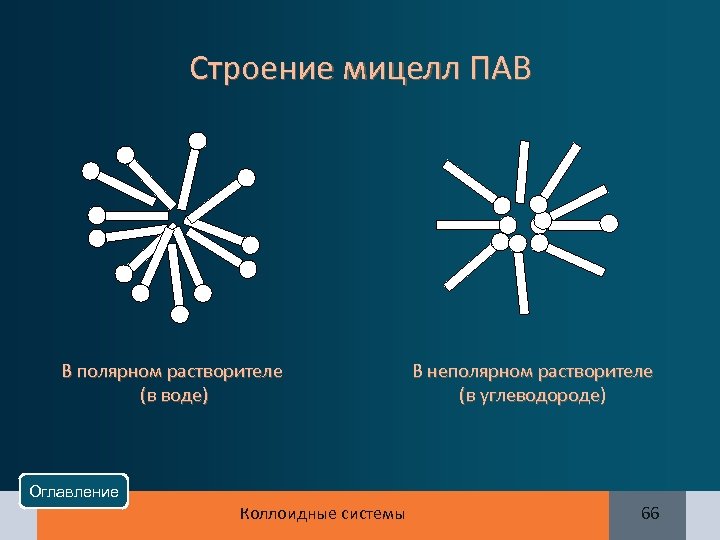
Строение мицелл ПАВ В полярном растворителе (в воде) В неполярном растворителе (в углеводороде) Оглавление Коллоидные системы 66

Особенности ПАВ 1. Способность понижать поверхностное и межфазное натяжение в очень разбавленных растворах вследствие адсорбции и ориентации молекул на поверхности раздела 2. Незначительная величина максимально возможной концентрации их в растворе в молекулярной форме 3. Образование мицелл выше критической концентрации мицеллообразования (ККМ) 4. Сольюбилизация (гидрофобное связывание) воднонерастворимых веществ внутри мицелл Оглавление Коллоидные системы 67
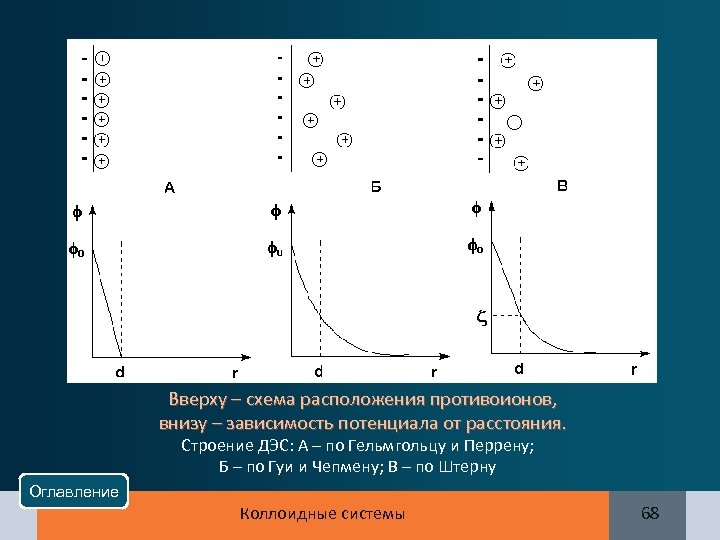
Вверху – схема расположения противоионов, внизу – зависимость потенциала от расстояния. Строение ДЭС: А – по Гельмгольцу и Перрену; Б – по Гуи и Чепмену; В – по Штерну Оглавление Коллоидные системы 68

Библиографический список 1. Горшков, В. И. Физическая химия / В. И. Горшков, И. А. Кузнецов. – М. : изд-во МГУ, 1986. – 264 с. 2. Левченков, С. И. Физическая и коллоидная химия [Электронный ресурс] / С. И. Левченков. – Режим доступа: http: //www. physchem. chimfak. rsu. ru/Source/Ph. Col_Lc. html. 3. Курс физической химии / под ред. Я. И. Герасимова. – М. : Химия, 1969. – Т. 1, 2. – 314 с. 4. Николаев, Л. А. Физическая химия / Л. А. Николаев. – М. : Высш. шк. , 1979. – 371 с. 5. Киреев, В. А. Курс физической химии / В. А. Киреев. – М. : Химия, 1975. – 775 с. Оглавление Физическая химия 69

Библиографический список 6. Чанг, О. Физическая химия с приложениями к биологическим системам / О. Чанг. – М. : Мир, 1980. – 662 с. 7. Кожевникова, О. В. Лекции по энзимологии : учебник для студентов четвертого курса факультета медицинской биотехнологии Уд. ГУ [Электронный ресурс] / О. В. Кожевникова. – 2003. – Режим доступа: http: //www. distedu. ru/edu 2/index. php 8. Кольман, Я. Наглядная биохимия [Электронный ресурс] / Я. Кольман, Рем К. -Г. , – М. : Мир, 2000. – Режим доступа : http: //yanko. lib. ru/books/biolog/nagl_biochem/index. htm 9. Захарченко, В. Н. Коллоидная химия / В. Н. Захарченко. – М. : Химия, 1985. – 300 с. 10. Коллоидная химия и химия высокомолекулярных соединений : методические указания / В. Н. Измайлова, В. С. Пшежецкий ; под ред. В. Н. Измайловой. – М. : изд-во МГУ, 1988. – 48 с. Оглавление Физическая химия 70
1a80190559ea47024a129625ddc8472a.ppt