Лекция физха.pptx
- Количество слайдов: 47
 Физическая Химия Константин Николаевич Михельсон к. 2058 +7 921 757 3632 Konstantin_Mikhelson@yahoo. com
Физическая Химия Константин Николаевич Михельсон к. 2058 +7 921 757 3632 Konstantin_Mikhelson@yahoo. com
 Особенности термодинамики ионных систем Полные потенциалы – потенциалы, которые включают все виды работы, совершаемой при перемещении массы компонента из одной части системы в другую Примеры: Гравитационно-химический потенциал. Пусть масса i-го компонента dni перемещается вдоль вертикальной оси (т. е. вдоль градиента поля тяготения) на расстояние (h”–h’). Изменение свободной энергии Гиббса составит d. G=(μi”- μi’)dni + Mig(h”-h’)dni. πi = μi + Migh (химическая + механическая работа) Mi – масса, соответствующая dni, g –ускорение свободного падения. Равновесие устанавливается при d. G=0, т. е. πi’= πi” или μi’+Migh’= μi”+Migh” Электрохимический потенциал. Пусть dni ионов сорта i перемещается по направлению, вдоль которого изменяется электрический потенциал: (ψ”- ψ’). Изменение свободной энергии Гиббса составит d. G = (μi”- μi’)dni + zi. F(ψ”- ψ’)dni. μ = μi+zi. Fψ (химическая и электрическая работа) I Равновесие устанавливается при d. G=0, т. е. или , т. е. 2
Особенности термодинамики ионных систем Полные потенциалы – потенциалы, которые включают все виды работы, совершаемой при перемещении массы компонента из одной части системы в другую Примеры: Гравитационно-химический потенциал. Пусть масса i-го компонента dni перемещается вдоль вертикальной оси (т. е. вдоль градиента поля тяготения) на расстояние (h”–h’). Изменение свободной энергии Гиббса составит d. G=(μi”- μi’)dni + Mig(h”-h’)dni. πi = μi + Migh (химическая + механическая работа) Mi – масса, соответствующая dni, g –ускорение свободного падения. Равновесие устанавливается при d. G=0, т. е. πi’= πi” или μi’+Migh’= μi”+Migh” Электрохимический потенциал. Пусть dni ионов сорта i перемещается по направлению, вдоль которого изменяется электрический потенциал: (ψ”- ψ’). Изменение свободной энергии Гиббса составит d. G = (μi”- μi’)dni + zi. F(ψ”- ψ’)dni. μ = μi+zi. Fψ (химическая и электрическая работа) I Равновесие устанавливается при d. G=0, т. е. или , т. е. 2
 Активность электролита, средние и ионные активности Электролит диссоциирует по схеме: Раствор: растворитель S и растворенный электролита E. Уравнение Гиббса-Дюгема: Но раствор состоит из растворителя и ионов. Для раствора в 1000 г растворителя можем записать: Моляльные концентрации ионов: Следовательно, т. е. или Стандартное состояние: Для электролита выбираем Const=1: Отсюда : Коэффициент активности электролита и ионные коэффициенты активности: 3
Активность электролита, средние и ионные активности Электролит диссоциирует по схеме: Раствор: растворитель S и растворенный электролита E. Уравнение Гиббса-Дюгема: Но раствор состоит из растворителя и ионов. Для раствора в 1000 г растворителя можем записать: Моляльные концентрации ионов: Следовательно, т. е. или Стандартное состояние: Для электролита выбираем Const=1: Отсюда : Коэффициент активности электролита и ионные коэффициенты активности: 3
 Активность, химический и электрохимический потенциалы Химический потенциал: Активность: Электрохимический потенциал: Приближения для расчета ионных активностей: Приближение Мак-Иннеса: Приближение Гуггенгейма: концентрации растворов одинаковы 4
Активность, химический и электрохимический потенциалы Химический потенциал: Активность: Электрохимический потенциал: Приближения для расчета ионных активностей: Приближение Мак-Иннеса: Приближение Гуггенгейма: концентрации растворов одинаковы 4
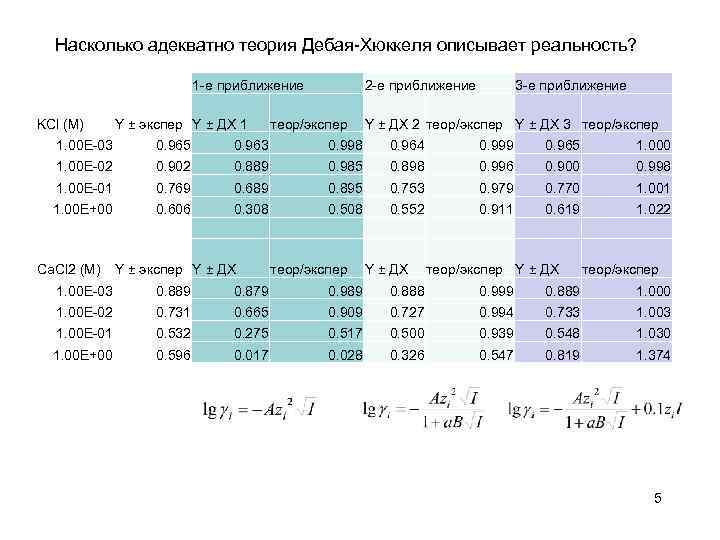 Насколько адекватно теория Дебая-Хюккеля описывает реальность? 1 -е приближение KCl (M) Υ ± экспер Υ ± ДХ 1 2 -е приближение теор/экспер 3 -е приближение Υ ± ДХ 2 теор/экспер Υ ± ДХ 3 теор/экспер 1. 00 E-03 0. 965 0. 963 0. 998 0. 964 0. 999 0. 965 1. 000 1. 00 E-02 0. 902 0. 889 0. 985 0. 898 0. 996 0. 900 0. 998 1. 00 E-01 0. 769 0. 689 0. 895 0. 753 0. 979 0. 770 1. 001 1. 00 E+00 0. 606 0. 308 0. 552 0. 911 0. 619 1. 022 Ca. Cl 2 (M) Υ ± экспер Υ ± ДХ теор/экспер 1. 00 E-03 0. 889 0. 879 0. 989 0. 888 0. 999 0. 889 1. 000 1. 00 E-02 0. 731 0. 665 0. 909 0. 727 0. 994 0. 733 1. 00 E-01 0. 532 0. 275 0. 517 0. 500 0. 939 0. 548 1. 030 1. 00 E+00 0. 596 0. 017 0. 028 0. 326 0. 547 0. 819 1. 374 5
Насколько адекватно теория Дебая-Хюккеля описывает реальность? 1 -е приближение KCl (M) Υ ± экспер Υ ± ДХ 1 2 -е приближение теор/экспер 3 -е приближение Υ ± ДХ 2 теор/экспер Υ ± ДХ 3 теор/экспер 1. 00 E-03 0. 965 0. 963 0. 998 0. 964 0. 999 0. 965 1. 000 1. 00 E-02 0. 902 0. 889 0. 985 0. 898 0. 996 0. 900 0. 998 1. 00 E-01 0. 769 0. 689 0. 895 0. 753 0. 979 0. 770 1. 001 1. 00 E+00 0. 606 0. 308 0. 552 0. 911 0. 619 1. 022 Ca. Cl 2 (M) Υ ± экспер Υ ± ДХ теор/экспер 1. 00 E-03 0. 889 0. 879 0. 989 0. 888 0. 999 0. 889 1. 000 1. 00 E-02 0. 731 0. 665 0. 909 0. 727 0. 994 0. 733 1. 00 E-01 0. 532 0. 275 0. 517 0. 500 0. 939 0. 548 1. 030 1. 00 E+00 0. 596 0. 017 0. 028 0. 326 0. 547 0. 819 1. 374 5
 Перенос электрического заряда в растворах электролитов Способы (виды) переноса: конвекция, диффузия, (электро)миграция Конвекция: перенос объема раствора, например – из-за перемешивания Диффузия: перенос электролита в объеме раствора под действием градиента химического потенциала Электромиграция: перенос электролита в объеме раствора под суммарным действием градиентов химического потенциала и внешнего электрического поля Сопротивление Электропроводность Удельная электропроводность: электропроводность объема материала (твердого или жидкого), заключенного в кубике с ребром 1 см, помещенном между двумя электродами большой площади Удельная электропроводность 1 см Вещество Серебро Алюминий Уголь Na. Cl (750 0 C) H 2 SO 4 30% KCl 1 M H 2 O κ (Ом-1 см-1) 6. 2· 105 3. 6· 105 2· 105 3. 4 0. 74 9. 8· 10 -2 5. 5· 10 -8 6
Перенос электрического заряда в растворах электролитов Способы (виды) переноса: конвекция, диффузия, (электро)миграция Конвекция: перенос объема раствора, например – из-за перемешивания Диффузия: перенос электролита в объеме раствора под действием градиента химического потенциала Электромиграция: перенос электролита в объеме раствора под суммарным действием градиентов химического потенциала и внешнего электрического поля Сопротивление Электропроводность Удельная электропроводность: электропроводность объема материала (твердого или жидкого), заключенного в кубике с ребром 1 см, помещенном между двумя электродами большой площади Удельная электропроводность 1 см Вещество Серебро Алюминий Уголь Na. Cl (750 0 C) H 2 SO 4 30% KCl 1 M H 2 O κ (Ом-1 см-1) 6. 2· 105 3. 6· 105 2· 105 3. 4 0. 74 9. 8· 10 -2 5. 5· 10 -8 6
 Основное понятие, применяемое при описании процессов переноса вещества, теплоты, электрического заряда, и т. д. – плотность потока. Вектор! Плотность потока частиц сорта i: число частиц этого сорта, пересекающих площадку единичной площади, расположенную перпендикулярно направлению движения частиц, за 1 единицу времени Ji – поток частиц сорта i, двигающихся со скоростью Vi относительно системы отсчета, которая движется со скоростью Vref Кристаллы: система отсчета – кристаллическая решетка Растворы: разные системы отсчета Характеристическая система Гитторфа: Vref – средняя скорость движения частиц растворителя Поток в системе Гитторфа Характеристическая система Фика: Vr = W – средняя скорость движения всего объема раствора, в котором происходит перенос. Удобство системы Фика: если нет конвекции, т. е. раствор покоится относительно наблюдателя, то Vref = W = 0 Ci – концентрация, vi – парциальный молярный объем частиц сорта i Поток в системе Фика 7
Основное понятие, применяемое при описании процессов переноса вещества, теплоты, электрического заряда, и т. д. – плотность потока. Вектор! Плотность потока частиц сорта i: число частиц этого сорта, пересекающих площадку единичной площади, расположенную перпендикулярно направлению движения частиц, за 1 единицу времени Ji – поток частиц сорта i, двигающихся со скоростью Vi относительно системы отсчета, которая движется со скоростью Vref Кристаллы: система отсчета – кристаллическая решетка Растворы: разные системы отсчета Характеристическая система Гитторфа: Vref – средняя скорость движения частиц растворителя Поток в системе Гитторфа Характеристическая система Фика: Vr = W – средняя скорость движения всего объема раствора, в котором происходит перенос. Удобство системы Фика: если нет конвекции, т. е. раствор покоится относительно наблюдателя, то Vref = W = 0 Ci – концентрация, vi – парциальный молярный объем частиц сорта i Поток в системе Фика 7
 Речь идет о движении только вдоль оси x, символ вектора в дальнейшем не применяем + Катод Анод x Плотность электрического тока: Плотность электрического тока не зависит от выбора характеристической системы отсчета! Число переноса ионов сорта i В разбавленных растворах числа переноса по Гитторфу и по Фику совпадают, но в концентрированных могут заметно различаться В любой системе отсчета 8
Речь идет о движении только вдоль оси x, символ вектора в дальнейшем не применяем + Катод Анод x Плотность электрического тока: Плотность электрического тока не зависит от выбора характеристической системы отсчета! Число переноса ионов сорта i В разбавленных растворах числа переноса по Гитторфу и по Фику совпадают, но в концентрированных могут заметно различаться В любой системе отсчета 8
 Подвижность иона Пусть система однородна (нет градиентов) даже по оси x. Тогда никакого направленного переноса не будет, только хаотичное тепловое движение частиц x Наложим внешнее электрическое поле с напряженностью На частицы действует постоянная ускоряющая сила напряженности электрического поля, и тормозящая сила трения , пропорциональная , пропорциональная скорости движения частицы относительно тормозящей среды в текущий момент времени t. В некий момент времени t = τ достигнутая частицей скорость порождает такую тормозящую силу, которая компенсирует действие ускоряющей: Начиная с этого момента t = τ частица движется с постоянной скоростью Vi – Vsolv = Vi, τ – Vsolv = ui - электрическая подвижность иона IZi Тогда для парциальной плотности тока и общей плотности тока получим и 9
Подвижность иона Пусть система однородна (нет градиентов) даже по оси x. Тогда никакого направленного переноса не будет, только хаотичное тепловое движение частиц x Наложим внешнее электрическое поле с напряженностью На частицы действует постоянная ускоряющая сила напряженности электрического поля, и тормозящая сила трения , пропорциональная , пропорциональная скорости движения частицы относительно тормозящей среды в текущий момент времени t. В некий момент времени t = τ достигнутая частицей скорость порождает такую тормозящую силу, которая компенсирует действие ускоряющей: Начиная с этого момента t = τ частица движется с постоянной скоростью Vi – Vsolv = Vi, τ – Vsolv = ui - электрическая подвижность иона IZi Тогда для парциальной плотности тока и общей плотности тока получим и 9
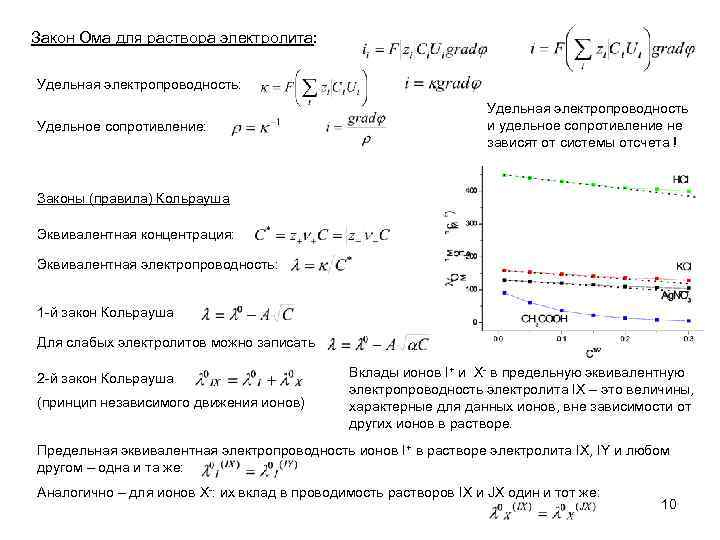 Закон Ома для раствора электролита: Удельная электропроводность: Удельное сопротивление: Удельная электропроводность и удельное сопротивление не зависят от системы отсчета ! Законы (правила) Кольрауша Эквивалентная концентрация: Эквивалентная электропроводность: 1 -й закон Кольрауша Для слабых электролитов можно записать 2 -й закон Кольрауша (принцип независимого движения ионов) Вклады ионов I+ и X- в предельную эквивалентную электропроводность электролита IX – это величины, характерные для данных ионов, вне зависимости от других ионов в растворе. Предельная эквивалентная электропроводность ионов I+ в растворе электролита IX, IY и любом другом – одна и та же: Аналогично – для ионов X-: их вклад в проводимость растворов IX и JX один и тот же: 10
Закон Ома для раствора электролита: Удельная электропроводность: Удельное сопротивление: Удельная электропроводность и удельное сопротивление не зависят от системы отсчета ! Законы (правила) Кольрауша Эквивалентная концентрация: Эквивалентная электропроводность: 1 -й закон Кольрауша Для слабых электролитов можно записать 2 -й закон Кольрауша (принцип независимого движения ионов) Вклады ионов I+ и X- в предельную эквивалентную электропроводность электролита IX – это величины, характерные для данных ионов, вне зависимости от других ионов в растворе. Предельная эквивалентная электропроводность ионов I+ в растворе электролита IX, IY и любом другом – одна и та же: Аналогично – для ионов X-: их вклад в проводимость растворов IX и JX один и тот же: 10
 Причины зависимости молярной электропроводности от концентрации Электрофоретический (катафоретический) эффект Движение иона в электрическом поле порождает движение той части жидкости, которая непосредственно прилегает к иону. Это характерное явление, оно наблюдается для жидкости в тонких капиллярах, кроме того - для коллоидных частиц. Такое явление называется электрофорезом. Аналогичное явление имеет место и при движении ионов в объеме раствора электролита. + Ион замедляет свое движение на величину скорости движения ионной атмосферы, которую можно оценить как Учитывая, что , получим 11
Причины зависимости молярной электропроводности от концентрации Электрофоретический (катафоретический) эффект Движение иона в электрическом поле порождает движение той части жидкости, которая непосредственно прилегает к иону. Это характерное явление, оно наблюдается для жидкости в тонких капиллярах, кроме того - для коллоидных частиц. Такое явление называется электрофорезом. Аналогичное явление имеет место и при движении ионов в объеме раствора электролита. + Ион замедляет свое движение на величину скорости движения ионной атмосферы, которую можно оценить как Учитывая, что , получим 11
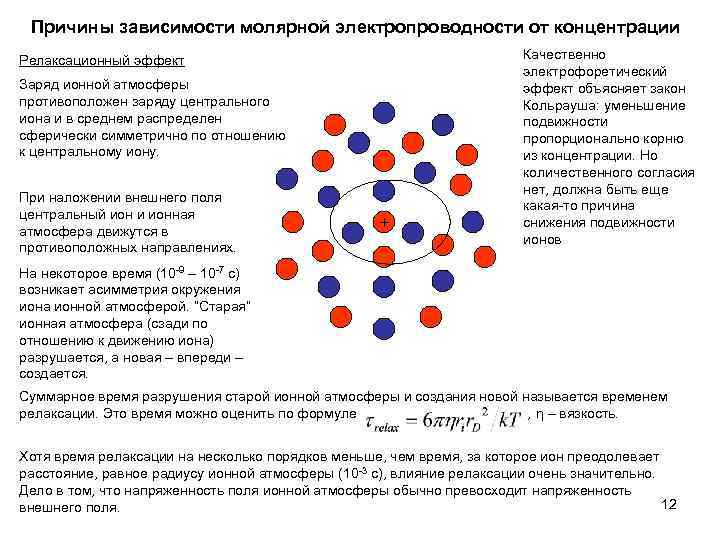 Причины зависимости молярной электропроводности от концентрации Релаксационный эффект Заряд ионной атмосферы противоположен заряду центрального иона и в среднем распределен сферически симметрично по отношению к центральному иону. При наложении внешнего поля центральный ион и ионная атмосфера движутся в противоположных направлениях. + Качественно электрофоретический эффект объясняет закон Кольрауша: уменьшение подвижности пропорционально корню из концентрации. Но количественного согласия нет, должна быть еще какая-то причина снижения подвижности ионов На некоторое время (10 -9 – 10 -7 с) возникает асимметрия окружения иона ионной атмосферой. “Старая” ионная атмосфера (сзади по отношению к движению иона) разрушается, а новая – впереди – создается. Суммарное время разрушения старой ионной атмосферы и создания новой называется временем релаксации. Это время можно оценить по формуле , η – вязкость. Хотя время релаксации на несколько порядков меньше, чем время, за которое ион преодолевает расстояние, равное радиусу ионной атмосферы (10 -3 с), влияние релаксации очень значительно. Дело в том, что напряженность поля ионной атмосферы обычно превосходит напряженность 12 внешнего поля.
Причины зависимости молярной электропроводности от концентрации Релаксационный эффект Заряд ионной атмосферы противоположен заряду центрального иона и в среднем распределен сферически симметрично по отношению к центральному иону. При наложении внешнего поля центральный ион и ионная атмосфера движутся в противоположных направлениях. + Качественно электрофоретический эффект объясняет закон Кольрауша: уменьшение подвижности пропорционально корню из концентрации. Но количественного согласия нет, должна быть еще какая-то причина снижения подвижности ионов На некоторое время (10 -9 – 10 -7 с) возникает асимметрия окружения иона ионной атмосферой. “Старая” ионная атмосфера (сзади по отношению к движению иона) разрушается, а новая – впереди – создается. Суммарное время разрушения старой ионной атмосферы и создания новой называется временем релаксации. Это время можно оценить по формуле , η – вязкость. Хотя время релаксации на несколько порядков меньше, чем время, за которое ион преодолевает расстояние, равное радиусу ионной атмосферы (10 -3 с), влияние релаксации очень значительно. Дело в том, что напряженность поля ионной атмосферы обычно превосходит напряженность 12 внешнего поля.
 Теория электропроводности Онзагера Теория Онзагера учитывает межионные электростатические взаимодействия примерно также, как они учтены в теории Дебая-Хюккеля, а потоки всех частиц описываются с помощью уравнений гидродинамики. Учитывается, что в результате электрофоретического эффекта подвижность иона уменьшается (по сравнению с величиной в предельно разбавленном растворе) Кроме того, на внешнее поле Eex накладывается релаксационное поле ΔE: В сильно разбавленном растворе одного электролита IX: где , В результате Онзагер получил для эквивалентной электропроводности выражение: Если и , то получим закон Кольрауша: 13
Теория электропроводности Онзагера Теория Онзагера учитывает межионные электростатические взаимодействия примерно также, как они учтены в теории Дебая-Хюккеля, а потоки всех частиц описываются с помощью уравнений гидродинамики. Учитывается, что в результате электрофоретического эффекта подвижность иона уменьшается (по сравнению с величиной в предельно разбавленном растворе) Кроме того, на внешнее поле Eex накладывается релаксационное поле ΔE: В сильно разбавленном растворе одного электролита IX: где , В результате Онзагер получил для эквивалентной электропроводности выражение: Если и , то получим закон Кольрауша: 13
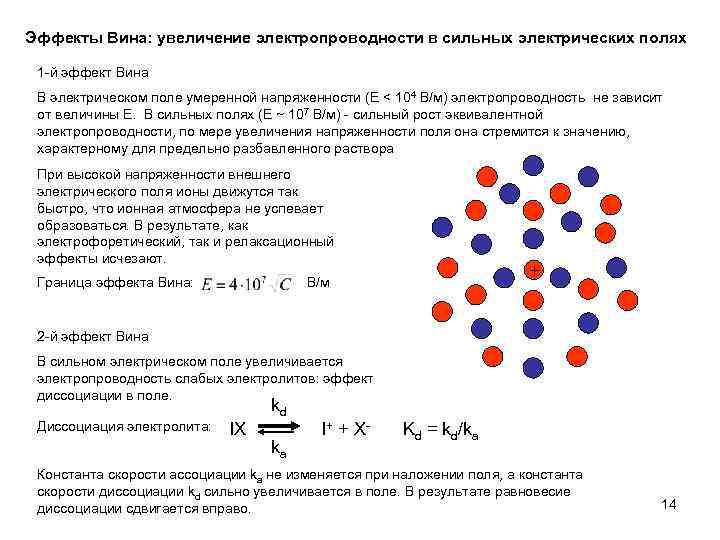 Эффекты Вина: увеличение электропроводности в сильных электрических полях 1 -й эффект Вина В электрическом поле умеренной напряженности (E < 104 В/м) электропроводность не зависит от величины E. В сильных полях (E ~ 107 В/м) - сильный рост эквивалентной электропроводности, по мере увеличения напряженности поля она стремится к значению, характерному для предельно разбавленного раствора При высокой напряженности внешнего электрического поля ионы движутся так быстро, что ионная атмосфера не успевает образоваться. В результате, как электрофоретический, так и релаксационный эффекты исчезают. Граница эффекта Вина: + В/м 2 -й эффект Вина В сильном электрическом поле увеличивается электропроводность слабых электролитов: эффект диссоциации в поле. kd Диссоциация электролита: IX ka I + + X- Kd = kd/ka Константа скорости ассоциации ka не изменяется при наложении поля, а константа скорости диссоциации kd сильно увеличивается в поле. В результате равновесие диссоциации сдвигается вправо. 14
Эффекты Вина: увеличение электропроводности в сильных электрических полях 1 -й эффект Вина В электрическом поле умеренной напряженности (E < 104 В/м) электропроводность не зависит от величины E. В сильных полях (E ~ 107 В/м) - сильный рост эквивалентной электропроводности, по мере увеличения напряженности поля она стремится к значению, характерному для предельно разбавленного раствора При высокой напряженности внешнего электрического поля ионы движутся так быстро, что ионная атмосфера не успевает образоваться. В результате, как электрофоретический, так и релаксационный эффекты исчезают. Граница эффекта Вина: + В/м 2 -й эффект Вина В сильном электрическом поле увеличивается электропроводность слабых электролитов: эффект диссоциации в поле. kd Диссоциация электролита: IX ka I + + X- Kd = kd/ka Константа скорости ассоциации ka не изменяется при наложении поля, а константа скорости диссоциации kd сильно увеличивается в поле. В результате равновесие диссоциации сдвигается вправо. 14
 Эффект Дебая-Фалькенгагена: увеличение электропроводности в переменном электрическом поле Исходя из идеи ионной атмосферы, Дебай и Фалькенгаген предсказали, что эффект асимметрии (релаксационный эффект) должен исчезнуть, если вместо постоянного электрического поля приложить переменное поле высокой частоты. + Действительно, при частотах порядка 1 МГц, когда период колебаний поля соизмерим со временем релаксации наблюдается заметное увеличение электропроводности Даже малые (и периодические) колебания ионов вызывают колебания их сольватных оболочек. Поэтому электрофоретический эффект сохраняется также и в переменном электрическом поле В переменном поле исчезает только релаксационный эффект, а электрофоретический остается, поэтому эквивалентная электропроводность в переменном поле не достигает значений, характерных для предельно разбавленных растворов 15
Эффект Дебая-Фалькенгагена: увеличение электропроводности в переменном электрическом поле Исходя из идеи ионной атмосферы, Дебай и Фалькенгаген предсказали, что эффект асимметрии (релаксационный эффект) должен исчезнуть, если вместо постоянного электрического поля приложить переменное поле высокой частоты. + Действительно, при частотах порядка 1 МГц, когда период колебаний поля соизмерим со временем релаксации наблюдается заметное увеличение электропроводности Даже малые (и периодические) колебания ионов вызывают колебания их сольватных оболочек. Поэтому электрофоретический эффект сохраняется также и в переменном электрическом поле В переменном поле исчезает только релаксационный эффект, а электрофоретический остается, поэтому эквивалентная электропроводность в переменном поле не достигает значений, характерных для предельно разбавленных растворов 15
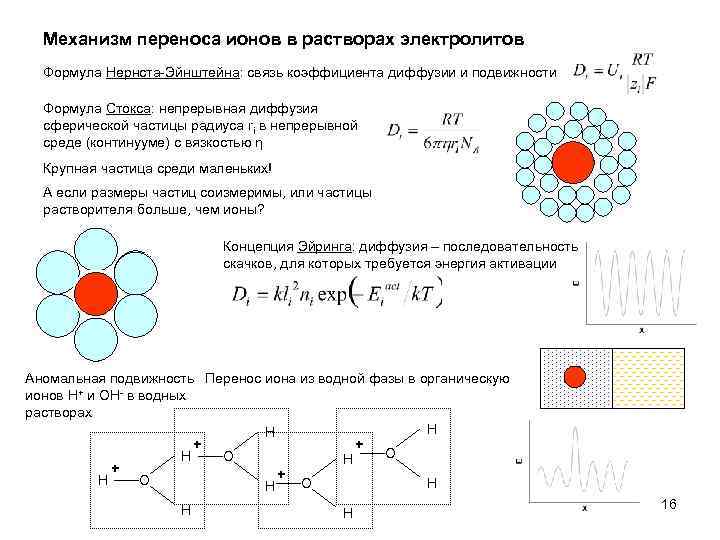 Механизм переноса ионов в растворах электролитов Формула Нернста-Эйнштейна: связь коэффициента диффузии и подвижности Формула Стокса: непрерывная диффузия сферической частицы радиуса ri в непрерывной среде (континууме) с вязкостью η Крупная частица среди маленьких! А если размеры частиц соизмеримы, или частицы растворителя больше, чем ионы? Концепция Эйринга: диффузия – последовательность скачков, для которых требуется энергия активации Аномальная подвижность Перенос иона из водной фазы в органическую ионов H+ и OH- в водных растворах H H + + O H + + H O O H H 16
Механизм переноса ионов в растворах электролитов Формула Нернста-Эйнштейна: связь коэффициента диффузии и подвижности Формула Стокса: непрерывная диффузия сферической частицы радиуса ri в непрерывной среде (континууме) с вязкостью η Крупная частица среди маленьких! А если размеры частиц соизмеримы, или частицы растворителя больше, чем ионы? Концепция Эйринга: диффузия – последовательность скачков, для которых требуется энергия активации Аномальная подвижность Перенос иона из водной фазы в органическую ионов H+ и OH- в водных растворах H H + + O H + + H O O H H 16
 Кислотность водных и неводных растворов Шкала p. H для водных растворов Ag│Ag. Cl, буфер, KCl (m) │H 2, Pt Буфер Фталатный Фосфатный Боратный Д-Х 4. 002 6. 858 9. 177 γ± 4. 011 6. 873 9. 180 Используют ГЯ без жидкостного соединения, чтобы избежать трудностей с диффузионным потенциалом Измеряют э. д. с. при разных значениях m. Cl и экстраполируют на m. Cl = 0 (γCl = 1). По ходу построения, γCl вычисляют по теории Дебая. Хюккеля или принимают γCl = γ±KCl Построить шкалу p. H водных растворов удается только путем внесения внетермодинамических допущений. Но результаты внесения различных допущений оказываются очень близкими друг к другу Шкала p. H для неводных растворов (? ) 1 aq 1 1 org aq 2 2 aq 2 org Построить единую согласованную шкалу p. H для разных растворителей не удается ! 17
Кислотность водных и неводных растворов Шкала p. H для водных растворов Ag│Ag. Cl, буфер, KCl (m) │H 2, Pt Буфер Фталатный Фосфатный Боратный Д-Х 4. 002 6. 858 9. 177 γ± 4. 011 6. 873 9. 180 Используют ГЯ без жидкостного соединения, чтобы избежать трудностей с диффузионным потенциалом Измеряют э. д. с. при разных значениях m. Cl и экстраполируют на m. Cl = 0 (γCl = 1). По ходу построения, γCl вычисляют по теории Дебая. Хюккеля или принимают γCl = γ±KCl Построить шкалу p. H водных растворов удается только путем внесения внетермодинамических допущений. Но результаты внесения различных допущений оказываются очень близкими друг к другу Шкала p. H для неводных растворов (? ) 1 aq 1 1 org aq 2 2 aq 2 org Построить единую согласованную шкалу p. H для разных растворителей не удается ! 17
 Функции кислотности Аррениус: кислота (HA) – вещество, которое в водном растворе отщепляет ион водорода основание (BOH) –вещество, которое в водном растворе отщепляет ион гидроксила HA ↔ H+ + ABOH ↔ B+ + OHБренстед: кислота (A, BH) – это вещество, способное отщеплять протон, основание (B) – это вещество, способное присоединять протон Az. A ↔ H+ + Bz. A-1 + H+ ↔ Az. A HCl ↔ H+ + Cl. NH 3 + H+ ↔ NH 4+ Важно: необходимы 2 протолитические системы, например A 1 + B 2 ↔ B 1 + A 2 Льюис: кислота (A) – это вещество, способное быть акцептором электронов, основание (B) – это вещество, способное быть донором электронов. Сам ион H+ - кислота Льюиса, реакции – это вытеснение одного основания другим: AB 1 + B 2 ↔ AB 2 + B 1 По Льюису для реакции необходимы 2 основания. Гаммет: для сопоставления кислотности растворов в разных растворителях можно использовать цветные индикаторы (B, BH), концентрации которых малы, поэтому внесение индикатора не влияет на кислотность раствора. Функция кислотности Гаммета (нитроанилины, B, BH+) Считается, что γB/γBH = Const для всех индикаторов во всех растворителях. Для этого химическая структура индикаторов д. б. близкой, а концентрации - маленькими Для индикаторов типа CH ↔ C- + H+ Для индикаторов типа DH 2+ ↔ D+ + H+ 18
Функции кислотности Аррениус: кислота (HA) – вещество, которое в водном растворе отщепляет ион водорода основание (BOH) –вещество, которое в водном растворе отщепляет ион гидроксила HA ↔ H+ + ABOH ↔ B+ + OHБренстед: кислота (A, BH) – это вещество, способное отщеплять протон, основание (B) – это вещество, способное присоединять протон Az. A ↔ H+ + Bz. A-1 + H+ ↔ Az. A HCl ↔ H+ + Cl. NH 3 + H+ ↔ NH 4+ Важно: необходимы 2 протолитические системы, например A 1 + B 2 ↔ B 1 + A 2 Льюис: кислота (A) – это вещество, способное быть акцептором электронов, основание (B) – это вещество, способное быть донором электронов. Сам ион H+ - кислота Льюиса, реакции – это вытеснение одного основания другим: AB 1 + B 2 ↔ AB 2 + B 1 По Льюису для реакции необходимы 2 основания. Гаммет: для сопоставления кислотности растворов в разных растворителях можно использовать цветные индикаторы (B, BH), концентрации которых малы, поэтому внесение индикатора не влияет на кислотность раствора. Функция кислотности Гаммета (нитроанилины, B, BH+) Считается, что γB/γBH = Const для всех индикаторов во всех растворителях. Для этого химическая структура индикаторов д. б. близкой, а концентрации - маленькими Для индикаторов типа CH ↔ C- + H+ Для индикаторов типа DH 2+ ↔ D+ + H+ 18
 Расплавы солей В расплавах в значительной мере сохраняется квазикристаллический порядок чередования ионов различных знаков – как в кристаллической решетке. Но в силу высокой температуры ионы в расплавах имеют высокую кинетическую энергию. Поэтому можно предполагать высокую степень диссоциации в расплавах. Вместе с тем, электропроводность их не так велика, как можно было бы ожидать при такой концентрации зарядов в единице объема и высокой степени диссоциации. Электропроводность расплавов обусловлена дефектами структуры, которых намного больше, чем в твердых солях. Сложные закономерности чисел переноса Удельная электропроводность Вещество Серебро Na. Cl (750 0 C) Li. F (905 0 C) Al. Cl 3 (200 0 C) H 2 SO 4 30% KCl 1 M H 2 O KCl – Mg. Cl 2 (1: 1) κ (Ом-1 см-1) 6. 2· 105 3. 4 20. 3 5. 6· 10 -8 0. 74 9. 8· 10 -2 5. 5· 10 -8 t. K = 0. 7, t. Mg = 0. 14, t. Cl = 0. 16 KCl – Mg. Cl 2 (2: 1) t. K = 0. 8, t. Mg = 0. 0, t. Cl = 0. 20 Расплавные источники тока Анод: металлический Li, Ca (!) Катод: Ca. Cr. O 4, Cu. O, Fe 2 O 3, WO 3 V ~ 3 В, i ~ 103 A/м 2 (!) Li. Cl - KCl 10 – 15 лет хранения в холодном виде 19
Расплавы солей В расплавах в значительной мере сохраняется квазикристаллический порядок чередования ионов различных знаков – как в кристаллической решетке. Но в силу высокой температуры ионы в расплавах имеют высокую кинетическую энергию. Поэтому можно предполагать высокую степень диссоциации в расплавах. Вместе с тем, электропроводность их не так велика, как можно было бы ожидать при такой концентрации зарядов в единице объема и высокой степени диссоциации. Электропроводность расплавов обусловлена дефектами структуры, которых намного больше, чем в твердых солях. Сложные закономерности чисел переноса Удельная электропроводность Вещество Серебро Na. Cl (750 0 C) Li. F (905 0 C) Al. Cl 3 (200 0 C) H 2 SO 4 30% KCl 1 M H 2 O KCl – Mg. Cl 2 (1: 1) κ (Ом-1 см-1) 6. 2· 105 3. 4 20. 3 5. 6· 10 -8 0. 74 9. 8· 10 -2 5. 5· 10 -8 t. K = 0. 7, t. Mg = 0. 14, t. Cl = 0. 16 KCl – Mg. Cl 2 (2: 1) t. K = 0. 8, t. Mg = 0. 0, t. Cl = 0. 20 Расплавные источники тока Анод: металлический Li, Ca (!) Катод: Ca. Cr. O 4, Cu. O, Fe 2 O 3, WO 3 V ~ 3 В, i ~ 103 A/м 2 (!) Li. Cl - KCl 10 – 15 лет хранения в холодном виде 19
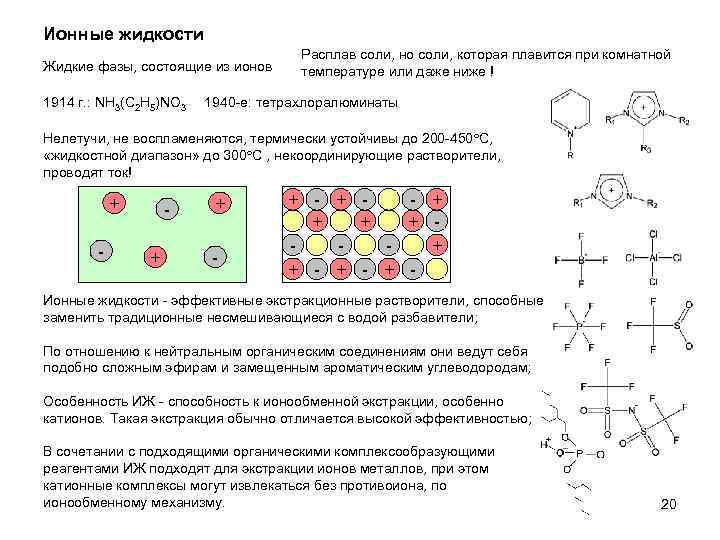 Ионные жидкости Жидкие фазы, состоящие из ионов 1914 г. : NH 3(C 2 H 5)NO 3 Расплав соли, но соли, которая плавится при комнатной температуре или даже ниже ! 1940 -e: тетрахлоралюминаты Нелетучи, не воспламеняются, термически устойчивы до 200 -450 С, «жидкостной диапазон» до 300 С , некоординирующие растворители, проводят ток! + - + - + + + + - + - Ионные жидкости - эффективные экстракционные растворители, способные заменить традиционные несмешивающиеся с водой разбавители; По отношению к нейтральным органическим соединениям они ведут себя подобно сложным эфирам и замещенным ароматическим углеводородам; Особенность ИЖ - способность к ионообменной экстракции, особенно катионов. Такая экстракция обычно отличается высокой эффективностью; В сочетании с подходящими органическими комплексообразующими реагентами ИЖ подходят для экстракции ионов металлов, при этом катионные комплексы могут извлекаться без противоиона, по ионообменному механизму. 20
Ионные жидкости Жидкие фазы, состоящие из ионов 1914 г. : NH 3(C 2 H 5)NO 3 Расплав соли, но соли, которая плавится при комнатной температуре или даже ниже ! 1940 -e: тетрахлоралюминаты Нелетучи, не воспламеняются, термически устойчивы до 200 -450 С, «жидкостной диапазон» до 300 С , некоординирующие растворители, проводят ток! + - + - + + + + - + - Ионные жидкости - эффективные экстракционные растворители, способные заменить традиционные несмешивающиеся с водой разбавители; По отношению к нейтральным органическим соединениям они ведут себя подобно сложным эфирам и замещенным ароматическим углеводородам; Особенность ИЖ - способность к ионообменной экстракции, особенно катионов. Такая экстракция обычно отличается высокой эффективностью; В сочетании с подходящими органическими комплексообразующими реагентами ИЖ подходят для экстракции ионов металлов, при этом катионные комплексы могут извлекаться без противоиона, по ионообменному механизму. 20
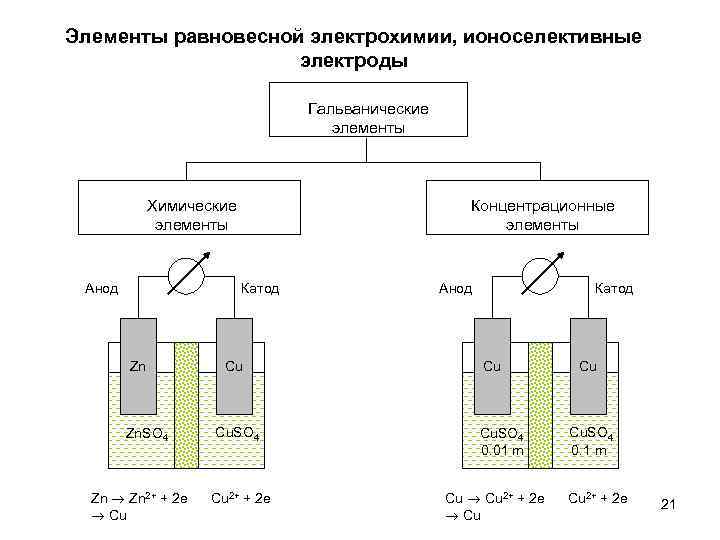 Элементы равновесной электрохимии, ионоселективные электроды Гальванические элементы Химические элементы Анод Концентрационные элементы Катод Zn Zn. SO 4 Zn 2+ + 2 e Cu Cu Cu. SO 4 Cu 2+ + 2 e Анод Катод Cu Cu. SO 4 0. 01 m Cu 2+ + 2 e Cu Cu Cu. SO 4 0. 1 m Cu 2+ + 2 e 21
Элементы равновесной электрохимии, ионоселективные электроды Гальванические элементы Химические элементы Анод Концентрационные элементы Катод Zn Zn. SO 4 Zn 2+ + 2 e Cu Cu Cu. SO 4 Cu 2+ + 2 e Анод Катод Cu Cu. SO 4 0. 01 m Cu 2+ + 2 e Cu Cu Cu. SO 4 0. 1 m Cu 2+ + 2 e 21
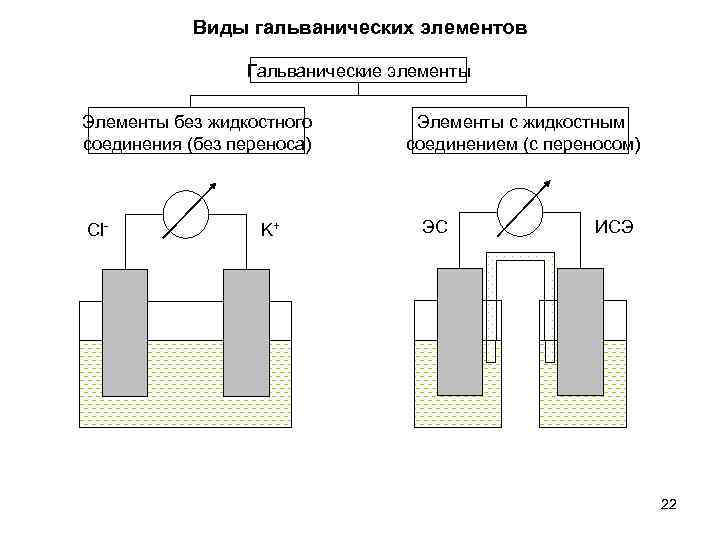 Виды гальванических элементов Гальванические элементы Элементы без жидкостного соединения (без переноса) Cl- K+ Элементы с жидкостным соединением (с переносом) ЭС ИСЭ 22
Виды гальванических элементов Гальванические элементы Элементы без жидкостного соединения (без переноса) Cl- K+ Элементы с жидкостным соединением (с переносом) ЭС ИСЭ 22
 Элементы без жидкостного соединения (без переноса) Cl- K+ Чистый KCl: a. K=CKCl K a. Cl=CCl Cl =CKCl Cl a KCl=(a. K a. Cl)1/2 = (CKCl K CKCl Cl )1/2= CKCl Пример E 0=200 м. В, S=118 м. В/дек 0. 01 m KCl: Смешанный раствор KCl+Na. Cl: a. K=CKCl K a. Cl=CCl Cl=(CKCl +CNa. Cl) Cl a KCl=(a. K a. Cl)1/2 = (CKCl +CNa. Cl))1/2 KCl a KCl=0. 01 0. 91=0. 0091 E=-40. 8 м. В 0. 01 m KCl + 0. 1 m Na. Cl a KCl= (0. 01+0. 1))1/2 KCl=0. 033 0. 79=0. 026 E=13. 0 м. В Ошибка определения концентрации ионов калия в 2. 9 раза! 23
Элементы без жидкостного соединения (без переноса) Cl- K+ Чистый KCl: a. K=CKCl K a. Cl=CCl Cl =CKCl Cl a KCl=(a. K a. Cl)1/2 = (CKCl K CKCl Cl )1/2= CKCl Пример E 0=200 м. В, S=118 м. В/дек 0. 01 m KCl: Смешанный раствор KCl+Na. Cl: a. K=CKCl K a. Cl=CCl Cl=(CKCl +CNa. Cl) Cl a KCl=(a. K a. Cl)1/2 = (CKCl +CNa. Cl))1/2 KCl a KCl=0. 01 0. 91=0. 0091 E=-40. 8 м. В 0. 01 m KCl + 0. 1 m Na. Cl a KCl= (0. 01+0. 1))1/2 KCl=0. 033 0. 79=0. 026 E=13. 0 м. В Ошибка определения концентрации ионов калия в 2. 9 раза! 23
 Элементы с жидкостным соединением (с переносом) ЭС ИСЭ Проблема диффузионного потенциала (потенциала жидкостного соединения! 24
Элементы с жидкостным соединением (с переносом) ЭС ИСЭ Проблема диффузионного потенциала (потенциала жидкостного соединения! 24
 Э. д. с. элемента с жидкостным соединением Cl. ИСЭ left K+ ИСЭ right Э. д. с. элемента с жидкостным соединением может быть выражена через термодинамически-определенные параметры Уравнение Гендерсона: Диффузионный слой Каким электролитом заполняют электролитические ключи? KCl, Li. CCl 3 COO, NH 4 NO 3 Концентрация электролита: 1 моль/л и выше 25
Э. д. с. элемента с жидкостным соединением Cl. ИСЭ left K+ ИСЭ right Э. д. с. элемента с жидкостным соединением может быть выражена через термодинамически-определенные параметры Уравнение Гендерсона: Диффузионный слой Каким электролитом заполняют электролитические ключи? KCl, Li. CCl 3 COO, NH 4 NO 3 Концентрация электролита: 1 моль/л и выше 25
 Электроды 1 -го рода Кусок активного металла M в растворе соли этого металла MX: Cu/Cu. Cl 2, Zn/Zn. SO Активный металл: атомы металла принимают участие в электродном процессе Ag Ag(NO)3 Э. д. с. lga. Ag 26
Электроды 1 -го рода Кусок активного металла M в растворе соли этого металла MX: Cu/Cu. Cl 2, Zn/Zn. SO Активный металл: атомы металла принимают участие в электродном процессе Ag Ag(NO)3 Э. д. с. lga. Ag 26
 Электроды 2 -го рода Активный металл в насыщенном растворе своей малорастворимой соли, содержащем также растворимую соль того же аниона: Ag/Ag 2 S, Na 2 S, Hg/Hg 2 Cl 2, KCl, Ag/Ag. Cl, KCl Обычно на электроде сформирован осадок малорастворимой соли Ag/Ag. Cl KCl (1) (2) Э. д. с. lga. Cl 27
Электроды 2 -го рода Активный металл в насыщенном растворе своей малорастворимой соли, содержащем также растворимую соль того же аниона: Ag/Ag 2 S, Na 2 S, Hg/Hg 2 Cl 2, KCl, Ag/Ag. Cl, KCl Обычно на электроде сформирован осадок малорастворимой соли Ag/Ag. Cl KCl (1) (2) Э. д. с. lga. Cl 27
 Электроды 3 -го рода Активный металл M с двумя осадками малорастворимых cолей MX, IY, SPMX < SPMY, в растворе соли IY: Ag/Ag 2 S, Cd. S, Ag/Ag. Cl, Pb. Cl 2, Pb(NO 3)2 Ag/Ag. Cl, Pb. Cl 2 (1) (2) Pb(NO 3)2 (3) Э. д. с. lga. Pb 28
Электроды 3 -го рода Активный металл M с двумя осадками малорастворимых cолей MX, IY, SPMX < SPMY, в растворе соли IY: Ag/Ag 2 S, Cd. S, Ag/Ag. Cl, Pb. Cl 2, Pb(NO 3)2 Ag/Ag. Cl, Pb. Cl 2 (1) (2) Pb(NO 3)2 (3) Э. д. с. lga. Pb 28
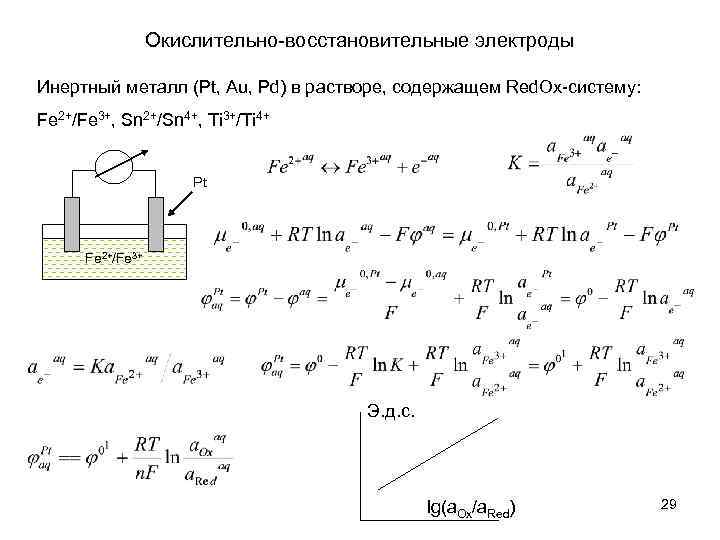 Окислительно-восстановительные электроды Инертный металл (Pt, Au, Pd) в растворе, содержащем Red. Ox-систему: Fe 2+/Fe 3+, Sn 2+/Sn 4+, Ti 3+/Ti 4+ Pt Fe 2+/Fe 3+ Э. д. с. lg(a. Ox/a. Red) 29
Окислительно-восстановительные электроды Инертный металл (Pt, Au, Pd) в растворе, содержащем Red. Ox-систему: Fe 2+/Fe 3+, Sn 2+/Sn 4+, Ti 3+/Ti 4+ Pt Fe 2+/Fe 3+ Э. д. с. lg(a. Ox/a. Red) 29
 Электроды 1 -го, 2 -го, 3 -го рода и окислительно-восстановительные Электрод Число равновесий с участием материала электрода 1 -го рода 1 2 -го рода 2 3 -го рода 3 Окисл. -восст. 0 30
Электроды 1 -го, 2 -го, 3 -го рода и окислительно-восстановительные Электрод Число равновесий с участием материала электрода 1 -го рода 1 2 -го рода 2 3 -го рода 3 Окисл. -восст. 0 30
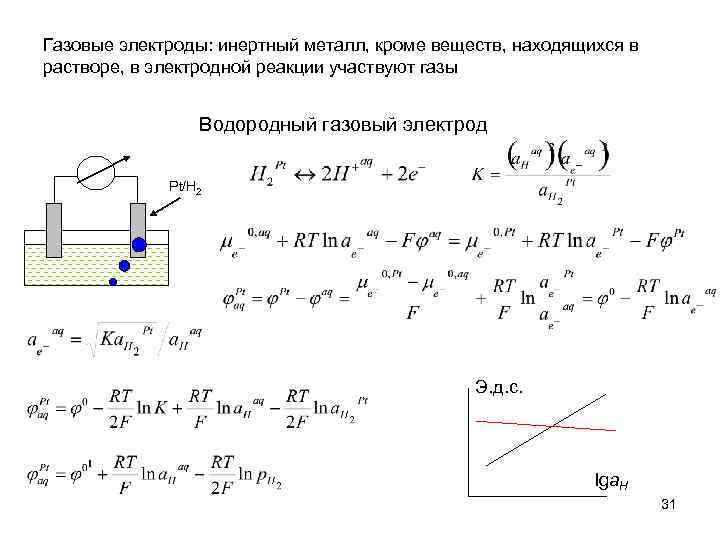 Газовые электроды: инертный металл, кроме веществ, находящихся в растворе, в электродной реакции участвуют газы Водородный газовый электрод Pt/H 2 Э. д. с. lga. H 31
Газовые электроды: инертный металл, кроме веществ, находящихся в растворе, в электродной реакции участвуют газы Водородный газовый электрод Pt/H 2 Э. д. с. lga. H 31
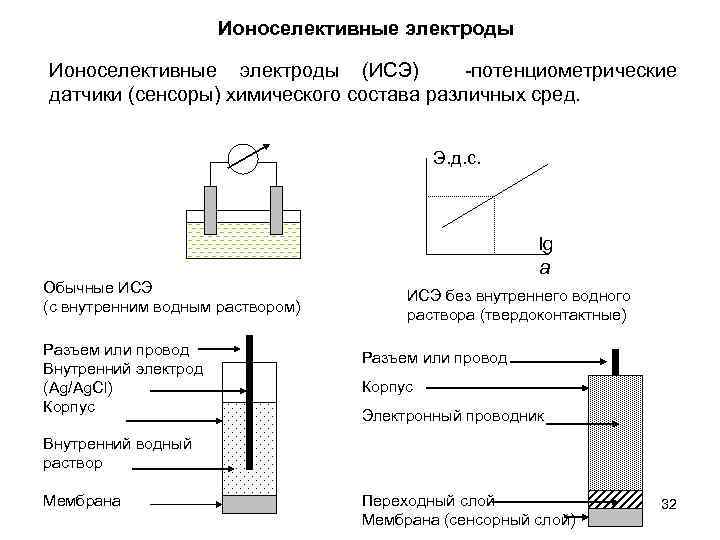 Ионоселективные электроды (ИСЭ) -потенциометрические датчики (сенсоры) химического состава различных сред. Э. д. с. lg a Обычные ИСЭ (с внутренним водным раствором) Разъем или провод Внутренний электрод (Ag/Ag. Cl) Корпус ИСЭ без внутреннего водного раствора (твердоконтактные) Разъем или провод Корпус Электронный проводник Внутренний водный раствор Мембрана Переходный слой Мембрана (сенсорный слой) 32
Ионоселективные электроды (ИСЭ) -потенциометрические датчики (сенсоры) химического состава различных сред. Э. д. с. lg a Обычные ИСЭ (с внутренним водным раствором) Разъем или провод Внутренний электрод (Ag/Ag. Cl) Корпус ИСЭ без внутреннего водного раствора (твердоконтактные) Разъем или провод Корпус Электронный проводник Внутренний водный раствор Мембрана Переходный слой Мембрана (сенсорный слой) 32
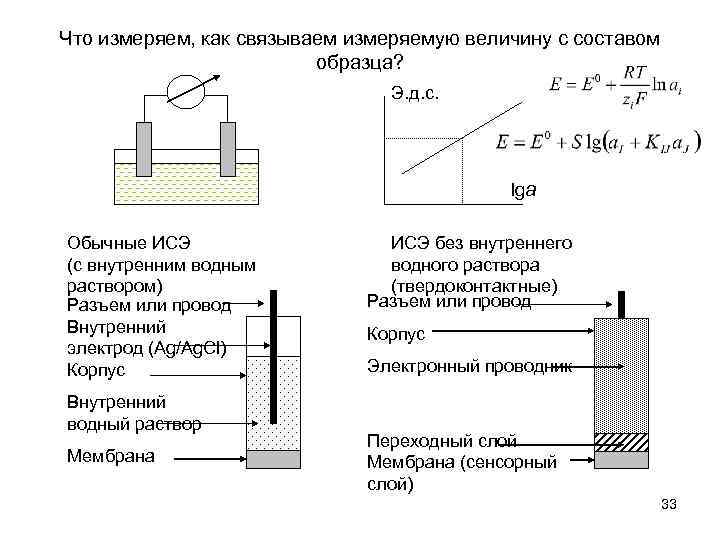 Что измеряем, как связываем измеряемую величину с составом образца? Э. д. с. lga Обычные ИСЭ (с внутренним водным раствором) Разъем или провод Внутренний электрод (Ag/Ag. Cl) Корпус Внутренний водный раствор Мембрана ИСЭ без внутреннего водного раствора (твердоконтактные) Разъем или провод Корпус Электронный проводник Переходный слой Мембрана (сенсорный слой) 33
Что измеряем, как связываем измеряемую величину с составом образца? Э. д. с. lga Обычные ИСЭ (с внутренним водным раствором) Разъем или провод Внутренний электрод (Ag/Ag. Cl) Корпус Внутренний водный раствор Мембрана ИСЭ без внутреннего водного раствора (твердоконтактные) Разъем или провод Корпус Электронный проводник Переходный слой Мембрана (сенсорный слой) 33
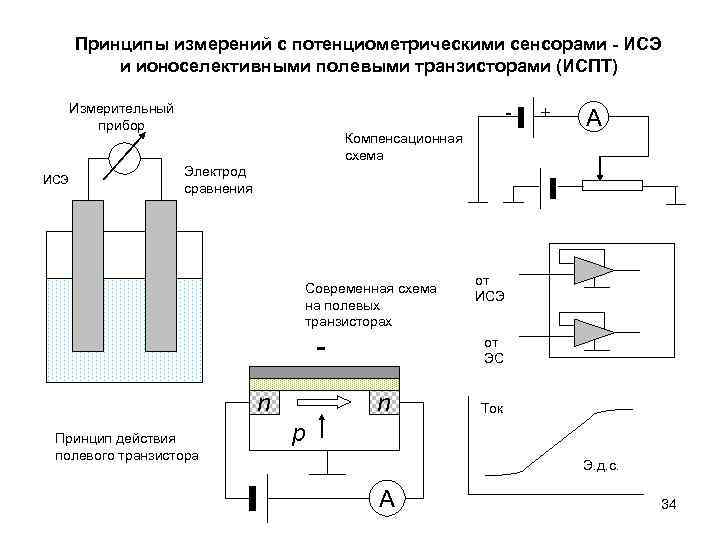 Принципы измерений с потенциометрическими сенсорами - ИСЭ и ионоселективными полевыми транзисторами (ИСПТ) Измерительный прибор ИСЭ Компенсационная схема + A Электрод сравнения Современная схема на полевых транзисторах n Принцип действия полевого транзистора от ИСЭ от ЭС n Ток p Э. д. с. A 34
Принципы измерений с потенциометрическими сенсорами - ИСЭ и ионоселективными полевыми транзисторами (ИСПТ) Измерительный прибор ИСЭ Компенсационная схема + A Электрод сравнения Современная схема на полевых транзисторах n Принцип действия полевого транзистора от ИСЭ от ЭС n Ток p Э. д. с. A 34
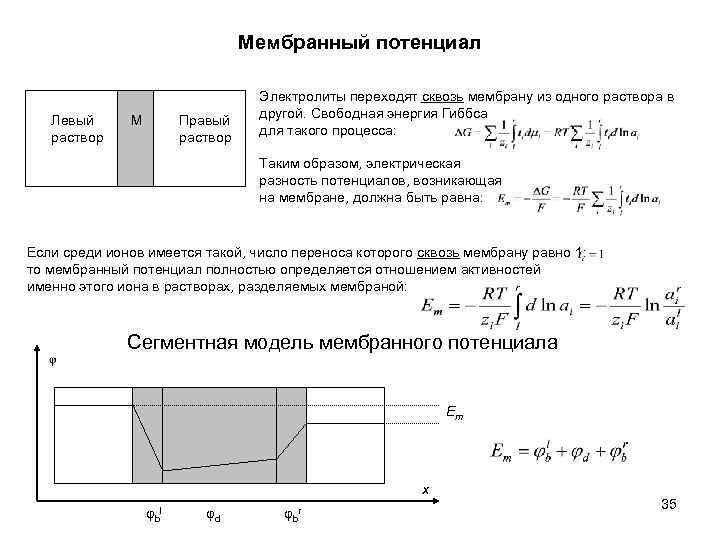 Мембранный потенциал Левый раствор Правый раствор М Электролиты переходят сквозь мембрану из одного раствора в другой. Свободная энергия Гиббса для такого процесса: Таким образом, электрическая разность потенциалов, возникающая на мембране, должна быть равна: Если среди ионов имеется такой, число переноса которого сквозь мембрану равно 1: то мембранный потенциал полностью определяется отношением активностей именно этого иона в растворах, разделяемых мембраной: Сегментная модель мембранного потенциала Em x φbl φd φbr 35
Мембранный потенциал Левый раствор Правый раствор М Электролиты переходят сквозь мембрану из одного раствора в другой. Свободная энергия Гиббса для такого процесса: Таким образом, электрическая разность потенциалов, возникающая на мембране, должна быть равна: Если среди ионов имеется такой, число переноса которого сквозь мембрану равно 1: то мембранный потенциал полностью определяется отношением активностей именно этого иона в растворах, разделяемых мембраной: Сегментная модель мембранного потенциала Em x φbl φd φbr 35
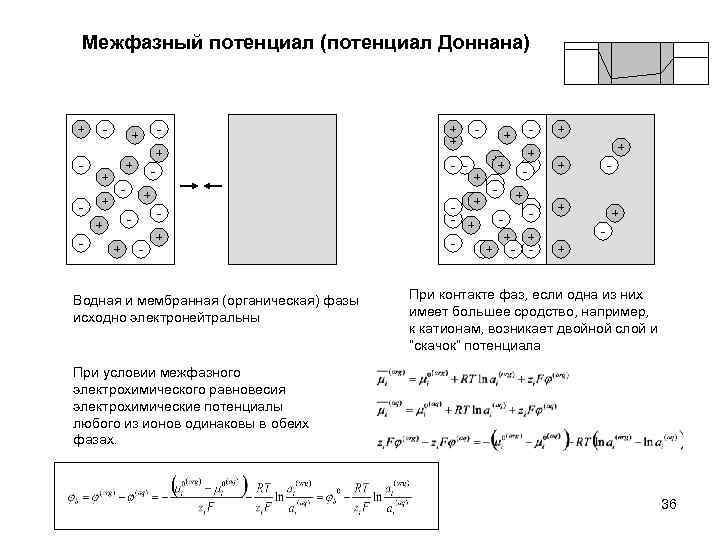 Межфазный потенциал (потенциал Доннана) + - + + - - - + - Водная и мембранная (органическая) фазы исходно электронейтральны - + ++ -+ - + ++ + -+ - - + + + - + При контакте фаз, если одна из них имеет большее сродство, например, к катионам, возникает двойной слой и “скачок” потенциала При условии межфазного электрохимического равновесия электрохимические потенциалы любого из ионов одинаковы в обеих фазах. 36
Межфазный потенциал (потенциал Доннана) + - + + - - - + - Водная и мембранная (органическая) фазы исходно электронейтральны - + ++ -+ - + ++ + -+ - - + + + - + При контакте фаз, если одна из них имеет большее сродство, например, к катионам, возникает двойной слой и “скачок” потенциала При условии межфазного электрохимического равновесия электрохимические потенциалы любого из ионов одинаковы в обеих фазах. 36
 Внутримембранный диффузионный потенциал + + - + + + - - - + + + - + - Идеальность мембранной фазы: + + - Ионы I+, J+, R Электрохимический потенциал частиц сорта i Поток частиц сорта i (ур-е Нернста. Планка) Потенциометрические условия (нулевой ток): R Rtot Ассоциация R IR J+ I+ Полная диссоциация J+ I+ J R 37
Внутримембранный диффузионный потенциал + + - + + + - - - + + + - + - Идеальность мембранной фазы: + + - Ионы I+, J+, R Электрохимический потенциал частиц сорта i Поток частиц сорта i (ур-е Нернста. Планка) Потенциометрические условия (нулевой ток): R Rtot Ассоциация R IR J+ I+ Полная диссоциация J+ I+ J R 37
 Полный мембранный потенциал Ионный коэффициент распределения: Реакция ионного обмена: I+, mem + J+, aq I+, aq + J+, mem Потенциалопределяющий ион задает межфазный потенциал, остальные под него подстраиваются Мембранный потенциал Уравнение Никольского Коэффициент селективности 38
Полный мембранный потенциал Ионный коэффициент распределения: Реакция ионного обмена: I+, mem + J+, aq I+, aq + J+, mem Потенциалопределяющий ион задает межфазный потенциал, остальные под него подстраиваются Мембранный потенциал Уравнение Никольского Коэффициент селективности 38
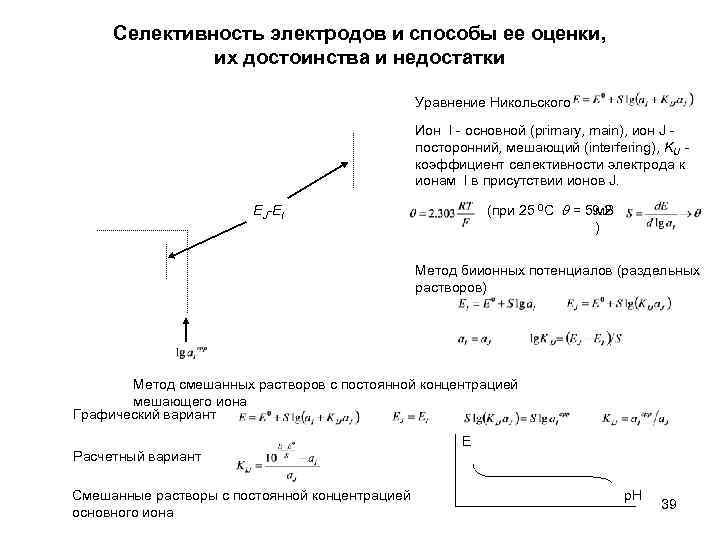 Селективность электродов и способы ее оценки, их достоинства и недостатки Уравнение Никольского Ион I - основной (primary, main), ион J посторонний, мешающий (interfering), KIJ коэффициент селективности электрода к ионам I в присутствии ионов J. (при 25 0 С = 59. 2 м. В ) EJ-EI Метод биионных потенциалов (раздельных растворов) Метод смешанных растворов с постоянной концентрацией мешающего иона Графический вариант Расчетный вариант Смешанные растворы с постоянной концентрацией основного иона E p. H 39
Селективность электродов и способы ее оценки, их достоинства и недостатки Уравнение Никольского Ион I - основной (primary, main), ион J посторонний, мешающий (interfering), KIJ коэффициент селективности электрода к ионам I в присутствии ионов J. (при 25 0 С = 59. 2 м. В ) EJ-EI Метод биионных потенциалов (раздельных растворов) Метод смешанных растворов с постоянной концентрацией мешающего иона Графический вариант Расчетный вариант Смешанные растворы с постоянной концентрацией основного иона E p. H 39
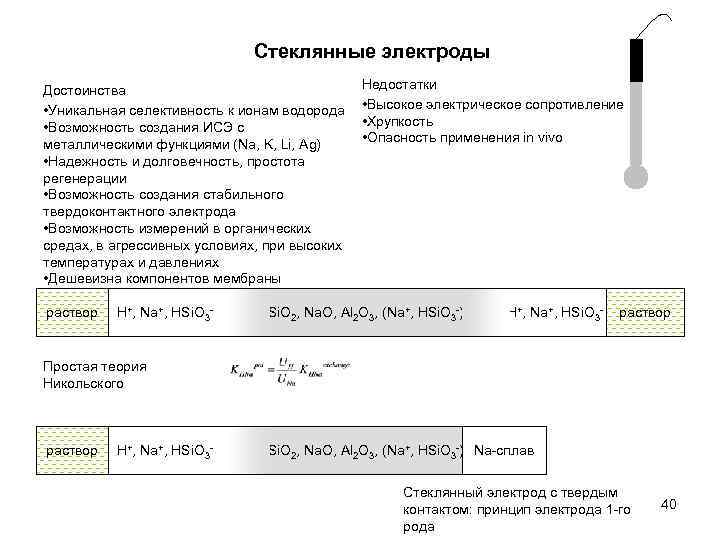 Стеклянные электроды Достоинства • Уникальная селективность к ионам водорода • Возможность создания ИСЭ с металлическими функциями (Na, K, Li, Ag) • Надежность и долговечность, простота регенерации • Возможность создания стабильного твердоконтактного электрода • Возможность измерений в органических средах, в агрессивных условиях, при высоких температурах и давлениях • Дешевизна компонентов мембраны раствор H+, Na+, HSi. O 3 - Недостатки • Высокое электрическое сопротивление • Хрупкость • Опасность применения in vivo Si. O 2, Na. O, Al 2 O 3, (Na+, HSi. O 3 -) H+, Na+, HSi. O 3 - раствор Простая теория Никольского раствор H+, Na+, HSi. O 3 - Si. O 2, Na. O, Al 2 O 3, (Na+, HSi. O 3 -) Na-сплав Стеклянный электрод с твердым контактом: принцип электрода 1 -го рода 40
Стеклянные электроды Достоинства • Уникальная селективность к ионам водорода • Возможность создания ИСЭ с металлическими функциями (Na, K, Li, Ag) • Надежность и долговечность, простота регенерации • Возможность создания стабильного твердоконтактного электрода • Возможность измерений в органических средах, в агрессивных условиях, при высоких температурах и давлениях • Дешевизна компонентов мембраны раствор H+, Na+, HSi. O 3 - Недостатки • Высокое электрическое сопротивление • Хрупкость • Опасность применения in vivo Si. O 2, Na. O, Al 2 O 3, (Na+, HSi. O 3 -) H+, Na+, HSi. O 3 - раствор Простая теория Никольского раствор H+, Na+, HSi. O 3 - Si. O 2, Na. O, Al 2 O 3, (Na+, HSi. O 3 -) Na-сплав Стеклянный электрод с твердым контактом: принцип электрода 1 -го рода 40
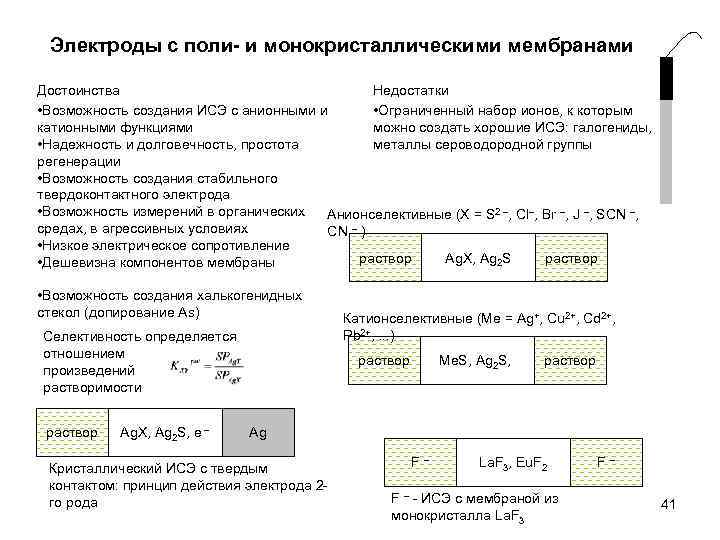 Электроды с поли- и монокристаллическими мембранами Недостатки Достоинства • Ограниченный набор ионов, к которым • Возможность создания ИСЭ с анионными и можно создать хорошие ИСЭ: галогениды, катионными функциями металлы сероводородной группы • Надежность и долговечность, простота регенерации • Возможность создания стабильного твердоконтактного электрода • Возможность измерений в органических Анионселективные (X = S 2 , Cl , Br , J , SCN , средах, в агрессивных условиях CN ) • Низкое электрическое сопротивление раствор Ag. X, Ag 2 S раствор • Дешевизна компонентов мембраны • Возможность создания халькогенидных стекол (допирование As) Селективность определяется отношением произведений растворимости раствор Ag. X, Ag 2 S, e Катионселективные (Me = Ag+, Cu 2+, Cd 2+, Pb 2+, . . . ) раствор Me. S, Ag 2 S, раствор Ag Кристаллический ИСЭ с твердым контактом: принцип действия электрода 2 го рода F La. F 3, Eu. F 2 F - ИСЭ с мембраной из монокристалла La. F 3 F 41
Электроды с поли- и монокристаллическими мембранами Недостатки Достоинства • Ограниченный набор ионов, к которым • Возможность создания ИСЭ с анионными и можно создать хорошие ИСЭ: галогениды, катионными функциями металлы сероводородной группы • Надежность и долговечность, простота регенерации • Возможность создания стабильного твердоконтактного электрода • Возможность измерений в органических Анионселективные (X = S 2 , Cl , Br , J , SCN , средах, в агрессивных условиях CN ) • Низкое электрическое сопротивление раствор Ag. X, Ag 2 S раствор • Дешевизна компонентов мембраны • Возможность создания халькогенидных стекол (допирование As) Селективность определяется отношением произведений растворимости раствор Ag. X, Ag 2 S, e Катионселективные (Me = Ag+, Cu 2+, Cd 2+, Pb 2+, . . . ) раствор Me. S, Ag 2 S, раствор Ag Кристаллический ИСЭ с твердым контактом: принцип действия электрода 2 го рода F La. F 3, Eu. F 2 F - ИСЭ с мембраной из монокристалла La. F 3 F 41
 ИСЭ с жидкими и полимерными мембранами (на основе ионофоров) Достоинства • Возможность создания самых разнообразных ИСЭ, в том числе - для потенциометрического определения нейтральных компонентов (НПАВ, фенолов и др. ) раствор Полимер (ПВХ) - 33% пластификатор - 66% раствор ионофор(ы) - 1% Недостатки • Сравнительно низкая долговечность ( 1 год) • Высокое электрическое сопротивление • Возможность измерений только в водных растворах • Трудность создания стабильного твердоконтактного варианта • Дороговизна компонентов мембран Заряженный ионофор (ионообменник) R J+ aq + IRmem I+ aq + JRmem Нейтральный ионофор L J+ aq + IL+rmem I+ aq + JL+mem раствор Полимер (ПВХ) - 33% Слой со смешанной пластификатор - 66%электроно-ионной Металл ионофор(ы) - 1% проводимостью (e ) Твердоконтактный электрод, разные принципы действия. В целом, проблема твердоконтактного ИСЭ с полимерной мембраной не решена 42
ИСЭ с жидкими и полимерными мембранами (на основе ионофоров) Достоинства • Возможность создания самых разнообразных ИСЭ, в том числе - для потенциометрического определения нейтральных компонентов (НПАВ, фенолов и др. ) раствор Полимер (ПВХ) - 33% пластификатор - 66% раствор ионофор(ы) - 1% Недостатки • Сравнительно низкая долговечность ( 1 год) • Высокое электрическое сопротивление • Возможность измерений только в водных растворах • Трудность создания стабильного твердоконтактного варианта • Дороговизна компонентов мембран Заряженный ионофор (ионообменник) R J+ aq + IRmem I+ aq + JRmem Нейтральный ионофор L J+ aq + IL+rmem I+ aq + JL+mem раствор Полимер (ПВХ) - 33% Слой со смешанной пластификатор - 66%электроно-ионной Металл ионофор(ы) - 1% проводимостью (e ) Твердоконтактный электрод, разные принципы действия. В целом, проблема твердоконтактного ИСЭ с полимерной мембраной не решена 42
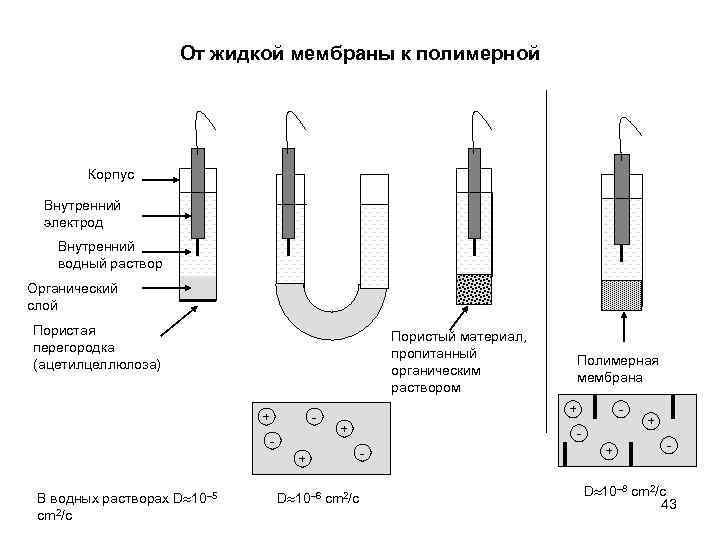 От жидкой мембраны к полимерной Корпус Внутренний электрод Внутренний водный раствор Органический слой Пористая перегородка (ацетилцеллюлоза) Пористый материал, пропитанный органическим раствором + - - + + + В водных растворах D 10 5 cm 2/c Полимерная мембрана D 10 6 cm 2/c - - + + - D 10 8 cm 2/c 43
От жидкой мембраны к полимерной Корпус Внутренний электрод Внутренний водный раствор Органический слой Пористая перегородка (ацетилцеллюлоза) Пористый материал, пропитанный органическим раствором + - - + + + В водных растворах D 10 5 cm 2/c Полимерная мембрана D 10 6 cm 2/c - - + + - D 10 8 cm 2/c 43
 Селективность ИСЭ с мембранами на основе ионообменников, ряд Гофмейстера K+, Cs+, NR 4+, R+, ПАВ+ Иллюстративный «вывод» формулы для коэффициента селективности ионообменных мембран (метод биионных потенциалов) Принимаем во внимание только межфазный потенциал NO 3 , Cl. O 4 , Br , SCN , R , ПАВ Будем считать Получим Ряд Гофмейстера R > Cl. O 4 > SCN J > NO 3 > Br > Cl HCO 3 > H 2 PO 4 > В мембране: SO 42 Гидратация Селективность А если ион не теряет воду ? - Итак, 44
Селективность ИСЭ с мембранами на основе ионообменников, ряд Гофмейстера K+, Cs+, NR 4+, R+, ПАВ+ Иллюстративный «вывод» формулы для коэффициента селективности ионообменных мембран (метод биионных потенциалов) Принимаем во внимание только межфазный потенциал NO 3 , Cl. O 4 , Br , SCN , R , ПАВ Будем считать Получим Ряд Гофмейстера R > Cl. O 4 > SCN J > NO 3 > Br > Cl HCO 3 > H 2 PO 4 > В мембране: SO 42 Гидратация Селективность А если ион не теряет воду ? - Итак, 44
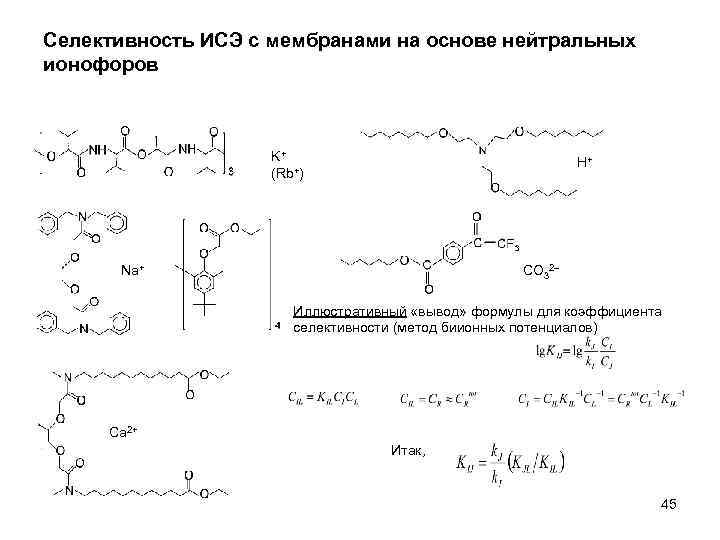 Селективность ИСЭ с мембранами на основе нейтральных ионофоров K+ (Rb+) H+ Na+ CO 32 Иллюстративный «вывод» формулы для коэффициента селективности (метод биионных потенциалов) Ca 2+ Итак, 45
Селективность ИСЭ с мембранами на основе нейтральных ионофоров K+ (Rb+) H+ Na+ CO 32 Иллюстративный «вывод» формулы для коэффициента селективности (метод биионных потенциалов) Ca 2+ Итак, 45
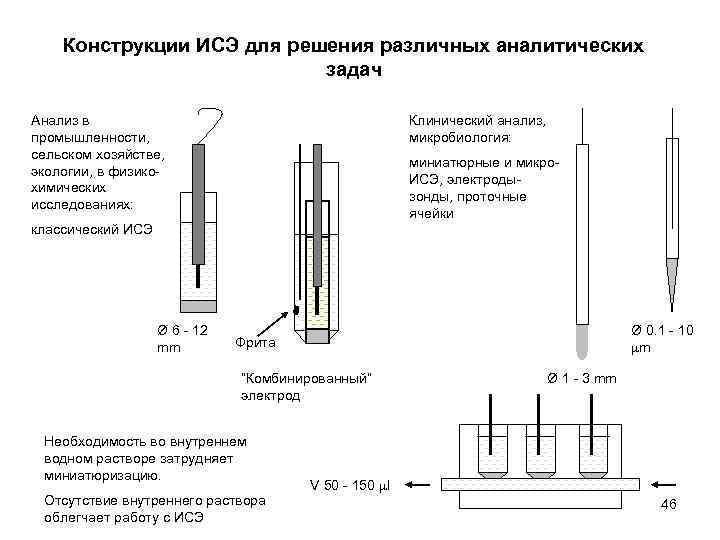 Конструкции ИСЭ для решения различных аналитических задач Анализ в промышленности, сельском хозяйстве, экологии, в физикохимических исследованиях: Клинический анализ, микробиология: миниатюрные и микро. ИСЭ, электродызонды, проточные ячейки классический ИСЭ Ø 6 - 12 mm Ø 0. 1 - 10 m Фрита “Комбинированный” электрод Необходимость во внутреннем водном растворе затрудняет миниатюризацию. Отсутствие внутреннего раствора облегчает работу с ИСЭ Ø 1 - 3 mm V 50 - 150 l 46
Конструкции ИСЭ для решения различных аналитических задач Анализ в промышленности, сельском хозяйстве, экологии, в физикохимических исследованиях: Клинический анализ, микробиология: миниатюрные и микро. ИСЭ, электродызонды, проточные ячейки классический ИСЭ Ø 6 - 12 mm Ø 0. 1 - 10 m Фрита “Комбинированный” электрод Необходимость во внутреннем водном растворе затрудняет миниатюризацию. Отсутствие внутреннего раствора облегчает работу с ИСЭ Ø 1 - 3 mm V 50 - 150 l 46
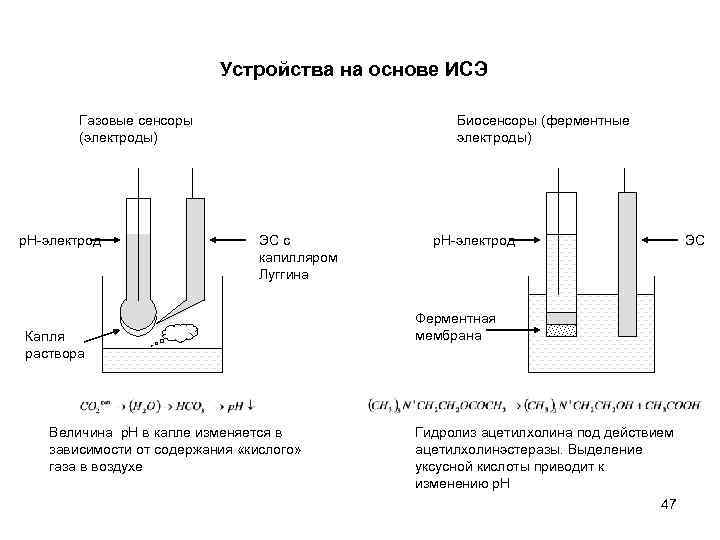 Устройства на основе ИСЭ Газовые сенсоры (электроды) p. H-электрод Биосенсоры (ферментные электроды) ЭС с капилляром Луггина Капля раствора Величина p. H в капле изменяется в зависимости от содержания «кислого» газа в воздухе p. H-электрод ЭС Ферментная мембрана Гидролиз ацетилхолина под действием ацетилхолинэстеразы. Выделение уксусной кислоты приводит к изменению p. H 47
Устройства на основе ИСЭ Газовые сенсоры (электроды) p. H-электрод Биосенсоры (ферментные электроды) ЭС с капилляром Луггина Капля раствора Величина p. H в капле изменяется в зависимости от содержания «кислого» газа в воздухе p. H-электрод ЭС Ферментная мембрана Гидролиз ацетилхолина под действием ацетилхолинэстеразы. Выделение уксусной кислоты приводит к изменению p. H 47


