Phys_Chem_Biol_1_2011.ppt
- Количество слайдов: 32

Физическая Химия для студентов биологических специальностей

Физическая и коллоидная химия Физическая химия: Константин Николаевич Михельсон ~10 лекций, в форме презентаций 428 4103, 428 4062 Konstantin_Mikhelson@yahoo. com Коллоидная химия: Николай Геннадиевич Суходолов ~ 6 лекций Зачет путем прохождения теста: выбор правильного ответа из трех предложенных вариантов 2

Рекомендуемая литература 1. Кузнецов, В. И. Горшков. Физическая химия. 4 -е изд. 2006. (Есть в библиотеке биофака). 2. Е. Г Ипполитов, А. В. Артемов, В. В. Батраков. Физическая химия (для педагогов). Academia. М. 2005. 3. И. Тиноко, К. Зауэр, Дж. Вэнг, Дж. Паглиси. Физическая химия. Принципы применение в биологических науках. Техносфера. М. 2005. 4. Р. Чанг Физическая химия с приложениями к биологическим системам. Мир. 1980. 5. В. Уильямс, Х. Уильямс. Физическая химия для биологов. Мир. 1976. 3

Предмет физической химии Задачи физической химии как одной из отраслей химической науки: 1. Выявление рамок возможностей протекания химических процессов. Например: в каком направлении при тех или иных условиях процесс может идти, а в каком не может, при каком соотношении концентраций веществ – участников химической реакции процесс прекратится, при каких изменениях внешних условий он возобновится, и т. п. 2. Выявление общих закономерностей перехода веществ из одного фазового состояния в другое (плавление/кристаллизация, испарение/конденсация), распределения веществ между фазами, например распределение солей между водным и неводным раствором. Эти рамки возможностей и закономерности - общие для самых разнообразных химических веществ, в том числе – ранее неизвестных и неизученных. Общность достигается тем, что физическая химия основывается на общих законах физики, в частности – термодинамики. 4

Соотношение областей интересов физической (в узком смысле) и коллоидной химии: Физическая химия – главным образом занимается процессами и явлениями в объеме фаз, составляющих физико-химическую систему; Коллоидная химия – главным образом сосредотачивается на границе раздела фаз и на объектах малых размеров, в том числе так называемых нанообъектах. 5

Что дает физическая химия? Физическая химия – совокупность преимущественно количественных подходов к изучению и описанию химических проблем. Выявляемые физической химией общие закономерности протекания химических реакций, фазовых переходов, распределения веществ и других физикохимических процессов и явлений позволяют химикам, биологам, технологам и другим специалистам прогнозировать, во многих случаях – строго количественно, как будет протекать процесс и каких явлений можно ожидать. Для этого достаточно иметь численные значения ограниченного числа параметров, причем перечень этих необходимых параметров и то, как ими пользоваться дает именно физическая химия. 6

Пример: хотим выяснить, пойдет ли самопроизвольно гидролиз белка глицил-глицина в водном растворе при 25 0 С и давлении 1 атм. Реакция гидролиза: +H 3 NCH 2 CONHCH 2 COO –(aq) + H 2 O → 2 +H 3 NCH 2 COO–(aq) Критерий возможности самопроизвольного протекания процесса - знак функции, которая называется «свободная энергия Гиббса» , обозначается ΔG (будет показано далее) Для вычисления ΔG химической реакции достаточно знать ΔG начальных веществ и продуктов при данных условиях. ΔG = 2 ΔG(г) - ΔG(г-г) - ΔG(в) = 2(-377. 69) - (-490. 57) - (-237. 13)= -27. 68 к. Дж/моль Знак отрицательный, следовательно гидролиз пойдет 7
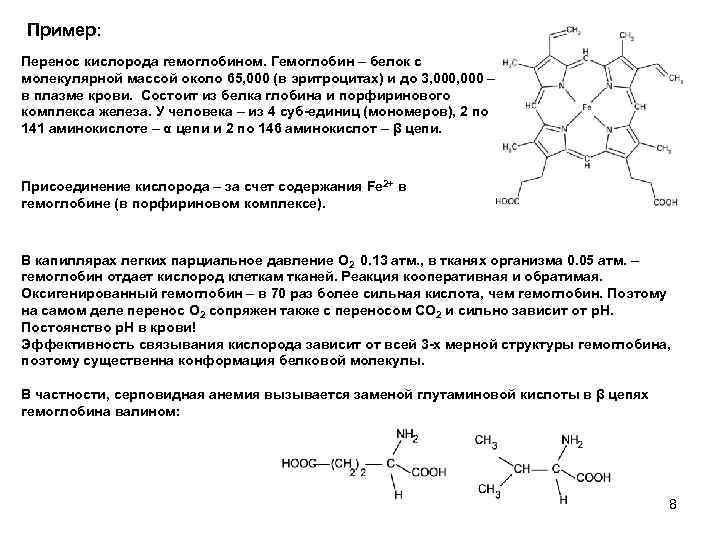
Пример: Перенос кислорода гемоглобином. Гемоглобин – белок с молекулярной массой около 65, 000 (в эритроцитах) и до 3, 000 – в в плазме крови. Состоит из белка глобина и порфиринового комплекса железа. У человека – из 4 суб-единиц (мономеров), 2 по 141 аминокислоте – α цепи и 2 по 146 аминокислот – β цепи. Присоединение кислорода – за счет содержания Fe 2+ в гемоглобине (в порфириновом комплексе). В капиллярах легких парциальное давление O 2 0. 13 атм. , в тканях организма 0. 05 атм. – гемоглобин отдает кислород клеткам тканей. Реакция кооперативная и обратимая. Оксигенированный гемоглобин – в 70 раз более сильная кислота, чем гемоглобин. Поэтому на самом деле перенос O 2 сопряжен также с переносом CO 2 и сильно зависит от p. H. Постоянство p. H в крови! Эффективность связывания кислорода зависит от всей 3 -х мерной структуры гемоглобина, поэтому существенна конформация белковой молекулы. В частности, серповидная анемия вызывается заменой глутаминовой кислоты в β цепях гемоглобина валином: 8

Разделы физической химии (в широком смысле слова) Квантово-химическая теория строения атомов и молекул Химическая термодинамика (феноменологическая и статистическая) Химическая кинетика Теория газов, жидкостей, твердых тел Теория растворов Теория гетерогенных систем Электрохимия Физическая органическая химия Коллоидная химия В более узком смысле (именно эти разделы составят предмет курса): Химическая термодинамика Теория газов, жидкостей и твердых тел Теория растворов Теория гетерогенных систем Элементы электрохимии Элементы химической кинетики 9

Основные понятия физической химии (1) Тело – вещество, раствор или смесь веществ, занимающая определенный объем и обладающая неким запасом энергии. Система – тело или группа тел, обособленная от окружающей среды мыслимой перегородкой (математической поверхностью). Окружающая среда – все то, что находится вне системы. Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом. Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией. Адиабатическая система – система, которая не обменивается с окружающей средой энергией в форме теплоты. Состояние системы – совокупность всех термодинамических свойств системы 10

Основные понятия физической химии (2) Параметры системы – те свойства системы, которые характеризуют ее состояние. К основным параметрам относятся температура, давление, объем, концентрации веществ (если система содержит несколько разных веществ. Для описания системы, состоящей из одного чистого вещества всегда достаточно двух параметров для ее полного описания. Однако в случае действия внешних полей для описания системы могут потребоваться дополнительные параметры. Компоненты – части системы, концентрации которых могут изменяться независимо. Варьируя концентрации компонентов можно выразить все возможные составы системы. Не каждое из веществ, имеющихся в системе, является компонентом. Например, если мы имеем раствор Na. HCO 3 в воде, то там есть Na+, HCO 3–, CO 3 2–, H 2 CO 3, Na. CO 3 –. Но компонентов только 2: H 2 O и Na. HCO 3. Экстенсивные параметры – параметры, которые зависят от количества вещества в системе (от ее массы). Экстенсивные параметры аддитивны, т. е. величина такого параметра для всей системы равна сумме соответствующих значений для частей системы. Интенсивные параметры – параметры, которые не зависят от массы. Интенсивные параметры не аддитивны. Если их значения в различных частях системы не одинаковы, то они стремятся выравняться. 11
![Интенсивные и экстенсивные параметры энергии p. V=RT [p. V]=Энергия p – интенсивный параметр, V Интенсивные и экстенсивные параметры энергии p. V=RT [p. V]=Энергия p – интенсивный параметр, V](https://present5.com/presentation/11795508_140443778/image-12.jpg)
Интенсивные и экстенсивные параметры энергии p. V=RT [p. V]=Энергия p – интенсивный параметр, V – экстенсивный. Энергия Интенсивный параметр Кинетическая E=mv 2/2 E=CT Электрическая Химическая E=zΨ E=nμ v E=σS m σ S T Поверхностное натяжения Тепловая Экстенсивный параметр C Ψ z μ n 12

Основные понятия физической химии (3) Гомогенная система – система, физические и химические свойства которой в любой ее точке одинаковы или меняются непрерывным образом. Гетерогенная система – система, состоящая из нескольких гомогенных частей, называемых фазами. Фаза – часть гетерогенной системы, химические свойства которой в любой ее точке одинаковы или меняются непрерывным образом, причем эта часть системы отделена от других ее частей видимой поверхностью раздела. Таким образом, фаза – гомогенная макроскопическая часть системы. Процесс – ряд последовательных состояний системы. Состояние равновесия – состояние, при котором отсутствуют видимые (макроскопические) изменения системы, хотя микроскопические изменения происходят (динамическое равновесие). Значения интенсивных параметров во всей системе одинаковы. Если систему вывести из состояния равновесия и предоставить себе самой, она вернется в состояние равновесия. Вывод системы из состояния равновесия требует совершения работы. Равновесие может быть достигнуто с разных сторон: как «прямым» , так и «обратным» процессом. Система может сохранять состояние равновесия бесконечно долго. 13

Основные понятия физической химии (4) Равновесные и неравновесные процессы Физико-химические процессы могут происходить равновесно или неравновесно. В первом случае весь процесс состоит из последовательности состояний равновесия. Это означает, что процесс идет медленно (формально – бесконечно медленно), т. к. равновесие не достигается мгновенно. Все параметры равновесного процесса строго определены. Процесс идет в прямом и обратном направлении через одни и те же состояния. Работа, полученная от системы в прямом процессе, равна работе, произведенной над системой для проведения обратного процесса. Неравновесные процессы могут идти быстро, через неравновесные состояния, при неопределенных параметрах, разыми путями для прямого и обратного процесса, и с разными работами этих процессов. Работа, полученная в равновесном процессе, всегда больше, чем в неравновесном, а затраченная – меньше. Обратимые и необратимые процессы – иногда воспринимаются как синонимы равновесных и неравновесных. Иногда уточняют: обратимый – это когда не только система, но и окружающая среда остается в равновесии по ходу процесса. Если система меняется равновесно, а окружающая среда – неравновесно, то процесс на самом деле необратимый. 14

Комментарий к равновесному и неравновесному процессам p 1 P 1 ’ Допустим, система переходит из состояния 1 в состояние 2, различающиеся давлением p и объемом V. 1’ Давление в системе снизилось (скачком) с величины p 1 до p 1’. С некоторым запаздыванием (из-за конечной упругости) объем вырос со значения V 1 до V 1’. И так далее, система переходит в состояние 2. 2’ P 2’ p 2 2 V 1’ V 2 V Работа, совершаемая системой на каждом скачке, равна площади под стрелочками. Для обратного процесса надо затратить работу: поднять давление от p 2 до p 2’, при этом объем уменьшится от V 2 до V 2’, и так далее. Работа, совершаемая над системой на каждом скачке равна площади под соответствующими стрелочками. Работа обратного процесса (затраченная) больше, чем прямого (полученная). Если скачки бесконечно малые, то в пределе процесс пойдет по прямой от 1 до 2, и обратно, работы прямого и обратного процесса будут равны, работа, полученная в прямом процессе будет максимальной из возможных, а затраченная – минимальной. 15

Основные понятия физической химии (5) Разность температур между двумя телами – мера отклонения их от состояния теплового равновесия. Таким образом постулируется, что при тепловом равновесии – то есть при отсутствии спонтанных потоков тепла, температуры тел одинаковы. Поток – количество вещества или энергии, переносимое сквозь мысленную поверхность единичной площади, ориентированную нормально направлению движения, за одну единицу времени. Стационарное состояние – состояние системы, в которой нет равновесия, то есть идут макроскопические процессы или есть потоки вещества либо энергии, но при этом состояние системы не меняется. Стационарное состояние – понятие, несколько выходящее за рамки классической термодинамики. Стационарное состояние поддерживается за счет обмена веществом и/или энергией между системой и окружающей средой (внешние исток и сток). Стационарное состояние может поддерживаться только пока не иссякнет исток и/или не переполнится сток для потока вещества или энергии. Исток Стационарный уровень жидкости Сток 16

Теория газов 17

Газовые законы Закон Бойля-Мариотта (1662 г. ): p 1 V 1=p 2 V 2 Бойль (и независимо от него – Мариотт) измеряли высоты столбиков воздуха и ртути в U-образной трубке постоянного сечения, добавляя ртуть через открытый конец трубки. Опыты проводили при постоянных внешних условиях (температура постоянна). V ~ 1/p 1 -й закон Гей-Люссака (1802) и Шарля (1787 г. ): Vt=V 0(1+(t/273. 15) (при постоянном давлении) Поршень pt=p 0(1+(t/273. 15) (при постоянном объеме) Запаянный конец Столбик воздуха Открытый конец Столбик ртути Постоянный груз Важно: уже была предложена 100 -градусная Цилиндр шкала и термометр Цельсия. с газом T = t + 273. 15, V ~ T 2 -й закон Гей-Люссака: закон простых объемных отношений: H 2+Cl 2=2 HCl VH: VCl: VHCl=1: 1: 2 Постулат Авогадро (1811 г. ): при постоянных давлении и температуре равные объемы разных газов содержат одинаковое число молекул, в 1 моле 6. 02· 1023 молекул. V ~ n Объединенный газовый закон (интуитивно): V ~ n. T/p = n. RT/p, p. V=n. RT Для реальных газов эти законы выполняются неточно. Отклонения нарастают по мере повышения давления и температуры, а для закона Гей-Люссака-Шарля – также при очень низких температурах. Гипотетический газ, для которого эти законы выполняются точно, называется идеальным газом. 18

Объединенный газовый закон (строго) Введем «абсолютную» температуру: T = t +273. 15 Теперь законы Бойля-Мариотта и Гей-Люссака-Шарля можно объединить. Для этого рассмотрим изотермы (т. е. линии, отвечающие постоянной температуре) идеального газа. Исходная точка: p 0 V 0 на изотерме 0 0 C при p 0=1 атм. и V 0=22. 414 л (т. е. 1 моль газа) p p. V Движемся вдоль изобары в точку p 0 VT (T – произвольная) p 0 VT 373. 15 (100 0 C) По закону Г-Л-Ш: VT=V 0 T/T 0 T 0= 0 0 C =273. 15 0 K 1 атм. 323. 15 (50 0 C) p 0 V 0 273. 15 (0 0 C) 22. 414 л V Домножим на p 0: p 0 VT=p 0 V 0 T/T 0. По изотерме, содержащей точки p 0 VT, переходим в точку p. V, выполняется p 0 VT=p. V. Таким образом, p. V=(p 0 V 0/T 0)T, введем R=p 0 V 0/T 0, тогда p. V=RT Для n молей идеального газа p. V=n. RT Постулат Авогадро означает, что величина R одинакова для всех газов 19

Комментарии к объединенному газовому закону p. V=RT – закон, справедливый для идеального газа. Реальные газы отклоняются от этого закона. Соответственно, идеальным называют газ, подчиняющийся формуле p. V=RT. Причины отклонений: Взаимодействие между молекулами реальных газов Конечный (не бесконечно малый) объем молекул реальных газов Идеальный газ – газ, состоящий из бесконечно малых молекул, которые никак не взаимодействуют друг с другом p. V=RT [p. V]=Энергия R=0. 08206 (л∙атм)/(моль∙град) R=1. 987 кал/(моль∙град) R=8. 314 Дж/(моль∙град) 20

Газовый закон и теплоемкость (пример физико-химического похода к реальным веществам) Теплоемкость – количество тепла, которое требуется для повышения температуры тела на 1 градус Удельная теплоемкость – теплоемкость на 1 единицу массы, или молярная на 1 моль вещества Молярная теплоемкость зависит от того, как присходит нагревание: при постоянном давлении (Cp) или при постоянном объеме (CV). Для жидкостей и для твердых тел Cp≈CV так как при изменении температуры их объем меняется достаточно мало. Для газов Cp больше, чем CV на то количество тепла, которое затрачивается на расширение газа (в Cp объем не фиксирован, фиксировано давление!) Как соотносятся Сp и CV для идеального газа? 21

Насколько вывод о том, что Сp-CV=R, подтверждается экспериментально? R=1. 987 кал/(моль∙град) Молярные теплоемкости некоторых газов при 25 0 С, кал/(моль∙град) Газ Число атомов в молекуле He 1 Ne 1 Ar 1 CO 2 N 2 2 H 2 2 CO 2 3 C 2 H 6 8 Cp 4. 97 6. 94 6. 90 8. 96 12. 71 CV Cp-CV 2. 98 4. 97 4. 95 4. 91 6. 92 10. 65 1. 99 2. 00 1. 99 2. 04 2. 06 Итак, действительно, Cp-CV≈R. Почему CV сильно зависит от числа атомов в молекуле газа и от геометрии молекулы (линейная или нелинейная), но слабо зависит от природы атомов? 22

Распределение энергии по степеням свободы z Средняя кинетическая энергия 1 моля газа y Принцип: энергия распределена поровну между всеми видами движения (степенями свободы) x На одну степень свободы трансляционного движения приходится Если речь идет об отдельной молекуле: Для описания движения молекулы из N атомов нужно 3 N координат – тогда мы описываем движения каждого атома как трансляционное. Но можно описывать молекулу как целое. Тогда 3 степени свободы приходится на трансляционное движение центра масс молекулы. Еще 3 степени свободы – на вращение молекулы: повороты вокруг трех взаимно перпендикулярных осей, проходящих через центр масс молекулы. Оставшиеся 3 N-6 степеней свободы приходятся на колебательное движение. Колебательное движение включает кинетическую и потенциальную энергии, поэтому на каждую колебательную степень свободы приходится 23

Распределение энергии по степеням свободы Тип частицы Поступательное движение Вращение Колебание Атом 3/2 RT - - Линейная молекула 3/2 RT RT (3 N-5) RT Нелинейная молекула 3/2 RT (3 N-6) RT Колебания Симметричное валентное Антисимметричное валентное α-цепочка белка Деформационное 24

25

Соответствие расчетных и экспериментальных теплоемкостей Молярные теплоемкости некоторых газов при 25 0 С, кал/(моль∙град) Газ Число атомов в молекуле He 1 Ne 1 Ar 1 H 2 2 N 2 2 O 2 2 CO 2 3 H 2 O 3 SO 2 3 Геометрия Линейная Уголковая Степени свободы tr rot vibr 3 0 0 3 2 1 3 2 4 3 3 3 Энергия 3/2 RT 7/2 RT 13/2 RT 12/2 RT Cvtheor 2. 98 6. 96 12. 92 11. 92 CVexp 2. 98 4. 91 4. 95 (5/2) 5. 03 6. 92 (7/2) 6. 03 7. 53 26

Уравнения состояния реального газа Идеальный газ: Uik Реальный газ: частицы имеют конечный размер и могут взаимодействовать друг с другом Потенциал Леннарда-Джонса: r Σ ε Уравнение Ван-дер-Ваальса: (модельный подход) Уравнение с вириальными коэффициентами: (феноменологический подход) 27
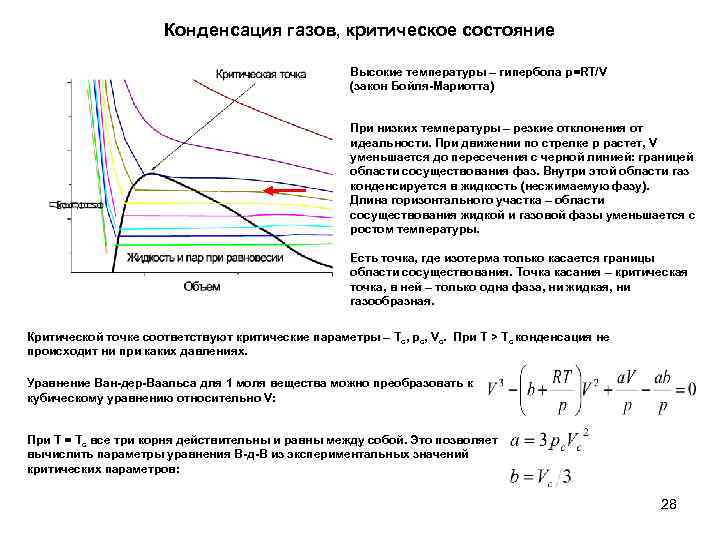
Конденсация газов, критическое состояние Высокие температуры – гипербола p=RT/V (закон Бойля-Мариотта) При низких температуры – резкие отклонения от идеальности. При движении по стрелке p растет, V уменьшается до пересечения с черной линией: границей области сосуществования фаз. Внутри этой области газ конденсируется в жидкость (несжимаемую фазу). Длина горизонтального участка – области сосуществования жидкой и газовой фазы уменьшается с ростом температуры. Есть точка, где изотерма только касается границы области сосуществования. Точка касания – критическая точка, в ней – только одна фаза, ни жидкая, ни газообразная. Критической точке соответствуют критические параметры – Tc, pc, Vc. При T > Tc конденсация не происходит ни при каких давлениях. Уравнение Ван-дер-Ваальса для 1 моля вещества можно преобразовать к кубическому уравнению относительно V: При T = Tc все три корня действительны и равны между собой. Это позволяет вычислить параметры уравнения В-д-В из экспериментальных значений критических параметров: 28

Закон парциальных давлений Дальтона Давление (полное давление) смеси газов - мольная доля i–го компонента 29
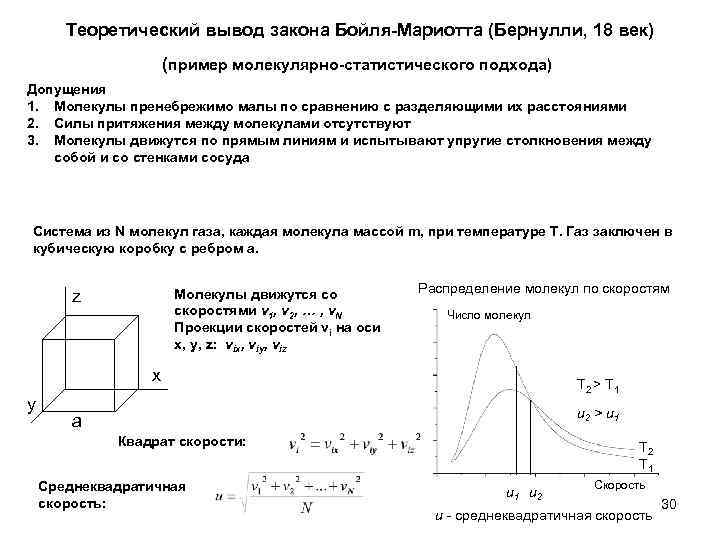
Теоретический вывод закона Бойля-Мариотта (Бернулли, 18 век) (пример молекулярно-статистического подхода) Допущения 1. Молекулы пренебрежимо малы по сравнению с разделяющими их расстояниями 2. Силы притяжения между молекулами отсутствуют 3. Молекулы движутся по прямым линиям и испытывают упругие столкновения между собой и со стенками сосуда Cистема из N молекул газа, каждая молекула массой m, при температуре T. Газ заключен в кубическую коробку с ребром a. Молекулы движутся со скоростями v 1, v 2, … , v. N Проекции скоростей vi на оси x, y, z: vix, viy, viz z Распределение молекул по скоростям Число молекул x y T 2 > T 1 u 2 > u 1 a Квадрат скорости: Среднеквадратичная скорость: T 2 T 1 u 2 Скорость u - среднеквадратичная скорость 30

Рассмотрим движение индивидуальной молекулы i вдоль оси x, т. е. влево и вправо вдоль коробки. Каждый раз, пройдя вдоль x расстояние 2 a, молекула i сталкивается с левой стенкой W. эти столкновения происходят раз в секунду. Считаем столкновения упругими, т. е. молекула после столкновения отскакивает, не теряя кинетической энергии, т. е. с той же скоростью vix. z W y x a Сила удара молекулы в стенку: Импульс молекулы до столкновения: , а после столкновения: Полное изменение импульса при одном столкновении Сила, действующая на стенку со стороны молекулы i равна изменению импульса в единицу времени: Сила, действующая на стенку W со стороны всех молекул: Давление на стенку W: 31

По закону Паскаля давление на все стенки одинаково: Свяжем давление с полной скоростью движения молекул в коробке (а не с проекцией скорости на одну из координат), воспользовавшись определением среднеквадратичной скорости: Получаем: В итоге: Если предположить, что среднеквадратичная скорость определяется только температурой, то получим, что p. V=Const при постоянной T – т. е. закон Бойля-Мариотта. Кинетическое уравнение газа из N молекул: Кинетическая энергия зависит только от Т (это мы уже предположили), считаем эту зависимость линейной с коэффициентом пропорциональности А: Таким образом, 32
Phys_Chem_Biol_1_2011.ppt