Презентация. растворы..pptx
- Количество слайдов: 38


Физическая теория растворов была предложена Якобом Г. Вант Гоффом(1885 г. ) и Сванте А. Аррениусом(1883 г. ). Согласно этой теории, растворитель рассматривается как химически индифферентная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия между частицами растворенного вещества, и между молекулами растворителя и частицами растворенного вещества. Частицы растворителя и растворенного вещества вследствие процессов диффузии перемешиваются и равномерно распределяются по всему объему раствора. Как выяснилось впоследствии, физическая теория удовлетворительно описывает поведение лишь идеальных растворов, в которых частицы растворителя и частицы растворенного вещества действительно практически не взаимодействуют между собой. Примерами идеальных растворов являются многие газовые растворы. Не реагирующие между собой газы смешиваются друг с другом в неограниченных соотношениях.

Химическая или сольватная теория растворов предложена Д. И. Менделеевым (1887 г. ). Суть этой теории состоит в том, что между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате которого образуются нестойкие соединения переменного состава называемые сольватами или гидратами, если растворителем является вода. Менделеев, посвятивший исследованиям растворов более сорока лет, первым указал, что в реальном растворе могут существовать не только частицы растворенного вещества и растворителя (примерами таких растворов являются растворы Н 2, О 2, N 2 в воде или в жидких углеводородах), но часто может происходить химическое или физическое взаимодействие частиц растворяемого вещества с растворителем. Это легло в основу разработанной им теории растворов.

Главную роль в образовании сольватов играет водородная связь. СОЛЬВАТЫ - продукты присоединения растворителя к растворенным веществам. Исследование растворов различными методами показало, что в водных растворах образуются соединения частиц растворенного вещества с молекулами воды — гидраты. В случае сульфата меди присутствие гидратов легко обнаружить по изменению цвета: без водная соль белого цвета, растворяясь в воде, образует раствор синего цвета. Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов. Кристаллические вещества, содержащие в своем составе воду, называются кристаллогидратами, а вода, входящая в структуру таких кристаллов, называется кристаллизационной.

Таким образом, растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны растворы, как и химические соединения, однородны. Образование растворов сопровождается, как правило, тепловым эффектом, что свидетельствует о взаимодействии растворенного вещества с моле кулами растворителя. С другой стороны, в растворах нет строгого соотношения между растворенным веществом и растворителем, т. е. растворы не подчиняются закону постоянства состава, кроме того, они могут быть разделены на составные части.

Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в воде или при плавлении.

Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др. ). Слабые электролиты — химические соединения, молкулы которых даже в сильно разбавленных растворах незначительно диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.

Диссоциация на ионы происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость. Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы. В растворах электролитов каждый ион окружен определенным количеством диполей воды.

Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс. Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа: Константа диссоциации Kd определяется равновесными активностями катионов, анионов и недиссоциированных молекул следующим образом:

В обще виде константу диссоциации для равновесия An. Bm n. Am+ + m. Bn надо представлять так: Kd = Здесь [Am+] и [Bn ] равновесные концентрации ионов, – равновесная концентрация непродиссоциированного вещества. Значение Kd не зависит от концентрации раствора, а определяется только природой растворённого вещества и растворителя и температурой и может быть определено различными экспериментальными методами. Таким образом, для различных электролитов при постоянной температуре константа диссоциации есть величина – характеризующая его природу и для каждого электролита она имеет свое определенное значение. В таблицах приведены значения констант диссоциации некоторых электролитов (кислот и оснований) в водных растворах.
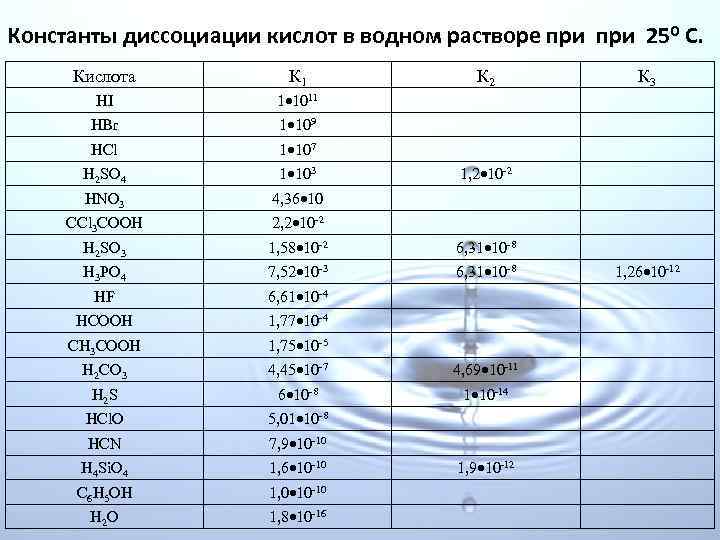
Константы диссоциации кислот в водном растворе при 250 С. Кислота К 1 К 2 К 3 HI 1 1011 HBr 1 109 HCl 1 107 H 2 SO 4 1 103 1, 2 10 2 HNO 3 4, 36 10 CCl 3 COOH 2, 2 10 2 H 2 SO 3 1, 58 10 2 6, 31 10 8 H 3 PO 4 7, 52 10 3 6, 31 10 8 1, 26 10 12 HF 6, 61 10 4 HCOOH 1, 77 10 4 CH 3 COOH 1, 75 10 5 H 2 CO 3 4, 45 10 7 4, 69 10 11 H 2 S 6 10 8 1 10 14 HCl. O 5, 01 10 8 HCN 7, 9 10 10 H 4 Si. O 4 1, 6 10 10 1, 9 10 12 C 6 H 5 OH 1, 0 10 10 H 2 O 1, 8 10 16
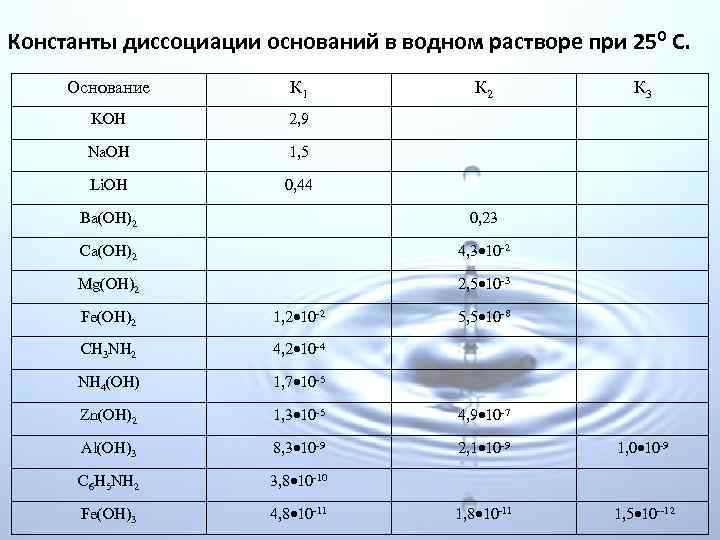
Константы диссоциации оснований в водном растворе при 250 С. Основание К 1 К 2 К 3 KOH 2, 9 Na. OH 1, 5 Li. OH 0, 44 Ba(OH)2 0, 23 Ca(OH)2 4, 3 10 2 Mg(OH)2 2, 5 10 3 Fe(OH)2 1, 2 10 2 5, 5 10 8 CH 3 NH 2 4, 2 10 4 NH 4(ОН) 1, 7 10 5 Zn(OH)2 1, 3 10 5 4, 9 10 7 Al(OH)3 8, 3 10 9 2, 1 10‑ 9 1, 0 10 9 C 6 H 5 NH 2 3, 8 10 10 Fe(OH)3 4, 8 10 11 1, 8 10‑ 11 1, 5 10 12

Константа диссоциации характеризует «силу электролита» , если она больше 1, электролит считается сильным, если < 1, слабым. Для многоосновных электролитов, константа диссоциации уменьшается по мере возрастания стадий. Пример: диссоциация многоосновной борной кислоты: I стадия: H 3 BO 3 ↔ H+ + H 2 BO 3−, II стадия: H 2 BO 3− ↔ H+ + HBO 32−, III стадия: HBO 32− ↔ H+ + BO 33−, Константа диссоциации по первой ступени для таких электролитов всегда много больше последующих, что означает, что диссоциация таких соединений идёт главным образом по первой стадии. Первый ион водорода H+ отрывается от молекулы легче, чем последующие от положительно заряженных анионов.

Кроме константы диссоциации силу электролита можно определить по значению другого параметра, зависящего от концентрации раствора. Таким параметром является кажущаяся степень диссоциации которая показывает долю молекул распавшихся на ионы. Степень диссоциации (a ) - это отношение числа распавшихся на ионы молекул (Nдис. ) к общему числу молекул растворенного вещества (Nобщ. ):

Степень диссоциации выражают в долях единицы или в процентах. Поскольку общее число молекул вещества в растворе пропорционально количеству его вещества и его молярной концентрации, то можно записать: где nдис. и cдис. соответственно, количество и молярная концентрация растворенного вещества, подвергшегося электролитической диссоциации. Сильные электролиты < 30% ( > 0, 3) Электролиты, которые в разбавленном водном растворе диссоциируют практически полностью. Их диссоциация практически необратимый процесс. Слабые электролиты < 3% ( < 0, 03) Электролиты, которые в разбавленном водном растворе диссоциируют частично, называют слабыми. Диссоциация слабых электролитов обратимый процесс. В остальных случаях электролиты считаются средней силы.

С точки зрения теории электролитической диссоциации : кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов водорода и анионов кислотного остатка, основания - это вещества, диссоциирующие в водном растворе с образованием гидроксид-ионов OH- и катионов металла. амфотерные гидроксиды (амфолиты) - это вещества, диссоциирующие в водном растворе как по типу кислот, так и по типу оснований. Слабые многоосновные кислоты диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации. В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, Na. HSO 4, Na. HCO 3, K 2 HPO 4 и т. д. Слабые многокислотные основания диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации. Этим объясняют способность многокислотных оснований образовывать основные соли: Cu. OHCl, (Zn. OH)2 SO 4 и др.

Степень электролитической диссоциации зависит от: § природы электролита и растворителя; § концентрации раствора; § температуры она возрастает при увеличении разбавления раствора. Степень диссоциации возрастает при увеличении температуры раствора. Увеличение кинетической энергии растворенных частиц способствует распаду молекул на ионы, что приводит к возрастанию степени диссоциации при нагревании растворов. Если в растворе слабой кислоты или слабого основания увеличить концентрацию одноименного иона введением соответствующей соли, то наблюдается резкое изменение степени диссоциации слабого электролита.

Между константой и степенью диссоциации существует определенная закономерность, которую в 1888 г. обнаружил В. Оствальд и сумел ее объяснить. Эта закономерность впоследствии была названа законом разведения Оствальда. Kд связана с α простой зависимостью. Если общую молярную концентрацию электролита в растворе обозначить СКА , то для бинарных электролитов концентрации ионов Ky+ и Ax будут равны a·CKA. Очевидно, что [Ky+] = [Ax ] = a·CKA , [KA] = CKA a·CKA = CKA·(1 a ), тогда Вильгельм Фридрих Оствальд (2. 09. 1853, — 4. 04. 1932)— балтийский немец, физико химик и философ идеалист, лауреат Нобелевской премии по химии 1909 года.

Для слабых электролитов α → 0 и (1 a )→ 1. Следовательно: закона разбавления Оствальда: степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.

Вода является очень слабым амфотерным электролитом: H 2 O « H+ + OH ; D H° » 56 к. Дж. Свободные ионы водорода H+ не способны к существованию в водном растворе они мгновенно гидратируются водой до гидратов переменного состава (H 2 n+1 O n +). Однако, для простоты записи часто используют обозначение H+: Константа диссоциации воды равна: В воде и разбавленных водных растворах электролитов молярная концентрация воды практически постоянна и равна: где 1000 масса 1 л воды, г; 18 молярная масса воды, г/моль.
![KВ·[H 2 O] = [H+]·[OH ] = 1, 8· 10 16· 55, 6 = KВ·[H 2 O] = [H+]·[OH ] = 1, 8· 10 16· 55, 6 =](https://present5.com/presentation/96159091_140577008/image-21.jpg)
KВ·[H 2 O] = [H+]·[OH ] = 1, 8· 10 16· 55, 6 = 1· 10 14 (моль/л) Произведение равновесных концентраций ионов водорода и гидроксила в воде и разбавленных водных растворах (при постоянной температуре) есть величина постоянная - ионное произведение воды (KВ). При увеличении температуры KВ значительно возрастает: t, °С 0 KВ· 1014 0, 1139 18 25 30 50 60 0, 5702 1, 0008 1, 469 5, 474 9, 614 Следовательно, в чистой воде при 25 ° С [H+] = [OH ] = 1· 10 7 моль/л. В водных растворах электролитов молярные концентрации ионов H+ и OH не обязательно равны 10 моль/л (как в чистой воде), но их произведение при 25 ° С всегда равно 1· 10 14. Следовательно, если задано значение [H+], то легко определить и [OH ], и наоборот:
![В кислых растворах преобладает концентрация ионов H+: [H+] > [OH ], т. е. [H+] В кислых растворах преобладает концентрация ионов H+: [H+] > [OH ], т. е. [H+]](https://present5.com/presentation/96159091_140577008/image-22.jpg)
В кислых растворах преобладает концентрация ионов H+: [H+] > [OH ], т. е. [H+] > 1· 10 7 и [OH ] < 1· 10 7 моль/л. В основных растворах преобладает концентрация ионов [OH ]: [OH ] > [H+], т. е. [OH ] >1· 10 7 и [H+] < 1· 10 7 моль/л.
![Для удобства вместо значений [H+] используют водородный показатель p. H. Водородный показатель есть отрицательный Для удобства вместо значений [H+] используют водородный показатель p. H. Водородный показатель есть отрицательный](https://present5.com/presentation/96159091_140577008/image-23.jpg)
Для удобства вместо значений [H+] используют водородный показатель p. H. Водородный показатель есть отрицательный десятичный логарифм числового значения молярной концентрации ионов водорода: p. H = - lg [H+] По аналогии используют гидроксильный показатель (p. OH): p. OH = - lg [OH-] Величина p. H используется как мера кислотности, нейтральности или основности водных растворов: в кислой среде p. H < 7; в нейтральной среде p. H = 7; в основной среде p. H > 7. Значение p. H может быть больше 14 (очень щелочная среда) или отрицательным (очень кислая среда) только при очень больших концентрациях (>10 М/л). Поскольку такие концентрации используются крайне редко, считается, что 0 < р. Н < 14.
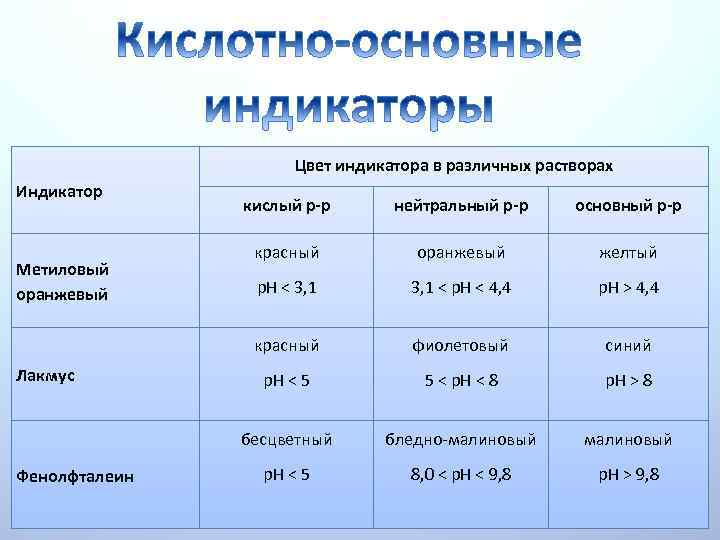
Цвет индикатора в различных растворах Индикатор Фенолфталеин основный р-р красный оранжевый желтый р. Н < 3, 1 < p. H < 4, 4 р. Н > 4, 4 фиолетовый синий р. Н < 5 5 < p. H < 8 р. Н > 8 бесцветный Лакмус нейтральный р-р красный Метиловый оранжевый кислый р-р бледно малиновый р. Н < 5 8, 0 < p. H < 9, 8 р. Н > 9, 8


Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.

Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена. В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода). В таких случаях реакции будут практически не обратимы. Реакцию обмена в растворе принято изображать тремя уравнениями: § молекулярным, § полным ионным § сокращённым ионным. Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2↑ +H 2 O 2 Na+ + CO 32 + 2 H+ + SO 42 → 2 Na+ + SO 42 + CO 2↑ + H 2 O CO 32 + 2 H+ → CO 2↑ + H 2 O Необходимым условием протекания обменных реакций в растворах электролитов является удаление из раствора тех или иных ионов вследствие образования малодиссоциирующих (слабые электролиты и комплексные ионы) или малорастворимых веществ (осадки и газы).

Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах. Реакции с образованием слабого электролита: а) Воды: 2 Na. OH + H 2 SO 4 = H 2 O + Na 2 SO 4 2 Na+ + 2 OH + 2 H+ +SO = 2 H 2 O + 2 Na+ + SO OH + H+ = H 2 O б) Слабой кислоты: 2 Na. NO 2 + H 2 SO 4 = 2 HNO 2 + Na 2 SO 4 2 Na+ + 2 NO 2 + 2 H+ + SO = 2 HNO 2 + 2 Na+ + SO H+ + NO 2 = HNO 2 в) Слабого основания: NH 4 Cl + Na. OH = NH 4 OH + Na. Cl NH 4+ + Cl + Na+ + OH = NH 4 OH + Na+ + Cl NH 4+ + OH = NH 4 OH Реакции нейтрализации слабых кислот (оснований) сильными основаниями (кислотами) или слабых кислот слабыми основаниями не доходят до конца (т. е. точка эквивалентности находится, соответственно, в основной или кислой области значений р. Н).

Na 2 S + 2 HCl = H 2 S↑ + 2 Na. Cl 2 Na+ + S 2 + 2 H+ + 2 Cl = H 2 S↑ + 2 Na+ + 2 Cl 2 H+ + S 2 = H 2 S↑
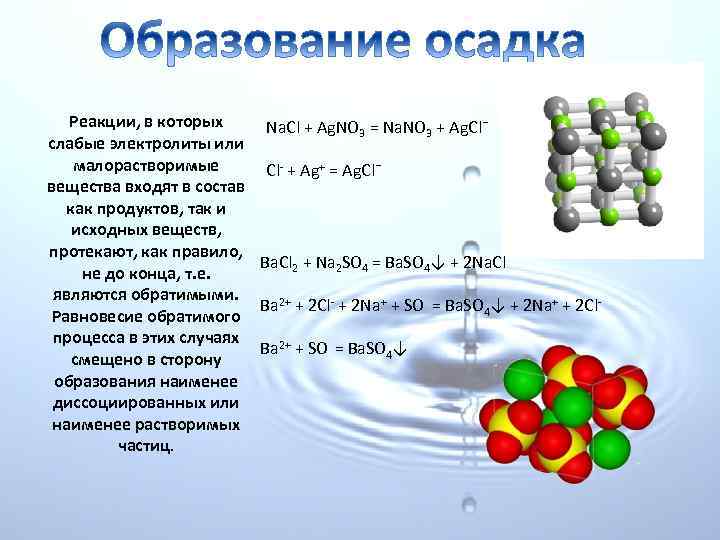
Реакции, в которых Na. Cl + Ag. NO 3 = Na. NO 3 + Ag. Cl¯ слабые электролиты или малорастворимые Cl + Ag+ = Ag. Cl¯ вещества входят в состав как продуктов, так и исходных веществ, протекают, как правило, Ba. Cl 2 + Na 2 SO 4 = Ba. SO 4↓ + 2 Na. Cl не до конца, т. е. являются обратимыми. Ba 2+ + 2 Cl + 2 Na+ + SO = Ba. SO 4↓ + 2 Na+ + 2 Cl Равновесие обратимого процесса в этих случаях Ba 2+ + SO = Ba. SO 4↓ смещено в сторону образования наименее диссоциированных или наименее растворимых частиц.

Абсолютно нерастворимых веществ нет. Большинство твердых веществ обладают ограниченной растворимостью. В насыщенных растворах электролитов малорастворимых веществ в состоянии динамического равновесия находятся осадок и насыщенный раствор электролита. Произведение растворимости характеризует растворимость малорастворимого вещества при данной температуре: чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора. В насыщенном растворе сильного малорастворимого электролита произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам при данных ионах (при данной температуре), есть величина постоянная, называемая произведением растворимости. Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ. Чем больше ПР данного вещества, тем больше его растворимость.

Данное условие достигают введением одноименного Условие образования осадка: иона в систему насыщенный раствор осадок. Подобный [Ky+]x·[Ax ]y > ПР(Kx. Ay). раствор является пересыщенным относительно данного электролита, поэтому из него будет выпадать осадок. Условие растворения осадка: [Ky+]x·[Ax ]y < ПР(Kx. Ay). Это условие достигают, связывая один из ионов, посылаемых осадком в раствор. Раствор в данном случае ненасыщенный. При введении в него кристаллов малорастворимого электролита они будут растворяться. Равновесные молярные концентрации ионов Ky+ и Ax пропорциональны растворимости S (моль/л) вещества Kx. Ay: [Ky+] = x· S и [Ax ] = y· S Отсюда ПР = (x· S)x· (y· S)y = xx· yy· Sx+y

Обменную реакцию между водой и соединением называют гидролизом. Гидролизом соли называют реакцию поляризационного взаимодействия ионов соли с молекулами воды, сопровождающуюся образованием малодиссоциирующщих веществ и изменением р. Н среды. Ky+ + HOH « KOH(y 1) + H+ Ax + HOH « HA(x 1) + OH Чем больше заряд и меньше радиус ионов соли, тем сильнее их поляризационное взаимодействие с водой, слабее диссоциация образующихся частиц KOH(y-1) и HA(x-1) и тем в большей степени происходит гидролиз. Соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются (р. Н = 7). Возможны следующие случаи гидролиза солей: § гидролиз по аниону, § по катиону и аниону одновременно.

Гидролиз по катиону. § Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты. § При гидролизе создается кислая среда (р. Н < 7). § Характер продуктов гидролиза зависит от природы катиона. катион однозарядный. катион многозарядный. NH 4 Cl ® NH 4+ + Cl Cu. Cl 2 ® Cu 2+ + Cl NH 4+ + HOH « NH 4 OH + H+ Cu 2+ + HOH « Cu. OH+ + H+ (1 ступень) молекулярное уравнение гидролиза: Cu. OH+ + HOH « Cu(OH)2 + H+ (2 ступень) NH 4 Cl + H 2 O « NH 4 OH + HCl Молекулярные уравнения, соответственно, имеют вид: Cu. Cl 2 + H 2 O « Cu. OHCl + HCl (1 ступень) Cu. OHCl + H 2 O « Cu(OH)2 + HCl (2 ступень)

Гидролиз по аниону. § Он характерен для солей, образованных катионом сильного основания и анионом слабой кислоты. § При гидролизе создается основная среда (р. Н > 7) § Вид продуктов гидролиза зависит от величины заряда и природы аниона. анион однозарядный. KCN ® K+ + CN + HOH « HCN + OH Молекулярное уравнение гидролиза: KCN + H 2 O « HCN + KOH анион многозарядный. K 2 CO 3 ® 2 K+ + CO 32 , CO 32 + HOH « HCO 3 + OH Молекулярное уравнение 1 ступени гидролиза: K 2 CO 3 + H 2 O « KHCO 3 + KOH

Гидролиз по катиону и аниону. Этот случай имеет место для солей, образованных катионом слабого основания и анионом слабой кислоты. Причем, чаще всего независимо от величины заряда катиона и аниона, продуктами гидролиза являются слабое основание и слабая кислота. Характер среды определяется соотношением величины констант диссоциации образующихся кислот и оснований, т. е. их силой. NH 4 CN ® NH 4+ + CN NH 4+ + HOH « NH 4 OH + H+ CN + HOH « HCN + OH NH 4+ + CN + 2 H 2 O « NH 4 OH + HCN + H+ + OH Молекулярное уравнение гидролиза: NH 4 CN + 2 H 2 O « NH 4 OH + HCN Гидролиз в данном случае протекает довольно интенсивно. Образующиеся при гидролизе ионы H+ и OH связываются в молекулы H 2 O, что усиливает гидролиз и по катиону и по аниону. Реакция среды в данном случае слабоосновная (р. Н несколько больше 7). Если кислота и основание, образующие соль, не только являются слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, гидролиз таких солей в ряде случаев протекает практически необратимо. 2 Al. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Al(OH)3¯ + 3 CO 2 + 6 Na. Cl 2 Cr. Cl 3 + 3 Na 2 S + 6 H 2 O = 2 Cr(OH)3¯ + 3 H 2 S + 6 Na. Cl Ионно молекулярные уравнения гидролиза, соответственно: 2 Al 3+ + 3 CO 32 + 3 HOH = 2 Al(OH)3¯ + 3 CO 2 2 Cr 3+ + 3 S 2 + 6 HOH = 2 Cr(OH)3¯ + 3 H 2 S

Равновесие в процессе гидролиза солей подчиняется закону действующих масс. Если в результате гидролиза образуется нерастворимое или легколетучее вещество, гидролиз идёт практически до полного разложения исходной соли. В остальных случаях гидролиз солей проходит тем полнее, чем слабее соответствующая соли кислота или основание. Если гидролизу подвергается соль, образованная слабой кислотой и сильным основанием, раствор имеет щелочную реакцию среды; это объясняется тем, что анион слабой кислоты частично связывает образовавшиеся при диссоциации воды ионы H+ и в растворе остаётся избыток ионов OH . Раствор соли сильной кислоты и слабого основания— кислый. Если заряд катиона (или аниона) соли больше единицы, то гидролиз часто приводит к образованию кислых (или основных) солей в качестве продуктов первой ступени процесса. Количественной характеристикой гидролиза солей служит степень гидролиза (β), определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. С повышением температуры и разбавлением раствора степень гидролиз увеличивается.

Презентация. растворы..pptx