лекция 24.ppt
- Количество слайдов: 16

Физическая и химическая адсорбция на поверхности твердых тел Адсорбция - процесс концентрирования вещества на границе раздела двух фаз. Вещество, на поверхности которого происходит адсорбция — адсорбент, а поглощаемое из объемной фазы — адсорбат. По характеру силовых взаимодействий между молекулами адсорбата и поверхностью адсорбента различают: физическую адсорбцию (физадсорбцию) химическую адсорбцию (хемосорбцию) Физическая и химическая адсорбции – два последовательных этапа единого сорбционного процесса

Причины возникновения физической адсорбции Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса) Водородная связь Межмолекулярные взаимодействия по своей природе относятся к типу диполь-дипольных взаимодействий и включают: дисперсионные силы, порожденные синхронными осцилляциями взаимодействующих диполей, — (адсорбция неполярных молекул (N 2, О 2, Н 2 и инертных газов) на неполярных адсорбентах (типа графита и угля)); индукционные силы, порожденные взаимодействием диполя с другим наведенным им диполем, — ( адсорбция неполярных молекул (N 2, О 2, Н 2 и инертных газов) на полярных адсорбентах с ионной связью (типа Na. Cl, Ba. O и др. ) и для адсорбции полярных молекул (Н 2 О, СО 2, NН 3 и др. ) на неполярных адсорбентах и металлах); ориентационные силы, порожденные взаимной ориентацией взаимодействующих диполей — адсорбция полярных молекул (Н 2 О, СО 2, NН 3 и др. ) на полярных адсорбентах с ионной связью (типа Na. Cl, Ba. O и др. ). Водородная связь обеспечивает адсорбцию полярных молекул (Н 2 О, СО 2, NН 3 и др. ) на поверхности адсорбентов с гидроксильными группами ОН (типа стекол, силикагелей и цеолитов).
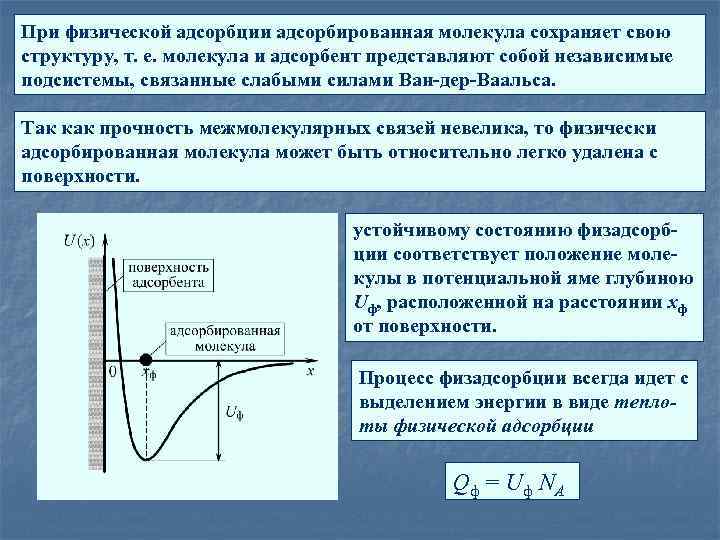
При физической адсорбции адсорбированная молекула сохраняет свою структуру, т. е. молекула и адсорбент представляют собой независимые подсистемы, связанные слабыми силами Ван-дер-Ваальса. Так как прочность межмолекулярных связей невелика, то физически адсорбированная молекула может быть относительно легко удалена с поверхности. устойчивому состоянию физадсорбции соответствует положение молекулы в потенциальной яме глубиною Uф, расположенной на расстоянии xф от поверхности. Процесс физадсорбции всегда идет с выделением энергии в виде теплоты физической адсорбции Qф = Uф NА

τа - среднее время жизни молекулы в адсорбированном состоянии основной параметр, определяющий постоянную времени процесса физадсорбции 0 10 – 13 сек (близка к периоду колебаний молекулы в потенциальной яме) , Qф обычно не превышает 10 ккал/моль, τа при комнатной температуре составляет микросекунды, уменьшаясь с ростом температуры. Кинетической характеристикой процесса служит степень заполнения адсорбционных центров где, Nа(t) — концентрация занятых адсорбционных центров (т. е. адсорбированных молекул) в момент времени t, а Nц — общее число адсорбционных центров на единице площади.

Физической адсорбцией начинается и заканчивается сорбционный процесс только для инертных газов, молекулы которых, имея полностью застроенную электронную конфигурацию, способны удерживаться у поверхности лишь межмолекулярными силами Ван-дер -Ваальса. Молекулы других газов и паров металлов, пройдя этап физадсорбции, способны к дальнейшему более сильному взаимодействию с поверхностью за счет сил химической природы типа гомеополярной и гетерополярной связи. Поскольку такая связь возможна лишь на атомарном уровне, то физически адсорбированная молекула предварительно диссоциирует на атомы, которые и обеспечивают межатомное взаимодействие, лежащее в основе процесса хемосорбции. Хемосорбцию нельзя считать химической реакцией, так как при этом не образуется каких-либо новых веществ.
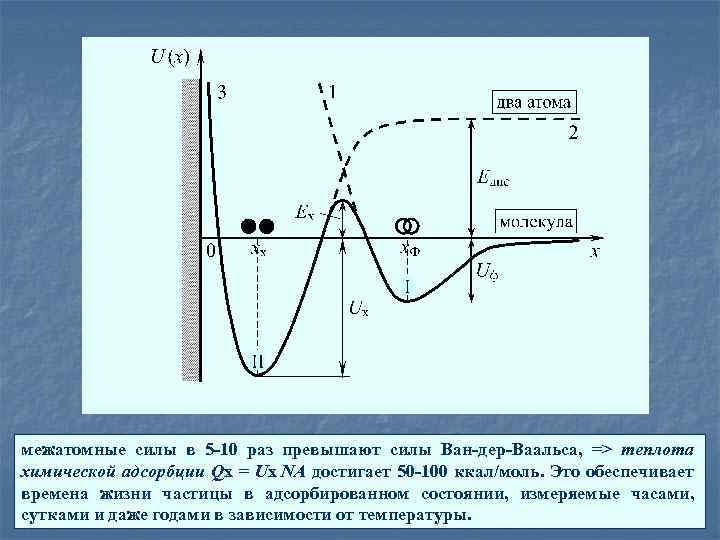
межатомные силы в 5 -10 раз превышают силы Ван-дер-Ваальса, => теплота химической адсорбции Qх = Uх NА достигает 50 -100 ккал/моль. Это обеспечивает времена жизни частицы в адсорбированном состоянии, измеряемые часами, сутками и даже годами в зависимости от температуры.


Кинетика процесса физической адсорбции. Уравнение изотермы Ленгмюра Nа Nц d. N +/ dt - плотность потока адсорбируемых частиц, d. N / dt плотность потока десорбируемых частиц при температуре Т из парогазовой фазы, имеющей для рассматриваемого компонента парциальное давление р, на любую поверхность падает поток молекул с массой m , имеющий плотность:

Зависимость коэффициента конденсации α от степени заполнения адсорбционных центров описывается функцией такой, что α( ) = α 0 (1 - ) для свободной поверхности (при = 0) и α= 0 для полностью заполненного монослоя (при = 1). Тогда плотность потока адсорбируемых молекул равняется Число молекул, десорбируемых с единицы площади в единицу времени (т. е. плотность потока d. N / dt), прямо пропорционально концентрации молекул Nа = Nц , адсорбированных в данный момент на поверхности, и обратно пропорционально среднему времени τа их жизни в адсорбированном состоянии



0 - стационарная степень заполнения, достигаемая при t → ∞ уравнение изотермы Ленгмюра


Роль адсорбции, растворения и диффузии в газопоглощении материалов Процесс газопоглощения заключается в проникновении газовых молекул внутрь твердого тела с образованием твердых растворов или химических соединений в объеме этого тела. Молекулы газа, пройдя предварительные этапы физической и химической адсорбции на поверхности твердого тела, растворяются в его поверхностных слоях путем вхождения в кристаллическую решетку с последующим диффузионным распределением по всему объему. Физадсорбция, хемосорбция, растворение и диффузия - четыре последовательные стадии единого процесса поглощения газов твердым телом. Исключение одной из стадий в этой последовательности делает невозможным газопоглощение в целом. Газы, не хемосорбируемые поверхностью металлов, не растворяются в них: все благородные газы и азот не хемосорбируются такими металлами, как Cu, Ni, Al, Ag, Au
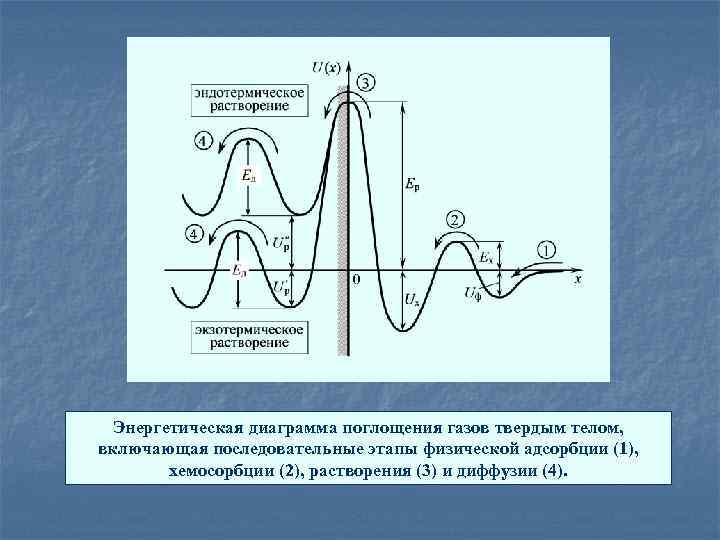
Энергетическая диаграмма поглощения газов твердым телом, включающая последовательные этапы физической адсорбции (1), хемосорбции (2), растворения (3) и диффузии (4).

при поглощении двухатомных газов (типа Н 2, N 2 и др. ) металлами концентрация атомов газа, растворенных в поверхностных слоях металла, связана законом Сивертса, s(Т) – коэффициент растворимости. тепловой эффект процесса растворения Если энергия связи атомов с решеткой велика, то процесс растворения экзотермический, т. е. сопровождается выделением теплоты (Hpаст = Qp. NА < 0). поглощении газов активными газопоглощающими материалами типа Ti, Zr, Ta, Nb и др. , в которых растворение газов идет с образованием химических соединений в твердой фазе (гидридов, нитридов, оксидов и т. д. ) Т↑ s(Т )↓ Если энергия связи атомов с решеткой относительно невелика, то процесс растворения эндотермический, т. е. сопровождается поглощением теплоты (Hpаст = Qp NА 0). поглощении газов обычными конструкционными металлами типа Fe, Ni, Cu, W, Mo и их сплавами, в которых растворение газов идет в основном с образованием твердых растворов. Т↑ s(Т )↑
лекция 24.ppt