Механизм мышечного сокращения.pptx
- Количество слайдов: 18
 ФГАОУВПО Казанский (Приволжский) Федеральный университет “Механизм мышечного сокращения. Роль АТФ и ионов Са 2+. ” Работу подготовили: Студентки группы 17. 2 -504 Камаева А. , Салихова Э. Руководитель: Розенталь С. Г. , Доцент, к. б. н. ИФМи. Б 2016
ФГАОУВПО Казанский (Приволжский) Федеральный университет “Механизм мышечного сокращения. Роль АТФ и ионов Са 2+. ” Работу подготовили: Студентки группы 17. 2 -504 Камаева А. , Салихова Э. Руководитель: Розенталь С. Г. , Доцент, к. б. н. ИФМи. Б 2016
 2 Задачи работы ØРассмотреть механизм мышечного сокращения на молекулярном уровне ØОпределить фазы мышечного сокращения ØОбозначить роль АТФ и ионов Ca 2+
2 Задачи работы ØРассмотреть механизм мышечного сокращения на молекулярном уровне ØОпределить фазы мышечного сокращения ØОбозначить роль АТФ и ионов Ca 2+
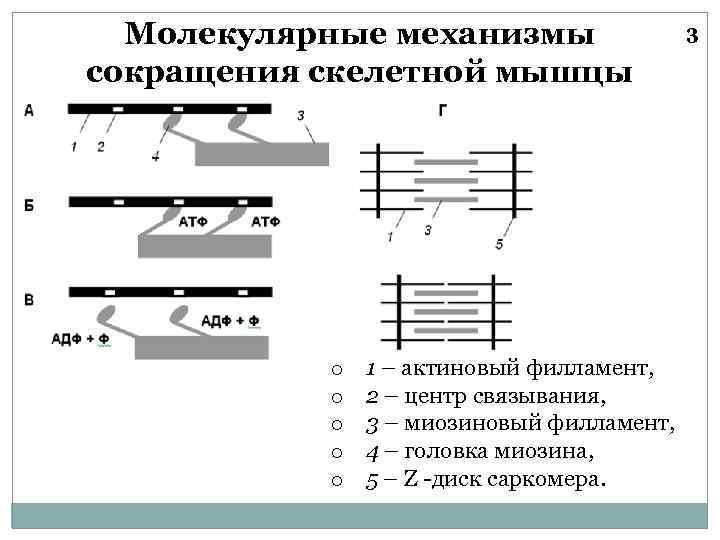 Молекулярные механизмы сокращения скелетной мышцы o o o 1 – актиновый филламент, 2 – центр связывания, 3 – миозиновый филламент, 4 – головка миозина, 5 – Z -диск саркомера. 3
Молекулярные механизмы сокращения скелетной мышцы o o o 1 – актиновый филламент, 2 – центр связывания, 3 – миозиновый филламент, 4 – головка миозина, 5 – Z -диск саркомера. 3
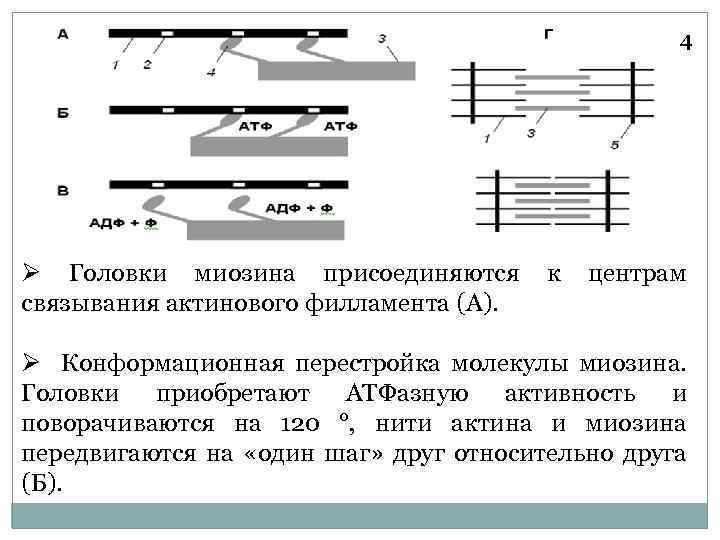 4 Ø Головки миозина присоединяются к центрам связывания актинового филламента (А). Ø Конформационная перестройка молекулы миозина. Головки приобретают АТФазную активность и поворачиваются на 120 °, нити актина и миозина передвигаются на «один шаг» друг относительно друга (Б).
4 Ø Головки миозина присоединяются к центрам связывания актинового филламента (А). Ø Конформационная перестройка молекулы миозина. Головки приобретают АТФазную активность и поворачиваются на 120 °, нити актина и миозина передвигаются на «один шаг» друг относительно друга (Б).
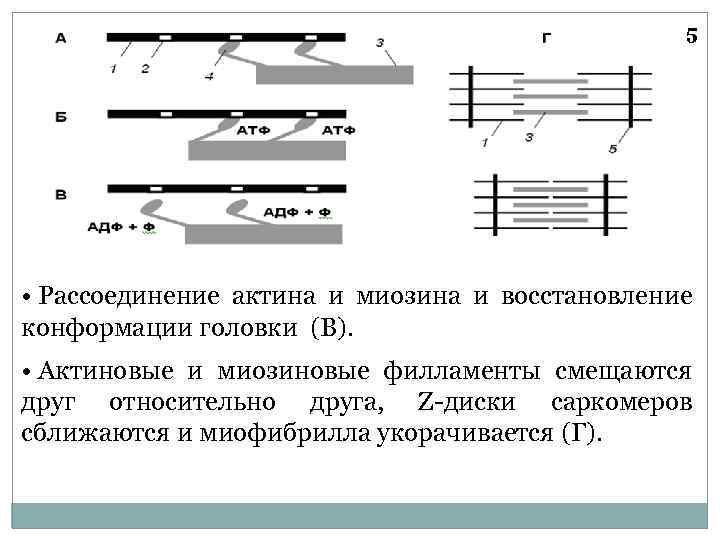 5 • Рассоединение актина и миозина и восстановление конформации головки (В). • Актиновые и миозиновые филламенты смещаются друг относительно друга, Z-диски саркомеров сближаются и миофибрилла укорачивается (Г).
5 • Рассоединение актина и миозина и восстановление конформации головки (В). • Актиновые и миозиновые филламенты смещаются друг относительно друга, Z-диски саркомеров сближаются и миофибрилла укорачивается (Г).
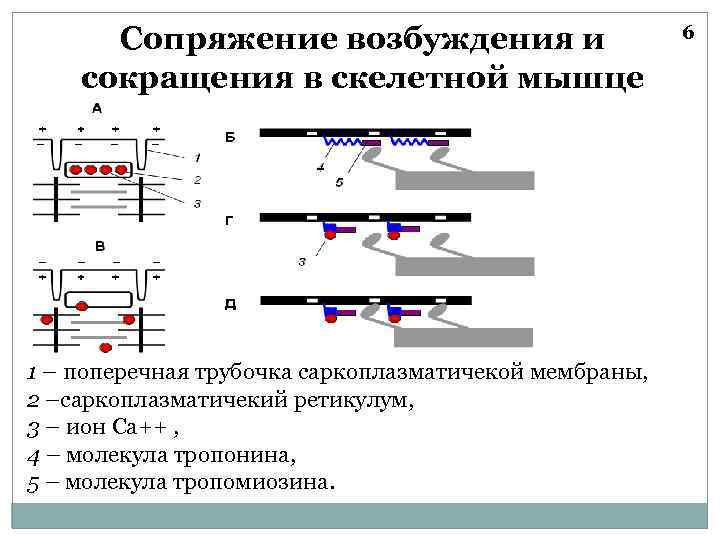 Сопряжение возбуждения и сокращения в скелетной мышце 1 – поперечная трубочка саркоплазматичекой мембраны, 2 –саркоплазматичекий ретикулум, 3 – ион Са++ , 4 – молекула тропонина, 5 – молекула тропомиозина. 6
Сопряжение возбуждения и сокращения в скелетной мышце 1 – поперечная трубочка саркоплазматичекой мембраны, 2 –саркоплазматичекий ретикулум, 3 – ион Са++ , 4 – молекула тропонина, 5 – молекула тропомиозина. 6
 Расслабление скелетной мышцы 7 v Расслабление мышцы вызывается обратным переносом ионов Са++ посредством кальциевого насоса в каналы саркоплазматического ретикулума. v Контрактурой называют стойкое длительное сокращение мышцы, сохраняющееся после прекращения действия раздражителя. v Кратковременная контрактура может развиваться после тетанического сокращения в результате накопления в саркоплазме большого количества Са++; длительная (иногда необратимая) контрактура может возникать в результате отравления ядами, нарушений метаболизма.
Расслабление скелетной мышцы 7 v Расслабление мышцы вызывается обратным переносом ионов Са++ посредством кальциевого насоса в каналы саркоплазматического ретикулума. v Контрактурой называют стойкое длительное сокращение мышцы, сохраняющееся после прекращения действия раздражителя. v Кратковременная контрактура может развиваться после тетанического сокращения в результате накопления в саркоплазме большого количества Са++; длительная (иногда необратимая) контрактура может возникать в результате отравления ядами, нарушений метаболизма.
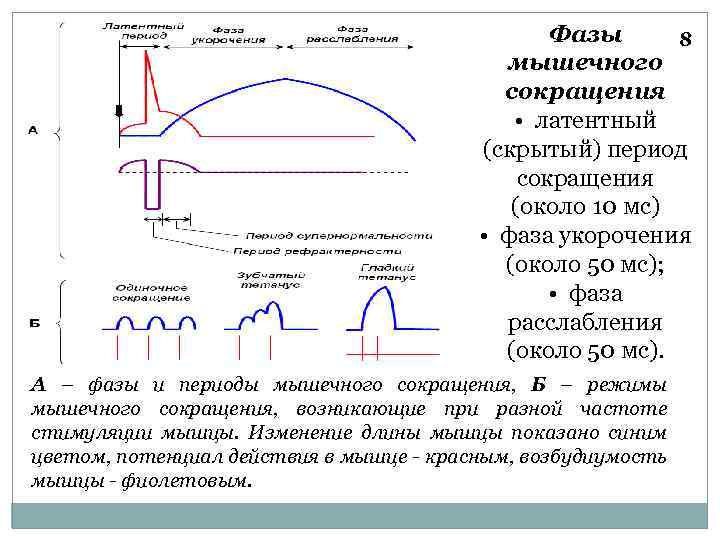 Фазы 8 мышечного сокращения • латентный (скрытый) период сокращения (около 10 мс) • фаза укорочения (около 50 мс); • фаза расслабления (около 50 мс). А – фазы и периоды мышечного сокращения, Б – режимы мышечного сокращения, возникающие при разной частоте стимуляции мышцы. Изменение длины мышцы показано синим цветом, потенциал действия в мышце - красным, возбудиумость мышцы - фиолетовым.
Фазы 8 мышечного сокращения • латентный (скрытый) период сокращения (около 10 мс) • фаза укорочения (около 50 мс); • фаза расслабления (около 50 мс). А – фазы и периоды мышечного сокращения, Б – режимы мышечного сокращения, возникающие при разной частоте стимуляции мышцы. Изменение длины мышцы показано синим цветом, потенциал действия в мышце - красным, возбудиумость мышцы - фиолетовым.
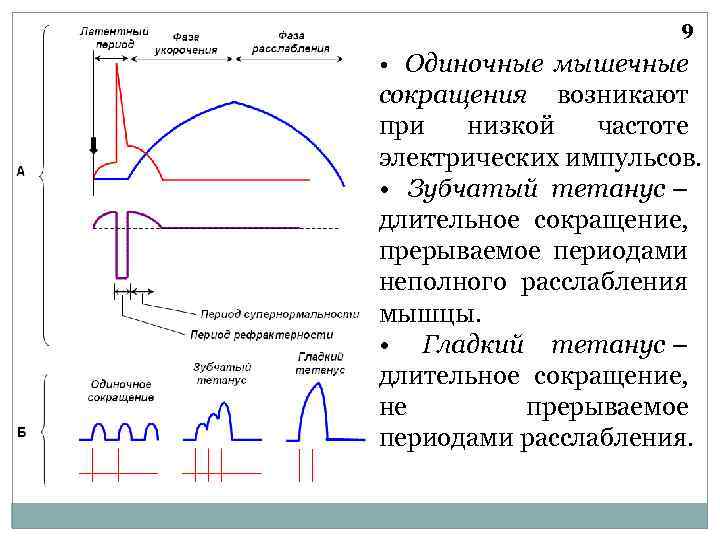 9 • Одиночные мышечные сокращения возникают при низкой частоте электрических импульсов. • Зубчатый тетанус – длительное сокращение, прерываемое периодами неполного расслабления мышцы. • Гладкий тетанус – длительное сокращение, не прерываемое периодами расслабления.
9 • Одиночные мышечные сокращения возникают при низкой частоте электрических импульсов. • Зубчатый тетанус – длительное сокращение, прерываемое периодами неполного расслабления мышцы. • Гладкий тетанус – длительное сокращение, не прерываемое периодами расслабления.
 Оптимум и пессимум частоты 10 Ø Оптимумом частоты называют такую частоту раздражающих импульсов, при которой каждый последующий импульс совпадает с фазой повышенной возбудимости и соответственно вызывает тетанус наибольшей амплитуды. Ø Пессимумом частоты называют более высокую частоту раздражения, при которой каждый последующий импульс тока попадает в фазу рефрактерности, в результате чего амплитуда тетануса значительно уменьшается.
Оптимум и пессимум частоты 10 Ø Оптимумом частоты называют такую частоту раздражающих импульсов, при которой каждый последующий импульс совпадает с фазой повышенной возбудимости и соответственно вызывает тетанус наибольшей амплитуды. Ø Пессимумом частоты называют более высокую частоту раздражения, при которой каждый последующий импульс тока попадает в фазу рефрактерности, в результате чего амплитуда тетануса значительно уменьшается.
 11 Впервые В. А. Энгельгард и М. Н. Любимова в 1939 г. нашли, что мышечный белок — миозин — обладает свойствами фермента аденозинтри-фосфатазы (АТФаза). Эти авторы также обнаружили, что под влиянием АТФ изменяются и механические свойства миозина — резко увеличивается растяжимость его нитей. В последующие годы был открыт белок актин и показано, что он активирует АТФ-азную активность миозина.
11 Впервые В. А. Энгельгард и М. Н. Любимова в 1939 г. нашли, что мышечный белок — миозин — обладает свойствами фермента аденозинтри-фосфатазы (АТФаза). Эти авторы также обнаружили, что под влиянием АТФ изменяются и механические свойства миозина — резко увеличивается растяжимость его нитей. В последующие годы был открыт белок актин и показано, что он активирует АТФ-азную активность миозина.
 12 В настоящее время взаимодействие АТФ с сократительными белками и ионами Са 2+ представляют следующим образом: 1. В покоящейся мышце, т. е. в условиях, когда концентрация ионов Са 2+в миоплазме очень низкая, взаимодействию миозиновых и актиновых нитей препятствуют молекулы белка тропонина, расположенные на актиновых нитях. 2. Тропонин обладает очень высоким сродством к ионам Са 2+. Как только концентрация Са 2+ в миофибриллах повышается, тропонин связывает Са 2+и изменяет свое расположение на актиновой нити, что делает возможным ее взаимодействие с миозиновой нитью. 3. Разъединение осуществляется при расщеплении молекул АТФазой миозина.
12 В настоящее время взаимодействие АТФ с сократительными белками и ионами Са 2+ представляют следующим образом: 1. В покоящейся мышце, т. е. в условиях, когда концентрация ионов Са 2+в миоплазме очень низкая, взаимодействию миозиновых и актиновых нитей препятствуют молекулы белка тропонина, расположенные на актиновых нитях. 2. Тропонин обладает очень высоким сродством к ионам Са 2+. Как только концентрация Са 2+ в миофибриллах повышается, тропонин связывает Са 2+и изменяет свое расположение на актиновой нити, что делает возможным ее взаимодействие с миозиновой нитью. 3. Разъединение осуществляется при расщеплении молекул АТФазой миозина.
 13 Таким образом, взаимодействие миозина и актина, возможное при связывании Са 2+тропонином, активирует АТФ-азу миозина, последняя расщепляет АТФ, а это приводит к разъединению миозина и актина. В присутствии Са 2+и АТФ в миоплазме этот процесс многократно повторяется: мостики повторно образуются и расходятся, в результате чего актиновые нити «скользят» и мышечное волокно укорачивается.
13 Таким образом, взаимодействие миозина и актина, возможное при связывании Са 2+тропонином, активирует АТФ-азу миозина, последняя расщепляет АТФ, а это приводит к разъединению миозина и актина. В присутствии Са 2+и АТФ в миоплазме этот процесс многократно повторяется: мостики повторно образуются и расходятся, в результате чего актиновые нити «скользят» и мышечное волокно укорачивается.
 14 1) Работы натрий-калиевого насоса, обеспечивающего поддержание постоянства градиента концентрации ионов Na+ и К+по обе стороны мембраны; 2) процесса «скольжения» актиновых и миозиноеых нитей, ведущего к укорочению миофибрилл; 3) работы кальциевого насоса, необходимого для расслабления волокна. В соответствии с этим ферменты, расщепляющие АТФ, локализованы в трех различных структурах мышечного волокна: клеточной мембране, миозиновых нитях и мембранах саркоплазматического ретикулума.
14 1) Работы натрий-калиевого насоса, обеспечивающего поддержание постоянства градиента концентрации ионов Na+ и К+по обе стороны мембраны; 2) процесса «скольжения» актиновых и миозиноеых нитей, ведущего к укорочению миофибрилл; 3) работы кальциевого насоса, необходимого для расслабления волокна. В соответствии с этим ферменты, расщепляющие АТФ, локализованы в трех различных структурах мышечного волокна: клеточной мембране, миозиновых нитях и мембранах саркоплазматического ретикулума.
 15 Ресинтез АТФ, непрерывно расщепляющейся в процессе деятельности мышцы, осуществляется двумя основными путями. Ø Ферментативный перенос фосфатной группы от богатого энергией фосфорного соединения креатинфосфатана аденозиндифосфорную кислоту. Ø Ресинтез АТФ. Он связан с гликолитическими и окислительными процессами, протекающими в мышце как в условиях покоя, так и особенно интенсивно во время деятельности. Ø Нарушение ресинтеза АТФ ядами, подавляющими гликолитические и окислительные процессы, ведет к полному исчезновению АТФ и креатинфосфата, вследствие чего кальциевый насос перестает работать. Концентрация Са+в области миофибрилл значительно возрастает и мышца приходит в состояние длительного необратимого укорочения
15 Ресинтез АТФ, непрерывно расщепляющейся в процессе деятельности мышцы, осуществляется двумя основными путями. Ø Ферментативный перенос фосфатной группы от богатого энергией фосфорного соединения креатинфосфатана аденозиндифосфорную кислоту. Ø Ресинтез АТФ. Он связан с гликолитическими и окислительными процессами, протекающими в мышце как в условиях покоя, так и особенно интенсивно во время деятельности. Ø Нарушение ресинтеза АТФ ядами, подавляющими гликолитические и окислительные процессы, ведет к полному исчезновению АТФ и креатинфосфата, вследствие чего кальциевый насос перестает работать. Концентрация Са+в области миофибрилл значительно возрастает и мышца приходит в состояние длительного необратимого укорочения
 Заключение по проделанной работе 16 Нами было рассмотрен механизм мышечного сокращения на молекулярном уровне, обозначены фазы мышечного сокращения и определена роль АТФ и ионов Ca 2+
Заключение по проделанной работе 16 Нами было рассмотрен механизм мышечного сокращения на молекулярном уровне, обозначены фазы мышечного сокращения и определена роль АТФ и ионов Ca 2+
 17 Перечень используемых источников 1. http: //www. bio. bsu. by/phha/06/06_text. h tml 2. Косицкий Г. И. Физиология человека
17 Перечень используемых источников 1. http: //www. bio. bsu. by/phha/06/06_text. h tml 2. Косицкий Г. И. Физиология человека
 Спасибо за внимание!
Спасибо за внимание!


