13703_Khimichni_vlastivosti_zaliza.pptx
- Количество слайдов: 42
 Ферум та Алюміній
Ферум та Алюміній
 «Залізо не тільки основа всього світу, найголовніший метал, що оточує нас, воно — основа культури й промисловості, воно — знаряддя війни й мирної праці. І важко в усій таблиці Менделєєва знайти інший елемент, який був би так пов’язаний із минулим, сьогоденням і майбутніми долями людства» . О. Є. Ферсман 2
«Залізо не тільки основа всього світу, найголовніший метал, що оточує нас, воно — основа культури й промисловості, воно — знаряддя війни й мирної праці. І важко в усій таблиці Менделєєва знайти інший елемент, який був би так пов’язаний із минулим, сьогоденням і майбутніми долями людства» . О. Є. Ферсман 2
 Я сріблястий, я криластий, Високо люблю літати. А корозії не знаю, Плівкою себе вкриваю. На опорах через ліс То дротами я повис. Можу двері змайструвати, Посудом на кухні стати. А народжуюсь із глини. Чи мене назвеш ти нині?
Я сріблястий, я криластий, Високо люблю літати. А корозії не знаю, Плівкою себе вкриваю. На опорах через ліс То дротами я повис. Можу двері змайструвати, Посудом на кухні стати. А народжуюсь із глини. Чи мене назвеш ти нині?
 Будова атома на основі положення в періодичній системі та можливі ступені окиснення 1. Опиши положення Феруму та Алюмінію в періодичній системі хімічних елементів. 2. В чому особливості будови електронної оболонки атомів цих елементів? 3. Які ступені окиснення вони можуть проявляти? 4. Який ступінь окиснення найбільш стійкий? Чому?
Будова атома на основі положення в періодичній системі та можливі ступені окиснення 1. Опиши положення Феруму та Алюмінію в періодичній системі хімічних елементів. 2. В чому особливості будови електронної оболонки атомів цих елементів? 3. Які ступені окиснення вони можуть проявляти? 4. Який ступінь окиснення найбільш стійкий? Чому?
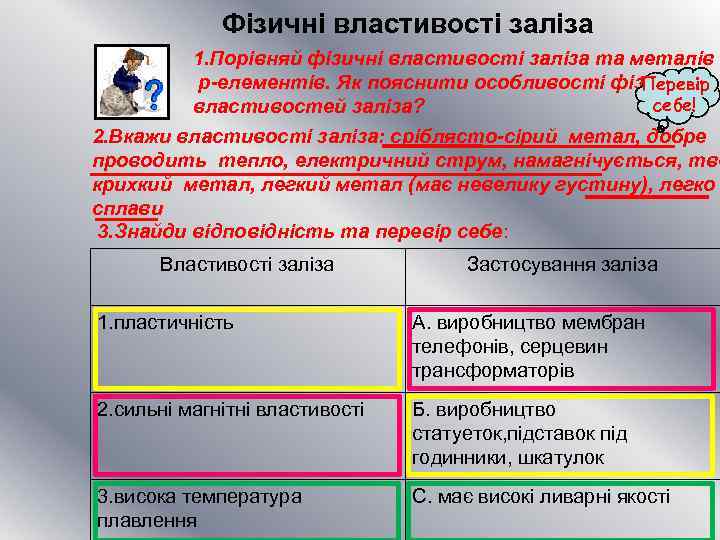 Фізичні властивості заліза 1. Порівняй фізичні властивості заліза та металів p-елементів. Як пояснити особливості фізичних Перевір себе! властивостей заліза? 2. Вкажи властивості заліза: сріблясто-сірий метал, добре проводить тепло, електричний струм, намагнічується, тве крихкий метал, легкий метал (має невелику густину), легко сплави 3. Знайди відповідність та перевір себе: Властивості заліза Застосування заліза 1. пластичність А. виробництво мембран телефонів, серцевин трансформаторів 2. сильні магнітні властивості Б. виробництво статуеток, підставок під годинники, шкатулок 3. висока температура плавлення С. має високі ливарні якості
Фізичні властивості заліза 1. Порівняй фізичні властивості заліза та металів p-елементів. Як пояснити особливості фізичних Перевір себе! властивостей заліза? 2. Вкажи властивості заліза: сріблясто-сірий метал, добре проводить тепло, електричний струм, намагнічується, тве крихкий метал, легкий метал (має невелику густину), легко сплави 3. Знайди відповідність та перевір себе: Властивості заліза Застосування заліза 1. пластичність А. виробництво мембран телефонів, серцевин трансформаторів 2. сильні магнітні властивості Б. виробництво статуеток, підставок під годинники, шкатулок 3. висока температура плавлення С. має високі ливарні якості
 сріблясто – білий метал; ковкий; легко витягується; tпл = 660 0 С; tкип = 2520 0 С; ρ = 22, 7 г/см 3; За кімнатної температури Al не змінюється, його поверхня вкрита тонкою оксидною плівкою.
сріблясто – білий метал; ковкий; легко витягується; tпл = 660 0 С; tкип = 2520 0 С; ρ = 22, 7 г/см 3; За кімнатної температури Al не змінюється, його поверхня вкрита тонкою оксидною плівкою.
 Поширення в природі Після Алюмінію Ферум – найпоширеніший метал на земній кулі, він трапляється у вигляді сполук, а у вільному стані – у метеоритах За твердженням вчених, ядро Землі переважно складається із заліза. Знайди відповідність даних у таблиці та перевір себ мінерал хімічна формула 1. червоний залізняк (гематит) А. Fe 2 O 3 2. магнітний залізняк (магнетит) Б. Fe 2 O 3 • H 2 O 3. бурий залізняк (лимоніт) С. Fe. S 2 4. залізний колчедан (пірит) Д. Fe 3 O 4 Перевір себе!
Поширення в природі Після Алюмінію Ферум – найпоширеніший метал на земній кулі, він трапляється у вигляді сполук, а у вільному стані – у метеоритах За твердженням вчених, ядро Землі переважно складається із заліза. Знайди відповідність даних у таблиці та перевір себ мінерал хімічна формула 1. червоний залізняк (гематит) А. Fe 2 O 3 2. магнітний залізняк (магнетит) Б. Fe 2 O 3 • H 2 O 3. бурий залізняк (лимоніт) С. Fe. S 2 4. залізний колчедан (пірит) Д. Fe 3 O 4 Перевір себе!
 Польовий шпат Al 2 O 3; Боксит Al 2 O 3 ∙n. H 2 O; Нефелін Al 2 O 3 ∙Na 2 O∙ 2 Si. O 2, або Na. Al. Si. O 4; Корунд (прозорі кристали) Al 2 O 3; Каолін (глина) Al 2 O 3 ∙ 2 Si. O 2∙ 2 H 2 O; Гідроаргеліт Al(OH)3; Беміт Al. O(OH); Діаспор HAl. O 2; Кріоліт Na 3 Al. F 6; Алюмінієві галуни KAl(SO)4∙ 12 H 2 O
Польовий шпат Al 2 O 3; Боксит Al 2 O 3 ∙n. H 2 O; Нефелін Al 2 O 3 ∙Na 2 O∙ 2 Si. O 2, або Na. Al. Si. O 4; Корунд (прозорі кристали) Al 2 O 3; Каолін (глина) Al 2 O 3 ∙ 2 Si. O 2∙ 2 H 2 O; Гідроаргеліт Al(OH)3; Беміт Al. O(OH); Діаспор HAl. O 2; Кріоліт Na 3 Al. F 6; Алюмінієві галуни KAl(SO)4∙ 12 H 2 O
 Хімічні властивості заліза Корозія. Застосування заліза та його сплавів 9
Хімічні властивості заліза Корозія. Застосування заліза та його сплавів 9
 Взаємодія з неметалами При нагріванні залізо реагує з більшістю неметалів. v взаємодія з киснем – при згоранні заліза в кисні утворюється змішаний оксид – залізна окалина - Fe 3 O 4 (Fe. O • Fe 2 O 3) Напишіть рівняння відповідної реакції, складіть схеми окиснення, відновлення і доберіть коефіцієнти. v взаємодія з галогенами – залізо згорає в атмосфері хлору з утворенням бурого диму – хлориду феруму зі ступенем окиснення +3. Ця реакція використовується для одержання сполук феруму такого ступеня окиснення. Також активно при нагріванні залізо реагує з фтором, з парами брому з утворенням броміду феруму (ІІ) при надлишку заліза. Складіть рівняння реакції утворення хлориду і броміду феруму (ІІ) і ІІІ). v взаємодія з сіркою при нагріванні відбувається дуже активно, реакція екзотермічна. Складіть рівняння реакції взаємодії сірки з залізом.
Взаємодія з неметалами При нагріванні залізо реагує з більшістю неметалів. v взаємодія з киснем – при згоранні заліза в кисні утворюється змішаний оксид – залізна окалина - Fe 3 O 4 (Fe. O • Fe 2 O 3) Напишіть рівняння відповідної реакції, складіть схеми окиснення, відновлення і доберіть коефіцієнти. v взаємодія з галогенами – залізо згорає в атмосфері хлору з утворенням бурого диму – хлориду феруму зі ступенем окиснення +3. Ця реакція використовується для одержання сполук феруму такого ступеня окиснення. Також активно при нагріванні залізо реагує з фтором, з парами брому з утворенням броміду феруму (ІІ) при надлишку заліза. Складіть рівняння реакції утворення хлориду і броміду феруму (ІІ) і ІІІ). v взаємодія з сіркою при нагріванні відбувається дуже активно, реакція екзотермічна. Складіть рівняння реакції взаємодії сірки з залізом.
 Взаємодія з неметалами • • • Взаємодія з киснем: Fe + O 2 → Взаємодія з галогенами: Fe + Cl 2 → Взаємодія із сіркою: Fe + S → 11
Взаємодія з неметалами • • • Взаємодія з киснем: Fe + O 2 → Взаємодія з галогенами: Fe + Cl 2 → Взаємодія із сіркою: Fe + S → 11
 Взаємодія з водою v. Чисте залізо стійке до дії води. Домішки підвищують його хімічну активність, і вода в присутності кисню взаємодіє з залізом з утворенням жовто-бурої плівки з гідроксиду феруму (ІІІ), яка не захищає метал від подальшого руйнування: 4 Fe+6 H 2 O+3 О 2= 4 Fe(OН)3 Цей процес називається корозією. Деякі види метеоритного заліза не піддаються корозії. v Розжарене залізо реагує з водяною парою з виділенням водню – це залізопаровий спосіб добування водню: 3 Fe+4 H 2 O= Fe 3 O 4+4 H 2↑ Лавуазьє використовував цю реакцію для добування водню: “Дослід Лавуазьє”
Взаємодія з водою v. Чисте залізо стійке до дії води. Домішки підвищують його хімічну активність, і вода в присутності кисню взаємодіє з залізом з утворенням жовто-бурої плівки з гідроксиду феруму (ІІІ), яка не захищає метал від подальшого руйнування: 4 Fe+6 H 2 O+3 О 2= 4 Fe(OН)3 Цей процес називається корозією. Деякі види метеоритного заліза не піддаються корозії. v Розжарене залізо реагує з водяною парою з виділенням водню – це залізопаровий спосіб добування водню: 3 Fe+4 H 2 O= Fe 3 O 4+4 H 2↑ Лавуазьє використовував цю реакцію для добування водню: “Дослід Лавуазьє”
 • Взаємодія заліза з водою: • 3 Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2 • За допомогою цієї реакції брати Монгольф’єр наповнили першу в історії повітряну кулю 13
• Взаємодія заліза з водою: • 3 Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2 • За допомогою цієї реакції брати Монгольф’єр наповнили першу в історії повітряну кулю 13
 Взаємодія з кислотами Взаємодія з розведеними кислотами HCl і H 2 SO 4 При взаємодії заліза з хлоридною, розбавленою сульфатною кислотами виділяється водень і утворюються солі Феруму (ІІ): Fe+HCl=Fe. Cl 2+H 2 Fe+H 2 SO 4=Fe. SO 4+H 2 При взаємодії заліза з розведеною HNO 3 (менше 5, 5%) Fe+ HNO 3= Fe(NO 3)2 +NH 4 NO 3+ H 2 O Зверни увагу! Утворюються сполуки феруму +2! Склади схеми окиснення і відновлення, добери коефіцієнти Взаємодія з концентрованими кислотами HNO 3 та H 2 SO 4 при нагріванні при звичайних умовах Fe+HNO 3=Fe(NO 3)3 +NO 2 +H 2 O залізо з кислотами практично Fe+H 2 SO 4=Fe 2(SO 4)3+SO 2+ H 2 O не взаємодіє, концентровані Склади схеми окиснення кислоти його пасивують. і відновлення, добери Тому ці кислоти транспортують коефіцієнти у залізних цистернах.
Взаємодія з кислотами Взаємодія з розведеними кислотами HCl і H 2 SO 4 При взаємодії заліза з хлоридною, розбавленою сульфатною кислотами виділяється водень і утворюються солі Феруму (ІІ): Fe+HCl=Fe. Cl 2+H 2 Fe+H 2 SO 4=Fe. SO 4+H 2 При взаємодії заліза з розведеною HNO 3 (менше 5, 5%) Fe+ HNO 3= Fe(NO 3)2 +NH 4 NO 3+ H 2 O Зверни увагу! Утворюються сполуки феруму +2! Склади схеми окиснення і відновлення, добери коефіцієнти Взаємодія з концентрованими кислотами HNO 3 та H 2 SO 4 при нагріванні при звичайних умовах Fe+HNO 3=Fe(NO 3)3 +NO 2 +H 2 O залізо з кислотами практично Fe+H 2 SO 4=Fe 2(SO 4)3+SO 2+ H 2 O не взаємодіє, концентровані Склади схеми окиснення кислоти його пасивують. і відновлення, добери Тому ці кислоти транспортують коефіцієнти у залізних цистернах.
 +3 O 2 +3 Cl 2 2 Al +3 S +6 HCl +3 Cu. SO 4 Al 2 O 3 2 Al. Cl 3 Al 2 S 3 2 Al. Cl 3 + 3 H 2 Al 2(SO 4)3 + 3 Cu
+3 O 2 +3 Cl 2 2 Al +3 S +6 HCl +3 Cu. SO 4 Al 2 O 3 2 Al. Cl 3 Al 2 S 3 2 Al. Cl 3 + 3 H 2 Al 2(SO 4)3 + 3 Cu
 Алюміній є амфотерним елементом: взаємодіє с кислотами та лугами. 2 Al + 6 HCl(розбавлена) = 2 Al. Cl 3 + 3 H 2 8 Al + 15 H 2 SO 4(конц. ) 4 Al 2(SO 4)3 + 3 H 2 S + 12 H 2 O Al + 6 HNO 3 (конц. ) Al(NO 3)3 + 3 NO 2 + 3 H 2 O 2 Al + 6 Na. OH 2 Na 3 Al. O 3 + 3 H 2 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OН)4] + 3 H 2 2 Al + 6 Na. OH(надлишок) + 6 H 2 O = 2 Na 3[Al(OH)6] + 3 H 2
Алюміній є амфотерним елементом: взаємодіє с кислотами та лугами. 2 Al + 6 HCl(розбавлена) = 2 Al. Cl 3 + 3 H 2 8 Al + 15 H 2 SO 4(конц. ) 4 Al 2(SO 4)3 + 3 H 2 S + 12 H 2 O Al + 6 HNO 3 (конц. ) Al(NO 3)3 + 3 NO 2 + 3 H 2 O 2 Al + 6 Na. OH 2 Na 3 Al. O 3 + 3 H 2 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OН)4] + 3 H 2 2 Al + 6 Na. OH(надлишок) + 6 H 2 O = 2 Na 3[Al(OH)6] + 3 H 2
 Оксид та гідроксид алюмінію також мають амфотерні властивості: • Al 2 O 3 + 6 HCl = 2 Al. Cl 3 + 3 H 2 O • Al 2 O 3 + 2 Na. OH = 2 Na. Al. O 2 + H 2 O • 2 Al(OH)3 + 6 HCl = 2 Al. Cl 3 + 6 H 2 O • Al(OH)3 + Na. OH = Na. Al. O 2 + 2 H 2 O (у процесі сплавлення) • Al(OH)3 + Na. OH = Na[Al(OH)4] (у розчинах)
Оксид та гідроксид алюмінію також мають амфотерні властивості: • Al 2 O 3 + 6 HCl = 2 Al. Cl 3 + 3 H 2 O • Al 2 O 3 + 2 Na. OH = 2 Na. Al. O 2 + H 2 O • 2 Al(OH)3 + 6 HCl = 2 Al. Cl 3 + 6 H 2 O • Al(OH)3 + Na. OH = Na. Al. O 2 + 2 H 2 O (у процесі сплавлення) • Al(OH)3 + Na. OH = Na[Al(OH)4] (у розчинах)
 Корозія заліза Корозія — це хімічний процес руйнування металів під дією навколишнього середовища: Fe + H 2 O + O 2 → Fe(OH)3 18
Корозія заліза Корозія — це хімічний процес руйнування металів під дією навколишнього середовища: Fe + H 2 O + O 2 → Fe(OH)3 18
 Роль кисню при корозії заліза 19
Роль кисню при корозії заліза 19
 Результати практичного досліду 20
Результати практичного досліду 20
 Засоби запобігання корозії Палаш, шишак, панцир зо щитом, Все буде золотом покрито, Як тульськії кабатирки: Насічка з черню, з образками. (Іван Котляревський, Енеїда) 21
Засоби запобігання корозії Палаш, шишак, панцир зо щитом, Все буде золотом покрито, Як тульськії кабатирки: Насічка з черню, з образками. (Іван Котляревський, Енеїда) 21
 Покриття золотом 22
Покриття золотом 22
 Покриття сріблом 23
Покриття сріблом 23
 Засоби запобігання корозії У котрогось знайшовся складаний ножик, і він пропонував його Михайликові в обмін на тоненький шкіряний ремінець з блискучою нікельованою пряжкою. ( Микола Олійник. Леся) 24
Засоби запобігання корозії У котрогось знайшовся складаний ножик, і він пропонував його Михайликові в обмін на тоненький шкіряний ремінець з блискучою нікельованою пряжкою. ( Микола Олійник. Леся) 24
 Покриття ніколом 25
Покриття ніколом 25
 Луджене та мідне покриття 26
Луджене та мідне покриття 26
 Способи захисту від корозії • Покриття металевих виробів фарбою, лаком, мастилами. • Покриття заліза іншими металами, стійкими до корозії (оцинковування, лудіння). • Виготовлення нержавіючих сплавів 27
Способи захисту від корозії • Покриття металевих виробів фарбою, лаком, мастилами. • Покриття заліза іншими металами, стійкими до корозії (оцинковування, лудіння). • Виготовлення нержавіючих сплавів 27
 Застосування заліза та його сплавів • Основний конструкційний матеріал. • Матеріал для осердя електромагнітів і якорів електромашин. • Матеріал для пластин акумуляторів. • Каталізатор у хімічній промисловості. • Матеріал для предметів побуту (цвяхи, леза ножів, столові прибори тощо) 28
Застосування заліза та його сплавів • Основний конструкційний матеріал. • Матеріал для осердя електромагнітів і якорів електромашин. • Матеріал для пластин акумуляторів. • Каталізатор у хімічній промисловості. • Матеріал для предметів побуту (цвяхи, леза ножів, столові прибори тощо) 28
 Алюміній дуже добре проводить електричний струм – за електропровідністю він іде після срібла та міді. Тому з чистого алюмінію виготовляють електропроводи. Алюмінієве покриття добре захищає стальні та чавунні вироби від корозії. Для цього поверхню таких виробів насичують алюмінієм – алітують. Сплавам алюмінію з міддю, магнієм, силіцієм властиві легкість та висока міцність, тому вони використовуються в авіації, суднобудуванні, залізничному транспорті, у будівництві, приладобудуванні. Алюміній застосовують для одержання металів і неметалів.
Алюміній дуже добре проводить електричний струм – за електропровідністю він іде після срібла та міді. Тому з чистого алюмінію виготовляють електропроводи. Алюмінієве покриття добре захищає стальні та чавунні вироби від корозії. Для цього поверхню таких виробів насичують алюмінієм – алітують. Сплавам алюмінію з міддю, магнієм, силіцієм властиві легкість та висока міцність, тому вони використовуються в авіації, суднобудуванні, залізничному транспорті, у будівництві, приладобудуванні. Алюміній застосовують для одержання металів і неметалів.


 Основний конструкційний матеріал 32
Основний конструкційний матеріал 32
 Матеріал для пластин акумуляторів 33
Матеріал для пластин акумуляторів 33
 Матеріал для предметів побуту 34
Матеріал для предметів побуту 34
 Застосування заліза 35
Застосування заліза 35
 Доповніть речення та закінчіть рівняння реакцій. 1. 2. У Періодичній системі Алюміній розташований у ____ періоді. В електронній оболонці атомів Алюмінію заповнюється ____ електронних шарів. 3. Скільки електронів міститься в іоні Алюмінію Al 3+? 4. Ступінь окиснення Алюмінію в сполуках дорівнює ____ 5. У хімічних взаємодіях атоми Алюмінію тільки ________ 6. Формула Алюміній оксиду _____ 7. Чи зустрічається Алюміній у природі у вільному вигляді _____ 8. Алюміній оксид утворює мінерал _______ 9. Спосіб відновлення металів з їх оксидів за допомогою Алюмінію називають _______ 10. Оксид та гідроксид Алюмінію мають _______ характер. 11. __Al + __H 2 SO 4(розб. ) _______________ 12. Al(OH)3 + ? [ Al(OH)4]- + ?
Доповніть речення та закінчіть рівняння реакцій. 1. 2. У Періодичній системі Алюміній розташований у ____ періоді. В електронній оболонці атомів Алюмінію заповнюється ____ електронних шарів. 3. Скільки електронів міститься в іоні Алюмінію Al 3+? 4. Ступінь окиснення Алюмінію в сполуках дорівнює ____ 5. У хімічних взаємодіях атоми Алюмінію тільки ________ 6. Формула Алюміній оксиду _____ 7. Чи зустрічається Алюміній у природі у вільному вигляді _____ 8. Алюміній оксид утворює мінерал _______ 9. Спосіб відновлення металів з їх оксидів за допомогою Алюмінію називають _______ 10. Оксид та гідроксид Алюмінію мають _______ характер. 11. __Al + __H 2 SO 4(розб. ) _______________ 12. Al(OH)3 + ? [ Al(OH)4]- + ?
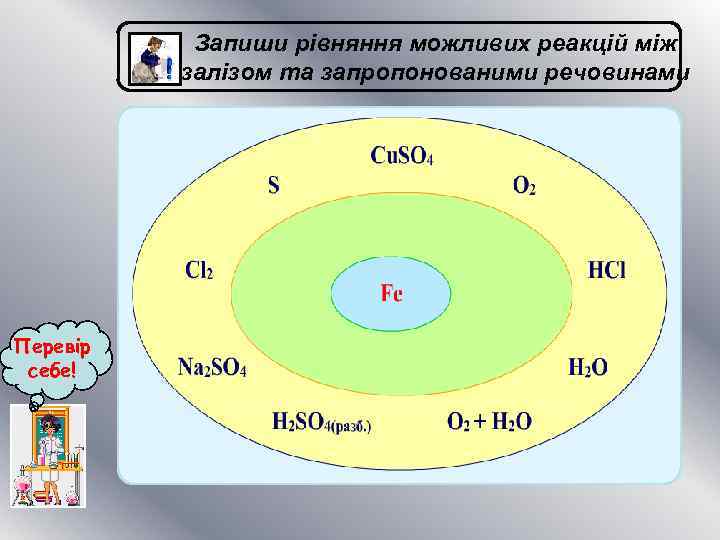 Запиши рівняння можливих реакцій між залізом та запропонованими речовинами Перевір себе!
Запиши рівняння можливих реакцій між залізом та запропонованими речовинами Перевір себе!
 Перевір себе!
Перевір себе!
 Якісні реакції на сполуки феруму +2 і +3 Сполуки феруму +2 Сполуки феруму +3 Реактивом на йони феруму +2 є гексаціаноферат (ІІІ) калію (червона кров'яна сіль). Під час взаємодії солей феруму (ІІ) з гексаціаном фератом (ІІІ) калію утворюється осад синього кольору – турнбулева синь. 3 Fe. SO 4 + 2 K 3[Fe(CN)6] = Fe 3[Fe(CN)6]2 ↓+3 K 2 SO 4 Реактивом на йони феруму +3 є гексаціаноферат (ІІ) калію (жовта кров'яна сіль) та тіоціанат (роданід) калію KSCN. Під час взаємодії солей феруму (ІІІ) з гексаціаном фератом (ІІ) калію також утворюється осад синього кольору – берлінська лазур. 4 Fe. Cl 3 + 3 K 4[Fe(CN)6] = Fe 4[Fe(CN)6]3 ↓+12 KCl Під час взаємодії солей феруму (ІІІ) з тіоціанат ом (роданідом) калію KSCN утворюється сполука темно-червоного кольору тіоціанат феруму (ІІІ) Fe. Cl 3 + 3 KSCN= Fe(SCN)3+3 KCl Напиши повні та скорочені йонні рівняння реакцій
Якісні реакції на сполуки феруму +2 і +3 Сполуки феруму +2 Сполуки феруму +3 Реактивом на йони феруму +2 є гексаціаноферат (ІІІ) калію (червона кров'яна сіль). Під час взаємодії солей феруму (ІІ) з гексаціаном фератом (ІІІ) калію утворюється осад синього кольору – турнбулева синь. 3 Fe. SO 4 + 2 K 3[Fe(CN)6] = Fe 3[Fe(CN)6]2 ↓+3 K 2 SO 4 Реактивом на йони феруму +3 є гексаціаноферат (ІІ) калію (жовта кров'яна сіль) та тіоціанат (роданід) калію KSCN. Під час взаємодії солей феруму (ІІІ) з гексаціаном фератом (ІІ) калію також утворюється осад синього кольору – берлінська лазур. 4 Fe. Cl 3 + 3 K 4[Fe(CN)6] = Fe 4[Fe(CN)6]3 ↓+12 KCl Під час взаємодії солей феруму (ІІІ) з тіоціанат ом (роданідом) калію KSCN утворюється сполука темно-червоного кольору тіоціанат феруму (ІІІ) Fe. Cl 3 + 3 KSCN= Fe(SCN)3+3 KCl Напиши повні та скорочені йонні рівняння реакцій
 Задачі-малюнки. Поясни хімічні реакції Fe. Cl 3 Cu
Задачі-малюнки. Поясни хімічні реакції Fe. Cl 3 Cu
 Домашній експеримент 1. Досліди вплив середовища на корозію заліза. В три посудини налий розчини оцту, кальцинованої соди та кухонної солі, опусти в кожну по залізному цвяху (попередньо промитого милом та зачищеного шкіркою). Для контролю один цвях опусти у чисту прокип'ячену воду. Чому саме прокип'ячену? Кожного дня спостерігай за змінами – перебігом корозії. Визнач, в якому розчині корозія відбувається найбільш інтенсивно. Яке середовище у цьому розчині – кисле, лужне чи нейтральне (врахуй гідроліз)? 2. Проведи реакцію окиснення заліза йодом. Залізну деталь зачисти шкіркою до блиску. Візьми настоянку йоду і піпеткою нанеси краплі йоду на поверхню металу. Спостерігай, що відбувається. Поясни спостережувані явища.
Домашній експеримент 1. Досліди вплив середовища на корозію заліза. В три посудини налий розчини оцту, кальцинованої соди та кухонної солі, опусти в кожну по залізному цвяху (попередньо промитого милом та зачищеного шкіркою). Для контролю один цвях опусти у чисту прокип'ячену воду. Чому саме прокип'ячену? Кожного дня спостерігай за змінами – перебігом корозії. Визнач, в якому розчині корозія відбувається найбільш інтенсивно. Яке середовище у цьому розчині – кисле, лужне чи нейтральне (врахуй гідроліз)? 2. Проведи реакцію окиснення заліза йодом. Залізну деталь зачисти шкіркою до блиску. Візьми настоянку йоду і піпеткою нанеси краплі йоду на поверхню металу. Спостерігай, що відбувається. Поясни спостережувані явища.
 Дякую за увагу !!! 42
Дякую за увагу !!! 42


