Ретроингибирование - Исмагилова 544 гр.ppt
- Количество слайдов: 17

Ферменты, регуляторы метаболических процессов.

ФЕРМЕНТЫ (enzymes) (Е) – биологические катализаторы белковой природы, ускоряющие реакции в клетке (исключ. рибозимы, мол. РНК ). Лат. Fermentum –закваска, а энзим от греч. Еп - в и zyme – дрожжи Ферменты (Е) катализируют превращение веществ, кот. наз. субстраты – (S), в продукт (Р). В общем виде: E S Р

Свойства Е как хим. катализаторов: • ↑ скорость р-ции , не меняют направление реакции; • не изменяют состояние хим. равновесия; • в ходе реакции не расходуются; • ускоряют лишь энергетически возможные реакции. Величина энергии активации с ферментом и без него

Изоферменты – это множественные формы Е которые катализируют одинаковые р-ции, но отличаются между собой по А/К составу и физ. -хим. св-вам. Изоф-ты кодируются разными генами, отличаются по свойствам и работают в разных условиях. Биол. роль: - «экономия» генетического материала; - многообразие форм

Виды аллостерической регуляции активности Е 1. Аллостерическое ингибирование по принципу обратной связи (ретроингибирование) 3. Аллостерическая активация предшественником 2. Аллостерическая перекрестная регуляция (сочетание ингибирования и активации)

Ингибиторы. Типы ингибирования Ингибиторы (I) Обратимые Необратимые E + I → EI Конкурентные E + I ↔ EI Неконкурентные
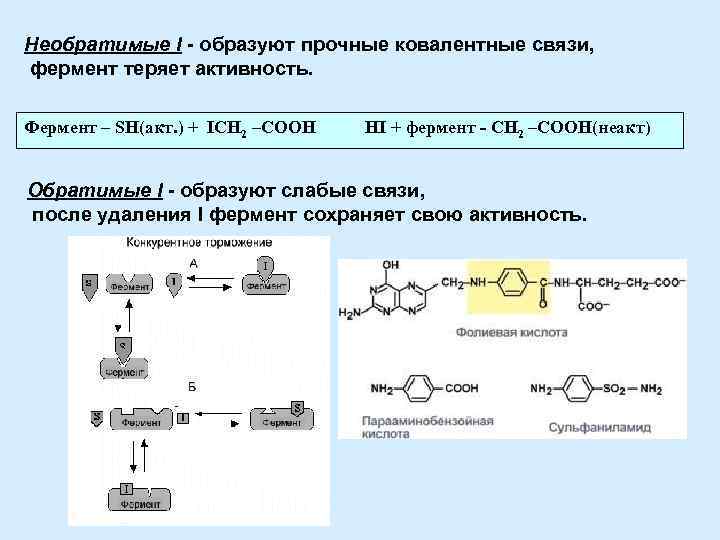
Необратимые I - образуют прочные ковалентные связи, фермент теряет активность. Фермент – SH(акт. ) + ICH 2 –COOH HI + фермент - CH 2 –COOH(неакт) Обратимые I - образуют слабые связи, после удаления I фермент сохраняет свою активность.

V фермент Vmax 1 ½ Vmax 1 Фермент +I Vmax 2 ½ Vmax 2 S Km 1 = Km 2 Кинетика ферментативных реакций в присутствии I


Активность фер-та определяют по V ферментативной р-ции при стандартны условиях (р. Н, t 0, буфер) в присутствии насыщающей S. Единицы активности Международная (стандартная) ед. активности - кол-во фер-та, которое катализирует превращение 1 мкмоль S за 1 мин (мкмоль субстрата/мин). В системе СИ : ед. ферментативной активности - "катал" (kat). 1 kat = 1 моль/сек. Удельная активность (лабораторная ед. ): моль/сек ∙ мг белка

Ферменты в медицине: энзимодиагностика заболеваний; лечение: комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и т. п. ) , фермент гиалуронидаза нужна организму для обратимого изменения проницаемости межклеточного вещества для рассаасывания рубцов, тромбов , Цитохром с – фермент, участвующий в процессах тканевого дыхания. Его применяют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах гепатита и т. п. и др; фармпрепараты регулируют активность Е => изменяют метаболизм клетки; в молекулярной генетике (изучение генома, генные рекомбинации)


Причины гиперферментемии 1. Некроз (гибель) клеток 2. Повышение проницаемости клеточных мембран 3. Усиление пролиферации клеток, продуцирующих фермент

Катаболитная репрессия. В то время как репрессия конечным продуктом действует на путях биосинтеза, при помощи катаболитной репрессии регулируются катаболические реакции. Если в питательной среде содержатся два разных субстрата, то, как правило, бактерии «предпочитают» тот, который обеспечивает более быстрый рост.

Этот субстрат вызывает репрессию синтеза тех ферментов, которые нужны для использования второго субстрата. Катаболитная репрессия лежит в основе, например, известного явления диауксии. При наличии двух субстратов (глюкоза + сорбит, глюкоза + ацетат) они используются клетками Е. coli не одновременно, а последовательно. Сна чала используется глюкоза, и при этом она подавляет синтез ферментов, необходимых для расщепления второго субстрата.

Сложнее обстоит дело, когда та или иная аминокислота служит для клеток не только источником энергии и углерода, но также источником азота. В среде, содержавшей глюкозу и аммонийный азот, образования гистидазы не происходило даже в присутствии гистидина. Глюкоза и ионы аммония совместно почти полностью подавляли синтез этого фермента. При отсутствии ионов ам-я, т. е. в условиях, когда клетки не имели дополнительного источника азота и должны были использовать азот гистидина, репрессирующее действие глюкозы на синтез гистидазы было менее выражено. Этот пример показывает, что недостаток азота может частично снимать катаболитную репрессию, вызываемую глюкозой. Таким образом, синтез катаболического фермента зависит здесь не только от наличия индуктора и источника энергии, но и от присутствия азота в среде.

Ретроингибирование - Исмагилова 544 гр.ppt