Лекция Оксидоредуктазы AA.ppt++.pptказ.ppt
- Количество слайдов: 47
 Ферменты. ОКСИДОРЕДУКТАЗЫ
Ферменты. ОКСИДОРЕДУКТАЗЫ
 1. 2. 3. 4. 5. 6. ПЛАН : Понятие об оксидоредуктазах Классификация оксидоредуктаз Дегидрогеназы, строение, роль Цитохромы , строение, роль Каталазы, пероксидазы, строение, роль Гидроксилазы, строение, роль
1. 2. 3. 4. 5. 6. ПЛАН : Понятие об оксидоредуктазах Классификация оксидоредуктаз Дегидрогеназы, строение, роль Цитохромы , строение, роль Каталазы, пероксидазы, строение, роль Гидроксилазы, строение, роль
 ОКСИДОРЕДУКТАЗЫ КАТАЛИЗИРУЮТ ОКИСЛИТЕЛЬНО ВОССТАНОВИТЕЛЬНОЕ РЕАКЦИИ (РЕАКЦИИ ОТЩЕПЛЕНИЯ ИЛИ ПРИСОЕДИНЕНИЯ ВОДОРОДОВ ИЛИ ЭЛЕКТРОНОВ). Двухкомпонентные ферменты, клеточные. По способу окисления субстрата различают 4 группы оксидоредуктаз. 1) ДЕГИДРОГЕНАЗЫ (анаэроб. , аэроб) 2) ЦИТОХРОМЫ 3) КАТАЛАЗА И ПЕРОКСИДАЗА 4) ГИДРООКСИЛАЗЫ ИЛИ ОКСИГЕНАЗЫ
ОКСИДОРЕДУКТАЗЫ КАТАЛИЗИРУЮТ ОКИСЛИТЕЛЬНО ВОССТАНОВИТЕЛЬНОЕ РЕАКЦИИ (РЕАКЦИИ ОТЩЕПЛЕНИЯ ИЛИ ПРИСОЕДИНЕНИЯ ВОДОРОДОВ ИЛИ ЭЛЕКТРОНОВ). Двухкомпонентные ферменты, клеточные. По способу окисления субстрата различают 4 группы оксидоредуктаз. 1) ДЕГИДРОГЕНАЗЫ (анаэроб. , аэроб) 2) ЦИТОХРОМЫ 3) КАТАЛАЗА И ПЕРОКСИДАЗА 4) ГИДРООКСИЛАЗЫ ИЛИ ОКСИГЕНАЗЫ
 Дегидрогеназы (ДГ) ДЕГИДРОГЕНАЗЫ–окисляют вещества путем дегидрирования(отнятия водорода (Н). СУЩЕСТВУЮТ В ОКИСЛЕННОЙ ВОССТАНОВЛЕННОЙ ФОРМЕ ПРЕДСТАВИТЕЛИ: 1) пиридиновые ферменты (ПФ); 2) флавин ферменты (ФП); 3) кофермент Q или убихинон (Ко. Q) И
Дегидрогеназы (ДГ) ДЕГИДРОГЕНАЗЫ–окисляют вещества путем дегидрирования(отнятия водорода (Н). СУЩЕСТВУЮТ В ОКИСЛЕННОЙ ВОССТАНОВЛЕННОЙ ФОРМЕ ПРЕДСТАВИТЕЛИ: 1) пиридиновые ферменты (ПФ); 2) флавин ферменты (ФП); 3) кофермент Q или убихинон (Ко. Q) И
 ПИРИДИНОВЫЕ ФЕРМЕНТЫ (ПФ) 2 КОМПОНЕНТНЫЕ, КОФЕРМЕНТЫ: НАД , НАДФ ( никотинамидадениндинуклеотид) (никотинамидадениндинуклеоти дфосфат)
ПИРИДИНОВЫЕ ФЕРМЕНТЫ (ПФ) 2 КОМПОНЕНТНЫЕ, КОФЕРМЕНТЫ: НАД , НАДФ ( никотинамидадениндинуклеотид) (никотинамидадениндинуклеоти дфосфат)
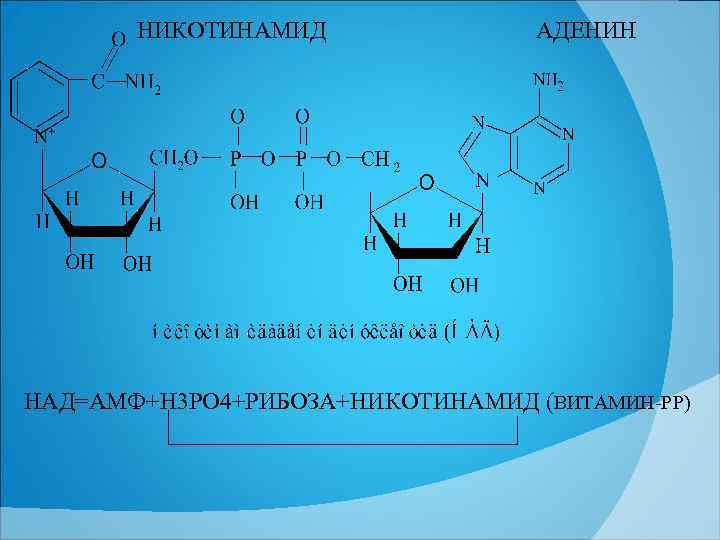 НИКОТИНАМИД АДЕНИН НАД=АМФ+Н 3 РО 4+РИБОЗА+НИКОТИНАМИД (ВИТАМИН РР)
НИКОТИНАМИД АДЕНИН НАД=АМФ+Н 3 РО 4+РИБОЗА+НИКОТИНАМИД (ВИТАМИН РР)
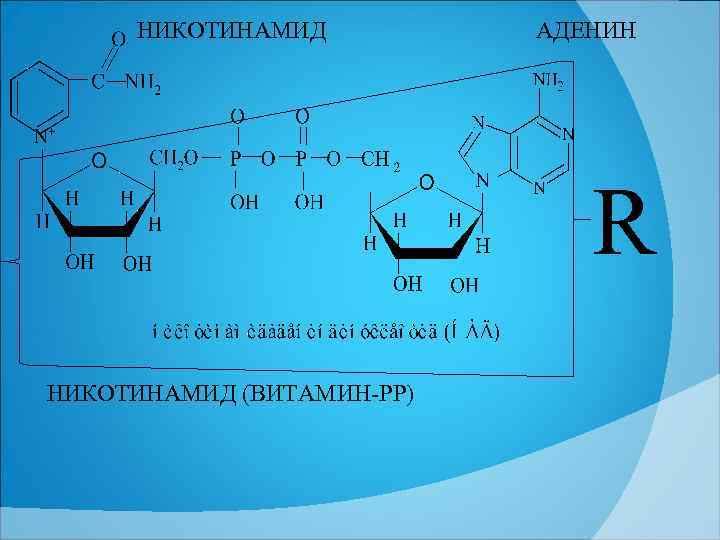 НИКОТИНАМИД АДЕНИН R НИКОТИНАМИД (ВИТАМИН РР)
НИКОТИНАМИД АДЕНИН R НИКОТИНАМИД (ВИТАМИН РР)
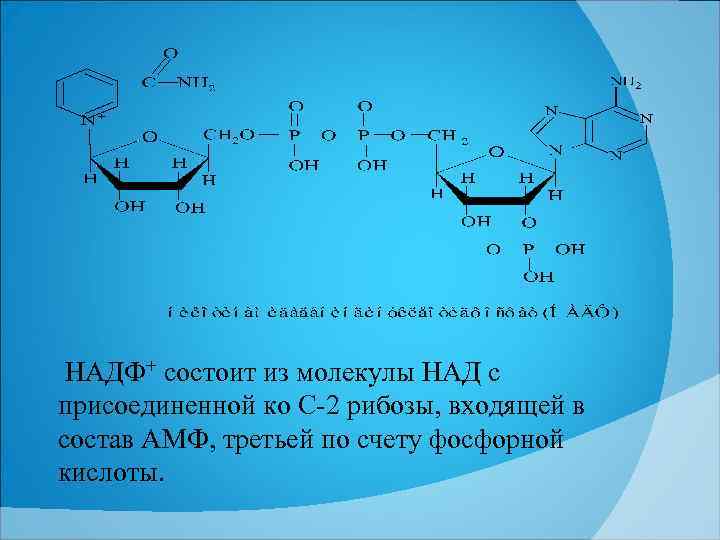 НАДФ+ состоит из молекулы НАД с присоединенной ко С 2 рибозы, входящей в состав АМФ, третьей по счету фосфорной кислоты.
НАДФ+ состоит из молекулы НАД с присоединенной ко С 2 рибозы, входящей в состав АМФ, третьей по счету фосфорной кислоты.
 ПФ апофермент + кофермент (НАД; НАДФ) Действующей группой в этих ферментах я/ся входящее в кофермент кольцо пиридина. Связь между апоферментом и коферментом непрочная, осуществляется с помощью цинка.
ПФ апофермент + кофермент (НАД; НАДФ) Действующей группой в этих ферментах я/ся входящее в кофермент кольцо пиридина. Связь между апоферментом и коферментом непрочная, осуществляется с помощью цинка.
 ПФ относятся к первичным дегидрогеназам, поскольку они катализируют отнятие атомов водорода непосредственно от окисляемого субстрата. Роль вещества в НАД+, отнимающего водород, выполняет никотинамид, остальная часть НАДа стабилизирует эту молекулу. Один водород, отнятый от субстрата, присоединяется к С 4 атому углерода никотинамида, а второй водород расщепляется (НО→Н+ + е ). Электрон присоединяется к азоту, нейтрализуя его заряд, а Н+ (протон) остается в растворе. В кольце никотинамида меняется количество и расположение двойных связей. Связь между апоферментом и коферментом разрывается.
ПФ относятся к первичным дегидрогеназам, поскольку они катализируют отнятие атомов водорода непосредственно от окисляемого субстрата. Роль вещества в НАД+, отнимающего водород, выполняет никотинамид, остальная часть НАДа стабилизирует эту молекулу. Один водород, отнятый от субстрата, присоединяется к С 4 атому углерода никотинамида, а второй водород расщепляется (НО→Н+ + е ). Электрон присоединяется к азоту, нейтрализуя его заряд, а Н+ (протон) остается в растворе. В кольце никотинамида меняется количество и расположение двойных связей. Связь между апоферментом и коферментом разрывается.
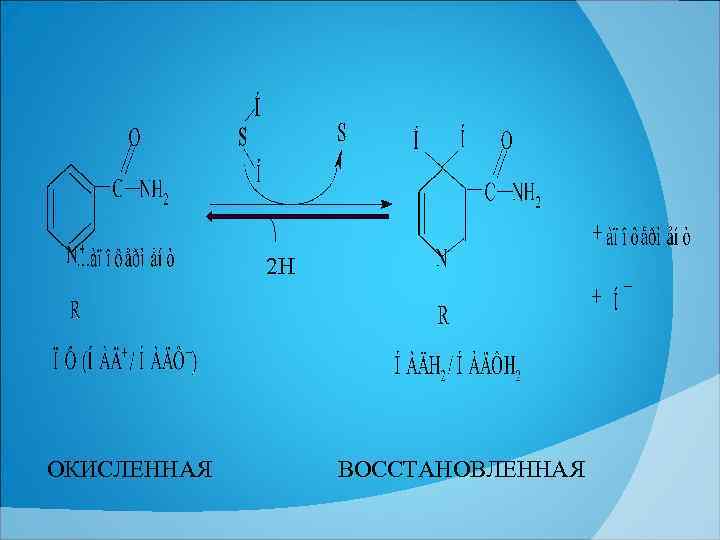 2 Н ОКИСЛЕННАЯ ВОССТАНОВЛЕННАЯ
2 Н ОКИСЛЕННАЯ ВОССТАНОВЛЕННАЯ
 ОТЛИЧИЯ НАД ОТ НАДФ: v. ПО СТРУКТУРЕ v БИОЛОГИЧЕСКАЯ ФУНКЦИЯ v. ЛОКАЛИЗАЦИЯ
ОТЛИЧИЯ НАД ОТ НАДФ: v. ПО СТРУКТУРЕ v БИОЛОГИЧЕСКАЯ ФУНКЦИЯ v. ЛОКАЛИЗАЦИЯ
 НАД принимает участие в процессе биологического окисления, содержится в митохондриях, выступая в роли окислительного агента при отщеплении атомов водорода от субстратов и служит источником энергии для образования АТФ. НАДФ, находятся, в основном, в цитоплазме. НАДФ восстанавливается до НАДФН 2. используется в реакциях восстановительного синтеза, в биологическом окислении участия не принимает. НАДФН 2 – это вторая форма сохранения энергии в клетках. Используется как источник энергии и водорода. Восстановленные формы пиридиновых дегидрогеназ (НАДН 2) обычно передают водород флавиновым ферментам.
НАД принимает участие в процессе биологического окисления, содержится в митохондриях, выступая в роли окислительного агента при отщеплении атомов водорода от субстратов и служит источником энергии для образования АТФ. НАДФ, находятся, в основном, в цитоплазме. НАДФ восстанавливается до НАДФН 2. используется в реакциях восстановительного синтеза, в биологическом окислении участия не принимает. НАДФН 2 – это вторая форма сохранения энергии в клетках. Используется как источник энергии и водорода. Восстановленные формы пиридиновых дегидрогеназ (НАДН 2) обычно передают водород флавиновым ферментам.
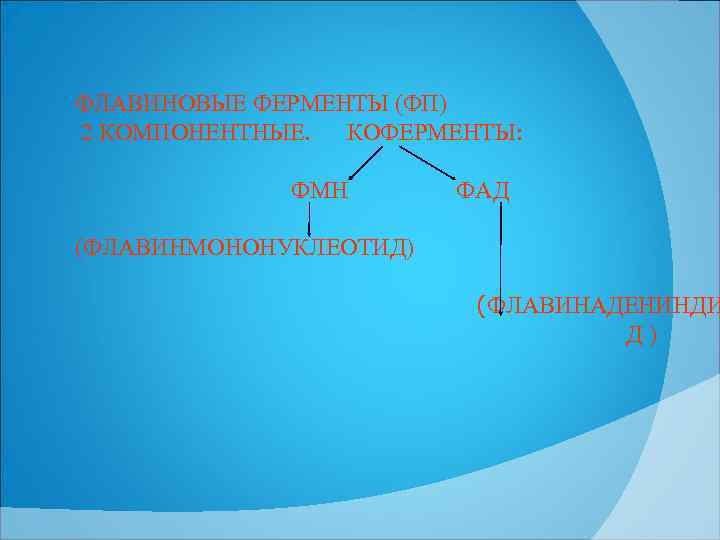 ФЛАВИНОВЫЕ ФЕРМЕНТЫ (ФП) 2 КОМПОНЕНТНЫЕ. КОФЕРМЕНТЫ: ФМН ФАД (ФЛАВИНМОНОНУКЛЕОТИД) (ФЛАВИНАДЕНИНДИ Д)
ФЛАВИНОВЫЕ ФЕРМЕНТЫ (ФП) 2 КОМПОНЕНТНЫЕ. КОФЕРМЕНТЫ: ФМН ФАД (ФЛАВИНМОНОНУКЛЕОТИД) (ФЛАВИНАДЕНИНДИ Д)
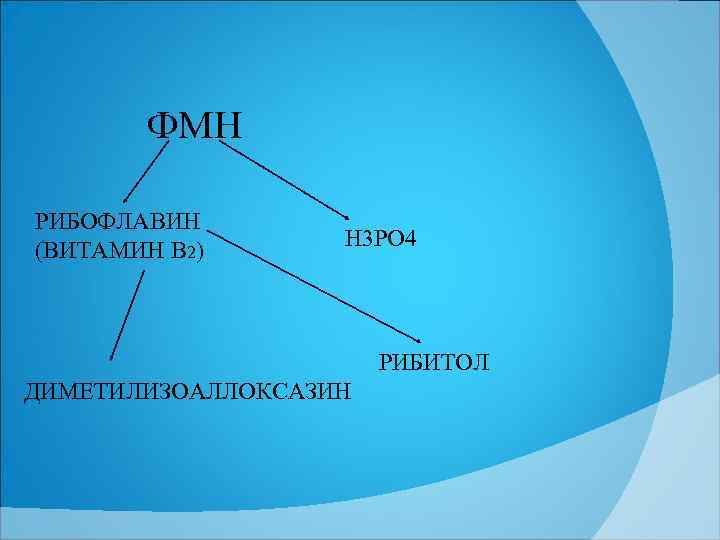 ФМН РИБОФЛАВИН (ВИТАМИН В 2) Н 3 РО 4 РИБИТОЛ ДИМЕТИЛИЗОАЛЛОКСАЗИН
ФМН РИБОФЛАВИН (ВИТАМИН В 2) Н 3 РО 4 РИБИТОЛ ДИМЕТИЛИЗОАЛЛОКСАЗИН
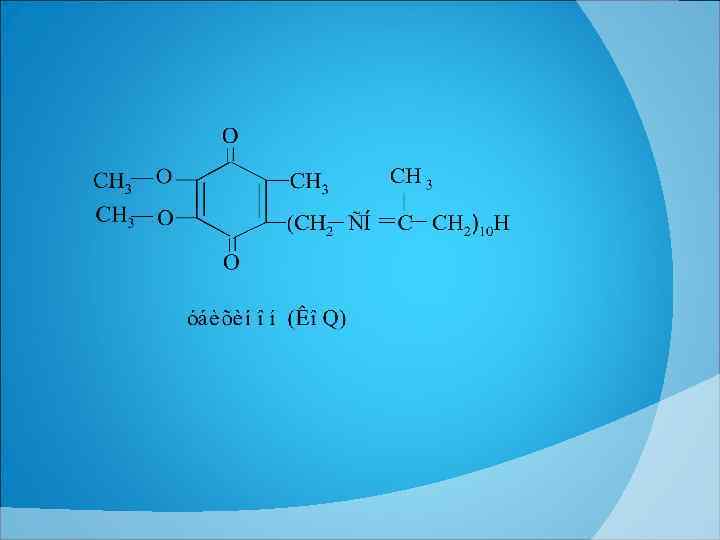
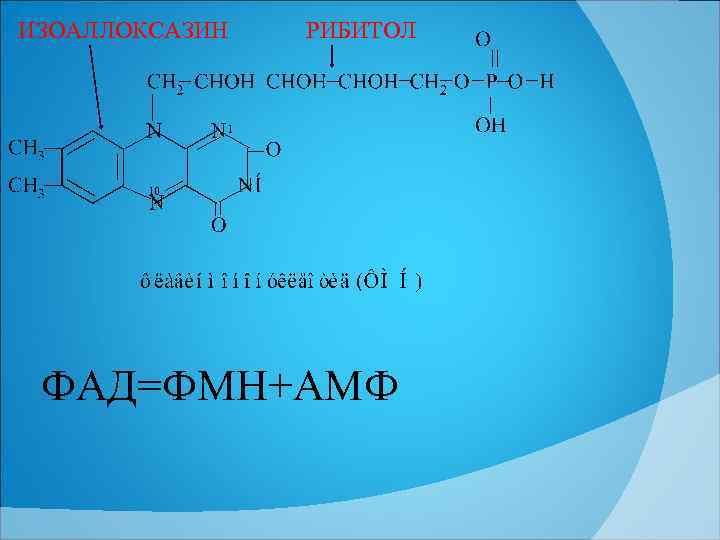 ИЗОАЛЛОКСАЗИН РИБИТОЛ 1 10 ФАД=ФМН+АМФ
ИЗОАЛЛОКСАЗИН РИБИТОЛ 1 10 ФАД=ФМН+АМФ
 ФП ОКИСЛЯЮТ СУБСТРАТ ПУТЕМ ДЕГИДРИРОВАНИЯ. Действующей частью фермента является кольцо диметилизоаллоксазина. ФП с коферментом ФМН окисляют НАДН 2, принимая от него два водорода, присоединяются к N 1 и N 10. Вместо двух двойных связей в указанных кольцах образуется одна связь 1 10 (ФМН) ФП(ФМНН 2 )
ФП ОКИСЛЯЮТ СУБСТРАТ ПУТЕМ ДЕГИДРИРОВАНИЯ. Действующей частью фермента является кольцо диметилизоаллоксазина. ФП с коферментом ФМН окисляют НАДН 2, принимая от него два водорода, присоединяются к N 1 и N 10. Вместо двух двойных связей в указанных кольцах образуется одна связь 1 10 (ФМН) ФП(ФМНН 2 )
 при этом ФП восстанавливается, а НАДН 2 окисляется. ФП(ФМН) называются вторичные дегидрогеназы, поскольку в качестве окисляемого субстрата для них служит восстановленный кофермент (НАДН 2), а не органическая кислота.
при этом ФП восстанавливается, а НАДН 2 окисляется. ФП(ФМН) называются вторичные дегидрогеназы, поскольку в качестве окисляемого субстрата для них служит восстановленный кофермент (НАДН 2), а не органическая кислота.
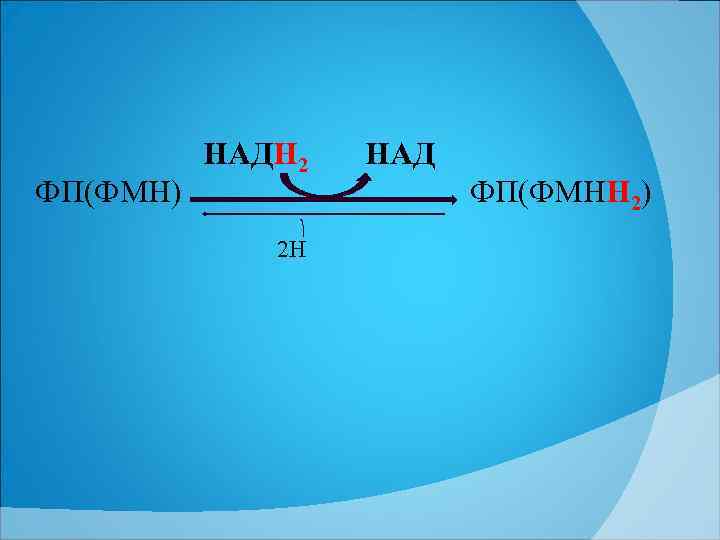 ФП(ФМН) НАДН 2 2 Н НАД ФП(ФМНН 2)
ФП(ФМН) НАДН 2 2 Н НАД ФП(ФМНН 2)
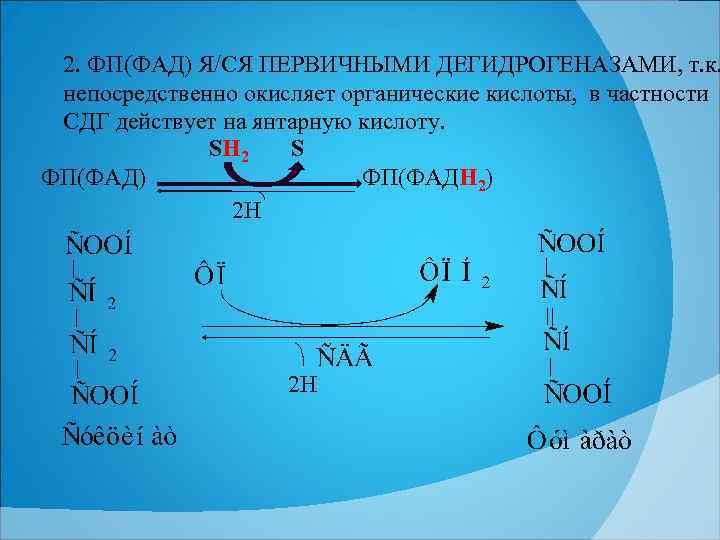 2. ФП(ФАД) Я/СЯ ПЕРВИЧНЫМИ ДЕГИДРОГЕНАЗАМИ, т. к. непосредственно окисляет органические кислоты, в частности СДГ действует на янтарную кислоту. SН 2 S ФП(ФАД) ФП(ФАДН 2) 2 Н 2 Н
2. ФП(ФАД) Я/СЯ ПЕРВИЧНЫМИ ДЕГИДРОГЕНАЗАМИ, т. к. непосредственно окисляет органические кислоты, в частности СДГ действует на янтарную кислоту. SН 2 S ФП(ФАД) ФП(ФАДН 2) 2 Н 2 Н
 Третья разновидность флавинферментов, окисляя вещество, передает водороды от вещества на кислород с образованием перекиси водорода. Например, ксантиноксидаза ускоряет окисление ксантина в мочевую кислоту с образованием перекиси водорода. Также действуют моно (МАО) и диаминоксидазы (ДАО). Этим ФП присуще свойство – аутооксидабельность. Поэтому такие флавинферменты относят к аэробным дегидрогеназам и называют оксидазы. ФПН 2 + О 2 ФП+ Н 2 О 2
Третья разновидность флавинферментов, окисляя вещество, передает водороды от вещества на кислород с образованием перекиси водорода. Например, ксантиноксидаза ускоряет окисление ксантина в мочевую кислоту с образованием перекиси водорода. Также действуют моно (МАО) и диаминоксидазы (ДАО). Этим ФП присуще свойство – аутооксидабельность. Поэтому такие флавинферменты относят к аэробным дегидрогеназам и называют оксидазы. ФПН 2 + О 2 ФП+ Н 2 О 2
 ФП(ФАДН 2) И ФП(ФМНН 2) ОКИСЛЯЕТСЯ ПЕРЕДАВАЯ 2 Н НА Ко. Q. .
ФП(ФАДН 2) И ФП(ФМНН 2) ОКИСЛЯЕТСЯ ПЕРЕДАВАЯ 2 Н НА Ко. Q. .
 Убихинон или Ko. Q. Убихинон функционирует в цепи переноса электрона, растворим в липидах митохондриальных мембран. По химической природе — бензохинон, имеющий длинную ненасыщенную изопреноидную боковую цепь. Благодаря длинной боковой цепи убихиноны свободно перемещаются в липидной фазе мембран как в окисленном, так и в восстановленном состоянии. По строению не является настоящим ферментом, т. к. не обнаружен апофермент. Роль убихинона заключается в том, что он окисляет ФПН 2 восстанавливает цхb.
Убихинон или Ko. Q. Убихинон функционирует в цепи переноса электрона, растворим в липидах митохондриальных мембран. По химической природе — бензохинон, имеющий длинную ненасыщенную изопреноидную боковую цепь. Благодаря длинной боковой цепи убихиноны свободно перемещаются в липидной фазе мембран как в окисленном, так и в восстановленном состоянии. По строению не является настоящим ферментом, т. к. не обнаружен апофермент. Роль убихинона заключается в том, что он окисляет ФПН 2 восстанавливает цхb.
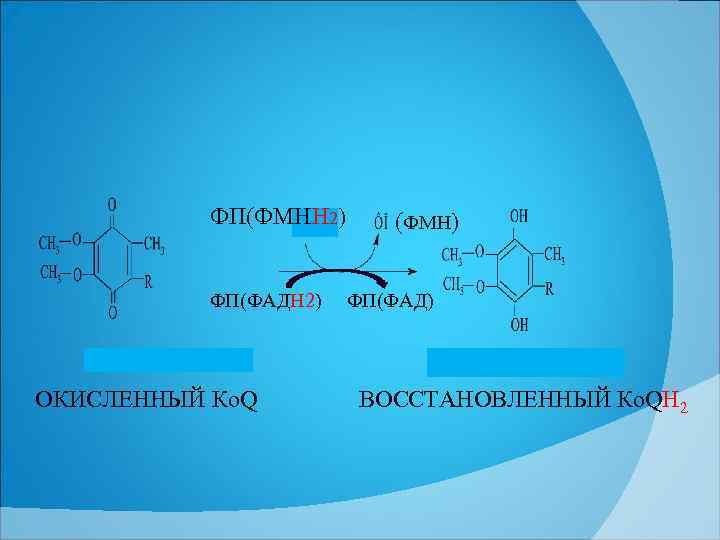 ФП(ФМНН 2) ФП(ФАДН 2) ОКИСЛЕННЫЙ Ко. Q (ФМН) ФП(ФАД) ВОССТАНОВЛЕННЫЙ Ко. QН 2
ФП(ФМНН 2) ФП(ФАДН 2) ОКИСЛЕННЫЙ Ко. Q (ФМН) ФП(ФАД) ВОССТАНОВЛЕННЫЙ Ко. QН 2
 При окислении восстановленного убихинона атомы водорода распадаются на два протона и два электрона, убихинон при этом окисляется.
При окислении восстановленного убихинона атомы водорода распадаются на два протона и два электрона, убихинон при этом окисляется.
 Цитохромы общая характеристика, роль. Цитохромы – это двукомпонентные ферменты, в качестве кофермента имеют гемы различного строения. Железо, входящее в гемы цитохромов может быть 2 и 3 валентным: (Fe 2+→Fe 3+)
Цитохромы общая характеристика, роль. Цитохромы – это двукомпонентные ферменты, в качестве кофермента имеют гемы различного строения. Железо, входящее в гемы цитохромов может быть 2 и 3 валентным: (Fe 2+→Fe 3+)
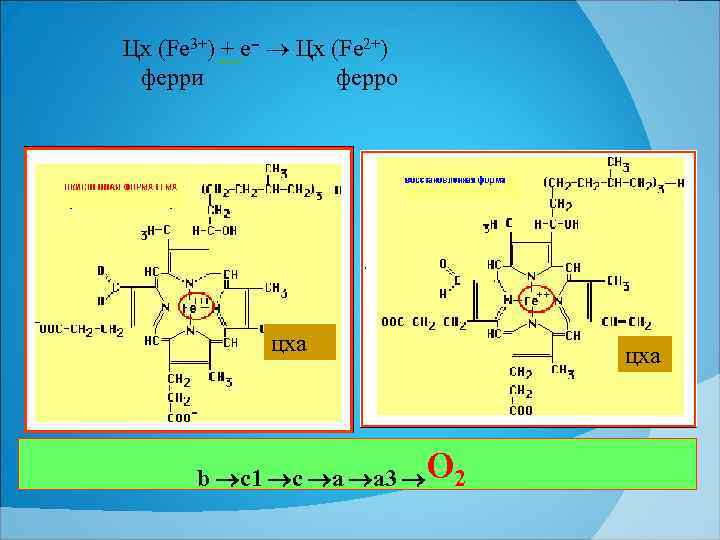 Цх (Fe 3+) + e ־ Цх (Fe 2+) ферри ферро цха b c 1 c a a 3 О 2 цха
Цх (Fe 3+) + e ־ Цх (Fe 2+) ферри ферро цха b c 1 c a a 3 О 2 цха
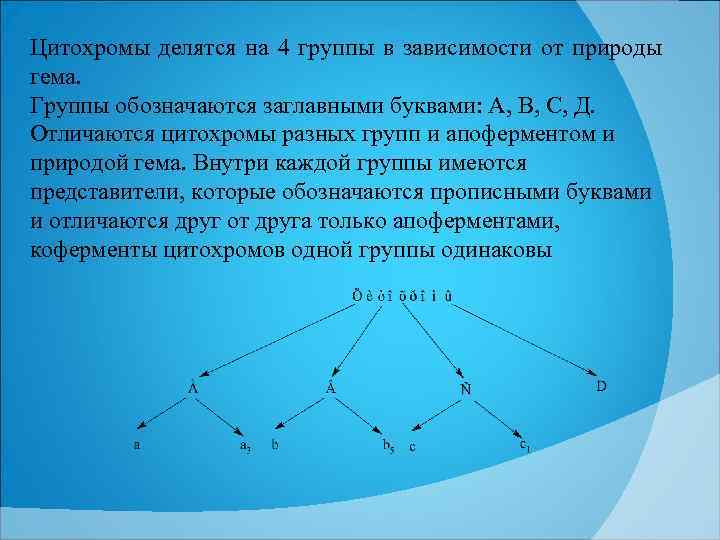 Цитохромы делятся на 4 группы в зависимости от природы гема. Группы обозначаются заглавными буквами: А, В, С, Д. Отличаются цитохромы разных групп и апоферментом и природой гема. Внутри каждой группы имеются представители, которые обозначаются прописными буквами и отличаются друг от друга только апоферментами, коферменты цитохромов одной группы одинаковы
Цитохромы делятся на 4 группы в зависимости от природы гема. Группы обозначаются заглавными буквами: А, В, С, Д. Отличаются цитохромы разных групп и апоферментом и природой гема. Внутри каждой группы имеются представители, которые обозначаются прописными буквами и отличаются друг от друга только апоферментами, коферменты цитохромов одной группы одинаковы
 Цитохромы окисляют субстрат путем переноса электронов от одного вещества к другому. последовательность цх ов в цепи БО Цх b → Цх с1 → Цх с → Цх а 3.
Цитохромы окисляют субстрат путем переноса электронов от одного вещества к другому. последовательность цх ов в цепи БО Цх b → Цх с1 → Цх с → Цх а 3.
 Цитохром b — двухкомпонентный Кофермент гем, имеющий рациональное название: 1, 3, 5, 8 тетраметил, 2, 4 дивинил, 6, 7 дипропионовокислый железопорфин и по составу подобен гему гемоглобина.
Цитохром b — двухкомпонентный Кофермент гем, имеющий рациональное название: 1, 3, 5, 8 тетраметил, 2, 4 дивинил, 6, 7 дипропионовокислый железопорфин и по составу подобен гему гемоглобина.
 Биологическая роль Цх b: Цх b получает электрон, образовавшийся при окислении Ko. QН 2 и передает его Цх с1: 2 цхb(Fe 3+) Ko. QН 2 Ко. Q+ 2 H++ 2 е ־ 2 цхb(Fe 2+) Ко. Q окисляется, цхb восстанавливается.
Биологическая роль Цх b: Цх b получает электрон, образовавшийся при окислении Ko. QН 2 и передает его Цх с1: 2 цхb(Fe 3+) Ko. QН 2 Ко. Q+ 2 H++ 2 е ־ 2 цхb(Fe 2+) Ко. Q окисляется, цхb восстанавливается.
 Цх. C, представители, строение, роль. Представители: Цхс и Цхс1. Это двукомпонентные ферменты, Цхс и Цхс1 в качестве кофермента имеют одинаковые гемы, разные апоферменты. Гем имеет рациональное название 1, 3, 5, 8 тетраметил; 2, 4, диэтил; 6, 7, дипропионовокислый железопорфин. Работают попарно.
Цх. C, представители, строение, роль. Представители: Цхс и Цхс1. Это двукомпонентные ферменты, Цхс и Цхс1 в качестве кофермента имеют одинаковые гемы, разные апоферменты. Гем имеет рациональное название 1, 3, 5, 8 тетраметил; 2, 4, диэтил; 6, 7, дипропионовокислый железопорфин. Работают попарно.
 Биологическая роль Цх с1: Цх с1 получает электрон от восстановленной формы Цх b и отдает его на Цх с: 2 е
Биологическая роль Цх с1: Цх с1 получает электрон от восстановленной формы Цх b и отдает его на Цх с: 2 е
 Биологическая роль Цх с получает электрон от восстановленной формы Цх с1 и отдает его Цх а: 2 е
Биологическая роль Цх с получает электрон от восстановленной формы Цх с1 и отдает его Цх а: 2 е
 Цх а и Цх а 3 имеют одинаковые коферменты, но разные апоферменты. Гем имеет следующее строение: у С 1 и С 3 метильные группы, у С 2 радикал, состоящий из 15 углеродных атомов. У С 8 формильная группа, у С 4 винильная группа, у С 6 и С 7 остатки пропионовой кислоты.
Цх а и Цх а 3 имеют одинаковые коферменты, но разные апоферменты. Гем имеет следующее строение: у С 1 и С 3 метильные группы, у С 2 радикал, состоящий из 15 углеродных атомов. У С 8 формильная группа, у С 4 винильная группа, у С 6 и С 7 остатки пропионовой кислоты.
 Биологическая роль Цх а получает электрон от восстановленной формы Цх с и отдает его на Цх а 3: 2 2 2 2
Биологическая роль Цх а получает электрон от восстановленной формы Цх с и отдает его на Цх а 3: 2 2 2 2
 Цха 3, получив электрон от восстановленной формы Цх а, отдает его на молекулярный кислород, восстанавливая его. Однако цх а и цх а 3 находятся в тесной взаимосвязи друг с другом, объединяясь в один комплекс, называемый цитохромоксидазой (ЦХО) состоит 2 Цх а+4 Цх а 3 + 6 Сu
Цха 3, получив электрон от восстановленной формы Цх а, отдает его на молекулярный кислород, восстанавливая его. Однако цх а и цх а 3 находятся в тесной взаимосвязи друг с другом, объединяясь в один комплекс, называемый цитохромоксидазой (ЦХО) состоит 2 Цх а+4 Цх а 3 + 6 Сu
 Гидропероксидазы- это группа ферментов, в которую входят каталаза и пероксидаза. Эти ферменты, не имеют прямого отношения к окислительно восстановительным процессам и катализируют реакции разложения перекиси водорода, образовавшегося в результате окислительных реакций.
Гидропероксидазы- это группа ферментов, в которую входят каталаза и пероксидаза. Эти ферменты, не имеют прямого отношения к окислительно восстановительным процессам и катализируют реакции разложения перекиси водорода, образовавшегося в результате окислительных реакций.
 Пероксидаза содержит один гем. Пероксидазы распространены, в основном, в растительном мире, но встречаются и в животных организмах, например, миелопероксидаза в лейкоцитах, лактатпероксидаза в молоке и т. д. Пероксидаза катализирует следующую реакцию: Н 202 Н 2 О + О
Пероксидаза содержит один гем. Пероксидазы распространены, в основном, в растительном мире, но встречаются и в животных организмах, например, миелопероксидаза в лейкоцитах, лактатпероксидаза в молоке и т. д. Пероксидаза катализирует следующую реакцию: Н 202 Н 2 О + О
 Т. о. биологическое значение пероксидаз определяется их участием в окислении различных субстратов на мембранах митохондрий и микросом опосредовано: вначале способствует образованию атомарного кислорода, который является сильным окислителем и окисляет субстраты или способствует образованию более реакционноспособных соединений, типа гипохлорной кислоты или пероксинитрита.
Т. о. биологическое значение пероксидаз определяется их участием в окислении различных субстратов на мембранах митохондрий и микросом опосредовано: вначале способствует образованию атомарного кислорода, который является сильным окислителем и окисляет субстраты или способствует образованию более реакционноспособных соединений, типа гипохлорной кислоты или пероксинитрита.
 Каталаза двухкомпонентный, кофермент которого содержит 4 тема, по химической природе соответствующих гему гемоглобина и Цх b, но железо, входящее в гем каталазы, является трехвалентным. 2 Н 202 2 Н 2 О + О 2 Присутствие каталазы обеспечивает эффективную защиту клеточных структур от деградации под действием перекиси водорода.
Каталаза двухкомпонентный, кофермент которого содержит 4 тема, по химической природе соответствующих гему гемоглобина и Цх b, но железо, входящее в гем каталазы, является трехвалентным. 2 Н 202 2 Н 2 О + О 2 Присутствие каталазы обеспечивает эффективную защиту клеточных структур от деградации под действием перекиси водорода.
 Гидроксилазы, понятие о строении, виды, каталитическое действие. Гидроксилазы — это двухкомпонентные ферменты, состоящие из апофермента и кофермента, в состав которого входит витамин С. Гидроксилазы играют важную роль в обмене стероидов, ксенобиотиков и других циклических соединений. Это двукомпонентные ферменты, в состав кофермента входит вит. С – аскорбиновая кислота. Гидроксилазы делятся на МОНООКСИГЕНАЗЫ И ДИОКСИГЕНАЗЫ: МОНООКСИГЕНАЗЫ способствуют включению одного атома кислорода в молекулу субстрата, а другого атома кислорода в молекулу воды, т. е. окисляют субстрат монооксигеназным способом. Донатором водорода в этих реакциях является НАДФ Н 2 RH + O 2 + HADФН 2 → ROH + Н 2 О + НАДФ+
Гидроксилазы, понятие о строении, виды, каталитическое действие. Гидроксилазы — это двухкомпонентные ферменты, состоящие из апофермента и кофермента, в состав которого входит витамин С. Гидроксилазы играют важную роль в обмене стероидов, ксенобиотиков и других циклических соединений. Это двукомпонентные ферменты, в состав кофермента входит вит. С – аскорбиновая кислота. Гидроксилазы делятся на МОНООКСИГЕНАЗЫ И ДИОКСИГЕНАЗЫ: МОНООКСИГЕНАЗЫ способствуют включению одного атома кислорода в молекулу субстрата, а другого атома кислорода в молекулу воды, т. е. окисляют субстрат монооксигеназным способом. Донатором водорода в этих реакциях является НАДФ Н 2 RH + O 2 + HADФН 2 → ROH + Н 2 О + НАДФ+
 Например, гидроксилирование фенилаланина в тирозин, пролина в оксипролин. Эти ферменты участвуют в реакциях образования холестерина, адреналина, оксистероидов. Ферменты эти могут содержаться в цитозоле или же составлять цепи, расположенные в мембранах эндоплазматического ретикулума печеночных клеток или в мембранах мито хондрий клеток коры надпочечника. ДИОКСИГЕНАЗЫ включают в субстрат молекулярный кислород, активируя его за счет электрона атома железа в активном центре, т. е. окисляют субстрат диоксигеназным способом. R + О 2 → RО 2
Например, гидроксилирование фенилаланина в тирозин, пролина в оксипролин. Эти ферменты участвуют в реакциях образования холестерина, адреналина, оксистероидов. Ферменты эти могут содержаться в цитозоле или же составлять цепи, расположенные в мембранах эндоплазматического ретикулума печеночных клеток или в мембранах мито хондрий клеток коры надпочечника. ДИОКСИГЕНАЗЫ включают в субстрат молекулярный кислород, активируя его за счет электрона атома железа в активном центре, т. е. окисляют субстрат диоксигеназным способом. R + О 2 → RО 2
 Оксигеназы в отличие от гидроксилаз способствуют вклю чениюобоих атомов кислорода в вещество, вызывая окислитель ное расщепление двойной связи С=С. Например, ненасы щенная жирная кислота под влиянием этого фермента присоединяет молекулу кислорода, образуя пероксид ненасыщенной жир ной кислоты:
Оксигеназы в отличие от гидроксилаз способствуют вклю чениюобоих атомов кислорода в вещество, вызывая окислитель ное расщепление двойной связи С=С. Например, ненасы щенная жирная кислота под влиянием этого фермента присоединяет молекулу кислорода, образуя пероксид ненасыщенной жир ной кислоты:
 Литература: 1. Березов Т. Т. , Коровкин Б. Ф. «Биологическая химия» , 1998 - С. 114 -168. 2. . Сеитов 3. С. «Биохимия» , ЗОС С. 277 -337. 3. Северин Е. С. «Биохимия» , 2008 – с 74 -118 4. Строев Е. А. «Биологическая химия» , 1986, Москва, Высшая школа, с 122 -163
Литература: 1. Березов Т. Т. , Коровкин Б. Ф. «Биологическая химия» , 1998 - С. 114 -168. 2. . Сеитов 3. С. «Биохимия» , ЗОС С. 277 -337. 3. Северин Е. С. «Биохимия» , 2008 – с 74 -118 4. Строев Е. А. «Биологическая химия» , 1986, Москва, Высшая школа, с 122 -163
 Контрольные вопросы: 1. 2. 3. 4. 5. Оксидоредуктазы, определение Классификация окисдоредуктаз Почему пиридиновые ферменты называются первичными? Роль каталазы, пероксидазы Моно и диоксигеназы, роль
Контрольные вопросы: 1. 2. 3. 4. 5. Оксидоредуктазы, определение Классификация окисдоредуктаз Почему пиридиновые ферменты называются первичными? Роль каталазы, пероксидазы Моно и диоксигеназы, роль


