Fermenty_lektsia_dlya_LD.ppt
- Количество слайдов: 71
 Ферменты Лекция
Ферменты Лекция
 План лекции 1. Ферменты – биологические катализаторы. Отличительные признаки ферментативного и химического катализа. Специфичность 2. Природа катализа, теории ферментативного катализа 3. Классификация и номенклатура ферментов 4. Строение ферментов (активный и аллостерический центры) 5. Коферменты и кофакторы. Роль витаминов 6. Кинетика ферментативных реакций 7. Ингибирование ферментативных реакций 8. Регуляция активности ферментов 9. Принципы энзимодиагностики 10. Применение ферментов в медицине
План лекции 1. Ферменты – биологические катализаторы. Отличительные признаки ферментативного и химического катализа. Специфичность 2. Природа катализа, теории ферментативного катализа 3. Классификация и номенклатура ферментов 4. Строение ферментов (активный и аллостерический центры) 5. Коферменты и кофакторы. Роль витаминов 6. Кинетика ферментативных реакций 7. Ингибирование ферментативных реакций 8. Регуляция активности ферментов 9. Принципы энзимодиагностики 10. Применение ферментов в медицине
 Использование ферментов человеком • Человек с незапамятных времен использовал ферменты: • Дубление кожи • Сыроварение • Хлебопечение • Молочнокислые продукты • Люди научились контролировать процесс брожения: в Древнем Египте при строительстве пирамиды Хеопса рабочих кормили дрожжевым хлебом и пивом.
Использование ферментов человеком • Человек с незапамятных времен использовал ферменты: • Дубление кожи • Сыроварение • Хлебопечение • Молочнокислые продукты • Люди научились контролировать процесс брожения: в Древнем Египте при строительстве пирамиды Хеопса рабочих кормили дрожжевым хлебом и пивом.
 Значение брожения для приготовления и сохранения пищи • • • Обогащение пищи разнообразием вкусов, ароматов и текстуры Сохранение пищи с помощью молочной кислоты, алкоголя, уксусной кислоты и щелочного брожения Биологическое обогащение пищи аминокислотами, жирными кислотами и витаминами Детоксификация пищи в процессе брожения Уменьшение времени и затрат на приготовление пищи
Значение брожения для приготовления и сохранения пищи • • • Обогащение пищи разнообразием вкусов, ароматов и текстуры Сохранение пищи с помощью молочной кислоты, алкоголя, уксусной кислоты и щелочного брожения Биологическое обогащение пищи аминокислотами, жирными кислотами и витаминами Детоксификация пищи в процессе брожения Уменьшение времени и затрат на приготовление пищи
 ХVII век Жан Баптист ван Гельмонт (Jan Baptista van Helmont, 12 января 1580 -30 декабря 1644)) голландский химик, физиолог, врач и теософ-мистик близко подошёл к современному пониманию роли ферментов при пищеварении.
ХVII век Жан Баптист ван Гельмонт (Jan Baptista van Helmont, 12 января 1580 -30 декабря 1644)) голландский химик, физиолог, врач и теософ-мистик близко подошёл к современному пониманию роли ферментов при пищеварении.
 XIX век • Термины фермент и энзим отражали различные точки зрения. • «организованными ферментами» (от латинского fermentum — закваска)» Луи Пастер называл живые микроорганизмы • «неорганизованными ферментами» (от греческого ἐν- в- и ζύμη – дрожжи, закваска) называли секретируемых клетками сок
XIX век • Термины фермент и энзим отражали различные точки зрения. • «организованными ферментами» (от латинского fermentum — закваска)» Луи Пастер называл живые микроорганизмы • «неорганизованными ферментами» (от греческого ἐν- в- и ζύμη – дрожжи, закваска) называли секретируемых клетками сок
 Луи Пастер (12 декабря 1822 – 28 сентября 1895) Во второй половине XIX века брожение было подробно изучено Луи Пастером. Пастер доказал, что брожение – не чисто химический процесс и происходит только в присутствии живых клеток микроорганизмов.
Луи Пастер (12 декабря 1822 – 28 сентября 1895) Во второй половине XIX века брожение было подробно изучено Луи Пастером. Пастер доказал, что брожение – не чисто химический процесс и происходит только в присутствии живых клеток микроорганизмов.
 Эдуард Бухнер (20 мая 1860 -13 августа 1917 • Через два года после смерти Л. Пастера в 1897 г. Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток» , в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 за эту работу он был удостоен Нобелевской премии.
Эдуард Бухнер (20 мая 1860 -13 августа 1917 • Через два года после смерти Л. Пастера в 1897 г. Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток» , в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 за эту работу он был удостоен Нобелевской премии.
 ХХ век • Впервые высокоочищенный кристаллический фермент (уреазу) выделил в 1926 году Джеймс Бетчеллер Самнер (James Batcheller Sumner) (19 ноября 1887 – 12 августа 1955) - американский биохимик. • В 1930 г. Джон Нортроп получил кристаллический пепсин • В 1931 г. Нортроп и Кунитц получили кристаллический трипсин • В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана • В 1969 г. В лаборатории Б. Меррифилда был синтезирован первый фермент – рибонуклеаза, состоящая из 124 аминокислот. Искусственно синтезированный фермент не отличался от природной нуклеазы по химическим, каталитическим и иммунологическим тестам
ХХ век • Впервые высокоочищенный кристаллический фермент (уреазу) выделил в 1926 году Джеймс Бетчеллер Самнер (James Batcheller Sumner) (19 ноября 1887 – 12 августа 1955) - американский биохимик. • В 1930 г. Джон Нортроп получил кристаллический пепсин • В 1931 г. Нортроп и Кунитц получили кристаллический трипсин • В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана • В 1969 г. В лаборатории Б. Меррифилда был синтезирован первый фермент – рибонуклеаза, состоящая из 124 аминокислот. Искусственно синтезированный фермент не отличался от природной нуклеазы по химическим, каталитическим и иммунологическим тестам
 Рибозимы • Каталитическую активность РНК в 1980 -х годах впервые обнаружил Томас Роберт Чек (Thomas Robert Cech; 8 декабря 1947 г) - американский молекулярный биолог. • Удостоен Нобелевской премии (совместно с Сидни Олтменом) ( «for discovery of catalytic properties of RNA» ) в 1989 г.
Рибозимы • Каталитическую активность РНК в 1980 -х годах впервые обнаружил Томас Роберт Чек (Thomas Robert Cech; 8 декабря 1947 г) - американский молекулярный биолог. • Удостоен Нобелевской премии (совместно с Сидни Олтменом) ( «for discovery of catalytic properties of RNA» ) в 1989 г.
 Определение • Катализаторы – это вещества, которые влияют на скорость химической реакции, но сами при этом не расходуются. • Ферменты, или энзимы, - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах. • По своему химическому строению почти все ферменты являются белками. • Каталитически активные рибонуклеиновые кислоты называются рибозимами
Определение • Катализаторы – это вещества, которые влияют на скорость химической реакции, но сами при этом не расходуются. • Ферменты, или энзимы, - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах. • По своему химическому строению почти все ферменты являются белками. • Каталитически активные рибонуклеиновые кислоты называются рибозимами
 Общие свойства ферментов и небиологических катализаторов 1) не входят в состав конечных продуктов реакции и не тратятся в процессе катализа, выходят из реакции в неизменном виде. 2) ускоряют реакции, не противоречащие законам термодинамики. 3) не смещают положение равновесия, а лишь ускоряют его достижение.
Общие свойства ферментов и небиологических катализаторов 1) не входят в состав конечных продуктов реакции и не тратятся в процессе катализа, выходят из реакции в неизменном виде. 2) ускоряют реакции, не противоречащие законам термодинамики. 3) не смещают положение равновесия, а лишь ускоряют его достижение.
 Отличительные признаки ферментативного катализа: 1) Скорость ферментативного катализа выше, чем небиологического. 2) Ферменты обладают узкой избирательностью – специфичностью, действия на субстраты. 3) Ферментативные процессы не дают побочных реакций, для них характерен 100% выход продукта. 4) Ферменты катализируют реакции в мягких условиях: при обычном давлении, небольшой температуре и значениях р. Н, близких к нейтральным. 5) Активность ферментов регулируется – они могут изменять свою скорость под воздействием ряда факторов, обеспечивая скоординированность всех метаболических процессов во времени.
Отличительные признаки ферментативного катализа: 1) Скорость ферментативного катализа выше, чем небиологического. 2) Ферменты обладают узкой избирательностью – специфичностью, действия на субстраты. 3) Ферментативные процессы не дают побочных реакций, для них характерен 100% выход продукта. 4) Ферменты катализируют реакции в мягких условиях: при обычном давлении, небольшой температуре и значениях р. Н, близких к нейтральным. 5) Активность ферментов регулируется – они могут изменять свою скорость под воздействием ряда факторов, обеспечивая скоординированность всех метаболических процессов во времени.
 Специфичность действия • Под субстратной специфичностью понимают способность фермента взаимодействовать с одним или несколькими определенными субстратами Различают: • абсолютную специфичность (глюкокиназа) • относительную (или групповую) специфичность (пепсин) • cтереохимическую специфичность: например, глюкозооксидаза окисляет только β -D-глюкозу
Специфичность действия • Под субстратной специфичностью понимают способность фермента взаимодействовать с одним или несколькими определенными субстратами Различают: • абсолютную специфичность (глюкокиназа) • относительную (или групповую) специфичность (пепсин) • cтереохимическую специфичность: например, глюкозооксидаза окисляет только β -D-глюкозу
![• Процесс катализа можно представить следующим уравнением: E + S ⇆ [ES] → • Процесс катализа можно представить следующим уравнением: E + S ⇆ [ES] →](https://present5.com/presentation/71019041_50449224/image-15.jpg) • Процесс катализа можно представить следующим уравнением: E + S ⇆ [ES] → [EР] → E + P Стадии ферментативной реакции: 1. Сближение фермента и субстрата: E +S Стабилизация переходного состояния: [ES] 2. 3. Каталитическая реакция – превращение субстрата в продукт реакции – [EР] → E + P
• Процесс катализа можно представить следующим уравнением: E + S ⇆ [ES] → [EР] → E + P Стадии ферментативной реакции: 1. Сближение фермента и субстрата: E +S Стабилизация переходного состояния: [ES] 2. 3. Каталитическая реакция – превращение субстрата в продукт реакции – [EР] → E + P
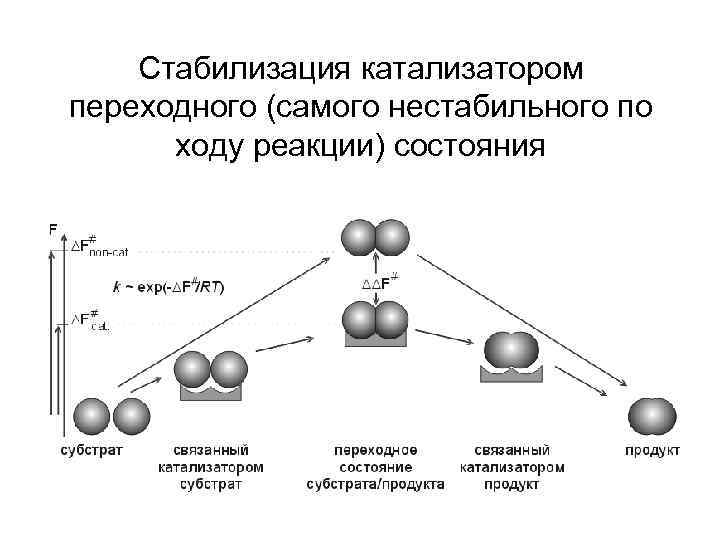 Стабилизация катализатором переходного (самого нестабильного по ходу реакции) состояния
Стабилизация катализатором переходного (самого нестабильного по ходу реакции) состояния
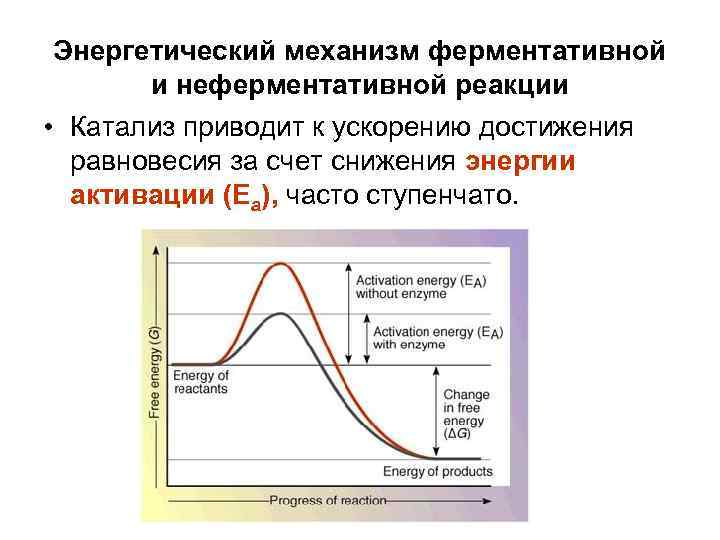 Энергетический механизм ферментативной и неферментативной реакции • Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто ступенчато.
Энергетический механизм ферментативной и неферментативной реакции • Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто ступенчато.
 Природа катализа • В реакцию вступают молекулы, преодолевшие энергетический барьер и обладающие энергией активации Еа • В переходном состоянии [ES] происходит перераспределение химических связей и образование продуктов реакции. • Природа ферментативного катализа состоит в том, что ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации. • Энергия активации – это та минимальная энергия, которая необходима для того, чтобы произошла химическая реакция, т. е. энергетический барьер преодолевают молекулы, обладающие энергией активации
Природа катализа • В реакцию вступают молекулы, преодолевшие энергетический барьер и обладающие энергией активации Еа • В переходном состоянии [ES] происходит перераспределение химических связей и образование продуктов реакции. • Природа ферментативного катализа состоит в том, что ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации. • Энергия активации – это та минимальная энергия, которая необходима для того, чтобы произошла химическая реакция, т. е. энергетический барьер преодолевают молекулы, обладающие энергией активации
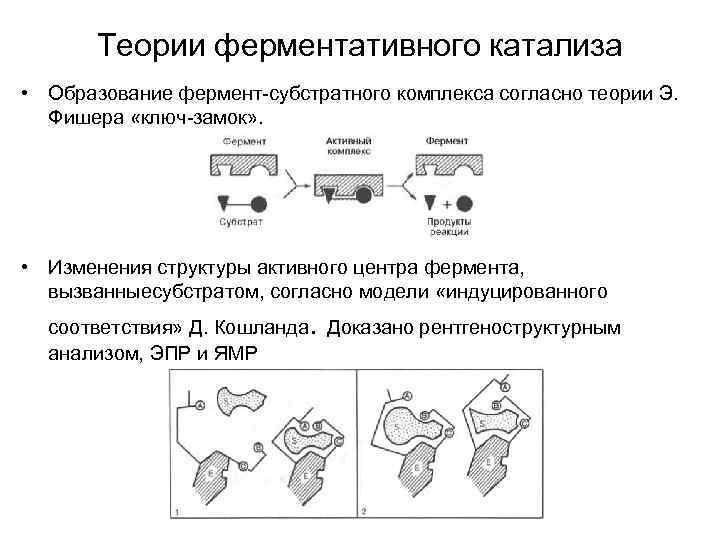 Теории ферментативного катализа • Образование фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок» . • Изменения структуры активного центра фермента, вызванныесубстратом, согласно модели «индуцированного . соответствия» Д. Кошланда Доказано рентгеноструктурным анализом, ЭПР и ЯМР
Теории ферментативного катализа • Образование фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок» . • Изменения структуры активного центра фермента, вызванныесубстратом, согласно модели «индуцированного . соответствия» Д. Кошланда Доказано рентгеноструктурным анализом, ЭПР и ЯМР
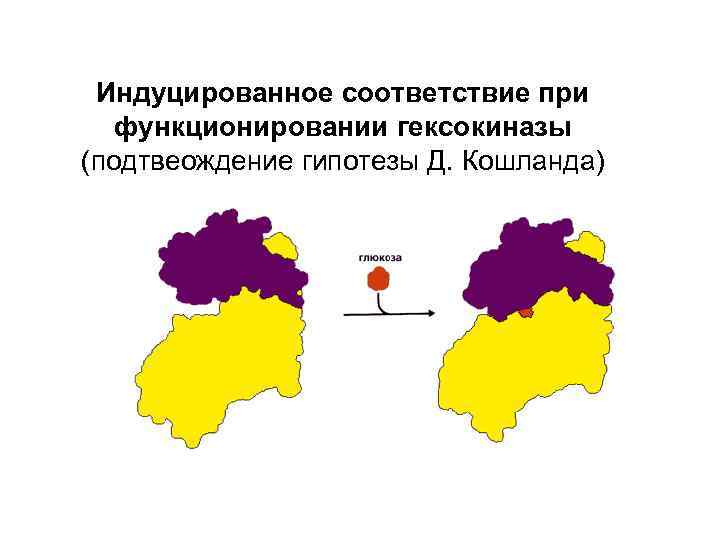 Индуцированное соответствие при функционировании гексокиназы (подтвеождение гипотезы Д. Кошланда)
Индуцированное соответствие при функционировании гексокиназы (подтвеождение гипотезы Д. Кошланда)
 Классы ферментов 1. 2. 3. 4. 5. 6. Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы
Классы ферментов 1. 2. 3. 4. 5. 6. Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы
 Название ферментов • В соответствии с классификацией ферментов каждый фермент получил систематической название: • название субстратов (через двоеточие), название типа химического превращения и окончания -аза). Например, лактатдегидрогеназа будет иметь систематическое название «L-лактат: NAD+ оксидоредуктаза» • На практике используют рабочие названия ферментов, которые состоят из названия субстрата, типа реакции и окончания «-аза» . Например: ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА. • Некоторые ферменты сохранили исторически сложившиеся тривиальные названия, например УРЕАЗА, ПЕПСИН
Название ферментов • В соответствии с классификацией ферментов каждый фермент получил систематической название: • название субстратов (через двоеточие), название типа химического превращения и окончания -аза). Например, лактатдегидрогеназа будет иметь систематическое название «L-лактат: NAD+ оксидоредуктаза» • На практике используют рабочие названия ферментов, которые состоят из названия субстрата, типа реакции и окончания «-аза» . Например: ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА. • Некоторые ферменты сохранили исторически сложившиеся тривиальные названия, например УРЕАЗА, ПЕПСИН
 Оксидоредуктазы катализируют реакции окислениявосстановления: Лактатдегидрогеназа (LDH, EC 1. 1. 1. 27) катализирует превращение молочной кислоты (лактат) в пировиноградную (пируват) и наоборот: СН 3 СН(ОН)СООН + NAD+ ↔ CH 3 COCООH + NADH + H+
Оксидоредуктазы катализируют реакции окислениявосстановления: Лактатдегидрогеназа (LDH, EC 1. 1. 1. 27) катализирует превращение молочной кислоты (лактат) в пировиноградную (пируват) и наоборот: СН 3 СН(ОН)СООН + NAD+ ↔ CH 3 COCООH + NADH + H+
 Трансферазы Катализируют реакции переноса групп с одной молекулы на другую Холинацетилтрансфераза, ЕС 2. 3. 1. 6, (систематическое название ацетил-Ко. А: холин О-ацетилтрансфераза) СH 3 CO-S-Ko. A + HO-СН 2 -N+(CН 3)3 → Ко. А-SH + СН 3 СОO-СН 2 -N+(CН 3)3
Трансферазы Катализируют реакции переноса групп с одной молекулы на другую Холинацетилтрансфераза, ЕС 2. 3. 1. 6, (систематическое название ацетил-Ко. А: холин О-ацетилтрансфераза) СH 3 CO-S-Ko. A + HO-СН 2 -N+(CН 3)3 → Ко. А-SH + СН 3 СОO-СН 2 -N+(CН 3)3
 Гидролазы (фосфатазы, эстеразы, фосфолипазы) Катализируют реакции разрыва связей с присоединением воды Дипептидаза расщепляет дипептид на две аминокислоты при участии воды: H 2 N-CH(R)-CO-NH-CH(R')-COOH + H 2 O→H 2 N-CH(R)-COOH + NH 2 -CH(R')-COOH
Гидролазы (фосфатазы, эстеразы, фосфолипазы) Катализируют реакции разрыва связей с присоединением воды Дипептидаза расщепляет дипептид на две аминокислоты при участии воды: H 2 N-CH(R)-CO-NH-CH(R')-COOH + H 2 O→H 2 N-CH(R)-COOH + NH 2 -CH(R')-COOH
 ЛИАЗЫ (альдолазы, гидратазыдегидратазы, синтазы, декарбоксилазы) Катализируют реакции разрыва связей в субстрате без присоединения воды или окисления): Пируватдекарбоксилаза (ЕС 4. 1. 1. 1, 2 кетокислоты карбокси-лиаза): CH 3 COCООH → CH 3 COH + СО 2
ЛИАЗЫ (альдолазы, гидратазыдегидратазы, синтазы, декарбоксилазы) Катализируют реакции разрыва связей в субстрате без присоединения воды или окисления): Пируватдекарбоксилаза (ЕС 4. 1. 1. 1, 2 кетокислоты карбокси-лиаза): CH 3 COCООH → CH 3 COH + СО 2
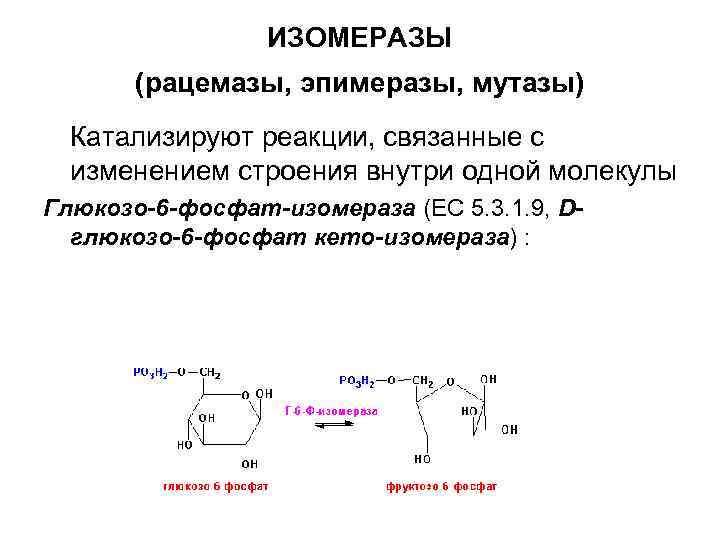 ИЗОМЕРАЗЫ (рацемазы, эпимеразы, мутазы) Катализируют реакции, связанные с изменением строения внутри одной молекулы Глюкозо-6 -фосфат-изомераза (ЕС 5. 3. 1. 9, Dглюкозо-6 -фосфат кето-изомераза) :
ИЗОМЕРАЗЫ (рацемазы, эпимеразы, мутазы) Катализируют реакции, связанные с изменением строения внутри одной молекулы Глюкозо-6 -фосфат-изомераза (ЕС 5. 3. 1. 9, Dглюкозо-6 -фосфат кето-изомераза) :
 Лигазы Катализируют реакции присоединения с образованием ковалентной связи. Аспартат -синтетаза (ЕС 6. 3. 1. 1, L-аспартат: аммиак-лигаза синтезирует аспарагин из аспарагиновой кислоты и аммиака:
Лигазы Катализируют реакции присоединения с образованием ковалентной связи. Аспартат -синтетаза (ЕС 6. 3. 1. 1, L-аспартат: аммиак-лигаза синтезирует аспарагин из аспарагиновой кислоты и аммиака:
 Номенклатура ферментов • По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент (энзим) имеет свой определенный код, состоящий из четырех цифр, разделенных точками. Первая цифра обозначает класс фермента, вторая – подкласс, третья – подподкласс, четвертая означает номер фермента.
Номенклатура ферментов • По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент (энзим) имеет свой определенный код, состоящий из четырех цифр, разделенных точками. Первая цифра обозначает класс фермента, вторая – подкласс, третья – подподкласс, четвертая означает номер фермента.
 Подклассы ферментов Внутри каждого класса происходит разделение на подклассы: • EC 1. 1 Действующие на CH-OH группы донора • EC 1. 2 Действующие на альдегидные или оксо- группы донора • EC 1. 3 Действующие на CH-СH группы донора • EC 1. 4 Действующие на CH-NH 2 группы донора • EC 1. 5 Действующие на CH-NH группы донора Фермент Лактатдегидрогеназа (LDH, EC 1. 1. 1. 27) – это оксидоредуктаза окисляет гидроксильную группу в молекуле лактата, поэтому относится к 1 подклассу: СН 3 СН(ОН)СООН + NAD+ → CH 3 COCООH + NADH + H+
Подклассы ферментов Внутри каждого класса происходит разделение на подклассы: • EC 1. 1 Действующие на CH-OH группы донора • EC 1. 2 Действующие на альдегидные или оксо- группы донора • EC 1. 3 Действующие на CH-СH группы донора • EC 1. 4 Действующие на CH-NH 2 группы донора • EC 1. 5 Действующие на CH-NH группы донора Фермент Лактатдегидрогеназа (LDH, EC 1. 1. 1. 27) – это оксидоредуктаза окисляет гидроксильную группу в молекуле лактата, поэтому относится к 1 подклассу: СН 3 СН(ОН)СООН + NAD+ → CH 3 COCООH + NADH + H+
 Подподклассы ферментов Внутри каждого подкласса происходит разделение на подподклассы: • • • EC 1. 1. 1 Акцептор NAD или NADP EC 1. 1. 2 Акцептор- цитохром EC 1. 1. 3 Акцептор- кислород EC 1. 1. 4 Акцептор- сульфид EC 1. 1. 5 Акцептор- хинон или подобная группировка Коферментом Лактатдегидрогеназы (LDH, EC 1. 1. 1. 27) является НАД, поэтому этот фермент относится к 1 подподклассу: СН 3 СН(ОН)СООН + NAD+ → CH 3 COCООH + NADH + H+
Подподклассы ферментов Внутри каждого подкласса происходит разделение на подподклассы: • • • EC 1. 1. 1 Акцептор NAD или NADP EC 1. 1. 2 Акцептор- цитохром EC 1. 1. 3 Акцептор- кислород EC 1. 1. 4 Акцептор- сульфид EC 1. 1. 5 Акцептор- хинон или подобная группировка Коферментом Лактатдегидрогеназы (LDH, EC 1. 1. 1. 27) является НАД, поэтому этот фермент относится к 1 подподклассу: СН 3 СН(ОН)СООН + NAD+ → CH 3 COCООH + NADH + H+
 Четвертая цифра – номер фермента • • • Последнее число – номер конкретного фермента: EC 1. 1 alcohol dehydrogenase EC 1. 1. 1. 2 alcohol dehydrogenase (NADP+) EC 1. 1. 1. 3 homoserine dehydrogenase EC 1. 1. 1. 4 (R, R)-butanediol dehydrogenase. . . и т. д. У Лактатдегидрогеназы (LDH, EC 1. 1. 1. 27) 27 порядковый номер в ряду ферментов 1 подподкласса СН 3 СН(ОН)СООН + NAD+ → CH 3 COCООH + NADH + H+
Четвертая цифра – номер фермента • • • Последнее число – номер конкретного фермента: EC 1. 1 alcohol dehydrogenase EC 1. 1. 1. 2 alcohol dehydrogenase (NADP+) EC 1. 1. 1. 3 homoserine dehydrogenase EC 1. 1. 1. 4 (R, R)-butanediol dehydrogenase. . . и т. д. У Лактатдегидрогеназы (LDH, EC 1. 1. 1. 27) 27 порядковый номер в ряду ферментов 1 подподкласса СН 3 СН(ОН)СООН + NAD+ → CH 3 COCООH + NADH + H+
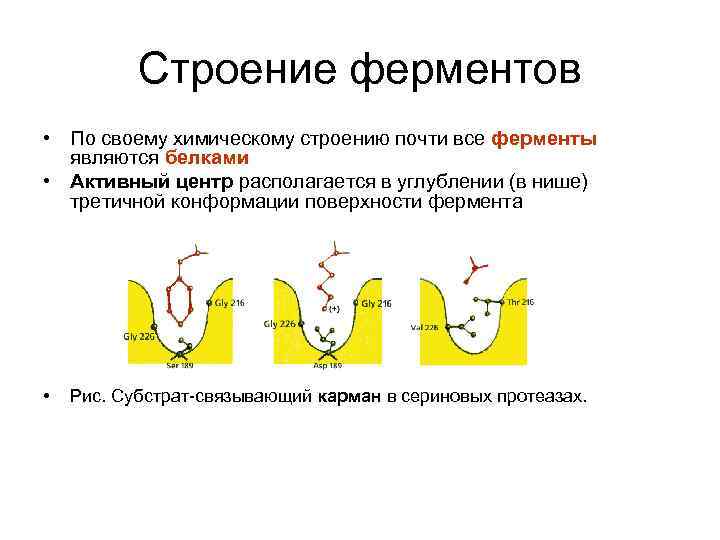 Строение ферментов • По своему химическому строению почти все ферменты являются белками • Активный центр располагается в углублении (в нише) третичной конформации поверхности фермента • Рис. Субстрат-связывающий карман в сериновых протеазах.
Строение ферментов • По своему химическому строению почти все ферменты являются белками • Активный центр располагается в углублении (в нише) третичной конформации поверхности фермента • Рис. Субстрат-связывающий карман в сериновых протеазах.
 Активный центр • Активный центр фермента – это уникальная комбинация аминокислот, благодаря которой осуществляется его каталитическое действие. В активном центре выделяют 2 домена: «контактный» , в котором происходит связывание и ориентация субстрата, и «каталитический» , в котором происходит химическое превращение субстрата • Эти 2 домена могут перекрываться • У простых белков-ферментов активный центр образован радикалами аминокислот • У сложных белков-ферментов в активном центре находятся коферменты или кофакторы
Активный центр • Активный центр фермента – это уникальная комбинация аминокислот, благодаря которой осуществляется его каталитическое действие. В активном центре выделяют 2 домена: «контактный» , в котором происходит связывание и ориентация субстрата, и «каталитический» , в котором происходит химическое превращение субстрата • Эти 2 домена могут перекрываться • У простых белков-ферментов активный центр образован радикалами аминокислот • У сложных белков-ферментов в активном центре находятся коферменты или кофакторы
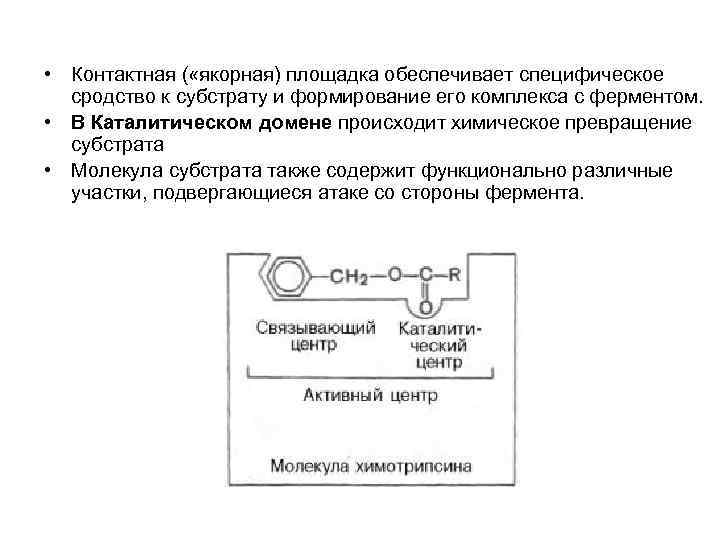 • Контактная ( «якорная) площадка обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. • В Каталитическом домене происходит химическое превращение субстрата • Молекула субстрата также содержит функционально различные участки, подвергающиеся атаке со стороны фермента.
• Контактная ( «якорная) площадка обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. • В Каталитическом домене происходит химическое превращение субстрата • Молекула субстрата также содержит функционально различные участки, подвергающиеся атаке со стороны фермента.
 • В образовании фермент-субстратных комплексов участвуют водородные, электростатические (ионные) и гидрофобные взаимодействия, а также координационные связи • Информация о природе связей между субстратом и связывающим участком активного центра фермента может быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии
• В образовании фермент-субстратных комплексов участвуют водородные, электростатические (ионные) и гидрофобные взаимодействия, а также координационные связи • Информация о природе связей между субстратом и связывающим участком активного центра фермента может быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии
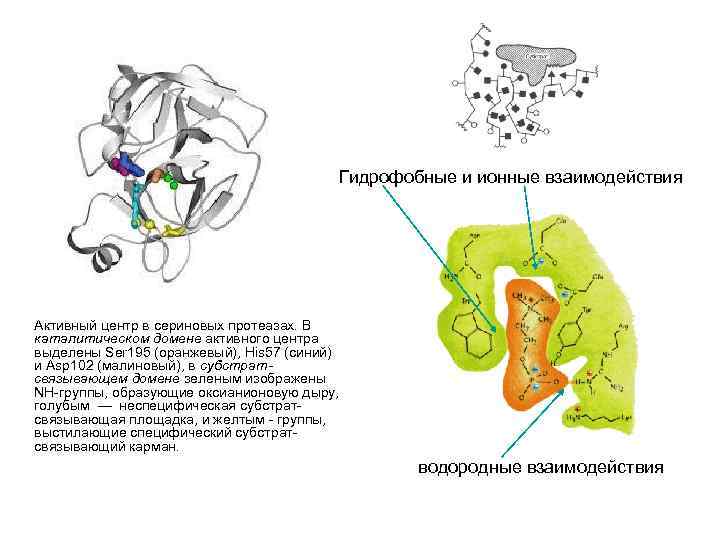 Гидрофобные и ионные взаимодействия Активный центр в сериновых протеазах. В каталитическом домене активного центра выделены Ser 195 (оранжевый), His 57 (синий) и Asp 102 (малиновый), в субстратсвязывающем домене зеленым изображены NH-группы, образующие оксианионовую дыру, голубым — неспецифическая субстратсвязывающая площадка, и желтым - группы, выстилающие специфический субстрат- связывающий карман. водородные взаимодействия
Гидрофобные и ионные взаимодействия Активный центр в сериновых протеазах. В каталитическом домене активного центра выделены Ser 195 (оранжевый), His 57 (синий) и Asp 102 (малиновый), в субстратсвязывающем домене зеленым изображены NH-группы, образующие оксианионовую дыру, голубым — неспецифическая субстратсвязывающая площадка, и желтым - группы, выстилающие специфический субстрат- связывающий карман. водородные взаимодействия
 • Аллостерический центр ( «Аллос» – другой, «Steros» - пространственный), расположенный вдали от активного центра, специальный регуляторный центр фермента, с которым связываются низкомолекулярные вещества – эффекторы, молекулы которых отличаются по структуре от субстратов. • Положительный эффектор ускоряет реакцию • Отрицательный эффектор замедляет реакцию • Ферменты, имеющие аллостерический центр, получили название аллостерических ферментов.
• Аллостерический центр ( «Аллос» – другой, «Steros» - пространственный), расположенный вдали от активного центра, специальный регуляторный центр фермента, с которым связываются низкомолекулярные вещества – эффекторы, молекулы которых отличаются по структуре от субстратов. • Положительный эффектор ускоряет реакцию • Отрицательный эффектор замедляет реакцию • Ферменты, имеющие аллостерический центр, получили название аллостерических ферментов.
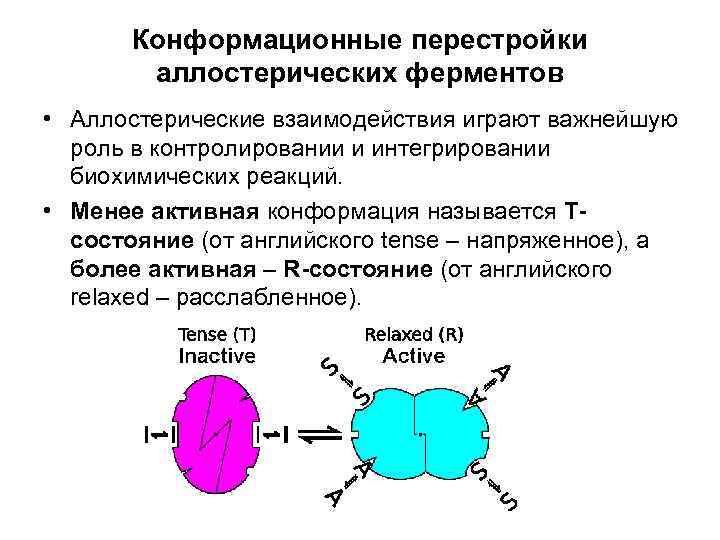 Конформационные перестройки аллостерических ферментов • Аллостерические взаимодействия играют важнейшую роль в контролировании и интегрировании биохимических реакций. • Менее активная конформация называется Тcостояние (от английского tense – напряженное), а более активная – R-состояние (от английского relaxed – расслабленное).
Конформационные перестройки аллостерических ферментов • Аллостерические взаимодействия играют важнейшую роль в контролировании и интегрировании биохимических реакций. • Менее активная конформация называется Тcостояние (от английского tense – напряженное), а более активная – R-состояние (от английского relaxed – расслабленное).
 Строение сложных белков-ферментов • Если молекула фермента состоит из белковой части (полипептидная нить) и небелковой части, то это сложные ферменты. • Белковая часть фермента, называется апоферментом • Небелковая часть сложного фермента, называется КОФЕРМЕНТОМ или кофактором • Если КОФЕРМЕНТ прочно связан с апоферментом, его называют ПРОСТЕТИЧЕСКОЙ ГРУППОй • Природный комплекс апофермента с кофактором составляет ХОЛОФЕРМЕНТ, т. е. функционально действенный энзим. Соединение в ХОЛОФЕРМЕНТ осуществляется любыми типами связей, кроме ковалентных. • Апофермент синтезируется в организме • Большинство коферментов – это производные витаминов или содержат витамин в качестве компонента
Строение сложных белков-ферментов • Если молекула фермента состоит из белковой части (полипептидная нить) и небелковой части, то это сложные ферменты. • Белковая часть фермента, называется апоферментом • Небелковая часть сложного фермента, называется КОФЕРМЕНТОМ или кофактором • Если КОФЕРМЕНТ прочно связан с апоферментом, его называют ПРОСТЕТИЧЕСКОЙ ГРУППОй • Природный комплекс апофермента с кофактором составляет ХОЛОФЕРМЕНТ, т. е. функционально действенный энзим. Соединение в ХОЛОФЕРМЕНТ осуществляется любыми типами связей, кроме ковалентных. • Апофермент синтезируется в организме • Большинство коферментов – это производные витаминов или содержат витамин в качестве компонента
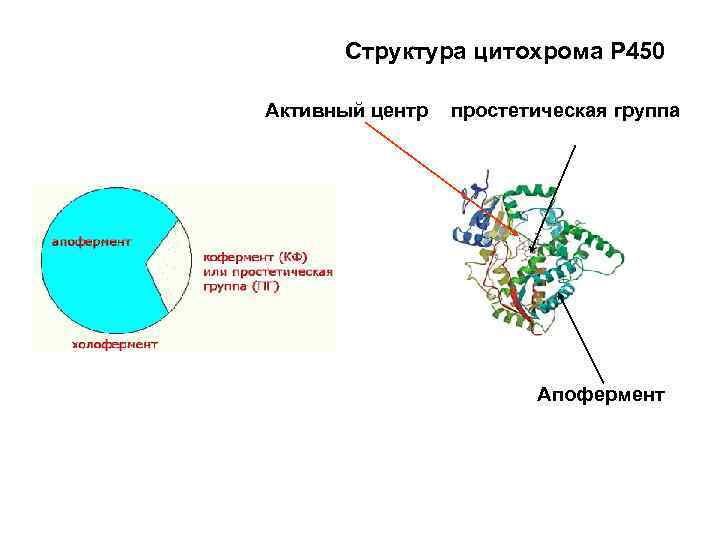 Структура цитохрома Р 450 Активный центр простетическая группа Апофермент
Структура цитохрома Р 450 Активный центр простетическая группа Апофермент
 • Кофермент – термостабильное низкомолекулярное соединение, небелковая часть сложных белков-ферментов, без которых фермент не активен • Кофакторы - ионы некоторых металлов (Mg, Zn, Fe, Сu, Со, Mo и др. ), прочно связанные с активным центром • Роль кофакторов – улучшение образования [ES] -комплекса, ориентация субстрата, стабилизация как субстрата, так и активного центра фермента
• Кофермент – термостабильное низкомолекулярное соединение, небелковая часть сложных белков-ферментов, без которых фермент не активен • Кофакторы - ионы некоторых металлов (Mg, Zn, Fe, Сu, Со, Mo и др. ), прочно связанные с активным центром • Роль кофакторов – улучшение образования [ES] -комплекса, ориентация субстрата, стабилизация как субстрата, так и активного центра фермента
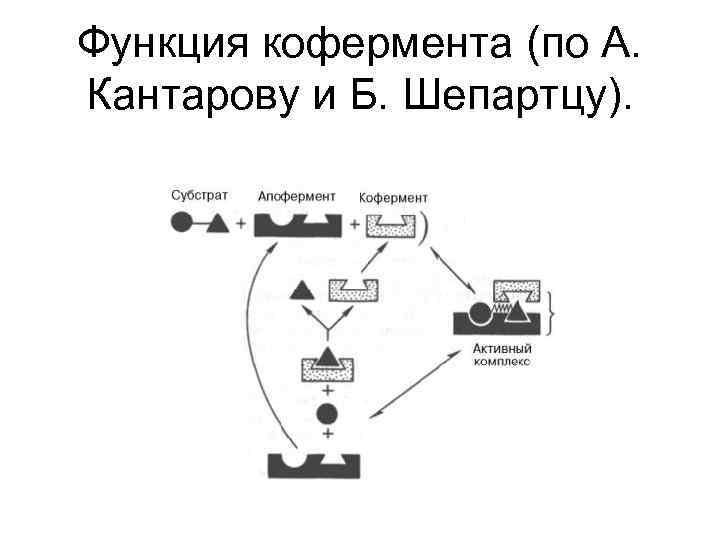
 Функции коферментов 1. Участие в акте катализа 2. Осуществление связи между ферментом и субстратом 3. Стабилизация апофермента • Апофермент усиливает каталитическую активность небелковой части (КФ и ПГ). Например, NAD+ является КФ многих дегидрогеназ, отличие - в апоферментной части.
Функции коферментов 1. Участие в акте катализа 2. Осуществление связи между ферментом и субстратом 3. Стабилизация апофермента • Апофермент усиливает каталитическую активность небелковой части (КФ и ПГ). Например, NAD+ является КФ многих дегидрогеназ, отличие - в апоферментной части.
 Химическая природа коферментов К коферментам относят следующие соединения: 1. Производные витаминов 2. Гемы, являющиеся простетической группой цитохромов, каталазы, пероксидазы 3. Нуклеотиды – доноры и акцепторы остатка Н 3 РО 4 4. Убихинон, или ко. Q 5. ФАФС – фосфоаденозилфосфосульфат донор сульфата 6. SAM – S-аденозилметионин донор метильной группы 7. Глутатион
Химическая природа коферментов К коферментам относят следующие соединения: 1. Производные витаминов 2. Гемы, являющиеся простетической группой цитохромов, каталазы, пероксидазы 3. Нуклеотиды – доноры и акцепторы остатка Н 3 РО 4 4. Убихинон, или ко. Q 5. ФАФС – фосфоаденозилфосфосульфат донор сульфата 6. SAM – S-аденозилметионин донор метильной группы 7. Глутатион
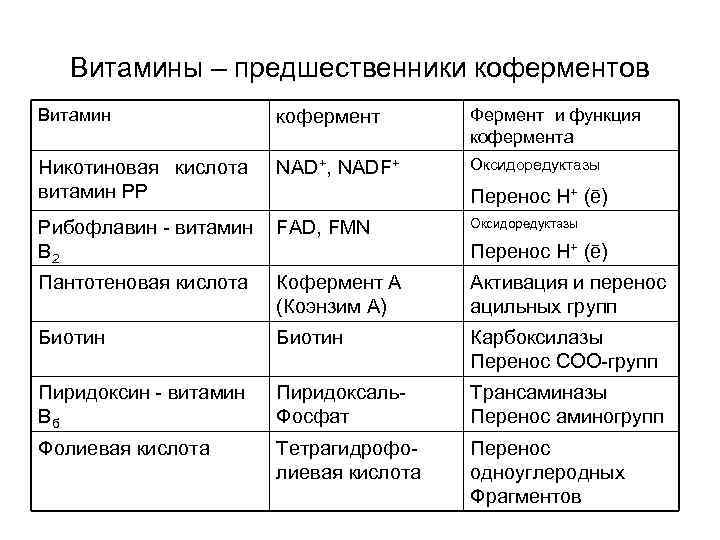 Витамины – предшественники коферментов Витамин кофермент Фермент и функция кофермента Никотиновая кислота NAD+, NADF+ витамин РР Оксидоредуктазы Рибофлавин - витамин FAD, FMN В 2 Оксидоредуктазы Пантотеновая кислота Кофермент А (Коэнзим А) Активация и перенос ацильных групп Биотин Карбоксилазы Перенос СОО-групп Пиридоксин - витамин Вб Пиридоксаль. Фосфат Трансаминазы Перенос аминогрупп Фолиевая кислота Тетрагидрофолиевая кислота Перенос одноуглеродных Фрагментов Перенос Н+ (ē)
Витамины – предшественники коферментов Витамин кофермент Фермент и функция кофермента Никотиновая кислота NAD+, NADF+ витамин РР Оксидоредуктазы Рибофлавин - витамин FAD, FMN В 2 Оксидоредуктазы Пантотеновая кислота Кофермент А (Коэнзим А) Активация и перенос ацильных групп Биотин Карбоксилазы Перенос СОО-групп Пиридоксин - витамин Вб Пиридоксаль. Фосфат Трансаминазы Перенос аминогрупп Фолиевая кислота Тетрагидрофолиевая кислота Перенос одноуглеродных Фрагментов Перенос Н+ (ē)
 Функция кофермента (по А. Кантарову и Б. Шепартцу).
Функция кофермента (по А. Кантарову и Б. Шепартцу).
 Изоферменты • Изоферменты(изоэнзимы, изозимы) разные структурные формы ферментов, обладающие каталитической активностью одного типа; встречаются у организмов одного вида (или в одной ткани). И. катализируют одну и ту же реакцию, но различаются аминокислотным составом, некоторыми физическими, иммунологическими и каталитическими • Лактатдегидрогеназа имеет 5 изоформ; каждая форма (тетрамер) построена из 4 белковых субъединиц двух типов.
Изоферменты • Изоферменты(изоэнзимы, изозимы) разные структурные формы ферментов, обладающие каталитической активностью одного типа; встречаются у организмов одного вида (или в одной ткани). И. катализируют одну и ту же реакцию, но различаются аминокислотным составом, некоторыми физическими, иммунологическими и каталитическими • Лактатдегидрогеназа имеет 5 изоформ; каждая форма (тетрамер) построена из 4 белковых субъединиц двух типов.
 Основы кинетики ферментативных реакций • Кинетика ферментативных реакций – раздел энзимологии, который изучает зависимость скорости реакции от химической природы реагирующих веществ и от факторов окружающей среды • Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени • Кинетика ферментативных реакций определяется образованием ферментсубстратного комплекса: E + S ⇆ [ES] → E + P
Основы кинетики ферментативных реакций • Кинетика ферментативных реакций – раздел энзимологии, который изучает зависимость скорости реакции от химической природы реагирующих веществ и от факторов окружающей среды • Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени • Кинетика ферментативных реакций определяется образованием ферментсубстратного комплекса: E + S ⇆ [ES] → E + P
 Единицы каталитической активности фермента Каталитическая активность ферментов выражается в каталах и международных единицах (МЕ): • 1 кат – это количество фермента, которое превращает 1 моль субстрата за 1 сек • МЕ фермента – это количество фермента, которое превращает 1 мкмоль субстрата за 1 мин 1 кат = 6 ∙ 107 МЕ или 1 МЕ = 16, 67 нкат • Удельная активность фермента – это количество единиц активности фермента в образце ткани, деленное на массу белка в этой ткани
Единицы каталитической активности фермента Каталитическая активность ферментов выражается в каталах и международных единицах (МЕ): • 1 кат – это количество фермента, которое превращает 1 моль субстрата за 1 сек • МЕ фермента – это количество фермента, которое превращает 1 мкмоль субстрата за 1 мин 1 кат = 6 ∙ 107 МЕ или 1 МЕ = 16, 67 нкат • Удельная активность фермента – это количество единиц активности фермента в образце ткани, деленное на массу белка в этой ткани
 • Полный математический анализ ферментативной реакции приводит к сложным уравнениям, не пригодным для практического применения. • Наиболее удобной оказалась модель ферментативной реакции первого порядка (один субстрат), разработанная в 1913 году немецким химиком Леонором Михаэлисом (1875 -1949) и канадским патологом Мо Ментеном (1879 -1960)
• Полный математический анализ ферментативной реакции приводит к сложным уравнениям, не пригодным для практического применения. • Наиболее удобной оказалась модель ферментативной реакции первого порядка (один субстрат), разработанная в 1913 году немецким химиком Леонором Михаэлисом (1875 -1949) и канадским патологом Мо Ментеном (1879 -1960)
 • Ферментативный процесс можно выразить следующим уравнением: где k 1 – константа скорости образования [ES] k-1 – константа скорости обратной реакции k 2 – константа скорости образования продукта реакции • Соотношение констант скоростей называют константой Михаэлиса Кm: km = (k-1 + k 2)/k 1 Скорость реакции пропорциональна концентрации [ES] • А скорость образования [ES] зависит от концентрации [S] и концентрации [Е] • Наибольшая скорость реакции наблюдается, когда все молекулы фермента находятся в комплексе с субстратом
• Ферментативный процесс можно выразить следующим уравнением: где k 1 – константа скорости образования [ES] k-1 – константа скорости обратной реакции k 2 – константа скорости образования продукта реакции • Соотношение констант скоростей называют константой Михаэлиса Кm: km = (k-1 + k 2)/k 1 Скорость реакции пропорциональна концентрации [ES] • А скорость образования [ES] зависит от концентрации [S] и концентрации [Е] • Наибольшая скорость реакции наблюдается, когда все молекулы фермента находятся в комплексе с субстратом
 Уравнение Михаэлиса- Ментен • Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике) V = Vmax • [S]/(Km+[S]) В этом уравнении Vmax и Km не зависят от концентрации субстрата и характеризуют свойства фермента – они являются кинетическими характеристиками эффективности фермента Vmax – дает характеристику каталитической активности фермента, имеет размерность моль/л и определяет максимальную возможность образования продукта при данной концентрации фермента в условиях избытка субстрата Km – характеризует сродство данного фермента к данному субстрату и является постоянной величиной. Константа Михаэлиса измеряется в моль/л и бывает от 10 -2 до 10 -7, чем меньше Кm, тем активнее фермент.
Уравнение Михаэлиса- Ментен • Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике) V = Vmax • [S]/(Km+[S]) В этом уравнении Vmax и Km не зависят от концентрации субстрата и характеризуют свойства фермента – они являются кинетическими характеристиками эффективности фермента Vmax – дает характеристику каталитической активности фермента, имеет размерность моль/л и определяет максимальную возможность образования продукта при данной концентрации фермента в условиях избытка субстрата Km – характеризует сродство данного фермента к данному субстрату и является постоянной величиной. Константа Михаэлиса измеряется в моль/л и бывает от 10 -2 до 10 -7, чем меньше Кm, тем активнее фермент.
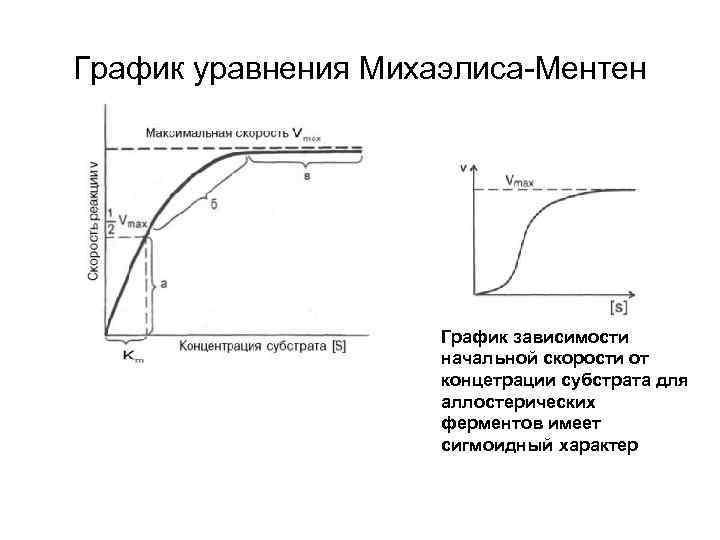 График уравнения Михаэлиса-Ментен График зависимости начальной скорости от концетрации субстрата для аллостерических ферментов имеет сигмоидный характер
График уравнения Михаэлиса-Ментен График зависимости начальной скорости от концетрации субстрата для аллостерических ферментов имеет сигмоидный характер
![Определение Vmax и Km • При [S] < < km V = Vmax • Определение Vmax и Km • При [S] < < km V = Vmax •](https://present5.com/presentation/71019041_50449224/image-54.jpg) Определение Vmax и Km • При [S] < < km V = Vmax • [S]/km = k • [S], т. е. при очень низких [S] скорость прямо пропорциональна концентрации субстрата • При [S] = km V = Vmax • [S]/( • [S]+[S]) = Vmax/2, т. е. km равна концентрации субстрата при половине максимальной скорости • При [S] > > km V = Vmax • [S]/(Km+[S]) = Vmax • [S]/[S] = Vmax, т. е. при очень высоких [S] скорость является максимальной и не зависит от [S]
Определение Vmax и Km • При [S] < < km V = Vmax • [S]/km = k • [S], т. е. при очень низких [S] скорость прямо пропорциональна концентрации субстрата • При [S] = km V = Vmax • [S]/( • [S]+[S]) = Vmax/2, т. е. km равна концентрации субстрата при половине максимальной скорости • При [S] > > km V = Vmax • [S]/(Km+[S]) = Vmax • [S]/[S] = Vmax, т. е. при очень высоких [S] скорость является максимальной и не зависит от [S]
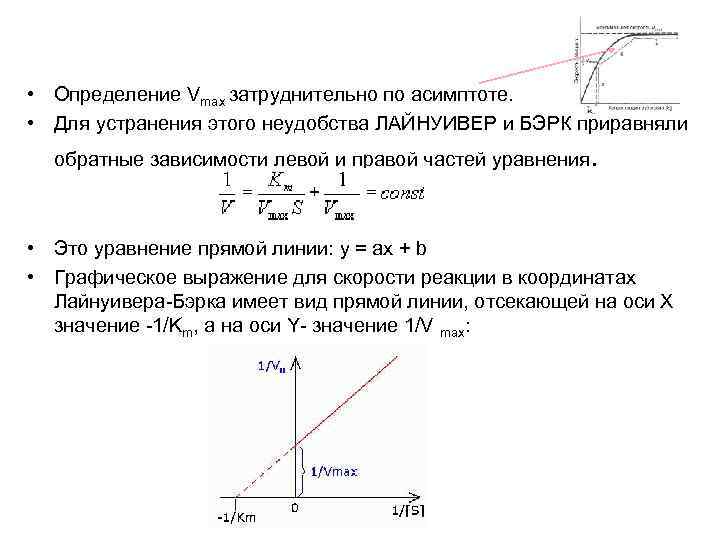 • Определение Vmax затруднительно по асимптоте. • Для устранения этого неудобства ЛАЙНУИВЕР и БЭРК приравняли обратные зависимости левой и правой частей уравнения . • Это уравнение прямой линии: у = ах + b • Графическое выражение для скорости реакции в координатах Лайнуивера-Бэрка имеет вид прямой линии, отсекающей на оси Х значение -1/Km, а на оси Y- значение 1/V max:
• Определение Vmax затруднительно по асимптоте. • Для устранения этого неудобства ЛАЙНУИВЕР и БЭРК приравняли обратные зависимости левой и правой частей уравнения . • Это уравнение прямой линии: у = ах + b • Графическое выражение для скорости реакции в координатах Лайнуивера-Бэрка имеет вид прямой линии, отсекающей на оси Х значение -1/Km, а на оси Y- значение 1/V max:
 Термолабильность ферментов • Температурный коэффициент Q 10 показывает во сколько раз ускоряется скорость реакции при повышении температуры на 100 С • При 1000 С почти все ферменты утрачивают свою активность (исключение составляют, очевидно, только один фермент мышечной ткани - миокиназа, которая выдерживает нагревание до 1000 С), так как происходит денатурация белка • При низких температурах (00 С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля (снижается кинетическая энергия - ЕА). • На термолабильность ферментов определенное влияние оказывают концентрация субстрата, р. Н среды и другие факторы.
Термолабильность ферментов • Температурный коэффициент Q 10 показывает во сколько раз ускоряется скорость реакции при повышении температуры на 100 С • При 1000 С почти все ферменты утрачивают свою активность (исключение составляют, очевидно, только один фермент мышечной ткани - миокиназа, которая выдерживает нагревание до 1000 С), так как происходит денатурация белка • При низких температурах (00 С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля (снижается кинетическая энергия - ЕА). • На термолабильность ферментов определенное влияние оказывают концентрация субстрата, р. Н среды и другие факторы.
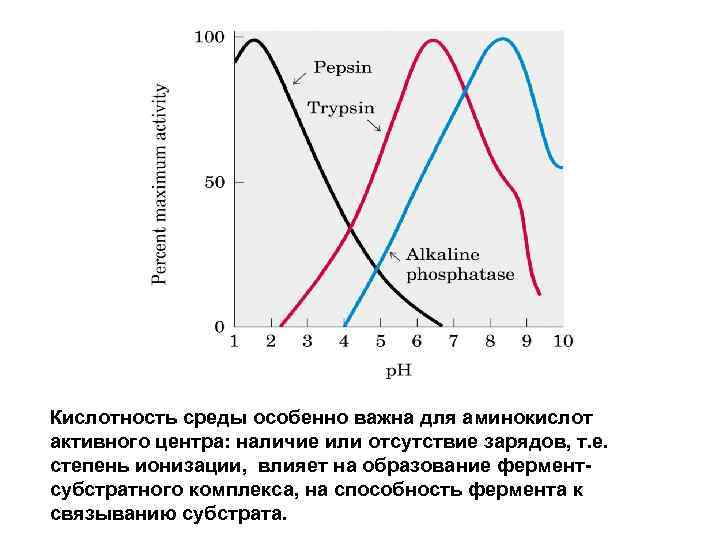 Кислотность среды особенно важна для аминокислот активного центра: наличие или отсутствие зарядов, т. е. степень ионизации, влияет на образование ферментсубстратного комплекса, на способность фермента к связыванию субстрата.
Кислотность среды особенно важна для аминокислот активного центра: наличие или отсутствие зарядов, т. е. степень ионизации, влияет на образование ферментсубстратного комплекса, на способность фермента к связыванию субстрата.
 Зависимость активности ферментов от р. Н среды • р. Н-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляет пепсин, р. Н-оптимум которого равен 2. 0. • Влияние изменений р. Н среды на молекулы фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина и др. ). • При разных значениях р. Н среды активный центр может находиться в частично ионизированной или в неионизированной форме, что сказывается на третичной структуре белка и соответственно формировании активного фермент-субстратного комплекса. -СООН АСП или ГЛУ при р. Н<7 будет нейтральной, а при р. Н>7 имеет «-» заряд -NH 2 АРГ, ГИС, ЛИЗ при р. Н<7 будет имеет «+» заряд, а при р. Н>7 будет нейтральной • Кроме того, имеет значение и состояние ионизации субстратов и кофакторов.
Зависимость активности ферментов от р. Н среды • р. Н-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляет пепсин, р. Н-оптимум которого равен 2. 0. • Влияние изменений р. Н среды на молекулы фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина и др. ). • При разных значениях р. Н среды активный центр может находиться в частично ионизированной или в неионизированной форме, что сказывается на третичной структуре белка и соответственно формировании активного фермент-субстратного комплекса. -СООН АСП или ГЛУ при р. Н<7 будет нейтральной, а при р. Н>7 имеет «-» заряд -NH 2 АРГ, ГИС, ЛИЗ при р. Н<7 будет имеет «+» заряд, а при р. Н>7 будет нейтральной • Кроме того, имеет значение и состояние ионизации субстратов и кофакторов.
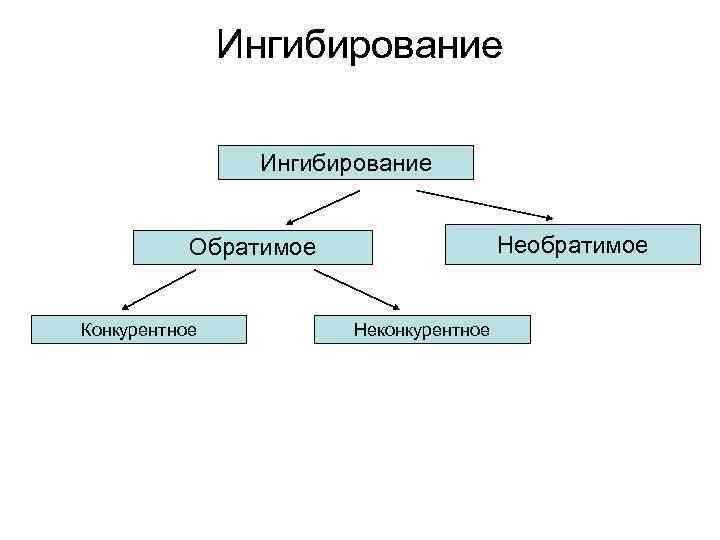 Ингибирование Необратимое Обратимое Конкурентное Неконкурентное
Ингибирование Необратимое Обратимое Конкурентное Неконкурентное
 Необратимое ингибирование • Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелыхи металлов, нагревание), приводят к необратимой инактивации фермента. • Необратимое ингибирование неспецифично, оно не связано с механизмами действия ферментов • С необратимым ингибированием связано действие многих токсинов и ядов на организм.
Необратимое ингибирование • Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелыхи металлов, нагревание), приводят к необратимой инактивации фермента. • Необратимое ингибирование неспецифично, оно не связано с механизмами действия ферментов • С необратимым ингибированием связано действие многих токсинов и ядов на организм.
 Обратимое ингибирование • Специфические ингибиторы вызывают обратимое ингибирование и поддаются количественному изучению на основе уравнения Михаэлиса-Ментен. • Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Обратимое ингибирование • Специфические ингибиторы вызывают обратимое ингибирование и поддаются количественному изучению на основе уравнения Михаэлиса-Ментен. • Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
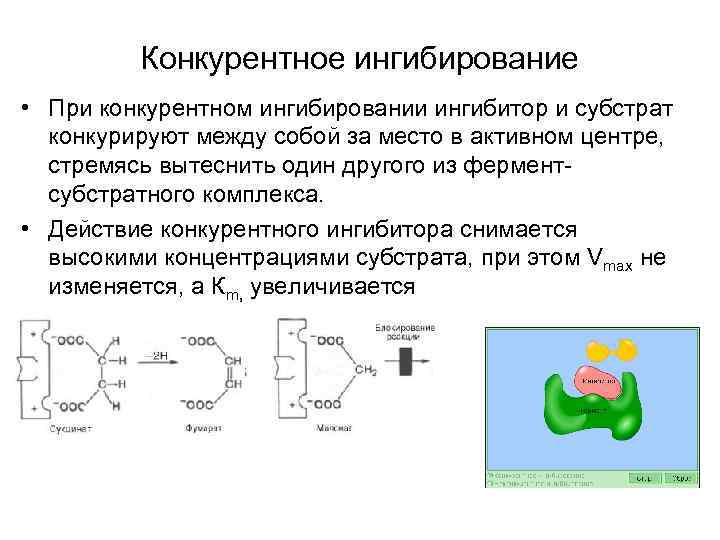 Конкурентное ингибирование • При конкурентном ингибировании ингибитор и субстрат конкурируют между собой за место в активном центре, стремясь вытеснить один другого из ферментсубстратного комплекса. • Действие конкурентного ингибитора снимается высокими концентрациями субстрата, при этом Vmax не изменяется, а Кm, увеличивается
Конкурентное ингибирование • При конкурентном ингибировании ингибитор и субстрат конкурируют между собой за место в активном центре, стремясь вытеснить один другого из ферментсубстратного комплекса. • Действие конкурентного ингибитора снимается высокими концентрациями субстрата, при этом Vmax не изменяется, а Кm, увеличивается
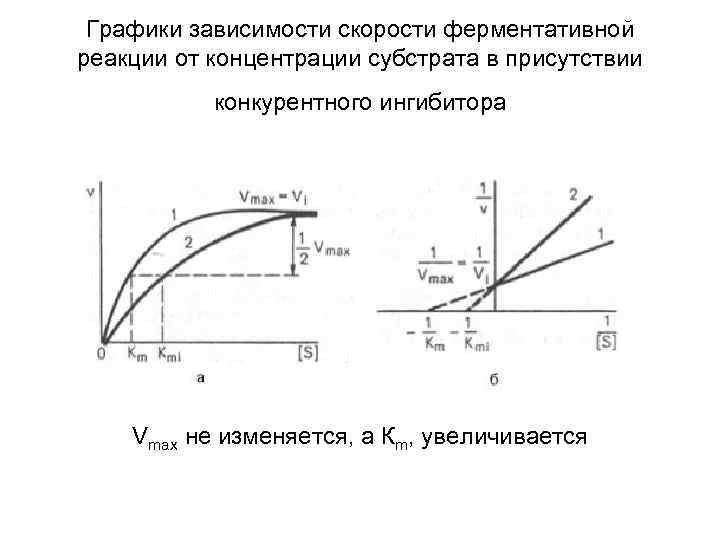 Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора Vmax не изменяется, а Кm, увеличивается
Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора Vmax не изменяется, а Кm, увеличивается
 Лекарственные препараты как конкурентные ингибиторы • Прозерин и эндрофоний – ингибиторы холинэстеразы используют при лечении мышечной дистрофии (нейромедиатор ацетилхолин вызывает деполяризацию мембраны) • Сульфаниламиды – аналоги пара-аминобензойной кислоты являются антиметаболитами
Лекарственные препараты как конкурентные ингибиторы • Прозерин и эндрофоний – ингибиторы холинэстеразы используют при лечении мышечной дистрофии (нейромедиатор ацетилхолин вызывает деполяризацию мембраны) • Сульфаниламиды – аналоги пара-аминобензойной кислоты являются антиметаболитами
 Неконкурентное ингибирование • Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента • Степень торможения определяется продолжительностью действия ингибитора на фермент. • Неконкурентное ингибирование может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. • Примером необратимого ингибирования является действие йодацетата, диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов в молекуле фермента
Неконкурентное ингибирование • Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента • Степень торможения определяется продолжительностью действия ингибитора на фермент. • Неконкурентное ингибирование может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. • Примером необратимого ингибирования является действие йодацетата, диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов в молекуле фермента
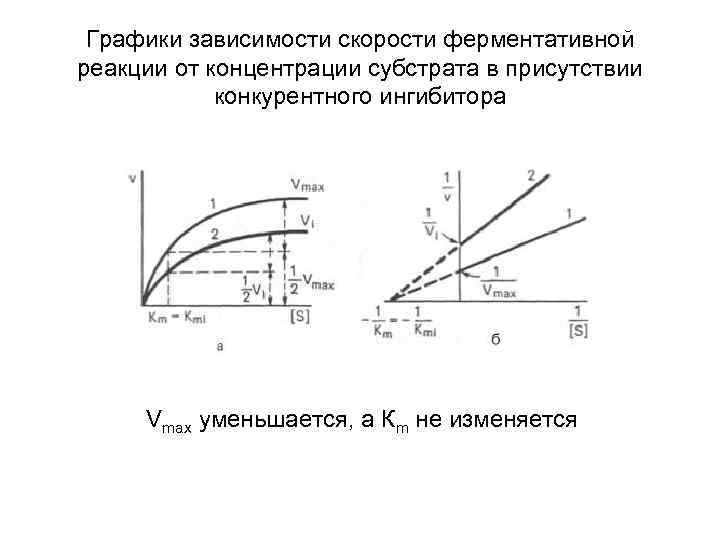 Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора Vmax уменьшается, а Кm не изменяется
Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора Vmax уменьшается, а Кm не изменяется
 Лекарственные препараты как неконкурентные ингибиторы • Аспирин ингибирует циклооксигеназу
Лекарственные препараты как неконкурентные ингибиторы • Аспирин ингибирует циклооксигеназу
 Регуляция активности ферментов • Ковалентная модификация – частичный протеолиз: зимогены - пепсиноген • Нековалентная модификация: фосфорилированиедефосфорилирование – гликогенфосфорилаза (фосфорилированная форма активная, дефосфорилированная – неактивная • Ингибирование – регуляция по принципу обратной связи: конечный продукт ингибирует ключевой фермент: холестерин – ГМГКо. А-редуктазу • Репрессия или индукция генов (изменение биосинтеза ферментов): тироксин взаимодействует с гормончувствительным участком ДНК • Компартментализация: ЖК синтезируются в цитоплазме, окисляются в митохондриях (ЦПЭ) • Аллостерическая регуляция
Регуляция активности ферментов • Ковалентная модификация – частичный протеолиз: зимогены - пепсиноген • Нековалентная модификация: фосфорилированиедефосфорилирование – гликогенфосфорилаза (фосфорилированная форма активная, дефосфорилированная – неактивная • Ингибирование – регуляция по принципу обратной связи: конечный продукт ингибирует ключевой фермент: холестерин – ГМГКо. А-редуктазу • Репрессия или индукция генов (изменение биосинтеза ферментов): тироксин взаимодействует с гормончувствительным участком ДНК • Компартментализация: ЖК синтезируются в цитоплазме, окисляются в митохондриях (ЦПЭ) • Аллостерическая регуляция
 Принципы энзимодиагностики • Концентрация внутриклеточных (тканевых) ферментов в крови увеличивается при поврежден клеток: АСТ, АЛТ – гепатит; КФК, АСТ, ЛДГ – инфаркт миокарда • Количество высвобождаемых ферментов достаточно для его обнаружения: АСТ в норме 2 -25 МЕ, при гепатитах – 150 -1000 МЕ • Активность высвобождаемых ферментов стабильна • Органоспецифичность: ЩФ Регана при раке легких
Принципы энзимодиагностики • Концентрация внутриклеточных (тканевых) ферментов в крови увеличивается при поврежден клеток: АСТ, АЛТ – гепатит; КФК, АСТ, ЛДГ – инфаркт миокарда • Количество высвобождаемых ферментов достаточно для его обнаружения: АСТ в норме 2 -25 МЕ, при гепатитах – 150 -1000 МЕ • Активность высвобождаемых ферментов стабильна • Органоспецифичность: ЩФ Регана при раке легких
 Применение ферментных препаратов в медицине • При заболеваниях ЖКТ: мезим-форте, фестал, энзистал, панкреатин • При иммунодефицитах: вобэнзим • Протеолитические ферменты: трипсин, химотрипсин • При тромбозах: урокиназа, стрептолиаза • Для рассасывания рубцов ( при ожогах): лидаза (гиалуронидаза)
Применение ферментных препаратов в медицине • При заболеваниях ЖКТ: мезим-форте, фестал, энзистал, панкреатин • При иммунодефицитах: вобэнзим • Протеолитические ферменты: трипсин, химотрипсин • При тромбозах: урокиназа, стрептолиаза • Для рассасывания рубцов ( при ожогах): лидаза (гиалуронидаза)
 Будущее энзимологии связано с развитием медицинской и инженерной энзимологии. Направления медицинской энзимологии: • Энзимопатология • Энзимодиагностика • Энзимотерапия Направления инженерной энзимологии: • Создание синзимов – синтетических энзимов, обладающих всеми свойствами ферментов, но лишенных побочных антигенных свойств • создание «гибридных» катализаторов, сочетающих свойства ферментов, антител и рецепторов. • создание биотехнологических реакторов, содержащих иммобилизованные ферменты или полиферментные комплексы, обеспечивающие производство ценных материалов для народного хозяйства и медицины
Будущее энзимологии связано с развитием медицинской и инженерной энзимологии. Направления медицинской энзимологии: • Энзимопатология • Энзимодиагностика • Энзимотерапия Направления инженерной энзимологии: • Создание синзимов – синтетических энзимов, обладающих всеми свойствами ферментов, но лишенных побочных антигенных свойств • создание «гибридных» катализаторов, сочетающих свойства ферментов, антител и рецепторов. • создание биотехнологических реакторов, содержащих иммобилизованные ферменты или полиферментные комплексы, обеспечивающие производство ценных материалов для народного хозяйства и медицины


