Ферменты как мишени действия ФАВ.ppt
- Количество слайдов: 28
 Ферменты как мишени действия ФАВ Составитель – асс. КХПВМС ЮФУ, А. В. Ткачук 1
Ферменты как мишени действия ФАВ Составитель – асс. КХПВМС ЮФУ, А. В. Ткачук 1
 Ферменты – специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Также обнаружены ферменты небелковой природы – рибозимы, построенные из молекул РНК и способные катализировать химические превращения нуклеиновых кислот 2
Ферменты – специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Также обнаружены ферменты небелковой природы – рибозимы, построенные из молекул РНК и способные катализировать химические превращения нуклеиновых кислот 2
 Ингибирование активности ферментов. 1. Обратимое конкурентное ингибирование аналогами субстрата. 1. 1. Превращение янтарной кислоты в фумаровую под действием фермента сукцинатдегидрогеназы. НООС СН 2 СООН → НООС СН=СН СООН (транс изомер) Ингибиторами являются малоновая кислота, щавелевоуксусная – по своей структуре напоминают субстрат (янтарную кислоту) 1. 2. Четвертичные аммониевые основания ингибируют фермент ацетилхолинэстеразу (АХЭ СН 2 ОН), катализирующую реакцию гидролиза ацетилхлина Ацетилхолин Функционирует как нейромедиатор Продукты распада – уксусная кислота и холин, не способные действовать как нейромедиаторы. 3
Ингибирование активности ферментов. 1. Обратимое конкурентное ингибирование аналогами субстрата. 1. 1. Превращение янтарной кислоты в фумаровую под действием фермента сукцинатдегидрогеназы. НООС СН 2 СООН → НООС СН=СН СООН (транс изомер) Ингибиторами являются малоновая кислота, щавелевоуксусная – по своей структуре напоминают субстрат (янтарную кислоту) 1. 2. Четвертичные аммониевые основания ингибируют фермент ацетилхолинэстеразу (АХЭ СН 2 ОН), катализирующую реакцию гидролиза ацетилхлина Ацетилхолин Функционирует как нейромедиатор Продукты распада – уксусная кислота и холин, не способные действовать как нейромедиаторы. 3
 Строение активных центров холинэстераз и локализация гидрофобных участков 4
Строение активных центров холинэстераз и локализация гидрофобных участков 4
 Классическая триада, характерная для сериновых гидролаз Кинетический механизм гидролиза ацетилхолина где Е — фермент(ХЭ), – субстрат (Ац. Х), ES – комплекс Михаэлиса, ES′ ацетилированный фермент Р' холин, Р" ацетат; k+1 k 1 k+2 k+3 – константы скоростей реакций промежуточных стадий, Стадия деацетилирования происходит с участием молекулы воды 5
Классическая триада, характерная для сериновых гидролаз Кинетический механизм гидролиза ацетилхолина где Е — фермент(ХЭ), – субстрат (Ац. Х), ES – комплекс Михаэлиса, ES′ ацетилированный фермент Р' холин, Р" ацетат; k+1 k 1 k+2 k+3 – константы скоростей реакций промежуточных стадий, Стадия деацетилирования происходит с участием молекулы воды 5
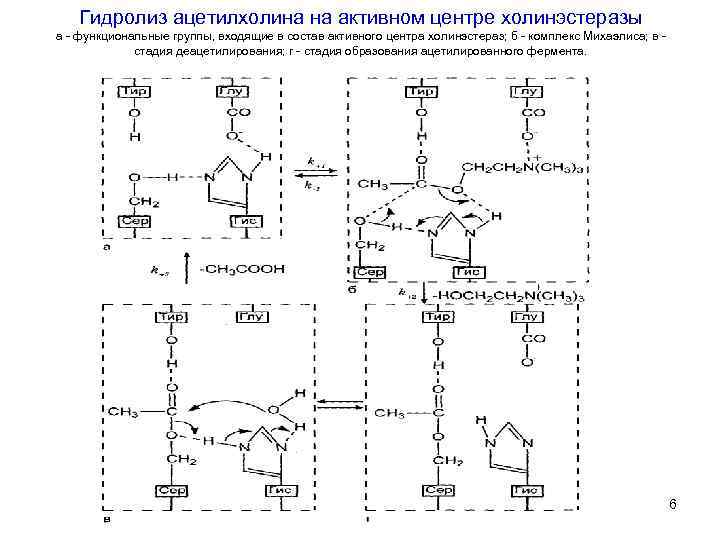 Гидролиз ацетилхолина на активном центре холинэстеразы а функциональные группы, входящие в состав активного центра холинэстераз; б комплекс Михаэлиса; в стадия деацетилирования; г стадия образования ацетилированного фермента. 6
Гидролиз ацетилхолина на активном центре холинэстеразы а функциональные группы, входящие в состав активного центра холинэстераз; б комплекс Михаэлиса; в стадия деацетилирования; г стадия образования ацетилированного фермента. 6
 Конкурентные ингибиторы холинэстераз – структурные аналоги ацетилхолина – физостигмин, прозерин (синтетический заменитель физостигмина) , эндорфоний, дитилин. Блокируют фермент холинэстеразу и предохраняет т. о. ацетилхолин от быстрого гидролитического расщепления.
Конкурентные ингибиторы холинэстераз – структурные аналоги ацетилхолина – физостигмин, прозерин (синтетический заменитель физостигмина) , эндорфоний, дитилин. Блокируют фермент холинэстеразу и предохраняет т. о. ацетилхолин от быстрого гидролитического расщепления.
 Антиметаболиты как лекарственные препараты. В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов и, и другой стороны, могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью. В результате наблюдается снижение скорости определенных метаболических путей. Например, сульфаниламидные препараты, применяемые для лечения инфекционных заболеваний являются аналогами п аминобензойной кислоты (из которой в бактериальной клетке синтезируется фолиевая кислота). Аналоги нуклеотидов используются для лечения онкологических заболеваний.
Антиметаболиты как лекарственные препараты. В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов и, и другой стороны, могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью. В результате наблюдается снижение скорости определенных метаболических путей. Например, сульфаниламидные препараты, применяемые для лечения инфекционных заболеваний являются аналогами п аминобензойной кислоты (из которой в бактериальной клетке синтезируется фолиевая кислота). Аналоги нуклеотидов используются для лечения онкологических заболеваний.
 2. Неконкурентное ингибирование. Обратимое и необратимое 2. 1. Неконкурентное обратимое ингибирование. Такие ингибиторы могут связывать и блокировать функциональную группу молекулы фермента в удалении от активного центра фермента
2. Неконкурентное ингибирование. Обратимое и необратимое 2. 1. Неконкурентное обратимое ингибирование. Такие ингибиторы могут связывать и блокировать функциональную группу молекулы фермента в удалении от активного центра фермента
 2. 2. Неконкурентное необратимое ингибирование. Связывают или разрушают функциональную группу фермента, необходимую для его каталитической активности. К необратимым ингибиторам относятся ионы тяжелых металлов, фосфорорганические соединения и др. Например, диизопропилфторфосфат ингибирует ферменты, имеющие серин в активном центре. Таким ферментом может быть ацетилхолинэстераза. Диизопропилфторфосфат — одно из отравляющих веществ нервно паралитического действия, так как ингибирование ацетилхолинэстеразы приводит к утрате способности нейронов проводить нервные импульсы. Относится к специфическим необратимым ингибиторам «сериновых» ферментов, т. к. образует ковалентную связь с ОН группой серина, находящейся в активном центре.
2. 2. Неконкурентное необратимое ингибирование. Связывают или разрушают функциональную группу фермента, необходимую для его каталитической активности. К необратимым ингибиторам относятся ионы тяжелых металлов, фосфорорганические соединения и др. Например, диизопропилфторфосфат ингибирует ферменты, имеющие серин в активном центре. Таким ферментом может быть ацетилхолинэстераза. Диизопропилфторфосфат — одно из отравляющих веществ нервно паралитического действия, так как ингибирование ацетилхолинэстеразы приводит к утрате способности нейронов проводить нервные импульсы. Относится к специфическим необратимым ингибиторам «сериновых» ферментов, т. к. образует ковалентную связь с ОН группой серина, находящейся в активном центре.
 Взаимодействие фосфорорганического ингибитора (типа G газа) с активным центром холинэстеразы. а функциональные группы, входящие в состав активного центра холинэсте раз; б комплекс фермент ингибитор; в стадия дефосфорили рования отсутствует; г стадия образования фосфорилированного фермента. 11
Взаимодействие фосфорорганического ингибитора (типа G газа) с активным центром холинэстеразы. а функциональные группы, входящие в состав активного центра холинэсте раз; б комплекс фермент ингибитор; в стадия дефосфорили рования отсутствует; г стадия образования фосфорилированного фермента. 11
 Реактивация фосфорилированн ой холинэстеразы с помощью 2 ПАМ (производные пиридина, содержащие положительно заряженный атом азота) а, б образование комплекса фосфорилированного фермента и 2 ПАМ; в образование фосфорилированного оксима и восстановленного фермента. 12
Реактивация фосфорилированн ой холинэстеразы с помощью 2 ПАМ (производные пиридина, содержащие положительно заряженный атом азота) а, б образование комплекса фосфорилированного фермента и 2 ПАМ; в образование фосфорилированного оксима и восстановленного фермента. 12
 Основные типы взаимодействия ОВ и токсинов на стадии транспорта к биомишеням 13
Основные типы взаимодействия ОВ и токсинов на стадии транспорта к биомишеням 13
 Основные принципы профилактики и терапии при поражениях ФОВ Принцип действия Средства медицинской защиты и меры помощи 1. Использование холинолитиков для защиты холинорецепторов от действия высоких концентраций Ац. Х 1. Атропин, бенактизин и другие холинолитики, действующие на т и п холинорецепторы и купирующие перевозбуждение холинергических отделов нервной системы 2. Реактивация холинэстераз, ингибированных ФОВ 2. Дипироксим, 2 ПАМ, 2 ПАС, токсогонии, НGG 12, 22, 42 и др. 3. Защита активных центров холинэстераз от взаимодействия с ФОВ 3. Галантамин, пиридостигмин и другие обратимые ингибиторы холинэстеразы 4. Снятие судорог 4. 5. Борьба с кислородным голоданием 5. Диазепам и другие противосудорожные средства Искусственное дыхание. Оксигенотерапия 6. Повышение скорости ферментативного гидролиза и других процессов расхода ФОВ на стадии транспорта к биомишеням 6. 7. 8. Ускорение выведения ФОВ из крови Иммунохимическая защита 7. 8. 9. Уменьшение синтеза Ац. Х 10. Антидоты различного действия, их комплексное использование Бензонал и другие стимуляторы синтеза ферментов печени, крови и других внутренних органов Гемотрансфузия, гемодиализ Специфические антигены, содержащие в качестве гаптеновых групп остатки ФОВ и вызывающие выработку антител 9. Гемихолиний и другие соединения 10. Реактиваторы типа НGG и другие антидоты с различной направленностью действия. Рецептуры антидотов. Симптоматическая 14 терапия
Основные принципы профилактики и терапии при поражениях ФОВ Принцип действия Средства медицинской защиты и меры помощи 1. Использование холинолитиков для защиты холинорецепторов от действия высоких концентраций Ац. Х 1. Атропин, бенактизин и другие холинолитики, действующие на т и п холинорецепторы и купирующие перевозбуждение холинергических отделов нервной системы 2. Реактивация холинэстераз, ингибированных ФОВ 2. Дипироксим, 2 ПАМ, 2 ПАС, токсогонии, НGG 12, 22, 42 и др. 3. Защита активных центров холинэстераз от взаимодействия с ФОВ 3. Галантамин, пиридостигмин и другие обратимые ингибиторы холинэстеразы 4. Снятие судорог 4. 5. Борьба с кислородным голоданием 5. Диазепам и другие противосудорожные средства Искусственное дыхание. Оксигенотерапия 6. Повышение скорости ферментативного гидролиза и других процессов расхода ФОВ на стадии транспорта к биомишеням 6. 7. 8. Ускорение выведения ФОВ из крови Иммунохимическая защита 7. 8. 9. Уменьшение синтеза Ац. Х 10. Антидоты различного действия, их комплексное использование Бензонал и другие стимуляторы синтеза ферментов печени, крови и других внутренних органов Гемотрансфузия, гемодиализ Специфические антигены, содержащие в качестве гаптеновых групп остатки ФОВ и вызывающие выработку антител 9. Гемихолиний и другие соединения 10. Реактиваторы типа НGG и другие антидоты с различной направленностью действия. Рецептуры антидотов. Симптоматическая 14 терапия
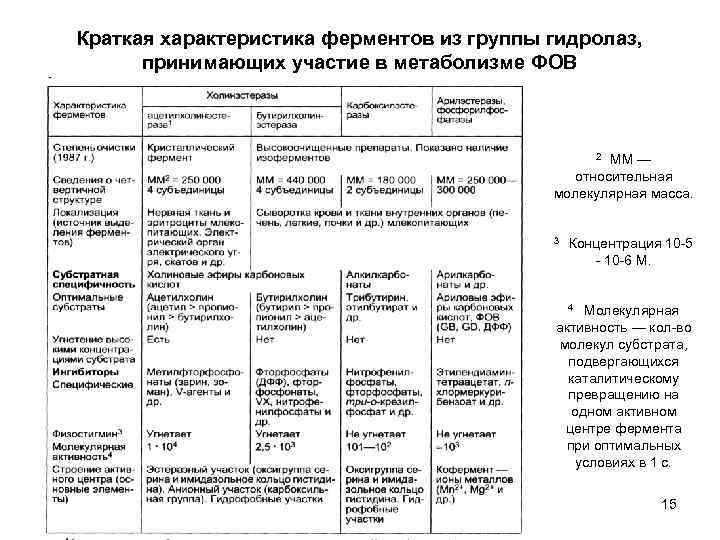 Краткая характеристика ферментов из группы гидролаз, принимающих участие в метаболизме ФОВ ММ — относительная молекулярная масса. 2 3 Концентрация 10 5 10 6 М. Молекулярная активность — кол во молекул субстрата, подвергающихся каталитическому превращению на одном активном центре фермента при оптимальных условиях в 1 с. 4 15
Краткая характеристика ферментов из группы гидролаз, принимающих участие в метаболизме ФОВ ММ — относительная молекулярная масса. 2 3 Концентрация 10 5 10 6 М. Молекулярная активность — кол во молекул субстрата, подвергающихся каталитическому превращению на одном активном центре фермента при оптимальных условиях в 1 с. 4 15
 Пути проникновения ОВ и токсинов из крови через стенки капилляров в ткани мишени. I — через поры в клетках эндотелия; II — через щели между клетками эндотелия; III — с помощью пиноцитозных пузырьков (ПП); 1 — плазма крови; 2 — цементирующее вещество (ЦВ) протеинат кальция, имеющее положительный заряд; 3 — клетки эндотелия (КЭ); 4 — базальная мембрана (БМ) капилляра; 5 — муральные клетки (МК); 6 — межклеточные пространства; 7 — астроциты (А); 8 — дендрит (Д), подходящий к нейрону; 9 — синапс; 10 — биомишени (ферменты и рецепторы в синаптической щели); 16 11 — нейрон.
Пути проникновения ОВ и токсинов из крови через стенки капилляров в ткани мишени. I — через поры в клетках эндотелия; II — через щели между клетками эндотелия; III — с помощью пиноцитозных пузырьков (ПП); 1 — плазма крови; 2 — цементирующее вещество (ЦВ) протеинат кальция, имеющее положительный заряд; 3 — клетки эндотелия (КЭ); 4 — базальная мембрана (БМ) капилляра; 5 — муральные клетки (МК); 6 — межклеточные пространства; 7 — астроциты (А); 8 — дендрит (Д), подходящий к нейрону; 9 — синапс; 10 — биомишени (ферменты и рецепторы в синаптической щели); 16 11 — нейрон.
 Действие ОВ и токсинов на биохимические мишени 17
Действие ОВ и токсинов на биохимические мишени 17
 Типы химических реакций при взаимодействии ОВ и токсинов с биомишенями, приводящие к образованию прочных комплексов, не распадающихся в организме ОВ, ТВ Функциональные группы молекулярных биомишеней Образование ковалентных связей. ОВ как алкилирующие агенты Иприты Нуклеофильные группы (Н 2 N, НN и др. ) активного центра фермента гексокиназы и пуриновых оснований нуклеиновых кислот Ирританты (ХАФ и др. ) Нуклеофильные группы (НS и др. ) рецепторов чувствительных нервных волокон слизистых оболочек глаз и дыхательных путей Образование ковалентных связей. ОВ как ацилирующие агенты ФОВ, карбоматы Нуклеофильная группа (активированная НО группа) остатка серина в эстеразном участке холинэстераз Люизит Нуклеофильные группы (НSгруппы) активного центра фер ментапируватоксидазы Фосген, дифосген и др. Нуклеофильные группы (Н 2 N—, НN=, НS, НО— и др. ) бел ков, липидов, жирных кислотбиомембран пневмоцитов стенок альвеол и эндотелиальных клеток стенок капилляров кровеносных сосудов легочной ткани 18
Типы химических реакций при взаимодействии ОВ и токсинов с биомишенями, приводящие к образованию прочных комплексов, не распадающихся в организме ОВ, ТВ Функциональные группы молекулярных биомишеней Образование ковалентных связей. ОВ как алкилирующие агенты Иприты Нуклеофильные группы (Н 2 N, НN и др. ) активного центра фермента гексокиназы и пуриновых оснований нуклеиновых кислот Ирританты (ХАФ и др. ) Нуклеофильные группы (НS и др. ) рецепторов чувствительных нервных волокон слизистых оболочек глаз и дыхательных путей Образование ковалентных связей. ОВ как ацилирующие агенты ФОВ, карбоматы Нуклеофильная группа (активированная НО группа) остатка серина в эстеразном участке холинэстераз Люизит Нуклеофильные группы (НSгруппы) активного центра фер ментапируватоксидазы Фосген, дифосген и др. Нуклеофильные группы (Н 2 N—, НN=, НS, НО— и др. ) бел ков, липидов, жирных кислотбиомембран пневмоцитов стенок альвеол и эндотелиальных клеток стенок капилляров кровеносных сосудов легочной ткани 18
 Продолжение таблицы ОВ, ТВ Функциональные группы молекулярных биомишеней Образование прочных комплексов. ОВ и ТВ — комплексообразователи НСN, цианиды Fе 3+ цитохромоксидазы (цитохромдаз) в митохондриях нейро нов и клеток миокарда Окись углерода Fе 2+ гемоглобина (Нb, Fе 2+) с образованием карбоксигемоглобина (Нb, Fе 2+, СО) Сакситоксин, тетродотоксин Молекулярные компоненты структур и Nа+ каналов биомембран аксонов Агент ВZ Активные центры холинорецепторов в холинергических синап сах ЦНС Рицин Низкомолекулярная (А) субъединица рицина образует комплек сы с белками рибосом ивнерибосомальных факторов, участву ющих в трансляции полипептидных цепей на рибосомах ГАМКлитики Функциональные группы хлорионного рецепторного комплекса в ГАМКергических синапсах ЦНС Ботулинические токсины Функциональные группы биомембран везикулярных пузырьков и внутренних поверхностей синаптических бляшек холинергических синапсов парасимпатических отделов периферической и центральной нервной систем 19
Продолжение таблицы ОВ, ТВ Функциональные группы молекулярных биомишеней Образование прочных комплексов. ОВ и ТВ — комплексообразователи НСN, цианиды Fе 3+ цитохромоксидазы (цитохромдаз) в митохондриях нейро нов и клеток миокарда Окись углерода Fе 2+ гемоглобина (Нb, Fе 2+) с образованием карбоксигемоглобина (Нb, Fе 2+, СО) Сакситоксин, тетродотоксин Молекулярные компоненты структур и Nа+ каналов биомембран аксонов Агент ВZ Активные центры холинорецепторов в холинергических синап сах ЦНС Рицин Низкомолекулярная (А) субъединица рицина образует комплек сы с белками рибосом ивнерибосомальных факторов, участву ющих в трансляции полипептидных цепей на рибосомах ГАМКлитики Функциональные группы хлорионного рецепторного комплекса в ГАМКергических синапсах ЦНС Ботулинические токсины Функциональные группы биомембран везикулярных пузырьков и внутренних поверхностей синаптических бляшек холинергических синапсов парасимпатических отделов периферической и центральной нервной систем 19
 Окончание таблицы ОВ, ТВ Функциональные группы молекулярных биомишеней Токсины, обладающие ферментативной активностью Ботулинические и другие бактериальные токсины, рицин После сорбции на поверхности клеток субъединицы (А и В) могут обладать ферментативной активностью или запустить ком плексы ферментов клеток, в результате чего разрушаются биомембраны клеток и происходит разрыв дисульфидной свя зи (— S—S—) между субъединицами А и В токсинов, и внутрь проникают более легкие (А) субъединицы Фракции некоторых токсинов, обладающие различными механизмами действия Помимо нейротоксинов, ботулотоксины содержат гематоглютирующие фракции. Некоторые токсины (змей и др. ) вызывают гемолиз эритроцитов. Есть и другие примеры Токсины, получаемые полусинтетическим путем Химерные токсины, отдельные субъединицы которых обладают разными механизмами токсического действия Одним из направлений исследований в области белковой инженерии за рубежом является получение химерных токсинов, состоящих из разных субъединиц (А и В) различных токсинов (например, субъединицы В — из бактериальных токсинов и субъединицы А— из фитотоксинов. Основные идеи работ подтверждены в опытах in vitro на культурах изолированных клеток и 20 тканей
Окончание таблицы ОВ, ТВ Функциональные группы молекулярных биомишеней Токсины, обладающие ферментативной активностью Ботулинические и другие бактериальные токсины, рицин После сорбции на поверхности клеток субъединицы (А и В) могут обладать ферментативной активностью или запустить ком плексы ферментов клеток, в результате чего разрушаются биомембраны клеток и происходит разрыв дисульфидной свя зи (— S—S—) между субъединицами А и В токсинов, и внутрь проникают более легкие (А) субъединицы Фракции некоторых токсинов, обладающие различными механизмами действия Помимо нейротоксинов, ботулотоксины содержат гематоглютирующие фракции. Некоторые токсины (змей и др. ) вызывают гемолиз эритроцитов. Есть и другие примеры Токсины, получаемые полусинтетическим путем Химерные токсины, отдельные субъединицы которых обладают разными механизмами токсического действия Одним из направлений исследований в области белковой инженерии за рубежом является получение химерных токсинов, состоящих из разных субъединиц (А и В) различных токсинов (например, субъединицы В — из бактериальных токсинов и субъединицы А— из фитотоксинов. Основные идеи работ подтверждены в опытах in vitro на культурах изолированных клеток и 20 тканей
 Отравляющие вещества как ингибиторы тканевого дыхания и энергетических процессов в клетках Энергетический обмен в клетках. 1 иприт угнетает гексокиназу; 2 люизит ингибирует пируватоксидазу; 3 фторацетат, превращающийся во фторлимонную кислоту, угнетает аконитазу фермент цикла Кребса; 4 циан ион блокирует цитохром а 3 (цитохромоксидазу); 5 окись углерода взаимодействует с гемоглобином, образуя карбоксигемоглобин; 6 гемолитические яды (Аs. Н 3 и др. ) действуют на оболочку эритро цитов, вызывая гемолиз; 7 вещества удушающего действия (фосген и др. ) нарушают проницае мостьстенок альвеол легких, вызывая отек легких; 8 ФОВ вызывают бронхоспазм; 9 опий и другие наркотики, а также ФОВ (зоман) вызывают угнетение дыхательного центра ЦНС. Места действия ОВ и ядов показаны в кружках, обозначенных цифрами. 21
Отравляющие вещества как ингибиторы тканевого дыхания и энергетических процессов в клетках Энергетический обмен в клетках. 1 иприт угнетает гексокиназу; 2 люизит ингибирует пируватоксидазу; 3 фторацетат, превращающийся во фторлимонную кислоту, угнетает аконитазу фермент цикла Кребса; 4 циан ион блокирует цитохром а 3 (цитохромоксидазу); 5 окись углерода взаимодействует с гемоглобином, образуя карбоксигемоглобин; 6 гемолитические яды (Аs. Н 3 и др. ) действуют на оболочку эритро цитов, вызывая гемолиз; 7 вещества удушающего действия (фосген и др. ) нарушают проницае мостьстенок альвеол легких, вызывая отек легких; 8 ФОВ вызывают бронхоспазм; 9 опий и другие наркотики, а также ФОВ (зоман) вызывают угнетение дыхательного центра ЦНС. Места действия ОВ и ядов показаны в кружках, обозначенных цифрами. 21
 Вещества, нарушающие различные стадии синаптической передачи 22
Вещества, нарушающие различные стадии синаптической передачи 22
 Автономная (вегетативная) иннервация внутренних органов (схема). • • • I — продолговатый и средний мозг; II — грудной и поясничный отделы спинного мозга; III — крест цовый отдел спинного мозга; IV — цепочки симпатических ганглиев; V — периферические ганглии; VI—органы: 1 —глаз (мышцы); 2 — слезная железа; 3 — слюнные железы; 4 — сердце; 5 — гортань; 6 — трахея; 7 — бронхи; 8 — желудок; 9 — кровеносные сосуды внутренних органов; 10 — печень и желчный пузырь; 11 — поджелудочная железа; 12 — надпочечник; 13 — тонкая кишка; 14 — толстая кишка; 15 — почки; 16 — мочевой пузырь; 17 — половые органы. 23
Автономная (вегетативная) иннервация внутренних органов (схема). • • • I — продолговатый и средний мозг; II — грудной и поясничный отделы спинного мозга; III — крест цовый отдел спинного мозга; IV — цепочки симпатических ганглиев; V — периферические ганглии; VI—органы: 1 —глаз (мышцы); 2 — слезная железа; 3 — слюнные железы; 4 — сердце; 5 — гортань; 6 — трахея; 7 — бронхи; 8 — желудок; 9 — кровеносные сосуды внутренних органов; 10 — печень и желчный пузырь; 11 — поджелудочная железа; 12 — надпочечник; 13 — тонкая кишка; 14 — толстая кишка; 15 — почки; 16 — мочевой пузырь; 17 — половые органы. 23
 Строение нервной клетки (А) и синапса (Б). А: 1 тело нейрона; 2 дендриты; 3 аксон; 4 6 синапсы. Б: 1 синаптическая бляшка; 2 синаптические пузырьки (с медиатором); 3 пресинаптическая мембрана; 4 синаптическая щель; 5 постсинаптическая мембрана; 6 холинорецептор (ХР); 7 ацетилхолинэстераза (Ац. ХЭ). 8 прохождение нервного импульса 24
Строение нервной клетки (А) и синапса (Б). А: 1 тело нейрона; 2 дендриты; 3 аксон; 4 6 синапсы. Б: 1 синаптическая бляшка; 2 синаптические пузырьки (с медиатором); 3 пресинаптическая мембрана; 4 синаптическая щель; 5 постсинаптическая мембрана; 6 холинорецептор (ХР); 7 ацетилхолинэстераза (Ац. ХЭ). 8 прохождение нервного импульса 24
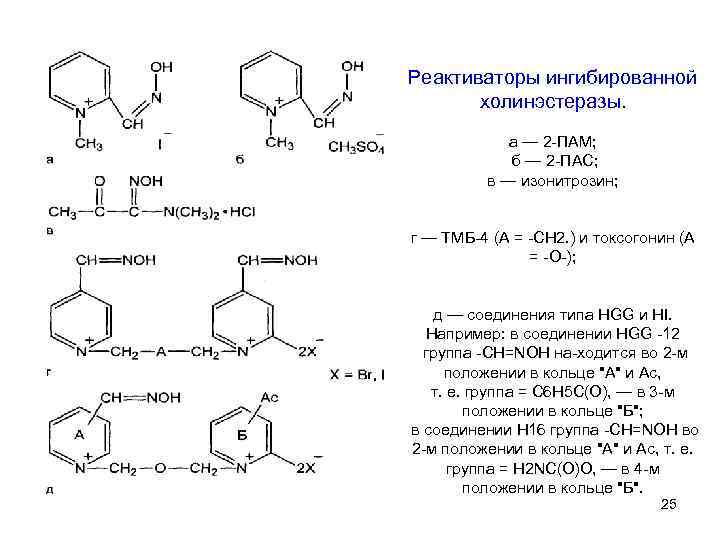 Реактиваторы ингибированной холинэстеразы. а — 2 ПАМ; б — 2 ПАС; в — изонитрозин; г — ТМБ 4 (А = СН 2. ) и токсогонин (А = О ); д — соединения типа НGG и НI. Например: в соединении НGG 12 группа СН=NОН на ходится во 2 м положении в кольце "А" и Ас, т. е. группа = С 6 Н 5 С(О), — в 3 м положении в кольце "Б"; в соединении Н 16 группа СН=NОН во 2 м положении в кольце "А" и Ас, т. е. группа = Н 2 NС(О)О, — в 4 м положении в кольце "Б". 25
Реактиваторы ингибированной холинэстеразы. а — 2 ПАМ; б — 2 ПАС; в — изонитрозин; г — ТМБ 4 (А = СН 2. ) и токсогонин (А = О ); д — соединения типа НGG и НI. Например: в соединении НGG 12 группа СН=NОН на ходится во 2 м положении в кольце "А" и Ас, т. е. группа = С 6 Н 5 С(О), — в 3 м положении в кольце "Б"; в соединении Н 16 группа СН=NОН во 2 м положении в кольце "А" и Ас, т. е. группа = Н 2 NС(О)О, — в 4 м положении в кольце "Б". 25
 Гемихолиний и некоторые другие вещества, нарушающие синтез и захват ацетилхолина, исследуемые в качестве потенциальных антидотов при интоксикации ФОВ. а – N 2 оксиэтил нафтилвинилпиридин б — 2 бензилиден З хинуклидинон; в — N аллил 3 хинуклидинол. 26
Гемихолиний и некоторые другие вещества, нарушающие синтез и захват ацетилхолина, исследуемые в качестве потенциальных антидотов при интоксикации ФОВ. а – N 2 оксиэтил нафтилвинилпиридин б — 2 бензилиден З хинуклидинон; в — N аллил 3 хинуклидинол. 26
 Необратимые ингибиторы ферментов как лекарственные препараты Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины — вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента — простагландинсинтетазы (ПГС NH 2) происходит ацилирование аминогруппы фермента аспирином.
Необратимые ингибиторы ферментов как лекарственные препараты Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины — вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента — простагландинсинтетазы (ПГС NH 2) происходит ацилирование аминогруппы фермента аспирином.
 Необратимое ингибирование лекарственных препаратов может быть основано также на связывании «суицидных» субстратов с активными центрами ферментов. При этом между субстратом и ферментом формируются ковалентные связи, которые расщепляются очень медленно и фермент долго не способен выполнять свою функцию. Примером взаимодействия такого типа является антибиотик пенициллин. Мишенью β лактамных антибиотиков является фермент – мурамоилпентапептидкарбоксипептидаза, который важен для образования поперечных связей в стенках бактериальных клеток. Ацилированный фермент остаток серина Комплекс фермент ингибитор
Необратимое ингибирование лекарственных препаратов может быть основано также на связывании «суицидных» субстратов с активными центрами ферментов. При этом между субстратом и ферментом формируются ковалентные связи, которые расщепляются очень медленно и фермент долго не способен выполнять свою функцию. Примером взаимодействия такого типа является антибиотик пенициллин. Мишенью β лактамных антибиотиков является фермент – мурамоилпентапептидкарбоксипептидаза, который важен для образования поперечных связей в стенках бактериальных клеток. Ацилированный фермент остаток серина Комплекс фермент ингибитор


