Лекция 4 ферменты.pptx
- Количество слайдов: 21
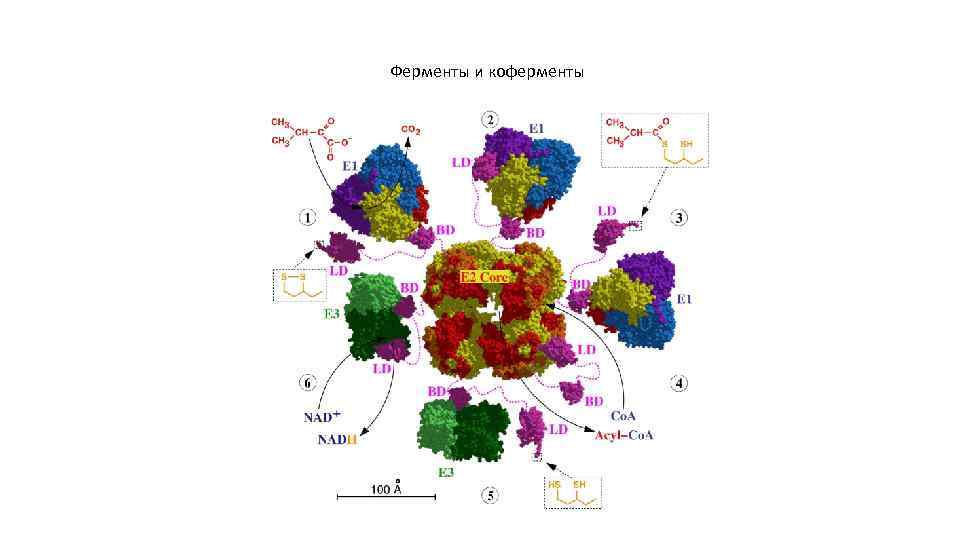 Ферменты и коферменты
Ферменты и коферменты
 В этой лекции…. 1. Структура фермента, необходимое и достаточное условие быть ферментом 2. Кинетика и термодинамика ферментативных реакций 3. Теория фермент-субстратного комплекса объясняет ферментативный катализ 4. Коферменты, кофакторы и простетические группы 5. Номенклатура и классификация ферментов
В этой лекции…. 1. Структура фермента, необходимое и достаточное условие быть ферментом 2. Кинетика и термодинамика ферментативных реакций 3. Теория фермент-субстратного комплекса объясняет ферментативный катализ 4. Коферменты, кофакторы и простетические группы 5. Номенклатура и классификация ферментов
 Основы ферментативного катализа 1. Молекулярная природа ферментов, особенности катализа в биологических системах - Реакции катализируемые ферментами достигают высоких скоростей, k скорости может достигать 105 -1017 - Ферменты проявляют высокую специфичность к субстратам и типам катализируемых реакций - Условия ферментативных реакций достаточно мягкие - Активность ферментов регулируется аллостерическими ингибиторами Как работают ферменты? Ферменты ускоряют реакцию не сдвигая равновесия Запишем простую ферментативную реакцию в виде модели
Основы ферментативного катализа 1. Молекулярная природа ферментов, особенности катализа в биологических системах - Реакции катализируемые ферментами достигают высоких скоростей, k скорости может достигать 105 -1017 - Ферменты проявляют высокую специфичность к субстратам и типам катализируемых реакций - Условия ферментативных реакций достаточно мягкие - Активность ферментов регулируется аллостерическими ингибиторами Как работают ферменты? Ферменты ускоряют реакцию не сдвигая равновесия Запишем простую ферментативную реакцию в виде модели
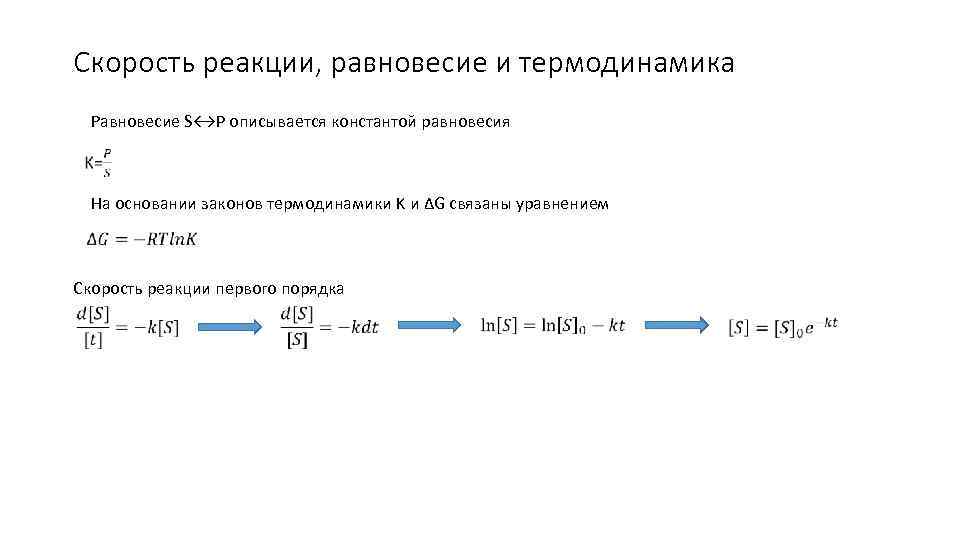 Скорость реакции, равновесие и термодинамика Равновесие S↔P описывается константой равновесия На основании законов термодинамики K и ΔG связаны уравнением Скорость реакции первого порядка
Скорость реакции, равновесие и термодинамика Равновесие S↔P описывается константой равновесия На основании законов термодинамики K и ΔG связаны уравнением Скорость реакции первого порядка
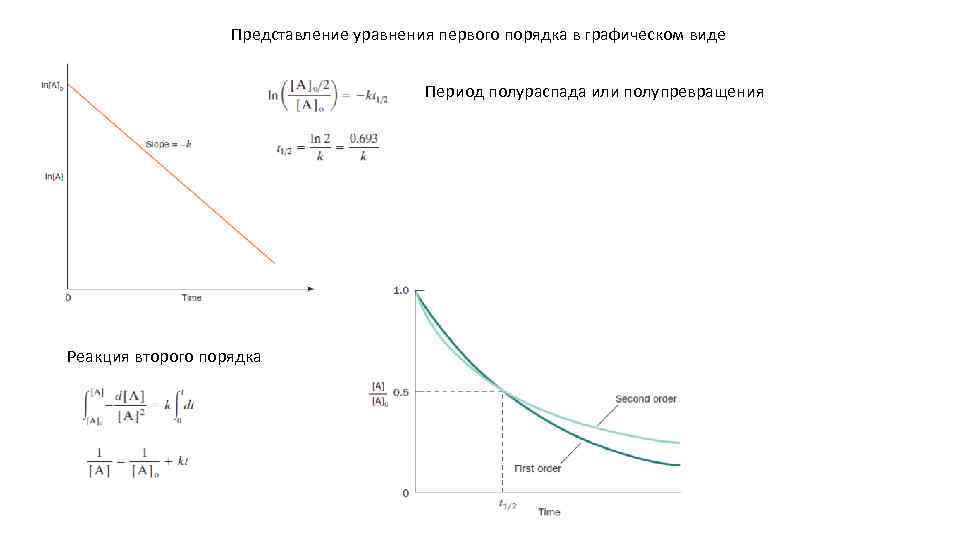 Представление уравнения первого порядка в графическом виде Период полураспада или полупревращения Реакция второго порядка
Представление уравнения первого порядка в графическом виде Период полураспада или полупревращения Реакция второго порядка
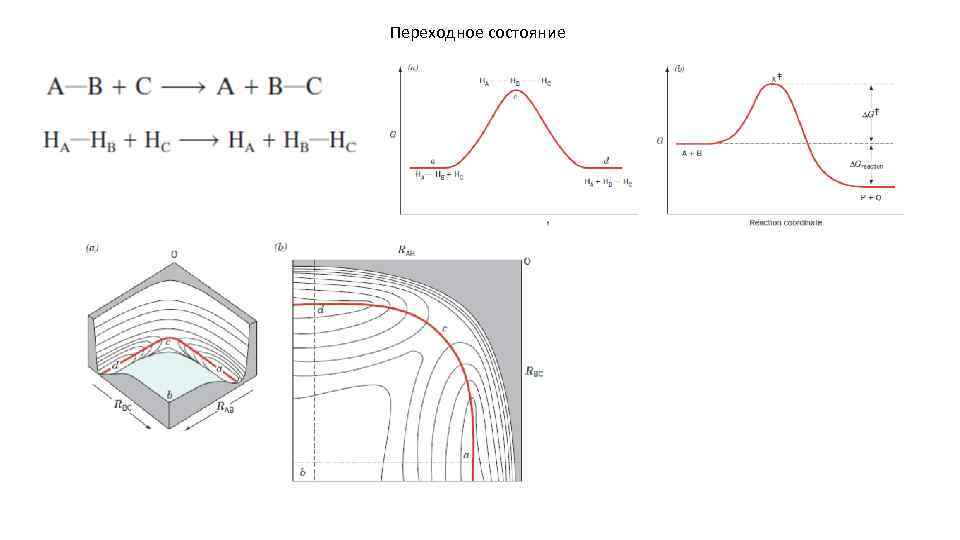 Переходное состояние
Переходное состояние
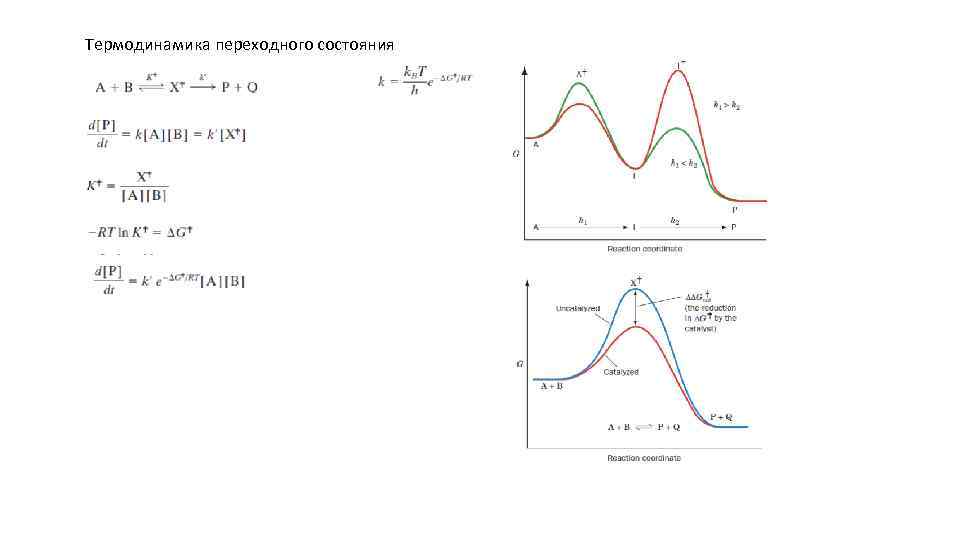 Термодинамика переходного состояния
Термодинамика переходного состояния
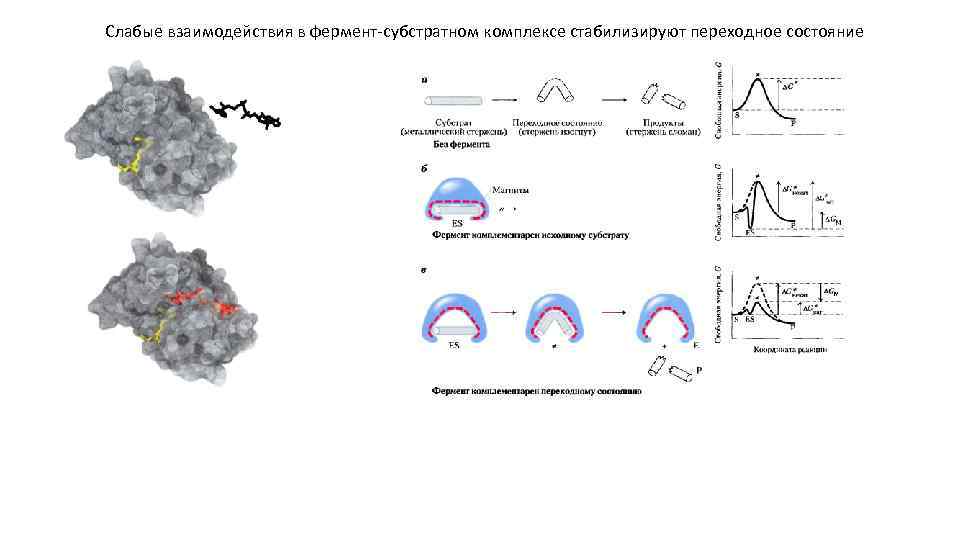 Слабые взаимодействия в фермент-субстратном комплексе стабилизируют переходное состояние
Слабые взаимодействия в фермент-субстратном комплексе стабилизируют переходное состояние
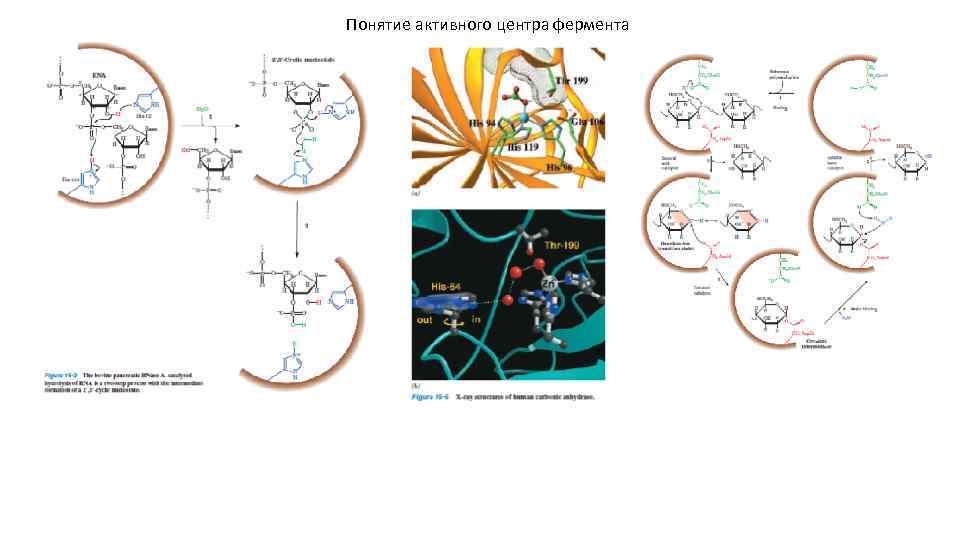 Понятие активного центра фермента
Понятие активного центра фермента
 Общий кислотно-основной катализ
Общий кислотно-основной катализ
![Моделирование кинетики ферментативной реакции Скорость ферментативной реакции зависит от концентрации субстрата Подбирая [S]0 исследователь Моделирование кинетики ферментативной реакции Скорость ферментативной реакции зависит от концентрации субстрата Подбирая [S]0 исследователь](https://present5.com/presentation/-90933273_378534374/image-11.jpg) Моделирование кинетики ферментативной реакции Скорость ферментативной реакции зависит от концентрации субстрата Подбирая [S]0 исследователь может измерить V 0 Построив график зависимости начальной скорости от концентрации субстрата, можно определить при какой концентрации субстрата начальная скорость Реакции равна половине от максимальной
Моделирование кинетики ферментативной реакции Скорость ферментативной реакции зависит от концентрации субстрата Подбирая [S]0 исследователь может измерить V 0 Построив график зависимости начальной скорости от концентрации субстрата, можно определить при какой концентрации субстрата начальная скорость Реакции равна половине от максимальной
 Уравнение Михаэлиса - Ментен Скорость образования продукта реакции Скорость превращения фермент-субстратного комплекса Сделаем следующие допущения: 1. Концентрация свободного фермента равна разнице общей концентрации фермента и концентрации фермента в фермент субстратном комплексе: [E]t – [ES] 2. Начальная скорость соответствует моменту когда концентрация ES постоянна
Уравнение Михаэлиса - Ментен Скорость образования продукта реакции Скорость превращения фермент-субстратного комплекса Сделаем следующие допущения: 1. Концентрация свободного фермента равна разнице общей концентрации фермента и концентрации фермента в фермент субстратном комплексе: [E]t – [ES] 2. Начальная скорость соответствует моменту когда концентрация ES постоянна
![Решим это уравнение Раскрываем скобки Прибавим к обоим частям k 1[ES][S] Под константой Михаэлиса Решим это уравнение Раскрываем скобки Прибавим к обоим частям k 1[ES][S] Под константой Михаэлиса](https://present5.com/presentation/-90933273_378534374/image-13.jpg) Решим это уравнение Раскрываем скобки Прибавим к обоим частям k 1[ES][S] Под константой Михаэлиса понимают выражение вида Вспомним что:
Решим это уравнение Раскрываем скобки Прибавим к обоим частям k 1[ES][S] Под константой Михаэлиса понимают выражение вида Вспомним что:
 Физический смысл уравнения и его преобразования График в координатах Лайнуивера-Берка Рассмотрим частный случай, когда начальная скорость равна половине максимальной Решаем уравнения относительно KM получаем
Физический смысл уравнения и его преобразования График в координатах Лайнуивера-Берка Рассмотрим частный случай, когда начальная скорость равна половине максимальной Решаем уравнения относительно KM получаем
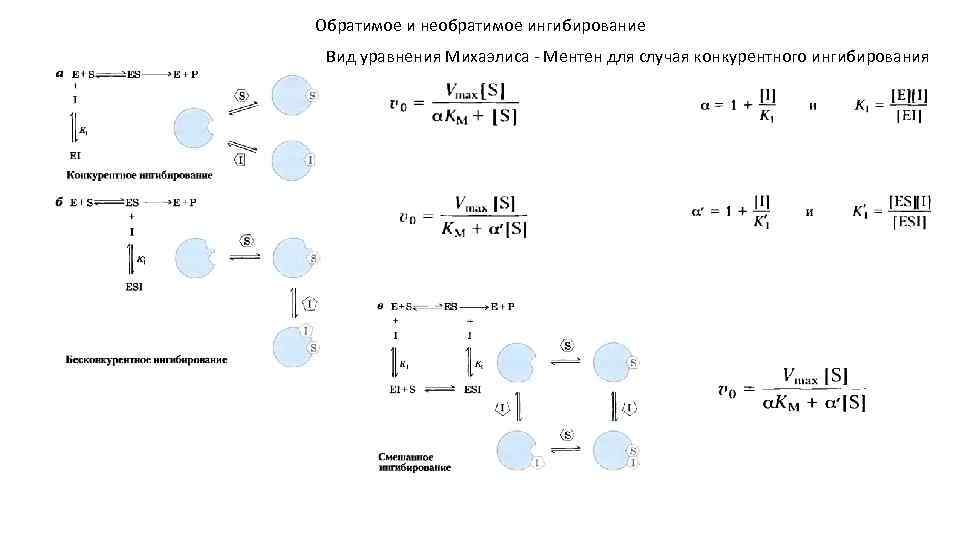 Обратимое и необратимое ингибирование Вид уравнения Михаэлиса - Ментен для случая конкурентного ингибирования
Обратимое и необратимое ингибирование Вид уравнения Михаэлиса - Ментен для случая конкурентного ингибирования
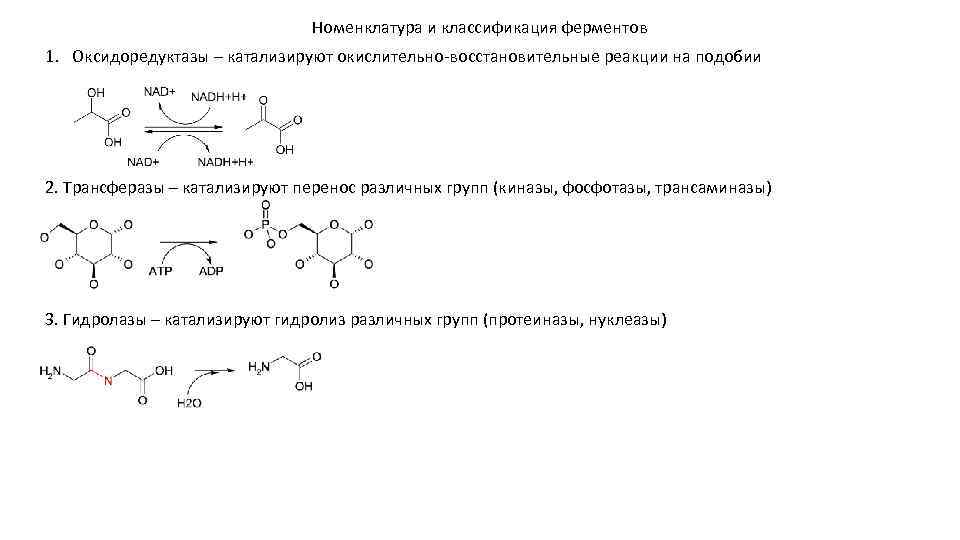 Номенклатура и классификация ферментов 1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции на подобии 2. Трансферазы – катализируют перенос различных групп (киназы, фосфотазы, трансаминазы) 3. Гидролазы – катализируют гидролиз различных групп (протеиназы, нуклеазы)
Номенклатура и классификация ферментов 1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции на подобии 2. Трансферазы – катализируют перенос различных групп (киназы, фосфотазы, трансаминазы) 3. Гидролазы – катализируют гидролиз различных групп (протеиназы, нуклеазы)
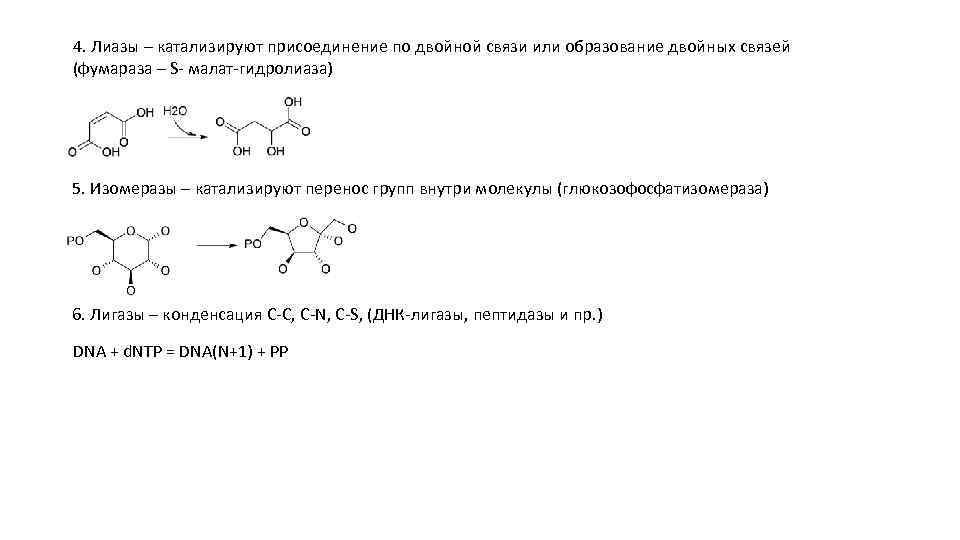 4. Лиазы – катализируют присоединение по двойной связи или образование двойных связей (фумараза – S- малат-гидролиаза) 5. Изомеразы – катализируют перенос групп внутри молекулы (глюкозофосфатизомераза) 6. Лигазы – конденсация C-C, C-N, C-S, (ДНК-лигазы, пептидазы и пр. ) DNA + d. NTP = DNA(N+1) + PP
4. Лиазы – катализируют присоединение по двойной связи или образование двойных связей (фумараза – S- малат-гидролиаза) 5. Изомеразы – катализируют перенос групп внутри молекулы (глюкозофосфатизомераза) 6. Лигазы – конденсация C-C, C-N, C-S, (ДНК-лигазы, пептидазы и пр. ) DNA + d. NTP = DNA(N+1) + PP
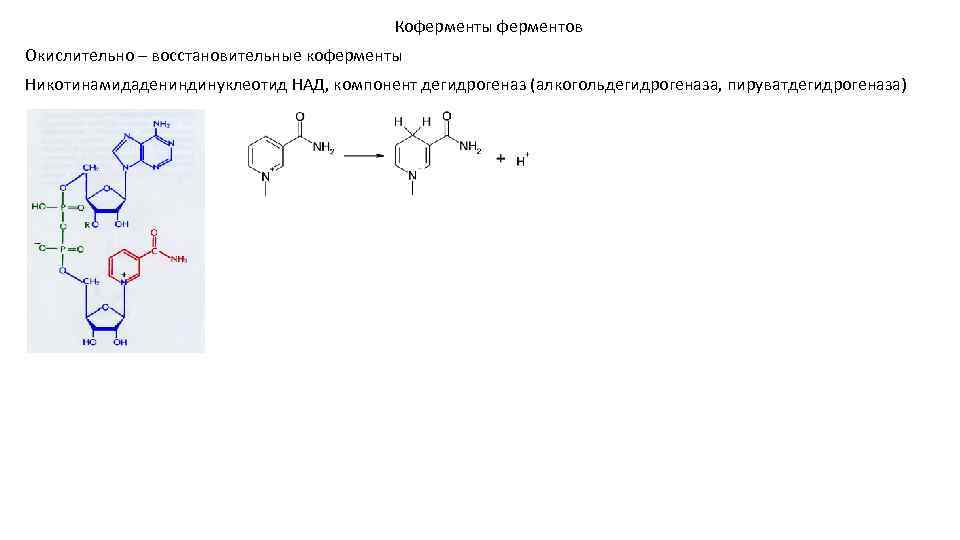 Коферменты ферментов Окислительно – восстановительные коферменты Никотинамидадениндинуклеотид НАД, компонент дегидрогеназ (алкогольдегидрогеназа, пируватдегидрогеназа)
Коферменты ферментов Окислительно – восстановительные коферменты Никотинамидадениндинуклеотид НАД, компонент дегидрогеназ (алкогольдегидрогеназа, пируватдегидрогеназа)
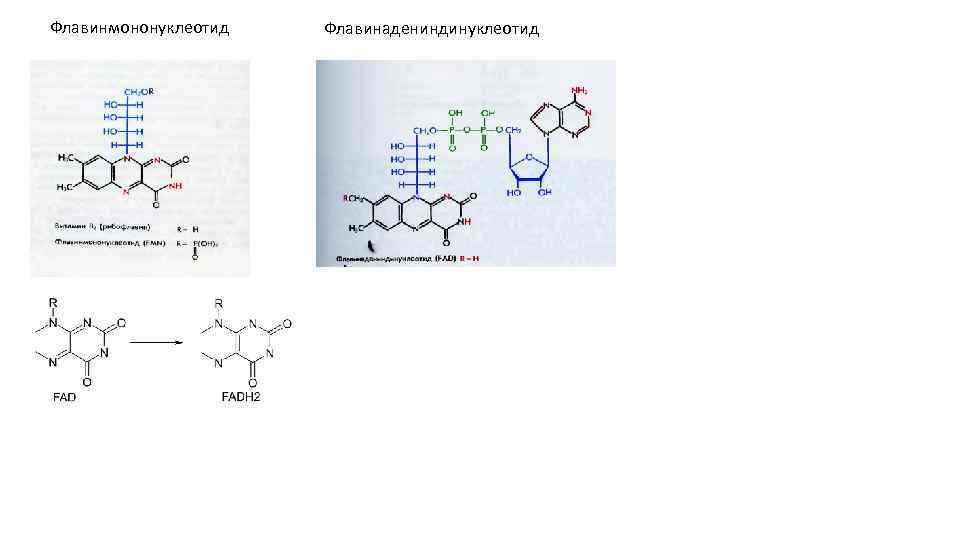 Флавинмононуклеотид Флавинадениндинуклеотид
Флавинмононуклеотид Флавинадениндинуклеотид
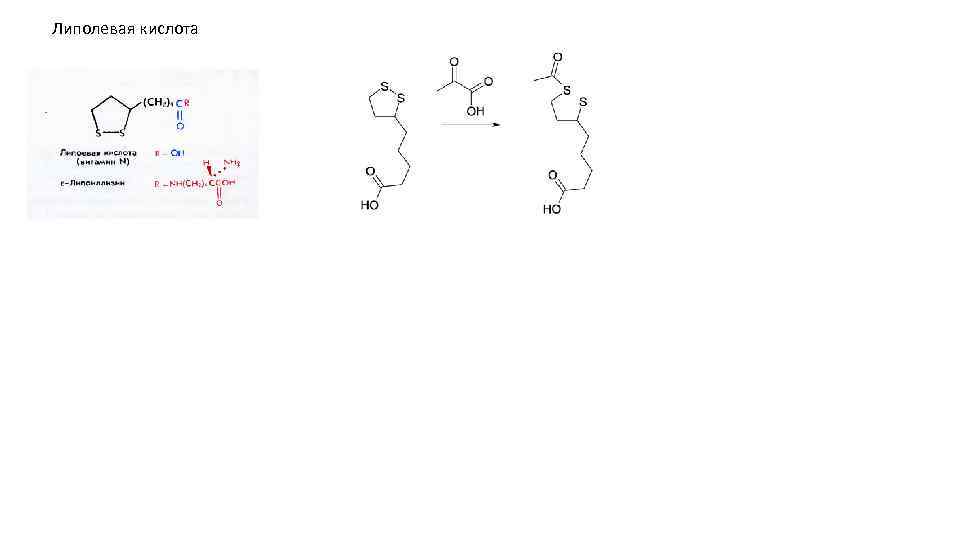 Липолевая кислота
Липолевая кислота
 Коферменты переноса групп
Коферменты переноса групп


