Ферменты и их роль в организме.ppt
- Количество слайдов: 20
 Ферменты и их роль в организме.
Ферменты и их роль в организме.
 Прежде чем начать изучение ферментов, послушаем небольшую сказку. Я расскажу вам сказку. Умирая, старый араб завещал своим сыновьям 17 прекрасных белых верблюдов. Старшему половину, среднему – третью часть, младшему – девятую часть. Когда араб умер, сыновья принялись делить свое наследство, но 17 верблюдов не делится ни на 2, ни на 3, ни на 9. В это время через пустыню шел бедный ученый, дервиш и вел за собой старого черного верблюда. Он подошел к братьям и спросил, о чем они горюют. Братья поведали о своем наследстве и невозможности его поделить. Тогда дервиш подарил им своего верблюда. У них стало 18 верблюдов и все получилось: старший получил 9 верблюдов, средний – 6 верблюдов, младший – 2 верблюда, остался старый верблюд ученого. “Что с ним делать? ” – спросили братья. “Отдайте его мне” – попросил ученый, и братья вернули ему верблюда. Вот и ферменты, так же, как и старый верблюд дервиша помогают осуществлять реакции в организме.
Прежде чем начать изучение ферментов, послушаем небольшую сказку. Я расскажу вам сказку. Умирая, старый араб завещал своим сыновьям 17 прекрасных белых верблюдов. Старшему половину, среднему – третью часть, младшему – девятую часть. Когда араб умер, сыновья принялись делить свое наследство, но 17 верблюдов не делится ни на 2, ни на 3, ни на 9. В это время через пустыню шел бедный ученый, дервиш и вел за собой старого черного верблюда. Он подошел к братьям и спросил, о чем они горюют. Братья поведали о своем наследстве и невозможности его поделить. Тогда дервиш подарил им своего верблюда. У них стало 18 верблюдов и все получилось: старший получил 9 верблюдов, средний – 6 верблюдов, младший – 2 верблюда, остался старый верблюд ученого. “Что с ним делать? ” – спросили братья. “Отдайте его мне” – попросил ученый, и братья вернули ему верблюда. Вот и ферменты, так же, как и старый верблюд дервиша помогают осуществлять реакции в организме.
 Так что же такое ферменты? • Ферменты – это белковые молекулы, синтезируемые живыми клетками. • В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые могут с большой скоростью идти при температурах, подходящих для данного организма, то есть в пределах от 5 о до 40 о. Чтобы эти реакции протекали вне организма с той же скоростью потребовались бы высокие температуры и резкие изменения условий. Для клетки это означало бы гибель, так как вся работа клетки строится таким образом, чтобы избежать любых сколько-нибудь заметных изменений в нормальных условиях ее существования. • Таким образом, можно сказать, что ферменты – это биологические катализаторы, то есть вещества, которые ускоряют биохимические реакции. Они абсолютно необходимы, потому что без них реакции в клетке протекали бы слишком медленно.
Так что же такое ферменты? • Ферменты – это белковые молекулы, синтезируемые живыми клетками. • В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые могут с большой скоростью идти при температурах, подходящих для данного организма, то есть в пределах от 5 о до 40 о. Чтобы эти реакции протекали вне организма с той же скоростью потребовались бы высокие температуры и резкие изменения условий. Для клетки это означало бы гибель, так как вся работа клетки строится таким образом, чтобы избежать любых сколько-нибудь заметных изменений в нормальных условиях ее существования. • Таким образом, можно сказать, что ферменты – это биологические катализаторы, то есть вещества, которые ускоряют биохимические реакции. Они абсолютно необходимы, потому что без них реакции в клетке протекали бы слишком медленно.
 Что же обозначает терминфермент Термин “фермент” (от лат. fermentum – закваска) был предложен в начале XVII века голландским ученым Ван Гельмондом. Почти все ферменты являются белками (но не все белки – ферменты). Представление о том, что ферменты – белки утвердилось не сразу. Для этого надо было научиться их выделять в высоко кристаллической форме. Впервые ферменты в такой форме выделил в 1926 году Дж. Самнер. После этого потребовалось еще 10 лет, в течение которых было получено еще несколько ферментов в кристаллической форме, чтобы представление о белковой природе ферментов стало доказанным и получило всеобщее признание. Для ферментов характерна своя эволюция, им также пришлось пройти длительный путь признания. Какими же свойствами обладают ферменты?
Что же обозначает терминфермент Термин “фермент” (от лат. fermentum – закваска) был предложен в начале XVII века голландским ученым Ван Гельмондом. Почти все ферменты являются белками (но не все белки – ферменты). Представление о том, что ферменты – белки утвердилось не сразу. Для этого надо было научиться их выделять в высоко кристаллической форме. Впервые ферменты в такой форме выделил в 1926 году Дж. Самнер. После этого потребовалось еще 10 лет, в течение которых было получено еще несколько ферментов в кристаллической форме, чтобы представление о белковой природе ферментов стало доказанным и получило всеобщее признание. Для ферментов характерна своя эволюция, им также пришлось пройти длительный путь признания. Какими же свойствами обладают ферменты?
 Катализ и энергия активации Несмотря на большое количество и разнообразие ферментов всех их по особенностям строения молекул можно разделить на 2 группы: простые белки и сложные белки.
Катализ и энергия активации Несмотря на большое количество и разнообразие ферментов всех их по особенностям строения молекул можно разделить на 2 группы: простые белки и сложные белки.
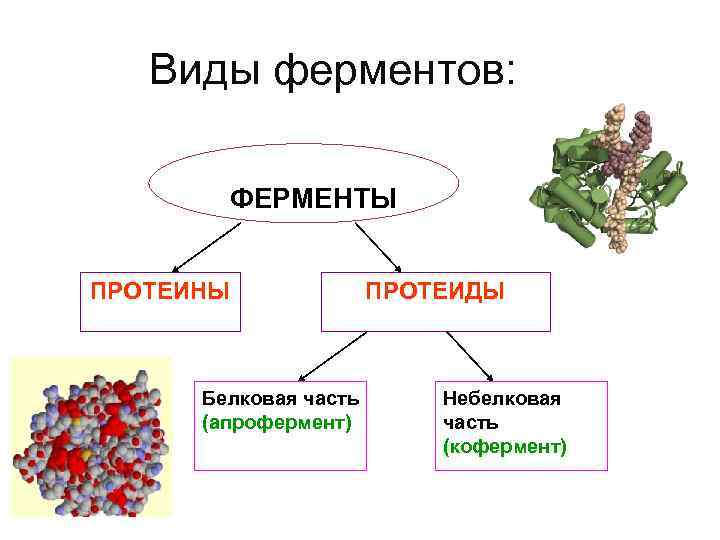 Виды ферментов: ФЕРМЕНТЫ ПРОТЕИНЫ Белковая часть (апрофермент) ПРОТЕИДЫ Небелковая часть (кофермент)
Виды ферментов: ФЕРМЕНТЫ ПРОТЕИНЫ Белковая часть (апрофермент) ПРОТЕИДЫ Небелковая часть (кофермент)
 Классификация ферментов • В 1961 году специальной комиссией международного биохимического союза была предложена систематическая номенклатура ферментов. Ферменты были подразделены на 6 групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент получил систематическое наименование, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было присвоено рабочее название для повседневного употребления. • Рабочее название складывалось из названия субстрата, типа катализируемой реакции и окончания –аза. • Например: • Лактат + дегидрогенизация + аза = лактатдегидрогеназа • Но для давно известных ферментов оставлены следующие названия, т. е. прежние названия пепсин, трипсин.
Классификация ферментов • В 1961 году специальной комиссией международного биохимического союза была предложена систематическая номенклатура ферментов. Ферменты были подразделены на 6 групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент получил систематическое наименование, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было присвоено рабочее название для повседневного употребления. • Рабочее название складывалось из названия субстрата, типа катализируемой реакции и окончания –аза. • Например: • Лактат + дегидрогенизация + аза = лактатдегидрогеназа • Но для давно известных ферментов оставлены следующие названия, т. е. прежние названия пепсин, трипсин.
 Классификация ферментов Классы ферментов Катализируемая реакция Примеры ферментов или их групп Оксидоредуктазы Перенос атомов водорода или электронов от одного вещества к другому. Дегидрогеназа, оксидаза Трансферазы Перенос определенной группы атомов метильной, ацильно , фосфатной или аминогруппы-одного вещества к другому Трансаминаза, киназа Гидролазы Реакции гидролиза Липаза , амилаза , пептидаза Лиазы Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, C-O или C-S Декарбоксилаза , фумараза , альдолаза Изомеразы Лигазы Внутримолекулярная перестройка Соединение двух молекул в результате образования новых связей, сопряженное с распадом АТФ Изомераза , мутаза Синтетаза
Классификация ферментов Классы ферментов Катализируемая реакция Примеры ферментов или их групп Оксидоредуктазы Перенос атомов водорода или электронов от одного вещества к другому. Дегидрогеназа, оксидаза Трансферазы Перенос определенной группы атомов метильной, ацильно , фосфатной или аминогруппы-одного вещества к другому Трансаминаза, киназа Гидролазы Реакции гидролиза Липаза , амилаза , пептидаза Лиазы Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, C-O или C-S Декарбоксилаза , фумараза , альдолаза Изомеразы Лигазы Внутримолекулярная перестройка Соединение двух молекул в результате образования новых связей, сопряженное с распадом АТФ Изомераза , мутаза Синтетаза
 Оксидоредукта зы • Оксидоредукта зы— отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы (восстановителя — акцептора протонов или донора электронов) на другую (окислитель — донора протонов или акцептора электронов). • Согласно международной классификации и номенклатуре ферментов оксидоредуктазы относятся к 1 классу, в пределах которого выделяют двадцать два подкласса
Оксидоредукта зы • Оксидоредукта зы— отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы (восстановителя — акцептора протонов или донора электронов) на другую (окислитель — донора протонов или акцептора электронов). • Согласно международной классификации и номенклатуре ферментов оксидоредуктазы относятся к 1 классу, в пределах которого выделяют двадцать два подкласса
 Трансферазы • • Трансфера зы — отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот. Реакции, катализируемые трансферазами, в общем случае выглядят так: – A—X + B ↔ A + B—X. Молекула A в здесь выступает в качестве донора группы атомов (X), а молекула B является акцептором группы. Часто в качестве донора в подобных реакциях переноса выступает один из коферментов. Многие из катализируемых трансферазами реакций являются обратимыми. Согласно международной классификации и номенклатуре ферментов трансферазы относятся ко 2 классу, в пределах которого выделяют девять подклассов:
Трансферазы • • Трансфера зы — отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот. Реакции, катализируемые трансферазами, в общем случае выглядят так: – A—X + B ↔ A + B—X. Молекула A в здесь выступает в качестве донора группы атомов (X), а молекула B является акцептором группы. Часто в качестве донора в подобных реакциях переноса выступает один из коферментов. Многие из катализируемых трансферазами реакций являются обратимыми. Согласно международной классификации и номенклатуре ферментов трансферазы относятся ко 2 классу, в пределах которого выделяют девять подклассов:
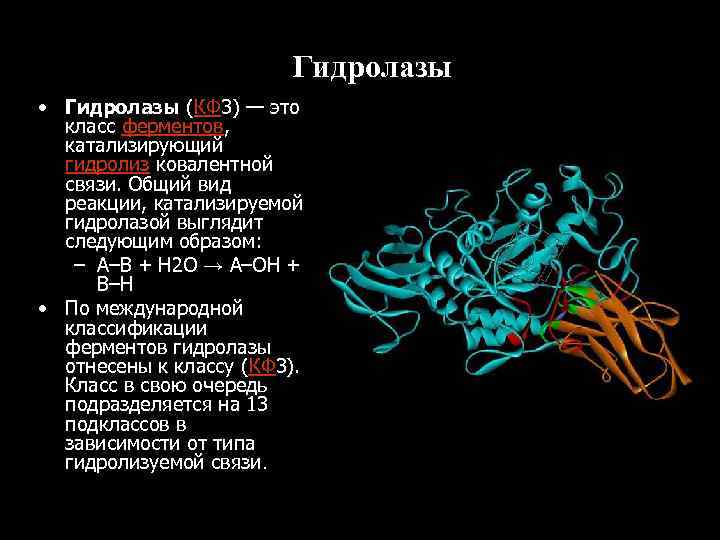 Гидролазы • Гидролазы (КФ 3) — это класс ферментов, катализирующий гидролиз ковалентной связи. Общий вид реакции, катализируемой гидролазой выглядит следующим образом: – A–B + H 2 O → A–OH + B–H • По международной классификации ферментов гидролазы отнесены к классу (КФ 3). Класс в свою очередь подразделяется на 13 подклассов в зависимости от типа гидролизуемой связи.
Гидролазы • Гидролазы (КФ 3) — это класс ферментов, катализирующий гидролиз ковалентной связи. Общий вид реакции, катализируемой гидролазой выглядит следующим образом: – A–B + H 2 O → A–OH + B–H • По международной классификации ферментов гидролазы отнесены к классу (КФ 3). Класс в свою очередь подразделяется на 13 подклассов в зависимости от типа гидролизуемой связи.
 Лиазы • Лиа зы — отдельный класс ферментов, катализирующих реакции негидролитического разрыва различных химических связей (C—C, C—O, C—N, C—S и других), обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур. По международной классификации и номенклатуре ферментов лиазы принадлежат к 4 классу, в пределах которого выделяют семь подклассов
Лиазы • Лиа зы — отдельный класс ферментов, катализирующих реакции негидролитического разрыва различных химических связей (C—C, C—O, C—N, C—S и других), обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур. По международной классификации и номенклатуре ферментов лиазы принадлежат к 4 классу, в пределах которого выделяют семь подклассов
 Изомеразы, класс ферментов, катализирующих внутримолекулярные перемещения различных групп, в том числе и реакции взаимного превращения различных изомеров. И. , катализирующие взаимопревращения стереоизомеров, называются рацемазами или эпимеразами в зависимости от числа центров асимметрии в молекуле субстрата. К И. относятся также цис-трансизомеразы, внутримолекулярные оксидоредуктазы, внутримолекулярные трансферазы, внутримолекулярные лиазы. Иногда ферменты, катализирующие перенос каких-либо групп от одного участка молекулы к другому, называются мутазами.
Изомеразы, класс ферментов, катализирующих внутримолекулярные перемещения различных групп, в том числе и реакции взаимного превращения различных изомеров. И. , катализирующие взаимопревращения стереоизомеров, называются рацемазами или эпимеразами в зависимости от числа центров асимметрии в молекуле субстрата. К И. относятся также цис-трансизомеразы, внутримолекулярные оксидоредуктазы, внутримолекулярные трансферазы, внутримолекулярные лиазы. Иногда ферменты, катализирующие перенос каких-либо групп от одного участка молекулы к другому, называются мутазами.
 Лигазы, синтетазы, класс ферментов; катализируют присоединение друг к другу двух молекул. Играют большую роль в важнейших анаболических процессах — биосинтезе белков, жиров, углеводов. Реакции, катализируемые Л. , осуществляются за счёт энергии, освобождающейся при расщеплении аденозинтрифосфата — АТФ или аналогичного трифосфата. Термин "Л. " применяют также к синтезирующим ферментам, действующим без участия нуклеозидтрифосфатов.
Лигазы, синтетазы, класс ферментов; катализируют присоединение друг к другу двух молекул. Играют большую роль в важнейших анаболических процессах — биосинтезе белков, жиров, углеводов. Реакции, катализируемые Л. , осуществляются за счёт энергии, освобождающейся при расщеплении аденозинтрифосфата — АТФ или аналогичного трифосфата. Термин "Л. " применяют также к синтезирующим ферментам, действующим без участия нуклеозидтрифосфатов.
 Механизм действия ферментов • Изучил немецкий ученый Эмиль Фишер. Он высказал гипотезу (1880), согласно которой субстрат подходит активному центру фермента как «ключ к замку»
Механизм действия ферментов • Изучил немецкий ученый Эмиль Фишер. Он высказал гипотезу (1880), согласно которой субстрат подходит активному центру фермента как «ключ к замку»
 Поскольку все ферменты являются белками, их активность наиболее велика при физиологически нормальных условиях: – Большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 50 о С) каталитическая активность растет (на каждые 10 о С скорость реакции повышается примерно в 2 раза). При t выше 50 о С белок подвергается денатурации и активность фермента падает. – Кроме того, для каждого фермента существует оптимальное значение p. H, при котором он проявляет максимальную активность. – На скорость реакции влияет также концентрация субстрата и концентрация фермента. – Все ферменты высокоспецифичны к своему субстрату и как правило, катализируют только одну вполне определенную реакцию.
Поскольку все ферменты являются белками, их активность наиболее велика при физиологически нормальных условиях: – Большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 50 о С) каталитическая активность растет (на каждые 10 о С скорость реакции повышается примерно в 2 раза). При t выше 50 о С белок подвергается денатурации и активность фермента падает. – Кроме того, для каждого фермента существует оптимальное значение p. H, при котором он проявляет максимальную активность. – На скорость реакции влияет также концентрация субстрата и концентрация фермента. – Все ферменты высокоспецифичны к своему субстрату и как правило, катализируют только одну вполне определенную реакцию.
 Свойства ферментов Будучи белками, ферменты обладают всеми их свойствами. Но у них есть и ряд специфических качеств, тоже вытекающих из их белковой природы: • 1) Специфичность - каждый из них действует только на одну реакцию (например, уреаза расщепляет только мочевину)
Свойства ферментов Будучи белками, ферменты обладают всеми их свойствами. Но у них есть и ряд специфических качеств, тоже вытекающих из их белковой природы: • 1) Специфичность - каждый из них действует только на одну реакцию (например, уреаза расщепляет только мочевину)
 Свойства ферментов • 2) Высокая эффективность действия. Ферменты могут ускорять реакцию в 108 -1012 раз. В среднем ферменты способны катализировать около 1000 реакций в секунду. Без катализаторов реакции протекали бы в миллионы раз медленнее. • 3) Термолабильность – действие в определённых температурных пределах. Для действия большинства ферментов теплокровных животных наиболее благоприятной температурой является 37 -40 o. С. • 4) Зависимость их действия от значения р. Н среды.
Свойства ферментов • 2) Высокая эффективность действия. Ферменты могут ускорять реакцию в 108 -1012 раз. В среднем ферменты способны катализировать около 1000 реакций в секунду. Без катализаторов реакции протекали бы в миллионы раз медленнее. • 3) Термолабильность – действие в определённых температурных пределах. Для действия большинства ферментов теплокровных животных наиболее благоприятной температурой является 37 -40 o. С. • 4) Зависимость их действия от значения р. Н среды.
 Получение ферментов Обычно ферменты выделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа и др. ). Для получения некоторых труднодоступных ферментов используются методы генетической инженерии.
Получение ферментов Обычно ферменты выделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа и др. ). Для получения некоторых труднодоступных ферментов используются методы генетической инженерии.
 Практическое применение ферментов • • 1)Может ли человек использовать знания о ферментах в своей практической деятельности? 2)Существует ли определенная наука, которая занимается изучением ферментов? Энзимология – учение о ферментах, выделено в самостоятельную науку. Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике. – В пищевой промышленности ферменты используют приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей. – В животноводстве ферменты используют приготовлении кормов. – Ферменты используют при изготовлении фотоматериалов. – Ферменты используют при обработке овса и конопли. – Ферменты используют для смягчения кожи в кожевенной промышленности. – Ферменты входят в состав стиральных порошков, зубных паст. – В медицине ферменты имеют диагностическое значение – определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например вирусный гепатит – по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.
Практическое применение ферментов • • 1)Может ли человек использовать знания о ферментах в своей практической деятельности? 2)Существует ли определенная наука, которая занимается изучением ферментов? Энзимология – учение о ферментах, выделено в самостоятельную науку. Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике. – В пищевой промышленности ферменты используют приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей. – В животноводстве ферменты используют приготовлении кормов. – Ферменты используют при изготовлении фотоматериалов. – Ферменты используют при обработке овса и конопли. – Ферменты используют для смягчения кожи в кожевенной промышленности. – Ферменты входят в состав стиральных порошков, зубных паст. – В медицине ферменты имеют диагностическое значение – определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например вирусный гепатит – по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.


