Ферменты и их роль в организме.ppt
- Количество слайдов: 20
 Ферменты и их роль в организме 1. 2. 3. 4. Свойства ферментов. Номенклатура и классификация ферментов. Пространственная структура ферментов. Механизмы взаимодействия ферментов с субстратами. 5. Ферментные ингибиторы. 6. Моно и полифункциональные ферменты. 7. Моделирование новых ферментов.
Ферменты и их роль в организме 1. 2. 3. 4. Свойства ферментов. Номенклатура и классификация ферментов. Пространственная структура ферментов. Механизмы взаимодействия ферментов с субстратами. 5. Ферментные ингибиторы. 6. Моно и полифункциональные ферменты. 7. Моделирование новых ферментов.
 Ферменты — биологически активные органические вещества белковой природы, которые ускоряют химические реакции в клетке в десятки миллионов раз, но в самих реакциях не затрачиваются.
Ферменты — биологически активные органические вещества белковой природы, которые ускоряют химические реакции в клетке в десятки миллионов раз, но в самих реакциях не затрачиваются.
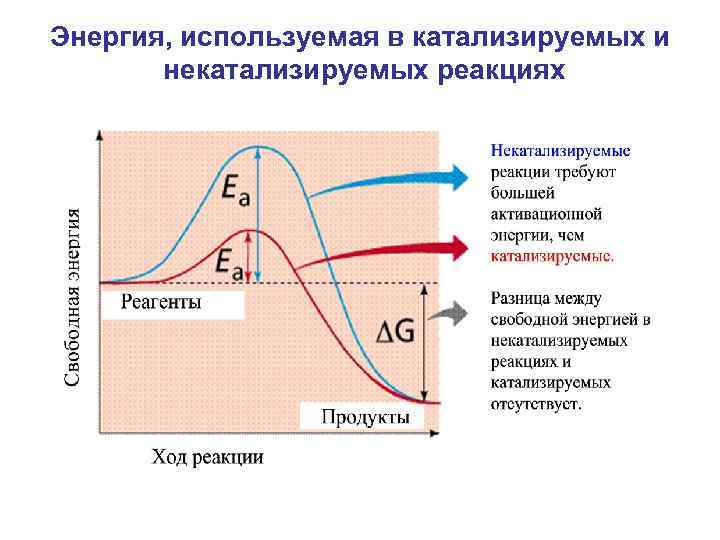 Энергия, используемая в катализируемых и некатализируемых реакциях
Энергия, используемая в катализируемых и некатализируемых реакциях
 Основные свойства ферментов: • катализируют реакции; • не расходуются в реакции; • их присутствие не влияет на свойства продуктов реакции; • активность ферментов зависит от p. H, температуры, давления и концентрации; • ферменты изменяют энергию активации, при которой может произойти реакция; • ферменты не изменяют сколько нибудь значительно температуру, при которой происходит реакция; • поддаются регулированию; • обладают высокой специфичностью.
Основные свойства ферментов: • катализируют реакции; • не расходуются в реакции; • их присутствие не влияет на свойства продуктов реакции; • активность ферментов зависит от p. H, температуры, давления и концентрации; • ферменты изменяют энергию активации, при которой может произойти реакция; • ферменты не изменяют сколько нибудь значительно температуру, при которой происходит реакция; • поддаются регулированию; • обладают высокой специфичностью.
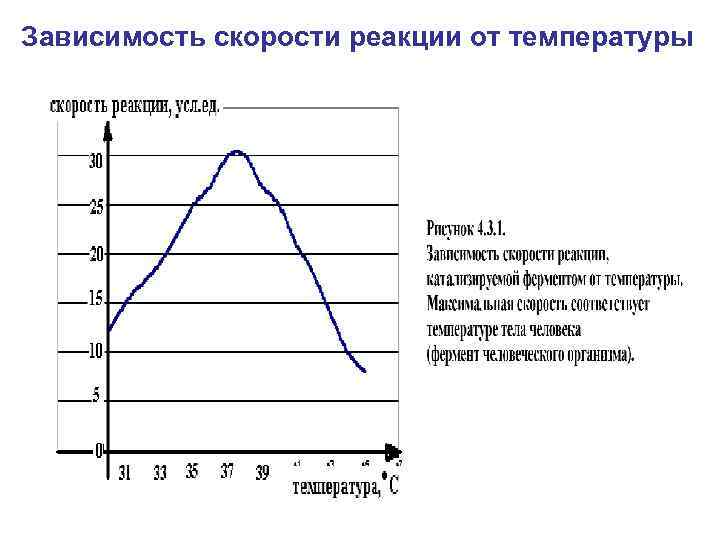 Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры
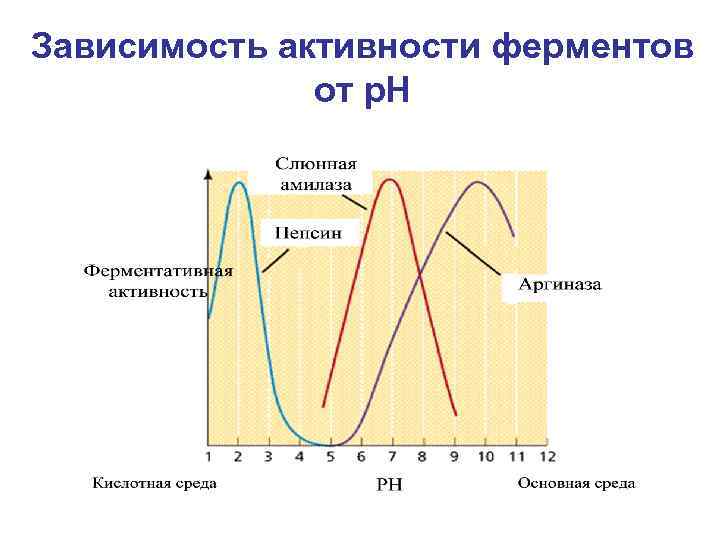 Зависимость активности ферментов от р. Н
Зависимость активности ферментов от р. Н
 Номенклатура и классификация ферментов Название фермента формируется из следующих частей: 1. название субстрата, с которым он взаимодействует 2. характер катализируемой реакции 3. суффикс -аза Например, пируват - декарбоксил - аза, сукцинат - дегидроген - аза Выделяют 6 классов, которые в свою очередь делятся на ряд подклассов
Номенклатура и классификация ферментов Название фермента формируется из следующих частей: 1. название субстрата, с которым он взаимодействует 2. характер катализируемой реакции 3. суффикс -аза Например, пируват - декарбоксил - аза, сукцинат - дегидроген - аза Выделяют 6 классов, которые в свою очередь делятся на ряд подклассов
 Классы ферментов • • • оксидоредуктазы (переносят электроны, гидрид ионы или атомы водорода); трансферазы (переносят отдельные атомы между разными молекулами; гидролазы (катализируют гидролитическое расщепление связей); лиазы (катализируют присоединение групп к двойным связям или образование двойных связей при удалении групп); изомеразы (катализируют перенос групп внутри молекулы с образованием изомерных форм; лигазы (катализируют образование связей С~С, С О и С Н при реакциях конденсации, сопряженных с расщеплением высокоэнергетической фосфатной связи).
Классы ферментов • • • оксидоредуктазы (переносят электроны, гидрид ионы или атомы водорода); трансферазы (переносят отдельные атомы между разными молекулами; гидролазы (катализируют гидролитическое расщепление связей); лиазы (катализируют присоединение групп к двойным связям или образование двойных связей при удалении групп); изомеразы (катализируют перенос групп внутри молекулы с образованием изомерных форм; лигазы (катализируют образование связей С~С, С О и С Н при реакциях конденсации, сопряженных с расщеплением высокоэнергетической фосфатной связи).
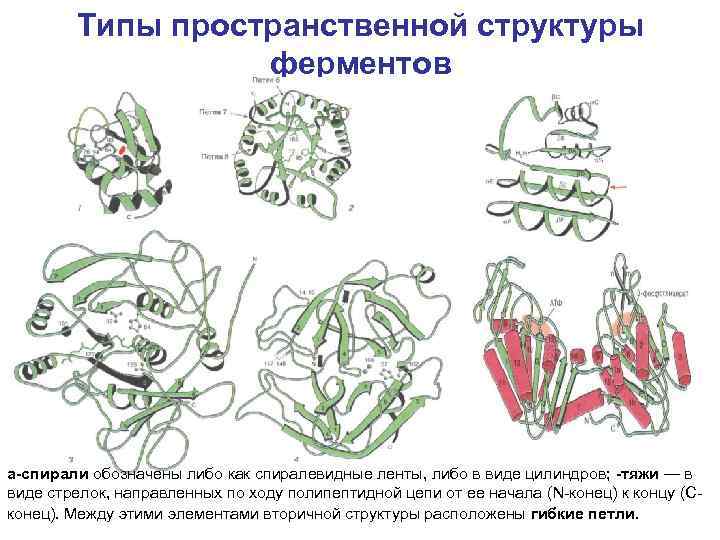 Типы пространственной структуры ферментов a спирали обозначены либо как спиралевидные ленты, либо в виде цилиндров; тяжи — в виде стрелок, направленных по ходу полипептидной цепи от ее начала (N конец) к концу (С конец). Между этими элементами вторичной структуры расположены гибкие петли.
Типы пространственной структуры ферментов a спирали обозначены либо как спиралевидные ленты, либо в виде цилиндров; тяжи — в виде стрелок, направленных по ходу полипептидной цепи от ее начала (N конец) к концу (С конец). Между этими элементами вторичной структуры расположены гибкие петли.
 Многим ферментам для эффективной работы требуются небелковые компоненты, называемые кофакторами. Это могут быть активаторы ферментов и коферменты, входящие в состав активного центра некоторых ферментов. Такими веществами могут быть неорганические ионы, заставляющие ферменты принять форму, способствующую ферментативной реакции, простетические группы (ФАД, гем), занимающие такое положение, при котором они могут эффективно содействовать реакции, а также макроэргические соединения (NAD, NADF, ATP). Большинство коферментов – производные витаминов, поэтому отсутствие последних в пище приводит к недостаточной активности некоторых ферментов и вызывает нарушения обмена веществ.
Многим ферментам для эффективной работы требуются небелковые компоненты, называемые кофакторами. Это могут быть активаторы ферментов и коферменты, входящие в состав активного центра некоторых ферментов. Такими веществами могут быть неорганические ионы, заставляющие ферменты принять форму, способствующую ферментативной реакции, простетические группы (ФАД, гем), занимающие такое положение, при котором они могут эффективно содействовать реакции, а также макроэргические соединения (NAD, NADF, ATP). Большинство коферментов – производные витаминов, поэтому отсутствие последних в пище приводит к недостаточной активности некоторых ферментов и вызывает нарушения обмена веществ.
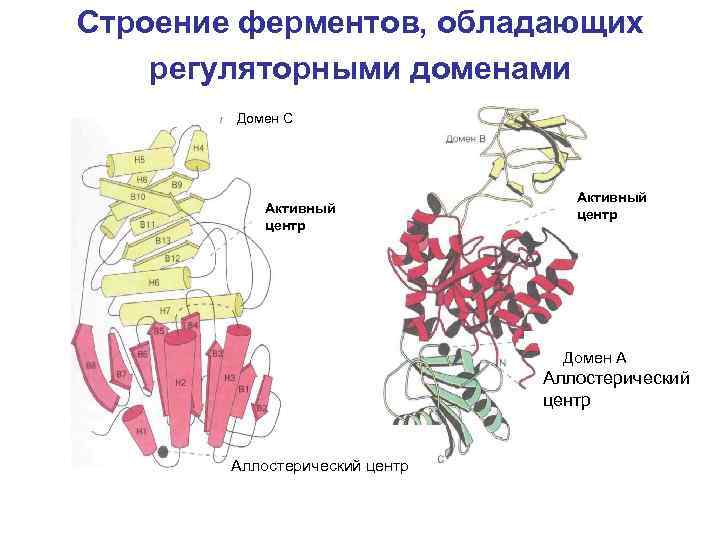 Строение ферментов, обладающих регуляторными доменами Домен С Активный центр Домен А Аллостерический центр
Строение ферментов, обладающих регуляторными доменами Домен С Активный центр Домен А Аллостерический центр
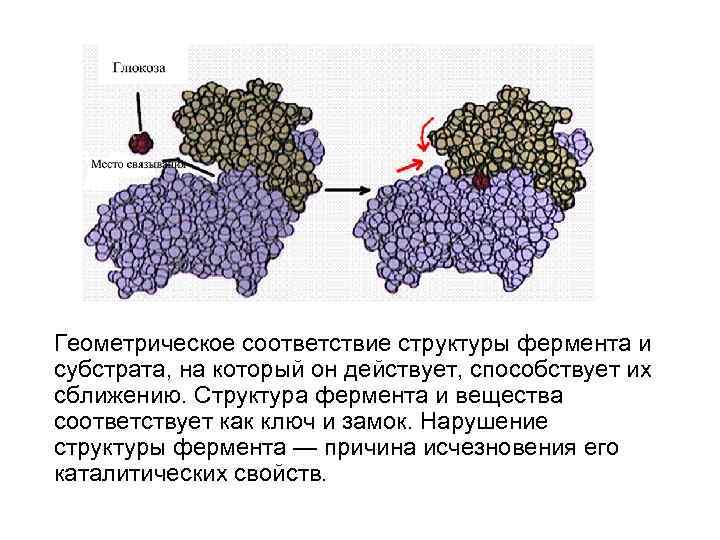 Геометрическое соответствие структуры фермента и субстрата, на который он действует, способствует их сближению. Структура фермента и вещества соответствует как ключ и замок. Нарушение структуры фермента — причина исчезновения его каталитических свойств.
Геометрическое соответствие структуры фермента и субстрата, на который он действует, способствует их сближению. Структура фермента и вещества соответствует как ключ и замок. Нарушение структуры фермента — причина исчезновения его каталитических свойств.
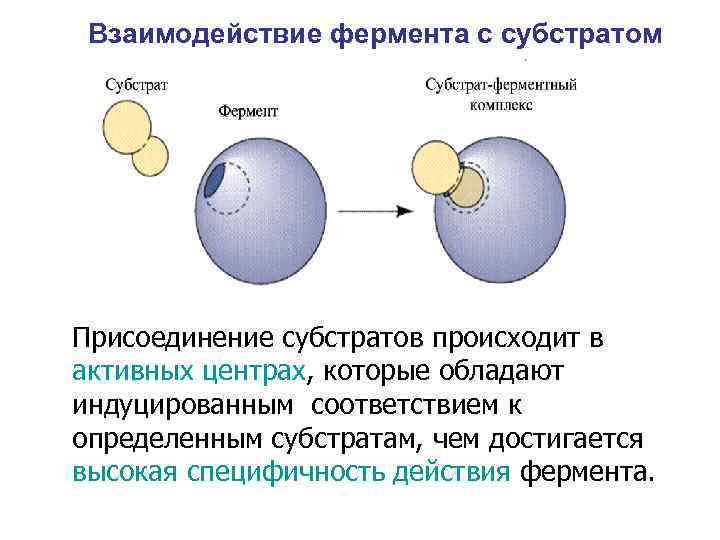 Взаимодействие фермента с субстратом Присоединение субстратов происходит в активных центрах, которые обладают индуцированным соответствием к определенным субстратам, чем достигается высокая специфичность действия фермента.
Взаимодействие фермента с субстратом Присоединение субстратов происходит в активных центрах, которые обладают индуцированным соответствием к определенным субстратам, чем достигается высокая специфичность действия фермента.
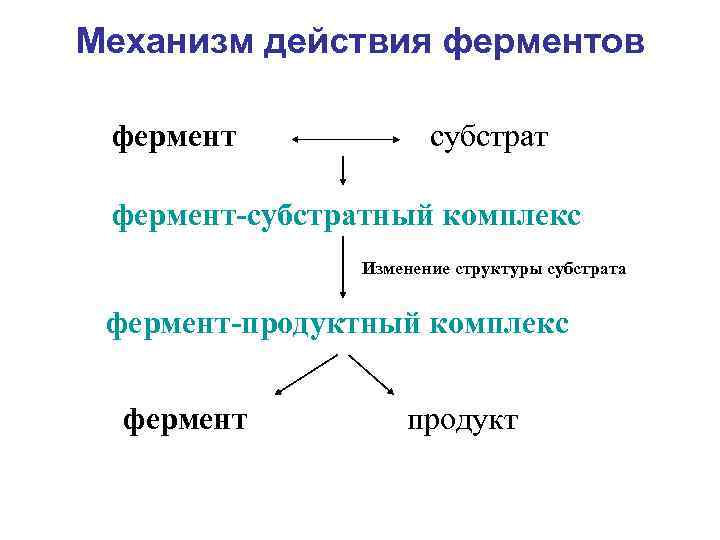 Механизм действия ферментов фермент субстрат фермент-субстратный комплекс Изменение структуры субстрата фермент-продуктный комплекс фермент продукт
Механизм действия ферментов фермент субстрат фермент-субстратный комплекс Изменение структуры субстрата фермент-продуктный комплекс фермент продукт
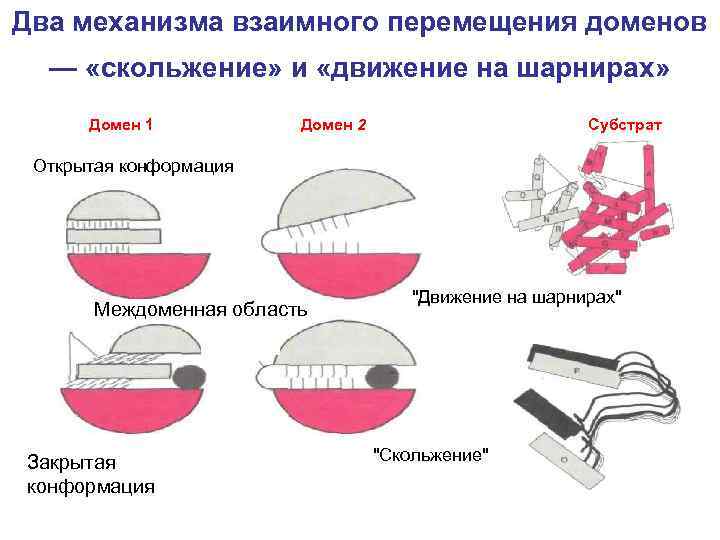 Два механизма взаимного перемещения доменов — «скольжение» и «движение на шарнирах» Домен 1 Домен 2 Субстрат Открытая конформация Междоменная область Закрытая конформация "Движение на шарнирах" "Скольжение"
Два механизма взаимного перемещения доменов — «скольжение» и «движение на шарнирах» Домен 1 Домен 2 Субстрат Открытая конформация Междоменная область Закрытая конформация "Движение на шарнирах" "Скольжение"
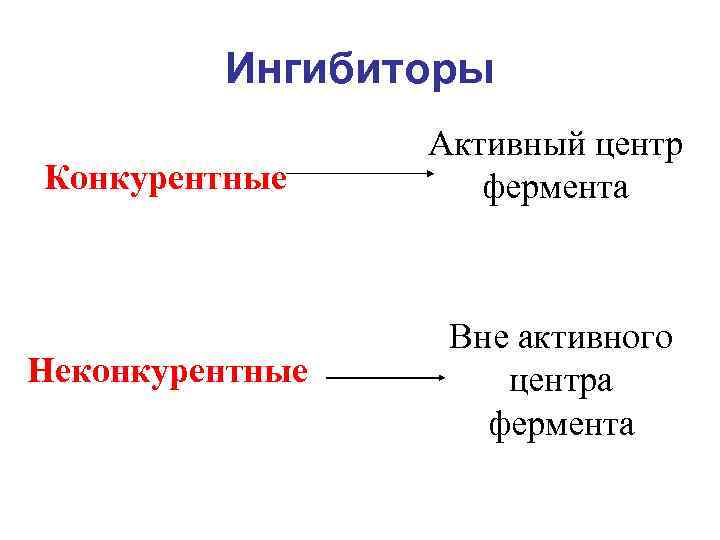 Ингибиторы Конкурентные Активный центр фермента Неконкурентные Вне активного центра фермента
Ингибиторы Конкурентные Активный центр фермента Неконкурентные Вне активного центра фермента
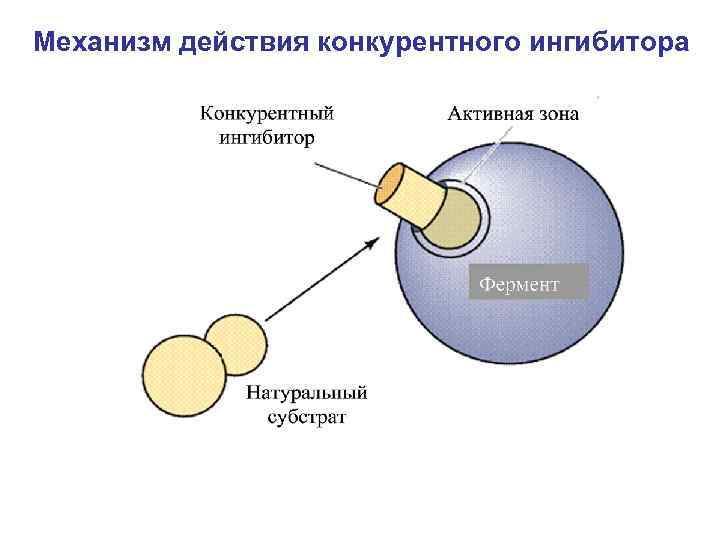 Механизм действия конкурентного ингибитора
Механизм действия конкурентного ингибитора
 Преимущества объединения моно функциональных ферментов в бифункциональные в в в 1— «туннелирование» интермедиата. Фермент Е, катализирует превращение метаболита А в метаболит Б. фермент Е 2 — превращение метаболита Б в метаболит В. При последовательном действии этих монофункциональных ферментов скорость накопления В будет зависеть от концентрации Б в растворе, тогда как бифункциональный фермент (Е) обеспечивает прямой перенос Б из активного центра Е 1 в активный центр Е 2; 2 — согласованное изменение обеих активностей бифункционального фермента при связывании аллостерического эффектора в одном центре: а— монофункциональный фермент обладает аллостерическим центром (обозначен крестиком) и при связывании эффектора (R] переходит в новое конформационное состояние, б — монофункциональный фермент нечувствителен к аплостерическому эффектору, в— обе части бифункционального фермента изменяют конформацию при связывании эффектора в одном центре; 3— согласованная регуляция активности ферментов, катализирующих противоположно направленные реакции; а — фермент катализиру ет реакцию превращения А в Б. Фермент Б катализирует обратную реакцию. В клетке эта ситуация не реализуется, так как оба фермента находятся под контролем аллостерических эффекторов, оказывающих на них противоположное влияние (б). В случае, когда ферменты объединены в общую структуру, описанный результат достигается при связывании эффектора лишь с одним из супердоменов (в)
Преимущества объединения моно функциональных ферментов в бифункциональные в в в 1— «туннелирование» интермедиата. Фермент Е, катализирует превращение метаболита А в метаболит Б. фермент Е 2 — превращение метаболита Б в метаболит В. При последовательном действии этих монофункциональных ферментов скорость накопления В будет зависеть от концентрации Б в растворе, тогда как бифункциональный фермент (Е) обеспечивает прямой перенос Б из активного центра Е 1 в активный центр Е 2; 2 — согласованное изменение обеих активностей бифункционального фермента при связывании аллостерического эффектора в одном центре: а— монофункциональный фермент обладает аллостерическим центром (обозначен крестиком) и при связывании эффектора (R] переходит в новое конформационное состояние, б — монофункциональный фермент нечувствителен к аплостерическому эффектору, в— обе части бифункционального фермента изменяют конформацию при связывании эффектора в одном центре; 3— согласованная регуляция активности ферментов, катализирующих противоположно направленные реакции; а — фермент катализиру ет реакцию превращения А в Б. Фермент Б катализирует обратную реакцию. В клетке эта ситуация не реализуется, так как оба фермента находятся под контролем аллостерических эффекторов, оказывающих на них противоположное влияние (б). В случае, когда ферменты объединены в общую структуру, описанный результат достигается при связывании эффектора лишь с одним из супердоменов (в)
 Примеры молекулярной графики биологически активных молекул (а) и белков (б) а— простейший «проволочный" тип отображения структуры молекул в виде линий, соединяющих центры атомов (зеленый цвет в центре). Сферы ван дер Ваальса (атомы с ван дер ваальсовыми радиусами) — белый цвет слева вверху, желтый справа и зеленый в центре внизу. 6— упрощенный тип отображения белка в виде трубки, (возможны варианты в виде плоской и обьемной ленты), показывающей общий ход белковой цепи, — в центре внизу. Дополнение «трубчатого» изображения «проволочным изображением боковых цепей аминокислот— желтый и голубой цвета слева. Схематичное изображение вторичных структур белка условными элементами (спирали— в виде скрученных лент.
Примеры молекулярной графики биологически активных молекул (а) и белков (б) а— простейший «проволочный" тип отображения структуры молекул в виде линий, соединяющих центры атомов (зеленый цвет в центре). Сферы ван дер Ваальса (атомы с ван дер ваальсовыми радиусами) — белый цвет слева вверху, желтый справа и зеленый в центре внизу. 6— упрощенный тип отображения белка в виде трубки, (возможны варианты в виде плоской и обьемной ленты), показывающей общий ход белковой цепи, — в центре внизу. Дополнение «трубчатого» изображения «проволочным изображением боковых цепей аминокислот— желтый и голубой цвета слева. Схематичное изображение вторичных структур белка условными элементами (спирали— в виде скрученных лент.


