лекция Ферментативный катализ (2).pptx
- Количество слайдов: 98

Ферментативный катализ Специальный курс

МЕТОДИКА РАБОТЫ С ФЕРМЕНТАМИ Характерным свойством ферментов является их способность катализировать определенные химические реакции. За исключением небольшого числа ферментов, которые могут быть обнаружены непосредственно при помощи спектрального анализа или наблюдений другого рода, присутствие ферментов обнаруживается по протеканию катализируемых ими специфических реакций, количество же присутствующего фермента определяется по скорости реакции. Поэтому измерение скорости реакции составляет наиболее существенную часть в методике исследования ферментов.

Измерение скорости ферментативных реакций Кривые хода большинства ферментативных реакций имеют общую форму Скорость реакции уменьшается со временем, что может объясняться различными причинами: продукты реакции могут угнетать фермент; степень насыщения фермента субстратом может уменьшаться в результате падения концентрации Рис. 1. 1. Типичная кривая хода ферментативной реакции субстрата по мере осуществления Вследствие отмеченных факторов, реакции; увеличении концентрации при изучении ферментативных при реакции более реакций используют измерение продуктов существенной может становиться начальной скорости реакции обратная реакция и др.

Для того, чтобы точно измерить скорость реакции, нужно проводить определение ферментативной активности в самом начале реакции, т. е. тогда, когда, например, за каждую минуту подвергается превращению одно и то же количество субстрата. Обычно определение скорости ферментативной реакции производят в условиях, когда количество превращенной части субстрата не превышает 20 % от исходной. Т. о. , измеряют начальную скорость реакции. В начальный период реакции имеется избыток субстрата, минимальное количество продуктов реакции и фермент находится в активной форме, т. е. перечисленные выше факторы еще не успевают проявить своего действия.

При работе с ферментами принято прослеживать изменение начальной скорости реакции под влиянием изменений только одного из факторов, определяющих скорость реакции, при сохранении всех, остальных факторов постоянными. Для отыскания начальной скорости достаточно построить только начальный участок кривой хода реакции и определить тангенс угла наклона в начальной точке. До тех пор пока степень превращения не превысит 20% максимально возможной, графики обычно представляют собой практически прямые линии. Количество субстрата, прореагировавшего за определенный отрезок времени от начала реакции, может рассматриваться как показатель скорости реакции

При проведении реакции субстраты и кофакторы должны находиться в реакционной смеси в избытке. Однако очень высокие концентрации субстратов и кофакторов могут приводить к снижению активности ферментов за счет субстратного ингибирования. Для того, чтобы убедиться, что измеряется истинная каталитическая активность, обычно увеличивают или уменьшают количество фермента в системе в 2 -3 раза. Если это приводит к соответствующему изменению активности, то значит, что при данных условиях скорость ферментативной реакции определяет только концентрация фермента.

Не в каждом случае получают кривую, подобную рассмотренной выше. Иногда ряд факторов вызывает не уменьшение, а увеличение скорости в течение первой фазы реакции. В этом случае кривая имеет S-образную, или аутокаталитическую, форму с максимумом скорости в одной из промежуточных точек. В таком случае, общего правила, как охарактеризовать активность фермента, нет, и в каждом случае следует поступать с учетом особенностей системы. Лучшим путем является установление причины ускорения; затем модифицируют процедуру определения так, чтобы устранить действие обнаруженной причины, и обычным путем определяют начальную скорость.

Например, оксидаза D-аминокислот функционирует при участии флавинового кофермента, который относительно медленно связывается с ферментом; в результате количество «активного фермента» в течение некоторого периода времени после смешивания реагентов возрастает и наблюдается ускорение реакции. Это осложнение можно устранить, если вначале проинкубировать фермент с коферментом и запускать реакцию добавлением субстрата.

Типы методов, используемых при изучении ферментативных реакций Различают два типа методов изучения ферментативных реакций: 1. методы, связанные с отбором проб 2. непрерывные методы В первом случае за самой реакционной смесью не следят, а через определенные промежутки времени отбирают пробы и в результате измерений получают ряд отдельных точек, по, которым строят кривые хода реакции. Во втором случае наблюдения проводят (по ходу реакции) над самой реакционной смесью: при этом с помощью большого числа измерений или автоматической регистрации удается получать непрерывные кривые хода реакции.

Общие правила работы с ферментами Ферменты — относительно неустойчивые вещества и при неблагоприятных условиях легко денатурируются и инактивируются. В работе с ферментами всегда следует, прежде всего, заботиться о том, чтобы не допустить их инактивации. Успех при работе с ферментами зависит от соблюдения условий, при которых ферменты остаются стабильными. Эти условия для разных ферментов различны, но всегда следует избегать высоких температур, а также растворов с выраженной кислотной или щелочной реакцией. В настоящее время при выделении и очистке многих ферментов поддерживают температуру 0°С как само собой разумеющееся условие.

Большинство ферментов инактивируются в растворах с р. Н<5 или >9, хотя из этого правила имеются исключения. Поэтому важно, чтобы при доведении р. Н раствора фермента до определенного значения путем добавления кислоты или щелочи вокруг каждой капли добавляемого к раствору реагента не возникало зоны деструкции. Реагент следует добавлять медленно, давая ему стекать по стенке сосуда, и одновременно энергично перемешивать раствор, желательно с помощью механической мешалки. Многие ферменты подвергаются денатурации на поверхностях раздела. Поэтому важно избегать образования пены — переливать раствор фермента из одного сосуда в другой следует по стенке сосуда. По той же причине не следует употреблять мешалки, вспенивающие поверхность жидкости.

Во многих случаях даже при наиболее благоприятных условиях наблюдается медленное инактивирование фермента. Рекомендуется проводить очистку фермента по возможности быстро, заканчивая выделение в течение 2— 3 дней, если только фермент не является достаточно устойчивым. Иногда возникают трудности в связи с необходимостью сохранять ферменты в лаборатории без потери активности. Если раствор фермента можно подвергать замораживанию и оттаиванию без потери активности, то удобнее всего хранить его в состоянии глубокого охлаждения; при этом он обычно остается стабильным в течение многих месяцев.

Высушивание растворов ферментов при комнатной температуре обычно вызывает полную инактивацию, но высушивание в условиях вакуума при низкой температуре из замороженного состояния представляет собой ценный метод, с помощью которого часто удается получать активный растворимый препарат, с возможностью хранения при комнатной температуре. Некоторые ферменты стабильны в концентрированных растворах солей; их можно длительное время сохранять без потери активности в форме осажденных суспензий в насыщенном растворе сульфата аммония, с тем, чтобы, когда это понадобится, отцентрифугировать и растворить в воде.

Методы количественного изучения ферментативных реакций Спектрофотометрические методы Многие субстраты и продукты ферментативных реакций поглощают свет либо в видимой, либо в ультрафиолетовой области спектра. Наличие в молекуле двойной связи или кольцевой структуры обычно сказывается на характере спектра поглощения. Так как маловероятно, чтобы субстрат и продукт рассматриваемой ферментативной реакции обладали идентичными спектрами поглощения, часто оказывается возможным найти такую длину волны, при которой в результате рассматриваемого превращения поглощение значительно изменяется. Измеряя величину этого изменения, можно изучать течение данной ферментативной реакции на количественном уровне.

Спектрофотометрические методы часто применяют для непрямого определения активности исследуемого фермента с использованием вспомогательных НАД(Ф)дегидрогеназ. Так, если действие фермента не сопровождается изменением поглощения, но образующийся в реакции продукт может служить акцептором или донором для какой -либо дегидрогеназы, то внесение в реакционную смесь ферментного препарата дегидрогеназы и соответствующего кофермента позволит определить активность изучаемого фермента.

Например, измерение активности аспартат-глутаматтрансаминазы можно осуществить по образующемуся глутамату, определяемого посредством внесения глутаматдегидрогеназы и НАД или же по оксалоацетату, добавляя НАДН и малатдегидрогеназу. В первом случае об активности фермента можно судить по приросту оптической плотности при 340 нм в результате образования НАДН; во втором – по убыли поглощения за счет окисления НАДН за единицу времени.

Флуоресцентные методы В ряде случаев флуоресцентный метод является более чувствительным, чем спектрофотометрический. Флавиновые соединения, сильно флуоресцирующие в окисленной форме, утрачивают флуоресценцию при восстановлении. NAD и NADР не флуоресцируют в окисленной форме, но в восстановленной форме обладают голубой флуоресценцией. Это свойство используется как основа чувствительного метода определения для регистрации протекания ферментативных окислительных и восстановительных реакций.

Манометрические методы представляют собой удобные и точные методы для наблюдения за ходом реакций, в которых один из компонентов находится в газообразном состоянии. Они пригодны, в частности, для изучения оксидаз и декарбоксилаз. Кроме того, многочисленные реакции, при которых образуется или потребляется щелочь или кислота, могут быть изучены с помощью манометрических методов, если эти реакции проводить в бикарбонатном буфере, находящемся в равновесии с газовой смесью, содержащей определенный процент СО 2. Образующаяся кислота будет освобождать из бикарбонатного буфера соответствующее количество СО 2, которое можно измерить манометрически.

Электродные методы Данные методы направлены для изучения тех реакций, в результате которых образуется кислота. Наиболее простым приемом является регистрация изменений р. Н в ходе реакции, однако против него имеются два возражения. Во-первых, изменение р. Н в ходе реакции может, вероятно, вызывать осложнения, связанные с изменением активности фермента. Во-вторых, скорость изменения р. Н зависит не только от скорости реакции, но также и от буферной емкости раствора. Последнее обстоятельство представляет серьезное затруднение, так как белки обладают высокой буферной емкостью. Неочищенные же препараты фермента содержат значительное количество неактивного белка, который удаляется в ходе очистки, в результате чего изменяется буферная емкость изучаемых препаратов.

Более значительными преимуществами обладает метод непрерывного титрования. В этом случае с помощью частых добавлений небольших количеств щелочи поддерживают приблизительно постоянный уровень р. Н; скорость добавления щелочи отражает скорость реакции и не зависит от количества буфера. Количество буфера влияет, однако, на точность метода: если буфера берут слишком мало, то трудно поддерживать р. Н на постоянном уровне, если же его берут слишком много, то метод становится нечувствительным.

Реакции, в которых участвует О 2, удобно изучать полярографическим методом. Сила тока, проходящего через поляризованный платиновый электрод, зависит от концентрации О 2 в растворе, в который погружен электрод, и при непрерывном измерении можно получать кривую, показывающую изменение концентрации О 2. Для этой цели используют кислородные электроды двух типов: вибрирующий платиновый электрод, погруженный непосредственно в реакционную смесь и электрод Кларка, который отделен от реакционной смеси полиэтиленовой мембраной, через которую способен диффундировать молекулярный кислород. Полярографический метод отличается от манометрического тем, что жидкость находится в закрытой системе без газовой фазы.

Поляриметрические методы Многие ферменты действуют только на один из оптических изомеров своих субстратов. Если, как это часто имеет место, продукт реакции оптически неактивен, то за ходом реакции следят по изменению оптического вращения. Подобная ситуация наблюдается и в том случае, когда субстрат оптически неактивен, но в ходе реакции образуется оптически активный продукт или когда и субстрат, и продукт оптически активны, но значительно различаются по величине удельного вращения. Этот метод, хотя и не столь удобный, как другие, все же может быть использован при изучении ряда ферментов, по отношению к которым другие методы неприменимы.

Методы с отбором проб Многие ферментативные реакции изучают, отбирая пробы через определенные промежутки времени и определяя количество субстрата или продукта химическими методами. По этому поводу можно сделать мало каких-либо общих замечаний, так как различные ферменты требуют разных методов определения. Поскольку расщепление гликозидной связи приводит к образованию восстанавливающей группы, при изучении ферментов, действующих на углеводы, широко используются методы, связанные с восстановлением меди.

В ряде случаев, когда другие методы не позволяют получить необходимые данные, образование продукта удается обнаружить с помощью хроматографии. Это, по существу, метод отбора проб: через определенные интервалы времени из реакционной смеси берут пробы, наносят на хроматографическую бумагу, высушивают и проводят хроматографию. Появление и увеличение (в последовательных пробах) размера нового пятна позволяет качественно оценить протекание ферментативной реакции. Если необходимы количественные данные, то пятна вырезают, экстрагируют вещества и определяют их количество подходящим химическим или спектрофотометрическим методом.

ФЕРМЕНТЫ КАК БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ Общая характеристика ферментов Ферменты (энзимы) – это, как правило, высокоспецифичные белки, выполняющие функции биологических катализаторов. В научной литературе на русском языке утвердились оба термина: "ферменты" и "энзимы", но предпочтение отдают термину "фермент", хотя наука о ферментах называется энзимология. Слово "фермент" происходит от лат. fermentium - закваска, а "энзим" - от греч. еп - в, внутри и zуте - дрожжи. Данная терминология возникла исторически при изучении ферментативных процессов спиртового брожения.

В роли биокатализаторов могут выступать и небелковые соединения. Например, некоторые типы РНК вызывают гидролиз фосфодиэфирных связей нуклеиновых кислот. Такие молекулы РНК с каталитической активностью называют рибозимами, однако их значение в химическом превращении соединений намного меньше, чем ферментов. Схематично процесс катализа можно представить следующим уравнением: Е + S ↔ ES ↔ ЕР ↔ Е + Р, где Е - фермент (энзим), S - субстрат, Р – продукт Данные обозначения общеприняты и происходят от английских слов enzyme, substrate, productе.

Общие свойства катализаторов, присущие и ферментам: • Катализаторы сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает и без них. • Они не влияют на итог реакции. • В обратимых реакциях катализаторы ускоряют как прямую, так и обратную, причем в одинаковой степени, из чего следует, что катализаторы: а) не влияют на направленность обратимой реакции, которая определяется только соотношением концентраций исходных веществ и конечных продуктов; б) не влияют на положение равновесия обратимой реакции.

Ферменты обладают особенностями, отличающими их от обычных катализаторов: • Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия). • Высокая эффективность действия. Ферменты могут ускорять реакцию в 10 8 -10 12 раз. • Высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды температуре, р. Н, ионной силе раствора и т. д. • Высокая чувствительность к химическим реагентам. • Высокая и избирательная чувствительность к физико -химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, повышая или снижая его активность.

Особенность ферментативного катализа состоит в том, что фермент специфическим образом связывает субстрат, и все реакции протекают внутри фермент-субстратного комплекса. Область ферментативной молекулы, в которой происходит связывание и превращение субстрата, называется активным центром. Он образуется на уровне третичной структуры белка-фермента из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных, пространственно сближенных, полипептидных цепей. В пределах активного центра различают адсорбционный участок (центр) и каталитический участок (центр)

Рис. Функциональная значимость отдельных участков активного центра фермента (по Северину, 2003)

Каталитический центр - это та область активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется каталитический центр за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. К каталитически активным радикалам белка относятся нуклеофильные группы (имидазол гистидина, оксигруппа серина или тирозина, тиольная группа цистеина, ε-аминогруппа лизина, ионизированные карбоксилы аспарагиновой и глутаминовой кислот и др. ) и электрофилы (ион имидазолия, неионизованные карбоксильные группы, ионы металлов и т. п. ).

Если для проведения реакции достаточно кислотноосновного катализа (гидролитические реакции: гидролиз амидной связи в белках или межнуклеотидной фосфатной связи), то каталитический центр формируется боковыми радикалами аминокислотных остатков белка. В этом случае фермент состоит только из полинуклеотидных цепей. Однако многие вещества могут быть получены только с помощью окислительно-восстановительных реакций или реакций переноса углеродсодержащих групп. Боковые радикалы аминокислотных остатков не могут катализировать такие реакции. В этом случае клетка использует составные ферменты, в которых имеются белковая часть и небелковые (мономерные) соединения, называемые коферментом (простетической группой).

Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. Белковая часть такого фермента называется апоферментом, а активный фермент (комплекс апофермента и кофермента) — холоферментом. В большинстве случаев кофермент связывается с апоферментом нековалентными взаимодействиями. В первичной структуре молекулы фермента группы активного центра обычно удалены друг от друга. Однако в третичной структуре аминокислотные остатки, принимающие участие в катализе, некоторым образом фиксированы (ориентированы) в сближенном состоянии, удобном для «одновременного» их взаимодействия с сорбированной молекулой субстрата.

Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями.

Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошланд положил в основу теории индуцированного соответствия (или наведенного соответствия), которая преодолела ограниченность существовавшей ранее теории «ключа и замка» (жесткого соответствия структуры субстрата структуре адсорбционного центра).

Очевидно, что именно структура адсорбционного центра определяет субстратную специфичность фермента, т. е. требования фермента к молекуле химического вещества, чтобы оно могло стать для него подходящим субстратом. В формировании активного центра принимают участие также молекулы воды, входящие в гидратационные слои, а в ряде случаев ионы металлов, связанные с белком, и органические кофакторы. Определенную жесткость такой конструкции придают α-спирали, β -структуры и дисульфидные мостики.

Рис. Строение активного центра фермента: А - присоединение субстрата в активном центре; Б - положение аминокислотных остатков, формирующих активный центр фермента, в первичной структуре белка; В - активный центр фермента условно разделяется на участок связывания и каталитический участок. Участок связывания представлен радикалами аминокислот, обеспечивающих связывание субстрата. Каталитический участок образован радикалами аминокислотных остатков, функциональные группы которых обеспечивают химическое превращение субстрата

Следовательно, структурные особенности поверхностного слоя белковых глобул позволяют сосредоточить в активном центре большое число различных по химической природе функциональных групп, способных не только сорбировать субстрат на ферменте, но взаимодействовать с ним также и химически. Изучение структуры ферментов показало, что часто активный центр помещается в стандартно расположенной вмятине в архитектуре белковой глобулы, что автоматически способствует окружению субстрата одновременно многими боковыми цепями белка. При этом место расположения активного центра определяется не боковыми группами белковой молекулы, а мотивом укладки полипептидной цепи ("folding pattern").

Консервативные мотивы - важные особенности первичной структуры: устойчивые сочетания аминокислотных остатков, выполняющие определённую функцию и встречающиеся во многих белках. Они сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. Кроме этого, столь же обычным местом активного центра является место стыка доменов. Положение активного центра обусловливает формирование особой среды, отличающейся от той, что окружает молекулы в растворе (клетке). Среда активного центра отличается, как правило, сильно развитой микрогетерогенностью. Это связано с тем, что в образовании поверхностного слоя белка принимают участие не только заряженные и полярные аминокислотные остатки, но также частично и аполярные (углеводородные) боковые группы.

В поверхностный слой прочно встроены также и молекулы воды. Поверхностный слой белковой глобулы характеризуется повышенной микровязкостью. Эффекты повышенной микровязкости особенно сильно развиты в области активного центра. Здесь полипептидные цепи белка расположены настолько жестко, что затрудняют не только поступательную диффузию в глобулу, но также и вращательное движение связанной молекулы. Вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр.

Аллостерическими центрами называют такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит обратимо) с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами или аллостерическими ингибиторами данного фермента. Термин "аллостерический" (т. е. "имеющий иную пространственную структуру") появился в связи с тем, что эти эффекторы по своей пространственной конфигурации совсем не похожи на молекулу субстрата данного фермента, а потому не могут связываться с активным центром фермента. Было сделано заключение, что и аллостерический центр не похож по своей структуре на активный центр фермента.

Аллостерические центры найдены не у всех ферментов. Они есть у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ. Некоторые искусственно синтезированные лекарства обладают биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.

Специфичность ферментов Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость фермента и субстрата. Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия.

Абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата, к которому комплементарен активный центр. Пример - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина:

Групповая субстратная специфичность – это способность большинства ферментов катализировать однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Фермент гидролизует эфирную связь у αатомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира:

Стереоспецифичность. При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам. Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к Dстереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.

Стереоспецифичность к L-аминокислотам. Белки человека состоят из аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение аминокислот, имеет стереоспецифичность к L-аминокислотам. Стереоспецифичность к цис-транс-изомерам. Фермент фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы. Исключение составляют только ферменты эпимеразы (рацемазы), катализирующие превращение оптических изомеров.

Стереоспецифичность к α- и β-гликозидным связям. Фермент амилаза действует только на α-гликозидные связи, что позволяет гидролизовать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.

Каталитическая специфичность – это способность фермента катализировать превращение присоединенного субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6 -фосфата в клетках печени человека субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6 -фосфатазы, фосфоглюкоизомеразы и глюкозо-6 -фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов

Рис. Различные пути превращения молекулы глюкозо-6 -фосфата в клетках печени человека

Специфичность действия - это способность фермента катализировать только определенный тип химической реакции. В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.

I класс - оксидоредуктазы К данному классу относятся ферменты, катализирующие окислительновосстановительные реакции. При окислении может происходить либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу. В зависимости от способа окисления различают следующие подклассы оксидоредуктаз: а) дегидрогеназы катализируют реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа, изоцитратдегидрогеназа, сукцинатдегидрогеназа, αкетобутиратдегидрогеназа и др.

Например, реакция, катализируемая малатдегидрогеназой: б) оксидазы катализируют реакции окисления с участием молекулярного кислорода. Например, реакция, катализируемая ферментом цитохромоксидазой:

в) оксигеназы катализируют включение кислорода в окисляемое вещество: монооксигеназы - включают один атом кислорода в окисляемое вещество; диоксигеназы - включают 2 атома кислорода в окисляемое вещество. Часто это сопровождается разрывом циклической структуры. По месту разрыва связи присоединяются атомы кислорода. Например, реакция гидроксилирования фенилаланина, где коферментами реакции являются тетрагидробиоптерин (Н 4 БП) и дигидробиоптерин (Н 2 БП):

II класс - трансферазы Катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества. В зависимости от переносимой группы подразделяются на подклассы: аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы). III класс - гидролазы Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Разделяются на подклассы в зависимости от субстрата. Названия образуются в зависимости от молекулы субстрата или конкретной гидролизуемой химической связи: протеазы, амилазы, гликозидазы, нуклеазы, эстеразы, фосфатазы и др.

Пример: реакции гидролиза молекулы белка: IV класс - лиазы Катализируют реакции отщепления от субстратов негидролитическим путем определенных групп, таких, как СО 2, Н 2 О, NH 2, SH 2 и др. , или присоединение (например, молекулы воды) по двойной связи.
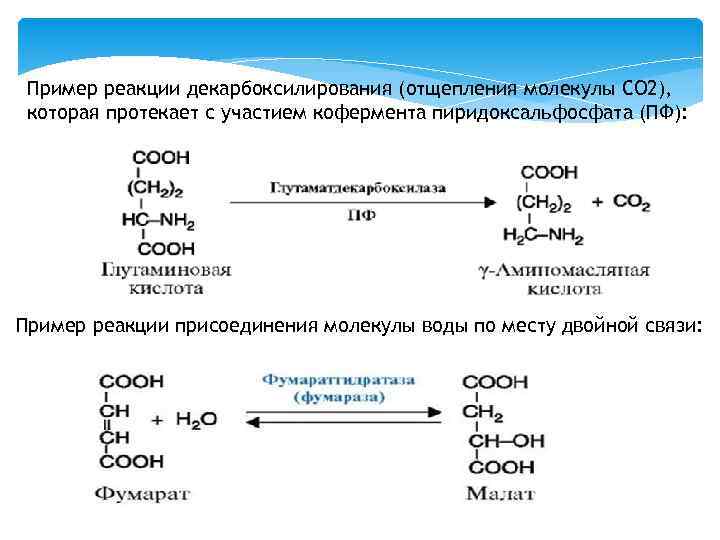
Пример реакции декарбоксилирования (отщепления молекулы CO 2), которая протекает с участием кофермента пиридоксальфосфата (ПФ): Пример реакции присоединения молекулы воды по месту двойной связи:

V класс - изомеразы Катализируют реакции различных внутримолекулярных превращений. Например, реакция, катализируемая ферментом фосфоглюкоизомеразой:

VI класс - лигазы (синтазы, синтетазы) Катализируют реакции усложнения молекулы за счет присоединения друг к другу двух молекул с образованием ковалентной связи; при этом используется энергия АТФ или других макроэргических соединений реакции синтеза. Например, реакция, катализируемая ферментом глутаминсинтетазой:

Каталитическая эффективность Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 10 8 -10 14 раз быстрее, чем некатализируемые реакции. Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт. Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессе реакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярной активностью (молярная каталитическая активность выражается в каталах на 1 гмоль фермента). Например, одна молекула каталазы эритроцитов способна расщепить в 1 с 44000 молекул пероксида водорода.

Лабильность ферментов Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от его конформации, и в частности, от конформации активного центра. Для ферментов характерна конформационная лабильность - способность к небольшим изменениям нативной конформации вследствие разрыва слабых связей. Поэтому воздействие денатурирующих агентов, способных изменять конформацию молекулы фермента, приводит к изменению конформации активного центра и снижению способности присоединять субстрат. В результате этого уменьшается каталитическая эффективность фермента.

Способность ферментов к регуляции Активность ферментов в клетке зависит от количества молекул субстрата, продукта, наличия кофакторов и коферментов. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной реакции является субстратом другой, образуя таким образом "метаболические пути". Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные, ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути. Регуляторные ферменты расположены, как правило, в начале и/или в месте разветвления метаболического пути. Они катализируют либо самые медленные (скоростьлимитирующие реакции), либо необратимые реакции.

КОФАКТОРЫ ФЕРМЕНТОВ Ионы металлов как кофакторы Большинство ферментов для проявления ферментативной активности нуждается в ионах металлов (кофакторах) и/или низкомолекулярных органических соединениях небелковой природы (коферментах). Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Роль металлов в присоединении субстрата в активном центре фермента Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.

Ионы металлов - стабилизаторы молекулы субстрата. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ATФ. В этом случае ион Mg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента:

Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла. В качестве примера можно привести расположение субстратов в активном центре гексокиназы, которая катализирует перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6 -фосфата.

Рис. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg 2+-АТФ. В результате ферментативной реакции происходит перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6 -фосфата

Ионы металла - стабилизаторы активного центра фермента. В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом и выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные функции выполняют такие металлы, как Mg 2+, Mn 2+, Zn 2+, Co 2+, Мо 2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом: E-Me-S

К металлоэнзимам относят, например, пируваткиназу, катализирующую реакцию: Рис. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоенолпирувата и АДФ. Мg 2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоенолпирувата. В ходе реакции образуется пируват и АТФ

Роль металлов в стабилизации третичной и четвертичной структуры фермента. Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях р. Н, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.

Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К+. Для стабилизации четвертичной структуры алкогольдегидрогеназы, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 к. Д. В состав фермента входят 4 атома Zn 2+. Удаление Zn 2+ приводит к потере активности фермента за счёт диссоциации Рис. Роль ионов цинка в стабилизации на 4 неактивные субъ- четвертичной структуры алкогольединицы с молекулярной дегидрогеназы массой 36 к. Д

Роль металлов в ферментативном катализе Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа. Участие в электрофильном катализе. Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn 2+, Fe 2+, Mn 2+, Cu 2+. Ионы щелочноземельных металлов, такие как Na+ и К+, не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза цинксодержащий фермент, катализирующий реакцию образования угольной кислоты: СО + H 2 O ↔ H 2 CO 3.

Ион Zn 2+ в результате электрофильной атаки участвует в образовании Н+ и ОН- ионов из молекулы воды: Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты: В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.

Участие в окислительно-восстановительных реакциях. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон: Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.

Другой пример участия ионов металлов в окислительновосстановительных реакциях работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С: За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди. Фермент, содержащий ион Сu 2+, не вступает в реакцию с молекулой кислорода. При восстановлении Сu 2+ до Сu+ с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.

Роль металлов в регуляции активности ферментов Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са 2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков. Ионы Са 2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов.

Коферменты - кофакторы органической природы Большинству ферментов для проявления каталитической активности необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов.

Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только во время химической реакции и может рассматриваться в качестве второго субстрата. Примеры NAD+, NADP+.

Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот. Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.

К коферментам относят следующие соединения: • производные витаминов; • гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов; • нуклеотиды - доноры и акцепторы остатка фосфорной кислоты; • убихинон, или кофермент Q, участвующий в переносе электронов и протонов в электронтранспортной цепи (ЭТЦ); • фосфоаденозилфосфосульфат, участвующий в переносе сульфата; • S-аденозилметионин (SAM) - донор метильной группы; • глутатион, участвующий в окислительновосстановительных реакциях.

Мультисубстратные реакции Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае, если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент. В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму "пинг-понг" (механизму двойного замещения) или последовательному механизму.
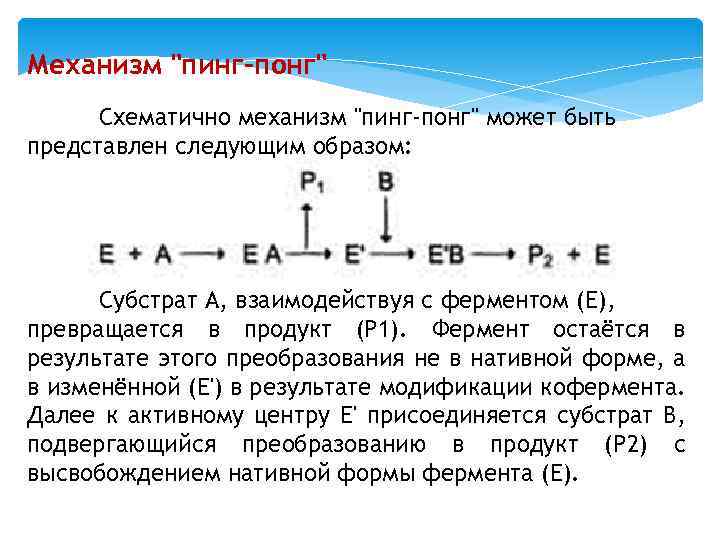
Механизм "пинг-понг" Схематично механизм "пинг-понг" может быть представлен следующим образом: Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р 1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р 2) с высвобождением нативной формы фермента (Е).

Хороший пример механизма "пинг-понг" - реакции трансаминирования с участием ферментов аминотрансфераз (кофермент пиридоксальфосфат). Аминотрансферазы, открытые отечественным учёным А. Е. Браунштейном, катализируют обратимые реакции переноса аминогруппы с аминокислоты на кетокислоту.

Рис. События в активном центре аминотрансферазы как пример механизма "пингпонг". Кофермент пиридоксальфосфат (ПФ), связанный с ферментом, принимает αаминогруппу от первой аминокислоты (АК 1), которая при этом превращается в α-кетокислоту 1 (КК 1) и высвобождается из активного центра фермента. Далее в активный центр фермента присоединяется αкетокислота 2 (КК 2), которая забирает аминогруппу от кофермента и превращается в α-аминокислоту (АК 2)

Другой пример механизма "пинг-понг" - реакции дегидрирования с участием кофермента FAD (флавинадениндинуклеотид) или FMN (флавинмононуклеотид), которые прочно связаны с ферментом и, следовательно, не могут рассматриваться в качестве второго субстрата. Схему реакции дегидрирования (как пример механизма "пинг-понг" с участием коферментов FMN и FAD) можно представить в следующем виде: Рис. АН 2 - донор водорода, окисляемый субстрат 1; А - окисленная форма субстрата 1; В - акцептор водорода - субстрат 2; ВН 2 - восстановленная форма субстрата 2; Е (FAD), Е (FADH 2) - окисленная и восстановленная формы кофермента FAD, входящего в состав фермента Е.

В качестве примера FAD-зависимой реакции можно привести сукцинатдегидрогеназную реакцию. В этой реакции в качестве второго субстрата участвует убихинон - один из посредников ЭТЦ:

Последовательный механизм В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями: Механизм упорядоченного взаимодействия субстрата с активным центром фермента: Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.

Механизм случайного взаимодействия субстрата с активным центром фермента: Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.

Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NAD+, NADP+. Оба кофермента функционируют как посредники переноса двух электронов и одного протона (гидрид-иона) от донора к акцептору, другого протона - в среду. При этом, донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакция

Такие реакции называют сопряжёнными: Рис. АН 2 - донор водорода, восстановленная форма субстрата 1; А - окисленная форма субстрата 1; В - акцептор водорода - второй субстрат; ВН 2 - восстановленная форма субстрата 2; NAD+, NADH окисленная и восстановленная формы кофермента; Е, и Е 2 ферменты. Две ферментативные реакции, катализируемые ферментами Е 1 и Е 2, сопряжены друг с другом посредством кофермента NAD, служащего в каждом из этих случаев субстратом. Для первого фермента (Е 1) субстратом служит окисленная форма NAD (NAD+), в качестве второго субстрата выступает донор водорода (АН 2), при этом в качестве продукта реакции образуется восстановленная форма NAD (NADН + Н+). Для второго фермента (Е 2) все наоборот.

МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ Энергетические изменения при химических реакциях Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения энергии и закону энтропии. Согласно этим законам, общая энергия химической системы и её окружения остаётся постоянной, при этом химическая система стремится к снижению упорядоченности (увеличению энтропии). Для понимания энергетики химической реакции недостаточно знать энергетический баланс входящих и выходящих из реакции реагентов, необходимо учитывать изменения энергии в процессе данной химической реакции и роль ферментов в динамике этого процесса.

Химическая реакция пойдёт при обычных условиях, если реагирующие молекулы имеют энергию, превышающую определённый уровень, называемый энергией активации Еа Рис. Изменение свободной энергии при разложении угольной кислоты

Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию. При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Молекулы, обладающие Еа, находятся в переходном состоянии. Разницу энергий между исходным реагентом и конечными соединениями называют изменением свободной энергии реакции ΔG. Молекулы Н 2 О и СО 2 - более стабильные вещества, чем Н 2 СО 3, т. е. обладают меньшей энергией и при обычных условиях практически не реагируют. Выделившаяся энергия в результате этой реакции рассеивается в виде тепла в окружающую среду.

Чем больше молекул обладает энергией, превышающей уровень Еа, тем выше скорость химической реакции. Повысить скорость химической реакции можно нагреванием. При этом увеличивается энергия реагирующих молекул. Однако для живых организмов высокие температуры губительны, поэтому в клетке для ускорения химических реакций используются ферменты. Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путем понижения уровня Еа. Таким образом, ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции.
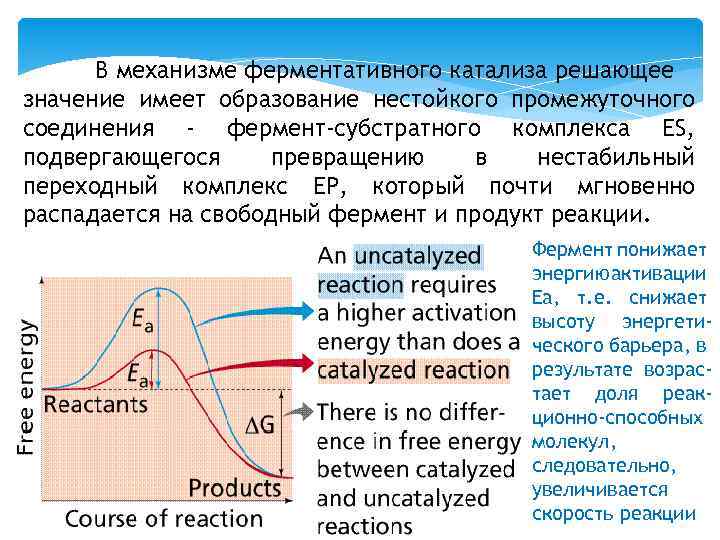
В механизме ферментативного катализа решающее значение имеет образование нестойкого промежуточного соединения - фермент-субстратного комплекса ES, подвергающегося превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции. Фермент понижает энергию активации Еа, т. е. снижает высоту энергетического барьера, в результате возрастает доля реакционно-способных молекул, следовательно, увеличивается скорость реакции

Биологические катализаторы (ферменты) не изменяют свободную энергию субстратов и продуктов и поэтому не меняют равновесие реакции Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов. Сходство ферментов с небиологическими катализаторами заключается в том, что: • ферменты катализируют энергетически возможные реакции; • энергия химической системы остаётся постоянной; • в ходе катализа направление реакции не изменяется; • ферменты не расходуются в процессе реакции.

Отличия ферментов от небиологических катализаторов заключаются в том, что: • скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами; • ферменты обладают высокой специфичностью; • ферментативная реакция проходит в клетке, т. е. при температуре около 37 °С, постоянном атмосферном давлении и физиологическом значении р. Н; • скорость ферментативной реакции может регулироваться.


лекция Ферментативный катализ (2).pptx