 Ферментативный катализ
Ферментативный катализ
 • 1897 г. – Эдвард Бухнер экстрагировал из дрожжевых клеток набор ферментов, ответственных за спиртовое брожение. • Нач. ХХ в. - Эмиль Фишер провел первые систематические исследования ферментов. • 1902 г. – Браун указал на важность стадии образования комплекса фермент-субстрат. • 1903 г. – разработка теории ферментативного катализа Виктором Генри. • 1903 г. – изучение и математическое описание хода реакции с участием ферментов (Михаэлис и Ментен).
• 1897 г. – Эдвард Бухнер экстрагировал из дрожжевых клеток набор ферментов, ответственных за спиртовое брожение. • Нач. ХХ в. - Эмиль Фишер провел первые систематические исследования ферментов. • 1902 г. – Браун указал на важность стадии образования комплекса фермент-субстрат. • 1903 г. – разработка теории ферментативного катализа Виктором Генри. • 1903 г. – изучение и математическое описание хода реакции с участием ферментов (Михаэлис и Ментен).
 Кофакторы
Кофакторы
 Простетическая группа – небелковая часть фермента, образующая прочную связь с белком. Голофермент – весь каталитически активный фермент вместе с коферментом или ионом металла. Апофермент – белковая часть фермента. Денатурирует при нагревании.
Простетическая группа – небелковая часть фермента, образующая прочную связь с белком. Голофермент – весь каталитически активный фермент вместе с коферментом или ионом металла. Апофермент – белковая часть фермента. Денатурирует при нагревании.
 Примеры: Без катализатора С добавлением фермента 32 ккал/моль 2, 4 ккал/моль Разложение Н 2 О 2 18 ккал/моль 1, 5 ккал/моль Реакция Гидролиз сахарозы
Примеры: Без катализатора С добавлением фермента 32 ккал/моль 2, 4 ккал/моль Разложение Н 2 О 2 18 ккал/моль 1, 5 ккал/моль Реакция Гидролиз сахарозы
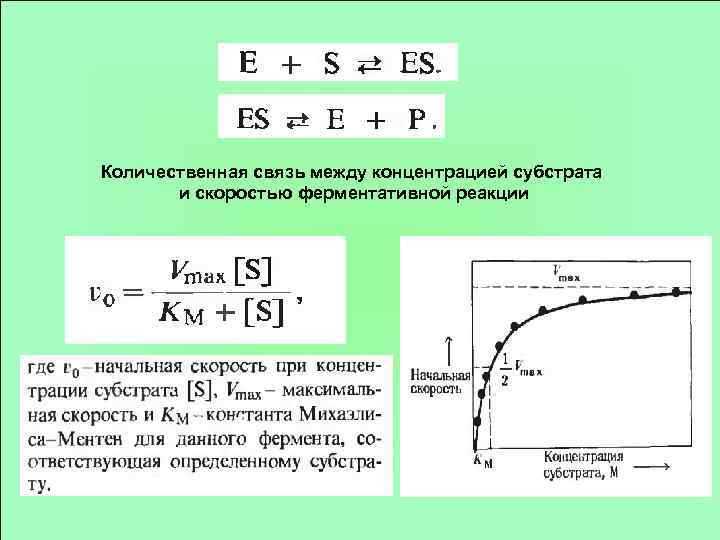 Количественная связь между концентрацией субстрата и скоростью ферментативной реакции
Количественная связь между концентрацией субстрата и скоростью ферментативной реакции
 Км - концентрация специфического субстрата, при которой данный фермент обеспечивает скорость реакции, равной половине ее максимальной скорости.
Км - концентрация специфического субстрата, при которой данный фермент обеспечивает скорость реакции, равной половине ее максимальной скорости.
![[Et] – [ES] – общая концентрация фермента (суммарное количество свободного и связанного фермента) концентрация [Et] – [ES] – общая концентрация фермента (суммарное количество свободного и связанного фермента) концентрация](https://present5.com/presentation/3/28685970_173347516.pdf-img/28685970_173347516.pdf-13.jpg) [Et] – [ES] – общая концентрация фермента (суммарное количество свободного и связанного фермента) концентрация фермент-субстратного комплекса [Et]-[ES] – концентрация несвязанного фермента
[Et] – [ES] – общая концентрация фермента (суммарное количество свободного и связанного фермента) концентрация фермент-субстратного комплекса [Et]-[ES] – концентрация несвязанного фермента
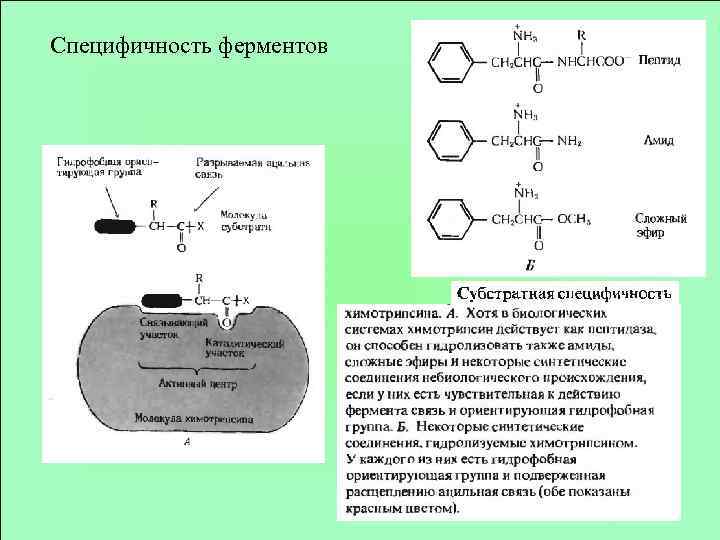 Специфичность ферментов
Специфичность ферментов
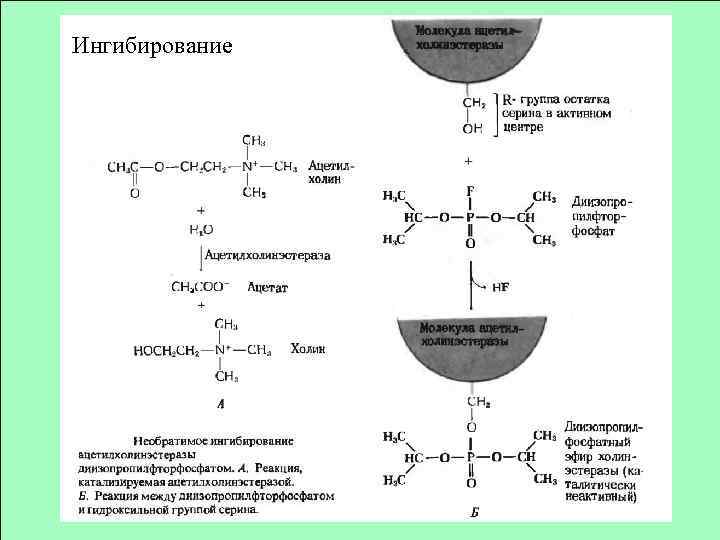 Ингибирование
Ингибирование
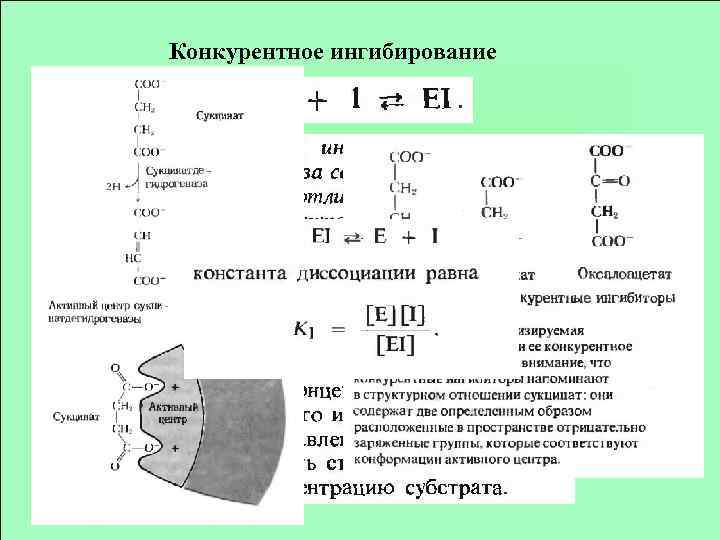 Конкурентное ингибирование
Конкурентное ингибирование
 Неконкурентное ингибирование Связывание идет не в активном центре
Неконкурентное ингибирование Связывание идет не в активном центре
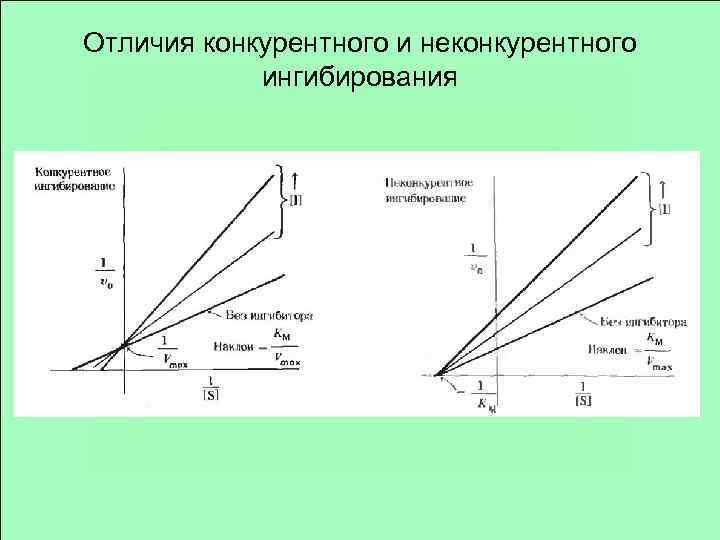 Отличия конкурентного и неконкурентного ингибирования
Отличия конкурентного и неконкурентного ингибирования
 Факторы, определяющие каталитическую способность фермента
Факторы, определяющие каталитическую способность фермента
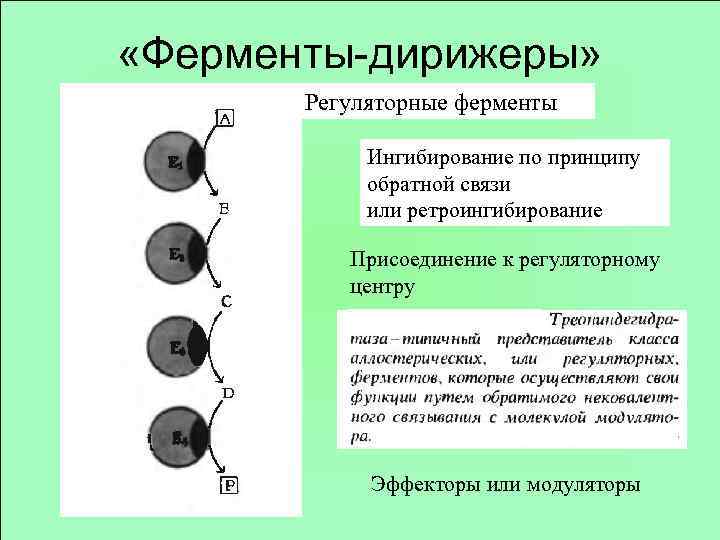 «Ферменты-дирижеры» Регуляторные ферменты Ингибирование по принципу обратной связи или ретроингибирование Присоединение к регуляторному центру Эффекторы или модуляторы
«Ферменты-дирижеры» Регуляторные ферменты Ингибирование по принципу обратной связи или ретроингибирование Присоединение к регуляторному центру Эффекторы или модуляторы
 1. А. Ленинджер «Основы биохимии» 2. Э. Корниш-Боуден «Основы ферментативной кинетики» 3. Г. Дюга, К. Пенни «Биоорганическая химия» 4. Я. Кольман, К. - Г. Рем «Наглядная БИОХИМИЯ»
1. А. Ленинджер «Основы биохимии» 2. Э. Корниш-Боуден «Основы ферментативной кинетики» 3. Г. Дюга, К. Пенни «Биоорганическая химия» 4. Я. Кольман, К. - Г. Рем «Наглядная БИОХИМИЯ»