lecture_3_enzime_substrate.pptx
- Количество слайдов: 19

Фермент-субстратний комплекс • Загальні уявлення про ферментсубстратний комплекс; • Механізм сорбції; • Міцність комплексів фермент-ліганд (оцінка вільної енергії сорбції)
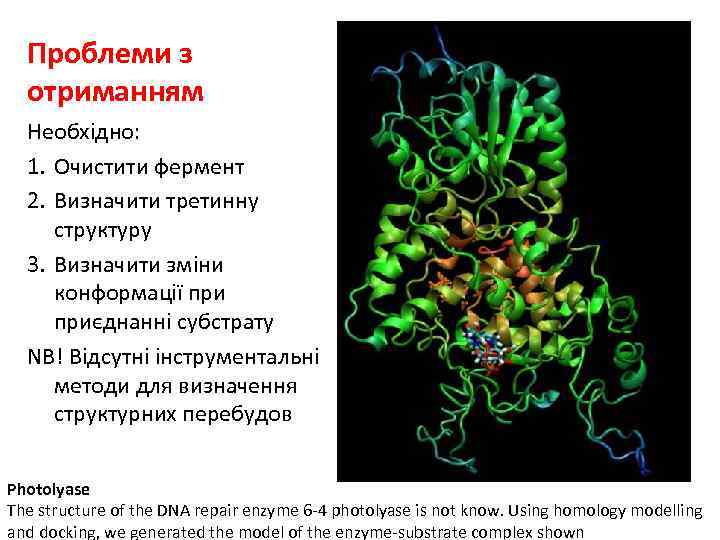
Проблеми з отриманням Необхідно: 1. Очистити фермент 2. Визначити третинну структуру 3. Визначити зміни конформації приєднанні субстрату NB! Відсутні інструментальні методи для визначення структурних перебудов Photolyase The structure of the DNA repair enzyme 6 -4 photolyase is not know. Using homology modelling and docking, we generated the model of the enzyme-substrate complex shown
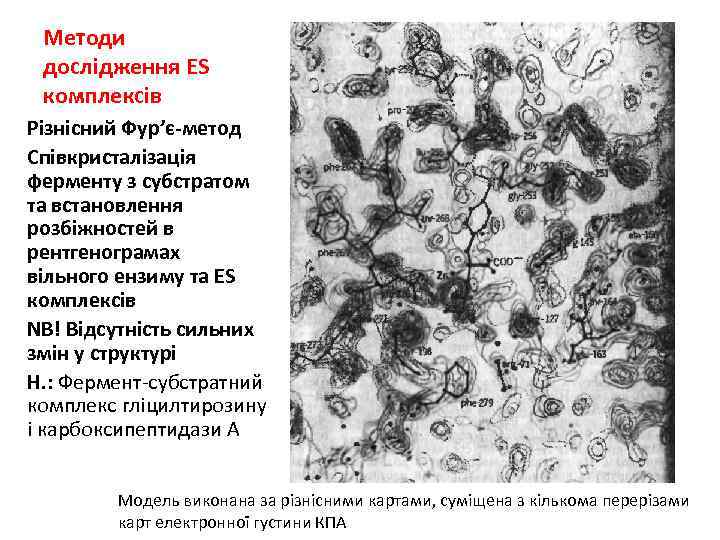
Методи дослідження ES комплексів Різнісний Фур’є-метод Співкристалізація ферменту з субстратом та встановлення розбіжностей в рентгенограмах вільного ензиму та ES комплексів NB! Відсутність сильних змін у структурі Н. : Фермент-субстратний комплекс гліцилтирозину і карбоксипептидази А Модель виконана за різнісними картами, суміщена з кількома перерізами карт електронної густини КПА
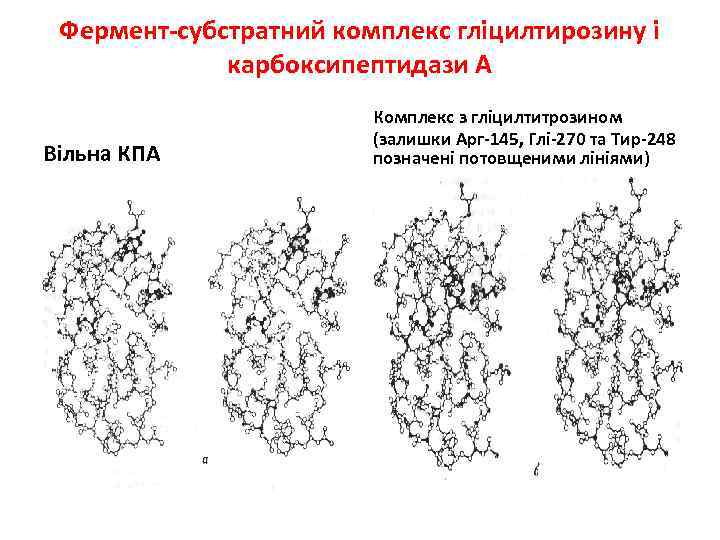
Фермент-субстратний комплекс гліцилтирозину і карбоксипептидази А Вільна КПА Комплекс з гліцилтитрозином (залишки Арг-145, Глі-270 та Тир-248 позначені потовщеними лініями)
Методи дослідження ES комплексів Отримання стабільних комплексів: Використання квазісубстратів – подібних за структурою до молекул субстратів (конкурентних інгібіторів) Н. : α-хімотрипсин (паранітрофенілацетат і інші інгібітори) рибонуклеаза (фосфонат замість фосфату) Використання повільно реагуючих субстратів при р. Н, що інактивують реакцйні групи в активному центрі, низьких температурах чи при використанні хімічно модифікованого ферменту Н. : лізоцим (відновлення Асп-52) Використання радіоізотопів Н. : фосфоглюкомутаза (використали мічений Глю-1 -Ф, довели наявність фосфосерину в активному центрі)
Механізми, які відіграють головну роль при утворенні комплексу ферментсубстрат в воді • утворення ковалентних зв'язків; • гідрофобні взаємодії між аполярними (вуглеводневими) фрагментами субстратної молекули й дегідратированими (хоча б частково) областями поверхневого шару глобули; • електростатичні взаємодії між зарядженими групами субстрату й іонізованими амінокислотними залишками поліпептидних ланцюгів; • утворення водневих зв'язків.

Багатоточковий характер комплексоутворення • Утворенню досить міцних «багатоточкових» (хелатних) комплексів сприяє те, що поліпептидні ланцюги білка й особливо бічні групи амінокислотних залишків, що перебувають у поверхневому шарі, не зафіксовані занадто жорстко й мають певну рухливість (гнучкість). • У результаті забезпечується можливість просторового настроювання окремих сорбційних ділянок глобули на відповідні (зв'язані ними) фрагменти сорбованої молекули. Іншими словами, сорбційна ділянка глобули, у принципі, здатна прийняти конфігурацію, трохи відмінну від рівноважної ( тобто термодинамічно стійкої під час відсутності ліганду), щоб забезпечити найбільший контакт ферменту з лігандом.

Багатоточковий характер комплексоутворення • Не менш важливу роль у комплексоутворенні відіграє також і підвищена мікров'язкість у поверхневому шарі. Підвищена мікров'язкість обумовлена тим, що рухливість поліпептидних ланцюгів загальмована. Якби це було не так, то ентропійні втрати при утворенні складного комплексу фермент-органічний ліганд могли б стати настільки великими, що утворення його був би неефективним. • Багатоточковий характер комплексоутворення в комбінації з ефектом підвищеної мікров'язкості приводить практично до повної втрати дифузійної рухливості органічного ліганду.
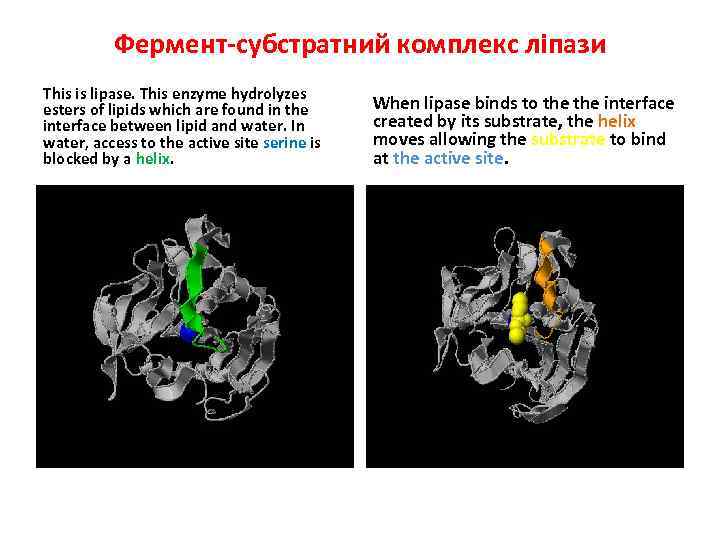
Фермент-субстратний комплекс ліпази This is lipase. This enzyme hydrolyzes esters of lipids which are found in the interface between lipid and water. In water, access to the active site serine is blocked by a helix. When lipase binds to the interface created by its substrate, the helix moves allowing the substrate to bind at the active site.
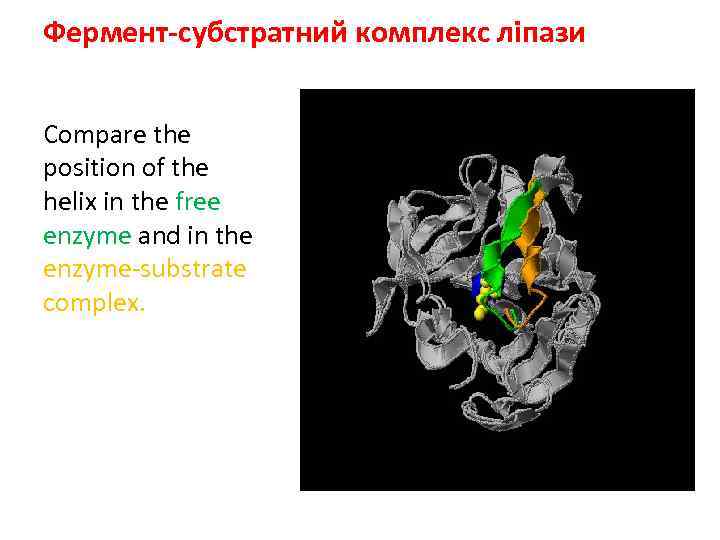
Фермент-субстратний комплекс ліпази Compare the position of the helix in the free enzyme and in the enzyme-substrate complex.
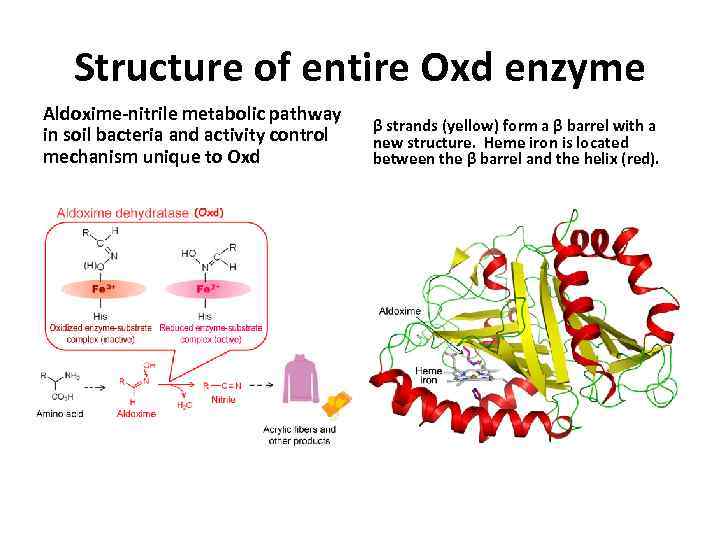
Structure of entire Oxd enzyme Aldoxime-nitrile metabolic pathway in soil bacteria and activity control mechanism unique to Oxd β strands (yellow) form a β barrel with a new structure. Heme iron is located between the β barrel and the helix (red).
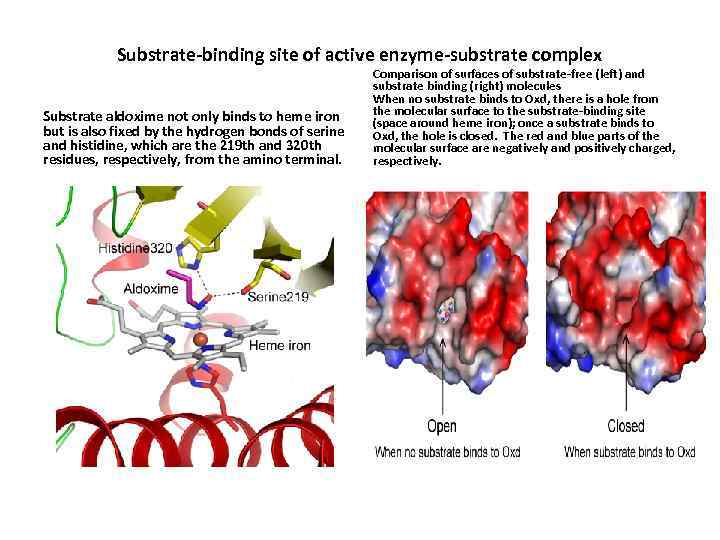
Substrate-binding site of active enzyme-substrate complex Substrate aldoxime not only binds to heme iron but is also fixed by the hydrogen bonds of serine and histidine, which are the 219 th and 320 th residues, respectively, from the amino terminal. Comparison of surfaces of substrate-free (left) and substrate binding (right) molecules When no substrate binds to Oxd, there is a hole from the molecular surface to the substrate-binding site (space around heme iron); once a substrate binds to Oxd, the hole is closed. The red and blue parts of the molecular surface are negatively and positively charged, respectively.

Міцність комплексів фермент-ліганд Е + L <==> E*L (1) - сорбція ліганду на ферменті ΔGасоц = - RTln. Kасоц 1 етап - зближення молекул, яке включає зупинку ліганду L проти центру сорбції ферменту E з одночасним «заморожуванням» обертання й деяких коливальних ступенів свободи. 2 етап - власне сорбції, який у рамках даної моделі умовно можна розглядати як «внутрішньомолекулярний» процес утворення зв'язку ΔGасоц = ΔGзближ + ΔGвнутр. E*L (2) ΔG зближ - втрата ентропії молекули, що зв'язується ; Ентропію зближення (ΔSзближ) просто оцінити для комплексоутворення твердої сферичної молекули з білком -TΔSзближ ∼ 3 -5 ккал/моль (12, 6 - 21 к. Дж/моль) або ~ 30 ккал/моль (126 к. Дж/моль) ( при втраті внутрішніх обертальних ступенів свободи) -TΔ Sзближ ~ 4 - 6 ккал/моль - втрата ентропії при включенні в комплекс молекул води Експериментально комплексоутворення амінокислотного субстрату з ферментом характеризується величиною ΔGзближ ~ 2 - 4 ккал/моль (8, 4 - 16, 8 к. Дж/моль)

ΔGвнутр. E*L – гідрофобні взаємодії При наявності одного типу взаємодії між Е та S утворення комплексу білок-органічний ліганд, що виникає в результаті гідрофобних взаємодій, можна розглядати фактично як термодинамічно вигідний переніс аполярної молекули (або її фрагмента) з води в органічну фазу білка.

ΔGвнутр. E*L Екстракційна модель - порівнюємо вільну енергію комплексоутворення (ΔGасоц): E + R - L <==> E*R - L (3) з вільною енергією модельного процесу перенесення (екстракції) молекули ліганду (або її фрагмента R) з води в органічний розчинник ΔGекстр або, відповідно, ΔGекстр. R: (R-L)у воді <==> (R-L)в орг р-ку (R-)у воді <==> (R-)в орг р-ку (4)
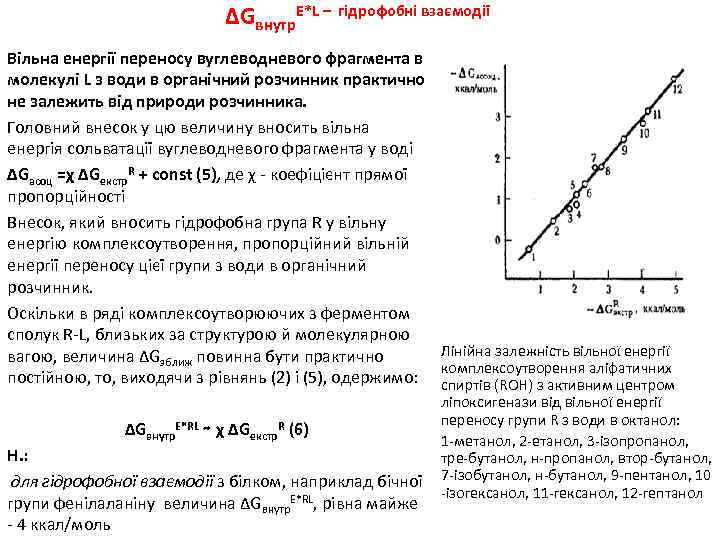
ΔGвнутр. E*L – гідрофобні взаємодії Вільна енергії переносу вуглеводневого фрагмента в молекулі L з води в органічний розчинник практично не залежить від природи розчинника. Головний внесок у цю величину вносить вільна енергія сольватації вуглеводневого фрагмента у воді ΔGасоц =χ ΔGекстр. R + const (5), де χ - коефіцієнт прямої пропорційності Внесок, який вносить гідрофобна група R у вільну енергію комплексоутворення, пропорційний вільній енергії переносу цієї групи з води в органічний розчинник. Оскільки в ряді комплексоутворюючих з ферментом сполук R-L, близьких за структурою й молекулярною вагою, величина ΔGзближ повинна бути практично постійною, то, виходячи з рівнянь (2) і (5), одержимо: ΔGвнутр. E*RL ∼ χ ΔGекстр. R (6) Н. : для гідрофобної взаємодії з білком, наприклад бічної групи фенілаланіну величина ΔGвнутр. E*RL, рівна майже - 4 ккал/моль Лінійна залежність вільної енергії комплексоутворення аліфатичних спиртів (ROH) з активним центром ліпоксигенази від вільної енергії переносу групи R з води в октанол: 1 -метанол, 2 -етанол, 3 -ізопропанол, тре-бутанол, н-пропанол, втор-бутанол, 7 -ізобутанол, н-бутанол, 9 -пентанол, 10 -ізогексанол, 11 -гексанол, 12 -гептанол

ΔGвнутр. E*RL ∼ χ ΔGекстр. R x < 1, субстратна група R, очевидно, або «занурюється» (переноситься з води) в органічне середовище білка не повністю, або зв'язування її вимагає термодинамічно невигідних витрат на конформаційну зміну структури того або іншого реагенту. Н. : 0, 3 у каталізі β-галактозидазою x > 1, активний центр повинен містити локальну ділянку з відносно невигідною поверхневою енергією поверхневого шару білок-розчинник; наприклад, з гідрофобними бічними групами поліпептидних ланцюгів, що контактують із водою. У результаті взаємодії із субстратом глобула може утворювати нову, термодинамічно більш сприятливу конформацію. Н. : α-хімотрипсин, для якого α = 2.

Інші види взаємодій • Величину електростатичної взаємодії між зарядами в поверхневому шарі білка й іонними формами ліганду можна оцінити, враховуючи закон Кулона. Обмежимося наближенням, при якому розглядається притягування двох одиничних різнойменних точкових зарядів, розташованих на відстані 10 Å друг від друга. Потенційна енергія такої взаємодії сильно залежить від діелектричної проникності середовища ε. Якщо в гідратованому поверхневому шарі ( при ε = 80, як у воді) ΔGвнутр. E*RL становить усього - 0, 5 ккал/моль, то в умовах з низькою діелектричною проникністю (ε < 10, що спостерігається в гідрофобних ділянках глобули) величина ΔGвнутр. E*RL повинна приймати значення - (5 -10) ккал/моль. • Не менш істотний внесок у комплексоутворення Е*L може внести й утворення водневого зв'язку між Е і L. В аполярному (неводному) середовищу ентальпія утворення водневого зв'язку приймає досить високі значення: -(4 - 8) ккал/моль.

Висновок Сили взаємодії між поверхневим шаром ферментної глобули й органічною молекулою або іонами цілком можуть перекрити (особливо при багатоточковій взаємодії Е-L) ентропійні втрати, обумовлені необхідним зближенням комплексоутворюючих агентів (ΔGзближ). Н. : комплексоутворення низькомолекулярних лігандів з білками характеризується досить високими значеннями констант асоціації порядку 102 -105 л/моль, що відповідає величині ΔGасоц рівній приблизно - (3 -7) ккал/моль або -(12, 6 -29, 4) к. Дж/моль.
lecture_3_enzime_substrate.pptx