Лекция_06_Сера+Азот.ppt
- Количество слайдов: 24

ФБГОУ ВПО «Калининградский государственный технический университет» ЦИКЛЫ СОЕДИНЕНИЙ СЕРЫ И АЗОТА Специальность «Экология и природопользование» Курс «Геоэкология»

Загрязнение окружающей среды Пиролиз – реакция, когда разрушение веществ происходит в результате нагревания. полное сгорание СН + О 2 СО 2 + Н 2 О неполное сгорание СН + примеси + О 2 + N 2 Sx. Ox + Nx. Ox + ЛОС – летучие органические соединения, являющиеся остатками органического топлива 2

Виды соединений серы в атмосфере Земли: Двуокись серы – SO 2 Трехокись серы – SO 3 Оксисульфид углерода – COS Сероуглерод – CS 2 Сероводород – H 2 S Диметилсульфид – (CH 3)2 S Сульфат-ион – SO 423

Источники соединений серы: Естественные источники эмиссии серы в атмосферу: I. Биологическое выделение. II. Вулканическая деятельность. III. Поверхность океанов. 4

Биологическое выделение серы: <30 -40 млн. т/год (1/3 общего количества серы) Биологические превращения в почвенных и водных экосистемах (около 50% серы в атмосфере). В результате микробиологических процессов в этих экосистемах сера улетучивается в форме сероводорода (H 2 S). Микроорганизмы продуцируют сероводород двумя путями: 1. 2. восстановление сульфатов (Desulfovibrio и родственные им бактерии населяют болота, топи и слабо дренированные почвы), разложение серосодержащего органического вещества (аэробы, термофилы, психрофилы, бактерии, актиномицеты, грибы. Поверхность и глубинные слои моря. 5

Вулканическая деятельность: около 2 млн. т/год серосодержащих соединений Выбросы при извержении вулкана: большое количество двуокиси серы SO 2, сероводород, сульфаты и элементарная сера. Поступают в тропосферу – количество серы незначительно по сравнению с биологическим выделением. При сильных извержениях – увеличение концентрации соединений серы в стратосфере; самый важный источник. 6

Поверхность океанов: от 50 до 200 млн. т/год серы После испарения капель воды, поступающих в атмосферу с поверхности океанов, остаётся морская соль, содержащая соединения серы – сульфаты. Ежегодное поступление серы с частичками морской соли гораздо больше, чем эмиссия естественным путём. Частицы соли быстро выпадают из атмосферы и только ничтожная часть серы попадает в верхние слои и распыляется над сушей. Из сульфатов морского происхождения не может образовываться серная кислота. 7
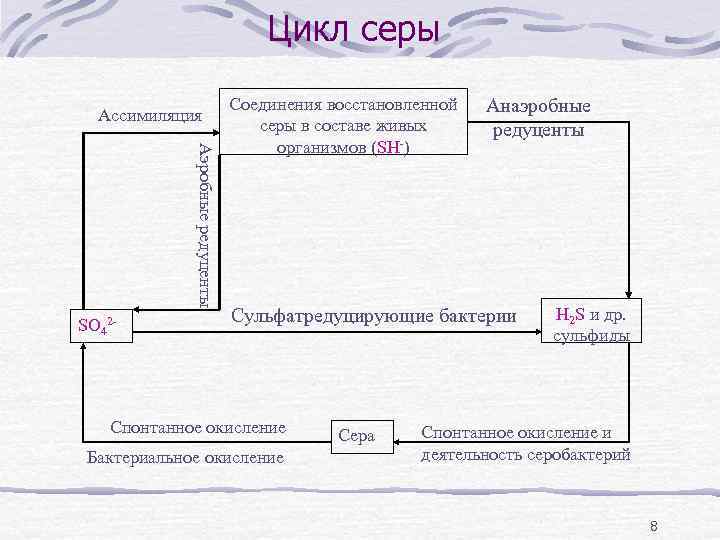
Цикл серы Ассимиляция Аэробные редуценты SO 42 - Соединения восстановленной серы в составе живых организмов (SH-) Анаэробные редуценты Сульфатредуцирующие бактерии Спонтанное окисление Бактериальное окисление Сера H 2 S и др. сульфиды Спонтанное окисление и деятельность серобактерий 8

Антропогенные источники: около 60 -70 млн. т/год серы в виде двуокиси SO 2 Значительные количества соединений серы, главным образом, в виде двуокиси (SO 2) – 95 -99%. Сжигание угля - 70% от всех антропогенных выбросов серы: содержание серы в каменном угле 0, 3 – 5%. часть серы превращается в сернистый газ SO 2, часть остается в золе в твердом состоянии. Сжигание нефтепродуктов – значительно меньше сернистого газа: содержание серы в неочищенной нефти 0, 1 – 2%. Антропогенные источники эмиссии серы дают в 2 раза больше загрязнений, чем естественные. 9

Антропогенные источники серы: На первом месте по выбросам сернистых соединений в атмосферу: металлургическая промышленности: чёрная металлургия: - обжиг руд и коксование угля для удаления серы при высокой температуре. цветная металлургия: - руды многих цветных металлов — сульфиды (Cu. S, Cu 2 S, Ni. S, Zn. S, Ag 2 S и Pb. S) - обжиг руд сера переходит в SO 2, - высококонцентрированный сернистый газ; предприятия по переработке нефти, предприятия по производству серной кислоты, обессеривание топлива: очистка природного газа от сероводорода H 2 S на месте добычи; нейтрализация отходящих газов: сжигание угля в кипящем слое, содержащем негашеную известь 2 Са. О + 2 SO 2 + О 2 = 2 Ca. SO 4 (нелетучий и нерастворимый, удаляется вместе с золой). 10

Химические превращения соединений серы: Сера входит в состав выбросов не в полностью окисленной форме SO 2 + Н 2 О SO 3 + Н 2 О Н 2 SO 4 + NН 3 (NН 4)2 SO 4 11

Время пребывания соединений серы в атмосфере : Вещество Формула Сульфат-ион Диоксид серы Сероводород SO 42 SO 2 Н 2 S Среднее время пребывания в атмосфере 10 суток 2 -4 суток 0, 5 -4 суток 12

Виды соединений азота в атмосфере Земли: Свободный азот – N 2 Закись азота – N 2 O Окись азота – NO Двуокись азота – NO 2 Азотистый ангидрид – N 2 O 3 Азотный ангидрид – N 2 O 5 Аммиак – NН 3 13

Источники соединений азота Общая эмиссия – почти 56 млн. т/год: Естественные источники эмиссии азота в атмосферу: I. Почвенная эмиссия. II. Грозовые разряды. III. Горение биомассы. IV. Прочие источники. 14

Почвенная эмиссия оксидов азота: около 8 млн. т/год (в пересчете на азот) В процессе деятельности живущих в почве денитрифицирующих бактерий из нитратов высвобождаются оксиды азота. Грозовые разряды: около 8 млн. т/год оксида азота Во время электрических разрядов в атмосфере молекулярные азот и кислород при очень высокой температуре переходят в плазменное состояние и соединяются. 15

Горение биомассы: 12 млн. т/год оксидов азота (в пересчете на азот) Искусственное и естественное происхождение. Наибольшее количество биомассы сгорает в результате: выжигания леса (с целью получения производственных площадей), пожаров в саванне. 16

Прочие источники естественных выбросов оксидов азота: от 2 до 12 млн. т/год оксидов азота (в пересчете на азот) Менее значительны. С трудом поддаются оценке. Включают: окисление аммиака NН 3 в атмосфере, разложение закиси азота N 2 O в стратосфере попадание смеси образовавшихся оксидов NO и NO 2 в тропосферу, фотолитические процессы в океанах, биологические процессы в океанах. 17

Цикл азота Атмосферный азот Животный белок Мертвые остатки, экскременты Сапрофи тные бактерии Аммонификация Бактерии Nitrosomonas NO 2 Бактерии Nitrobacter Нитрификация NH 3, NH 4 + Процессы денитрификации Ассимиляция Азотфиксация: азотфиксирующие бактерии, грозовые разряды и т. д. Растительный белок NO 318

Антропогенные источники соединений азота: На первом месте – горение ископаемого топлива (уголь, нефть, газ и т. д. ) горение N 2 + О 2 2 NО количество образовавшегося NO пропорционально температуре горения. Горение имеющихся в топливе азотосодержащих веществ. 37% ежегодных выбросов оксидов азота: Сжигание ископаемого топлива – около 12 млн. т/год. Сжигание горючего (бензина, дизельное топливо и т. д. ) в двигателях внутреннего сгорания – около 8 млн. т/год. Промышленность – около 1 млн. т/год. Доля антропогенных выбросов будет намного больше, если прибавить продукты сжигания биомассы. 19

Химические превращения соединений азота: Наиболее распространённое соединение азота в составе выбросов – окись азота NO: 2 NO + О 2 2 NO 2 (N 2 O 4) Свободные радикалы – химически высокоактивные осколки молекул, образующиеся в тропосфере под действием мягкого УФ излучения Солнца (ОН-, ЛОС), существующие в атмосфере доли секунды: NO 2 + ОН- НNO 3 + NН 3 NН 4 NO 3 NO 2 + СХНХ РАN (пероксиацетилнитрат) NO 2 NO + О 2 О 2 - + О 2 O 3 Когда концентрация свободных радикалов невелика, устанавливается равновесие: NO + О 3 NO 2 + О 2 20
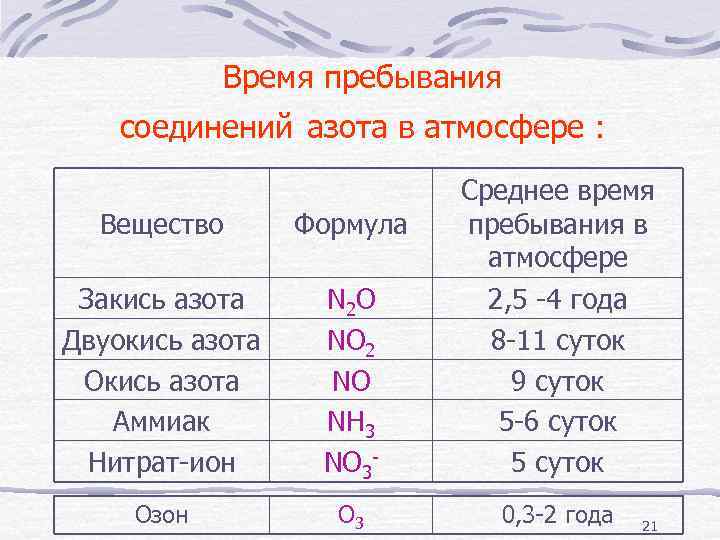
Время пребывания соединений азота в атмосфере : Вещество Формула Закись азота Двуокись азота Окись азота Аммиак Нитрат-ион N 2 O NO 2 NO NН 3 NO 3 - Среднее время пребывания в атмосфере 2, 5 -4 года 8 -11 суток 9 суток 5 -6 суток 5 суток Озон O 3 0, 3 -2 года 21
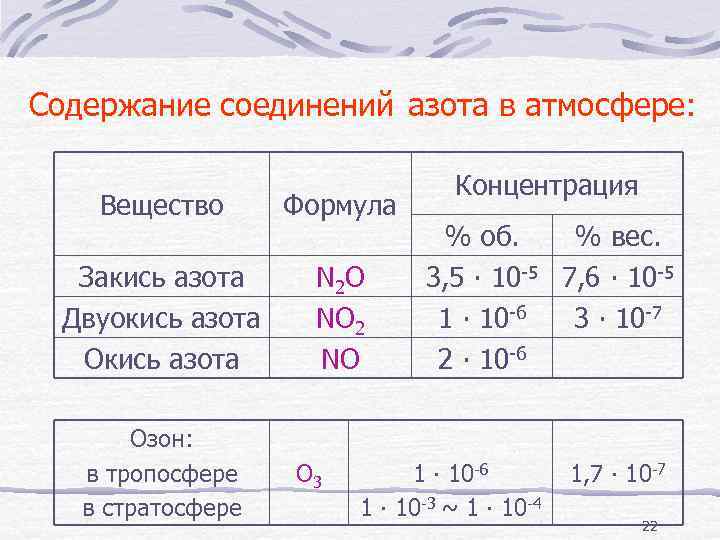
Содержание соединений азота в атмосфере: Вещество Формула Закись азота Двуокись азота Окись азота N 2 O NO 2 NO Озон: в тропосфере в стратосфере O 3 Концентрация % об. % вес. 3, 5 ∙ 10 -5 7, 6 ∙ 10 -5 1 ∙ 10 -6 3 ∙ 10 -7 2 ∙ 10 -6 1 ∙ 10 -3 ~ 1 ∙ 10 -4 1, 7 ∙ 10 -7 22

Кислотная седиментация 1. вымывание осадков – влажная седиментация 2. выпадение осадков – сухая седиментация В Калининградской области в год выпадает: 2 т/км 2 сульфатной серы (S-SО 42 -); 0, 3 – 0, 7 т/км 2 суммарного азота (N-NO 3 - + N-NH 4 -) 23

Благодарю за внимание! 24
Лекция_06_Сера+Азот.ppt