 Фазы и диаграммы фазового равновесия Доц. , к. т. н. О. А. Ушакова Весенний семестр 2011 г.
Фазы и диаграммы фазового равновесия Доц. , к. т. н. О. А. Ушакова Весенний семестр 2011 г.
 • Фаза – однородная часть неоднородной системы, характеризующаяся определенным химическим составом, структурой, набором свойств. В пределах одной фазы свойства могут изменяться только непрерывно, на границе раздела двух фаз – скачкообразно. • Примеры: лед и вода, растительное масло в воде… • Правило фаз Гиббса: С = К + Ф – 1, где С – число степеней свободы системы, К – число компонентов, Ф – число фаз, находящихся в равновесии. 2
• Фаза – однородная часть неоднородной системы, характеризующаяся определенным химическим составом, структурой, набором свойств. В пределах одной фазы свойства могут изменяться только непрерывно, на границе раздела двух фаз – скачкообразно. • Примеры: лед и вода, растительное масло в воде… • Правило фаз Гиббса: С = К + Ф – 1, где С – число степеней свободы системы, К – число компонентов, Ф – число фаз, находящихся в равновесии. 2
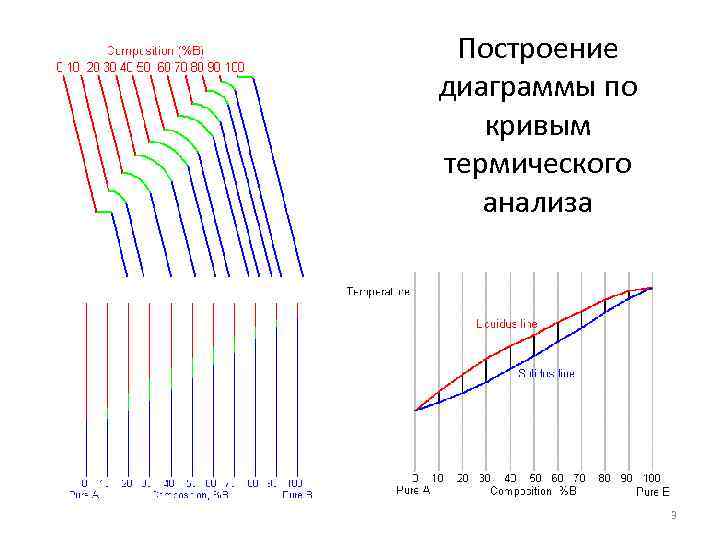 Построение диаграммы по кривым термического анализа 3
Построение диаграммы по кривым термического анализа 3
 4
4
 5
5
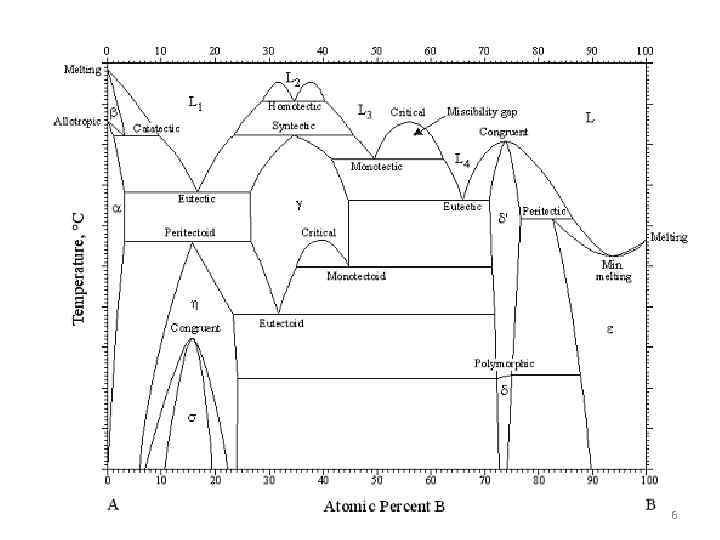 6
6
 Фазы в металлических системах • Жидкий расплав – жидкое расплавленное состояние веществ при температурах, в определённых границах удалённых от критической точки плавления и расположенных между температурами плавления и кипения. • Твердые растворы - фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решетке. q Граничный твердый раствор – твердый раствор на базе одного из компонентов, сохраняющий решетку основного компонента. • Промежуточные фазы • Химические соединения 7
Фазы в металлических системах • Жидкий расплав – жидкое расплавленное состояние веществ при температурах, в определённых границах удалённых от критической точки плавления и расположенных между температурами плавления и кипения. • Твердые растворы - фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решетке. q Граничный твердый раствор – твердый раствор на базе одного из компонентов, сохраняющий решетку основного компонента. • Промежуточные фазы • Химические соединения 7
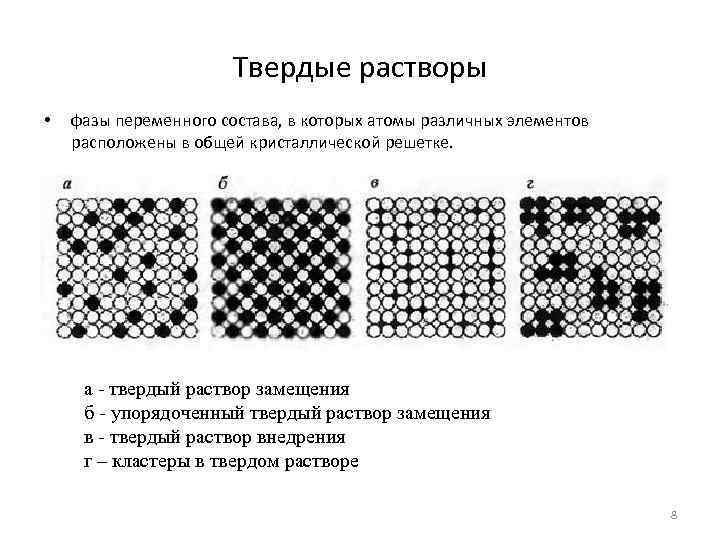 Твердые растворы • фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решетке. а - твердый раствор замещения б - упорядоченный твердый раствор замещения в - твердый раствор внедрения г – кластеры в твердом растворе 8
Твердые растворы • фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решетке. а - твердый раствор замещения б - упорядоченный твердый раствор замещения в - твердый раствор внедрения г – кластеры в твердом растворе 8
 Химические соединения -постоянство состава или очень узкие области гомогенности; -состав описывается стехиометрическими формулами, подчиняющимися правилам химической валентности (Mg. Si, Mg. Sb 2, Mg. Te); –наличие нового типа решетки, отличного от типа решеток компонентов, образующих это соединение; –ярко выраженные индивидуальные свойства; –постоянство температуры кристаллизации. 9
Химические соединения -постоянство состава или очень узкие области гомогенности; -состав описывается стехиометрическими формулами, подчиняющимися правилам химической валентности (Mg. Si, Mg. Sb 2, Mg. Te); –наличие нового типа решетки, отличного от типа решеток компонентов, образующих это соединение; –ярко выраженные индивидуальные свойства; –постоянство температуры кристаллизации. 9
 Промежуточные фазы • • Очень большое число фаз по своей природе являются промежуточными между химическими соединениями и твердыми растворами. Эти фазы часто называют металлическими соединениями, так как при их образовании возникают металлические или преимущественно металлические связи. Наиболее распространенными металлическими соединениями являются электронные соединения, фазы внедрения, фазы Лавеса, σ–фазы и др. Электронные соединения (фазы Юм–Розери) образуются в сплавах металлов первой группы и некоторых переходных металлов с элементами II–V групп таблицы Менделеева. Кристаллическая структура этих соединений зависит от электронной концентрации, равной отношению числа валентных электронов к числу атомов. Фазы внедрения возникают при взаимодействии атомов неметаллов малых размеров – водорода, бора, углерода, азота с переходными металлами. Фазы Лавеса – интерметаллические соединения постоянного состава, который можно описать формулой AB 2. 10
Промежуточные фазы • • Очень большое число фаз по своей природе являются промежуточными между химическими соединениями и твердыми растворами. Эти фазы часто называют металлическими соединениями, так как при их образовании возникают металлические или преимущественно металлические связи. Наиболее распространенными металлическими соединениями являются электронные соединения, фазы внедрения, фазы Лавеса, σ–фазы и др. Электронные соединения (фазы Юм–Розери) образуются в сплавах металлов первой группы и некоторых переходных металлов с элементами II–V групп таблицы Менделеева. Кристаллическая структура этих соединений зависит от электронной концентрации, равной отношению числа валентных электронов к числу атомов. Фазы внедрения возникают при взаимодействии атомов неметаллов малых размеров – водорода, бора, углерода, азота с переходными металлами. Фазы Лавеса – интерметаллические соединения постоянного состава, который можно описать формулой AB 2. 10
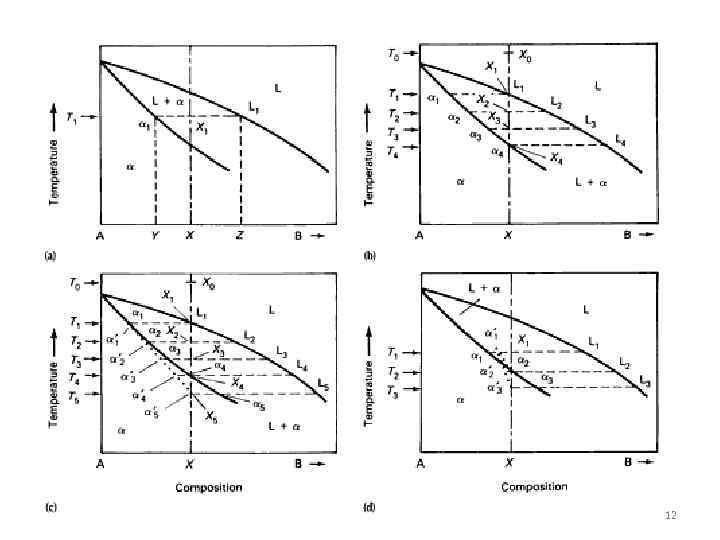
 Правило рычага • Конода – горизонтальный отрезок в двухфазной области, концы которого указывают составы фаз, находящихся в равновесии. • Массовая доля фазы прямо пропорциональна отношению противолежащего отрезка коноды ко всей длине коноды и массе сплава. 11
Правило рычага • Конода – горизонтальный отрезок в двухфазной области, концы которого указывают составы фаз, находящихся в равновесии. • Массовая доля фазы прямо пропорциональна отношению противолежащего отрезка коноды ко всей длине коноды и массе сплава. 11
 12
12
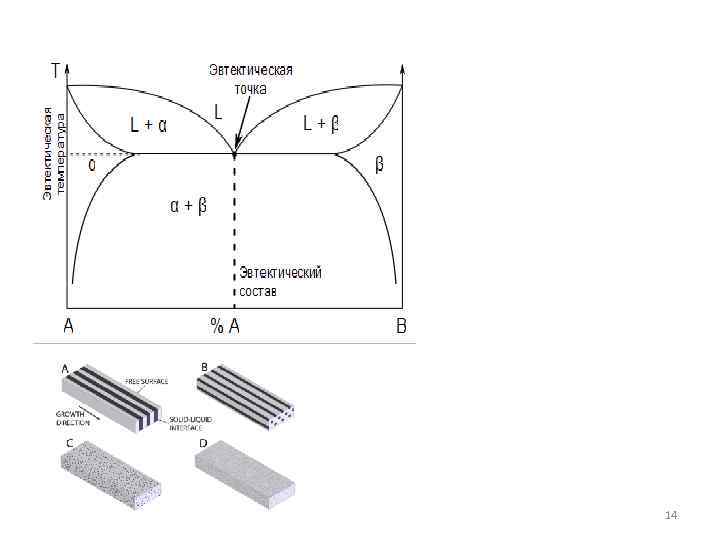
 Эвтектическое превращение 13
Эвтектическое превращение 13
 14
14
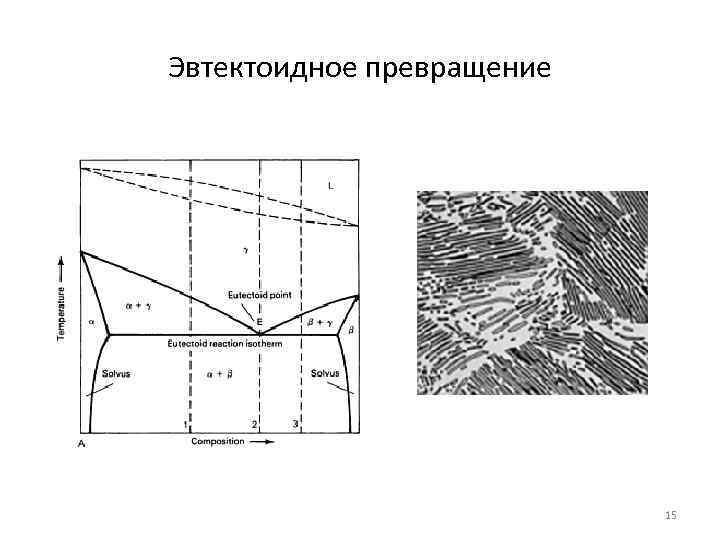 Эвтектоидное превращение 15
Эвтектоидное превращение 15
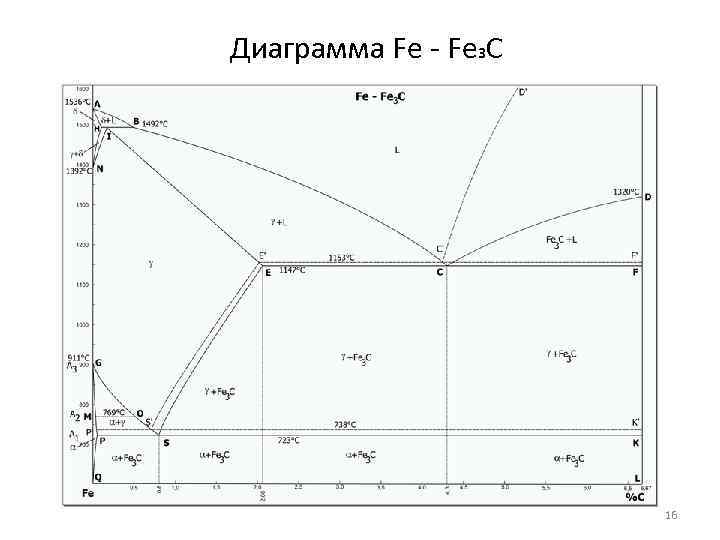 Диаграмма Fe - Fe 3 C 16
Диаграмма Fe - Fe 3 C 16


