Фазовые переходы.ppt
- Количество слайдов: 29

Фазовые переходы ФАЗОВЫЕ ПЕРЕХОДЫ без изменения химического состава (т. е. в простых и однофазных веществах) ПРЕВРАЩЕНИЯ в т. ч. и с изменением химического состава ( + химические реакции ) Термодинамика – определяет направление процессов, протекающих в системе в равновесных условиях – отклик системы на изменение внешних условий (температура, давление, состав). Отражается в конкретном виде диаграммы состояния. Кинетика – скорость протекания фазового превращения. Кроме внешних факторов влияет множество параметров самой системы.

Классификация фазовых переходов Классификация Бюргера Реконструктивные – реорганизация кристаллической структуры с разрывом химических связей и образованием новых (например, графит ↔ алмаз) Часто не происходит из-за кинетических затруднений! Деформационные – не разрыв, а искажение химических связей, т. е. небольшие изменения кристаллической структуры (например, модификации кварца тридимит ↔кристобаллит) Близкая симметрия, низкая энергия активации.

Термодинамическая классификация фазовых переходов ∆G = ∆H - T ∆S = 0 Нет скачка на зависимости свободной энергии от температуры (давления)! Фазовый переход первого рода – скачок первых производных свободной энергии по температуре и давлению (т. е. энтропия и объем) ∂G/∂T = -S ∂G/∂P = V ∆S = ∆H/T
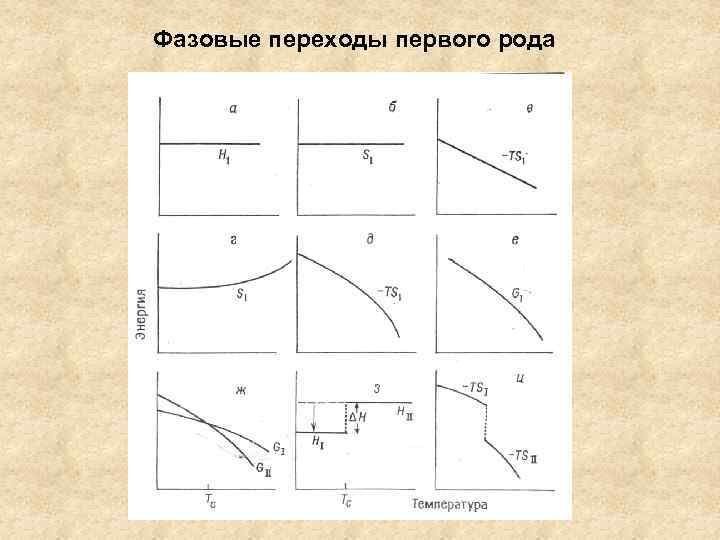
Фазовые переходы первого рода

Фазовый переход второго рода – скачок вторых производных свободной энергии по температуре и давлению (т. е. теплоемкость, коэффициент термического расширения α и сжимаемость β) ∂2 G/∂T 2 = -Ср/T; ∂2 G/∂P 2 = ∂V/∂P = -Vβ; ∂2 G/∂P∂T = ∂V/∂T = Vα Тс – температура завершения фазового перехода, верхняя граница существования НТ фазы. Аналогия с критической точкой на диаграмме состояния Можно переохладить ВТ фазу, но невозможно перегреть НТ фазу. Теоретически – фазовые переходы более высоких порядков Как изменяются основные термодинамические функции при ФП 2 -го рода?
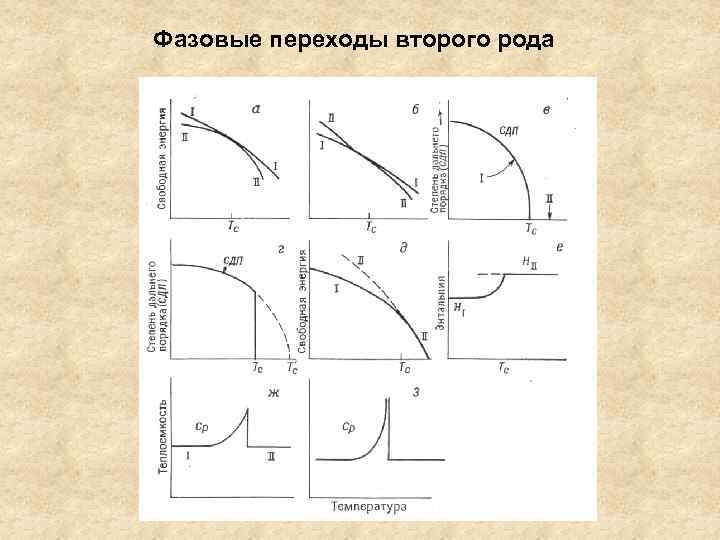
Фазовые переходы второго рода

Фазовые переходы первого и второго рода идеализированное представление изменения в системе, предшествующие превращению (Тс) - Можно пренебречь для переходов первого рода; - Нельзя пренебречь для переходов второго рода. Предкритические явления (например, изменение теплоемкости, степени дальнего порядка) заканчиваются скачком – 1 -го порядка (точечный) заканчиваются без скачка – 2 -го порядка (размытые) Классификация Уббелоде точечные и размытые фазовые переходы

Влияние давления на температуру фазового перехода d. T/d. P = ∆V/T∆H Плавление: ∆H > 0, ∆V > 0 (обычно) → Tпл ↑ с давлением Например, азот (d. T/d. P ≈ 19 К/1000 атм): Вода – исключение! (∆V< 0) 1 атм 10000 атм 28000 атм – 63, 15 К – 186 К – 308 К Барические фазовые переходы Принцип Ле Шателье – всегда протекают с уменьшением объема! Количественное выражение принципа Ле Шателье – уравнение Клаузиуса – Клапейрона d. P/d. T = ∆H/(T∆V) Какой знак ∆H ?
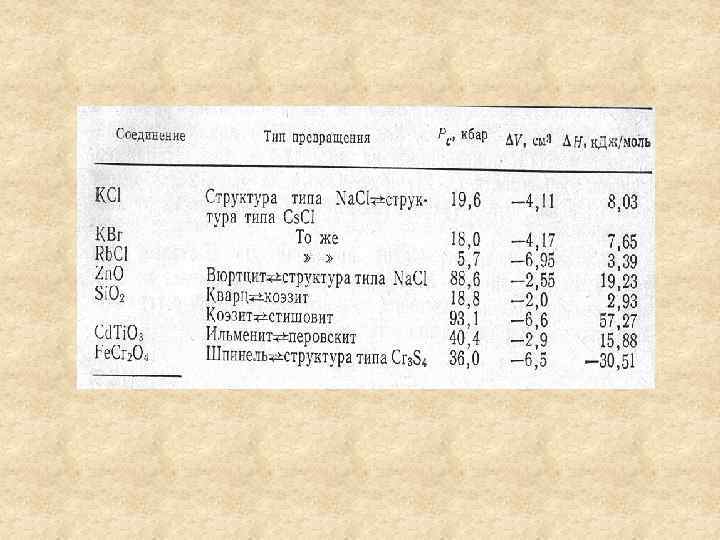

Изменение структуры при ФП Температура НТ → ВТ: рост энтропии и объема 1. 2. 3. ВТ фаза – более рыхлая структура, более низкие КЧ атомов ВТ фаза – более разупорядоченная ВТ фаза – более высокий тип симметрии Давление 1. 1. 3. ВД фаза – более плотная структура ВД фаза – более высокие КЧ атомов ВД фаза – более упорядоченная ∆G = ∆U + P ∆V - T ∆S = 0 Рост Р и снижение Т влияют в одном направлении

Представление фазовых переходов на диаграммах состояния Для однокомпонентных систем: линия моновариантного равновесия (изменение давления вызывает изменение температуры!) при постоянном давлении – постоянная температура Для двухкомпонентных систем: для твердых растворов – дополнительная степень свободы→ фазовый переход в интервале температур (чечевица) Переходы второго рода не могут быть изображены на фазовой диаграмме! (ни на одной из стадий превращения нет двухфазного равновесия)

Скорость фазовых переходов скорость = A exp(-E/RT) Определяющий при больших (Т-Тс) ∆G = ∆H - T ∆S HI, II ≠ f(T); SI, II ≠ f(T) → ∆G = (Tc-T)/Tc ∆H Определяющий при малых (Т-Тс)

Теория зародышеобразования GI = GII → скорость = 0 любое изменение приводит к увеличению G системы GI ≠ GII появление новой фазы вносит положительный вклад в G за счет появления новой поверхности ∆G∑ = ∆Gs +∆Gv ∆G∑ = 4 r 2 ∆Gs – 4/3 r 3 ∆Gv При малых r: 4 r 2 ∆Gs> 4/3 r 3 ∆Gv → ∆G∑ >0 При больших r: 4 r 2 ∆Gs< 4/3 r 3 ∆Gv → ∆G∑ <0

Критический размер зародыша d∆G/dr = 8 r∆Gs - 4 r 2∆Gv = 0 rc = 2 ∆Gs/∆Gv ∆Gc = 16 (∆Gs)2/3(∆Gv)2 rc = 2∆Gs. Tc/(Tc-T)∆H При Т=Тс rc →∞! Кроме поверхностной энергии еще и энергия напряжений при ∆V≠ 0!
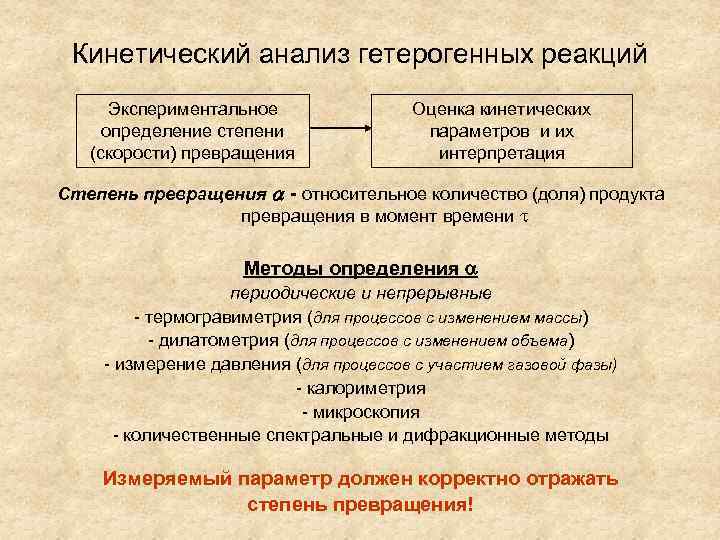
Кинетический анализ гетерогенных реакций Экспериментальное определение степени (скорости) превращения Оценка кинетических параметров и их интерпретация Степень превращения - относительное количество (доля) продукта превращения в момент времени Методы определения периодические и непрерывные - термогравиметрия (для процессов с изменением массы) - дилатометрия (для процессов с изменением объема) - измерение давления (для процессов с участием газовой фазы) - калориметрия - микроскопия - количественные спектральные и дифракционные методы Измеряемый параметр должен корректно отражать степень превращения!

Постановка кинетических экспериментов Изотермические условия Политермические условия - применимость стандартных кинетических уравнений; - отсутствие поправок на неизотермичность; -необходимость введения поправок на неизотермичность - необходимость интегрирования кинетических уравнений при переменных температуре и времени (выход на рабочую температуру, тепловой эффект реакции) Дисперсность (моно или контролируемая), размер и состояние поверхности Mg. O ( =3. 58 г/см 3) Монокристалл 1 х1 х1 см Порошок 100 мкм Порошок 10 нм S = 6 x 10 -4 м 2 S = 6 x 10 -1 м 2 S = 600 м 2 Дефектность кристаллической структуры (механохимическая активация)
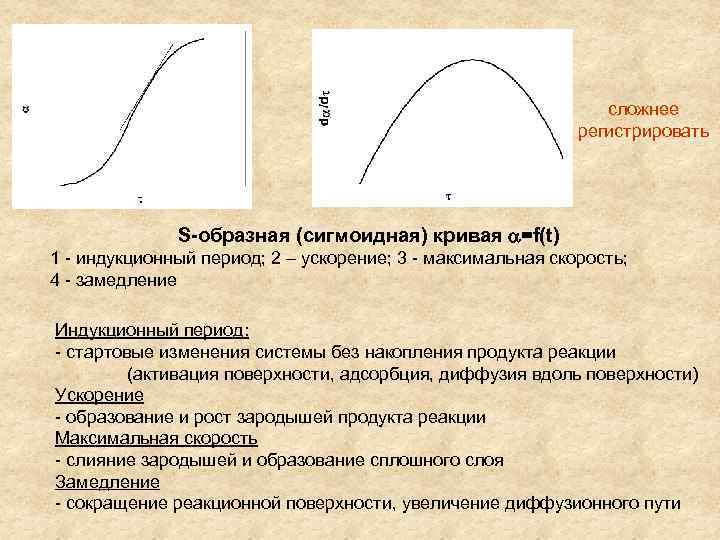
сложнее регистрировать S-образная (сигмоидная) кривая =f(t) 1 - индукционный период; 2 – ускорение; 3 - максимальная скорость; 4 - замедление Индукционный период: - стартовые изменения системы без накопления продукта реакции (активация поверхности, адсорбция, диффузия вдоль поверхности) Ускорение - образование и рост зародышей продукта реакции Максимальная скорость - слияние зародышей и образование сплошного слоя Замедление - сокращение реакционной поверхности, увеличение диффузионного пути
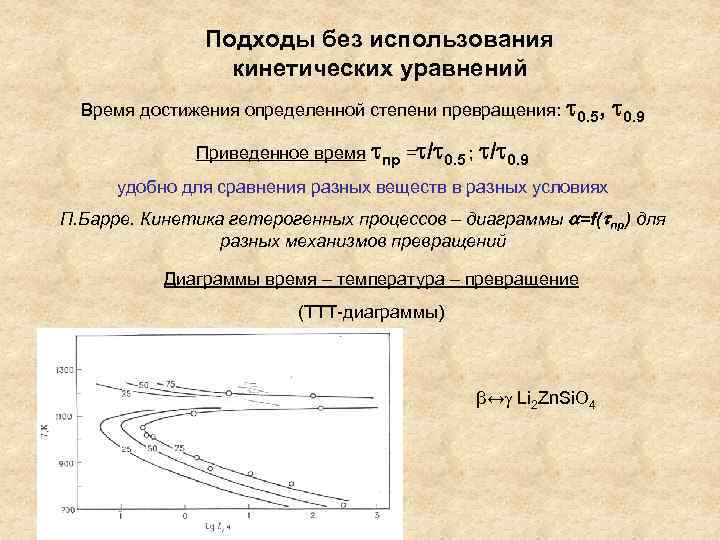
Подходы без использования кинетических уравнений Время достижения определенной степени превращения: 0. 5, 0. 9 Приведенное время пр = / 0. 5 ; / 0. 9 удобно для сравнения разных веществ в разных условиях П. Барре. Кинетика гетерогенных процессов – диаграммы =f( пр) для разных механизмов превращений Диаграммы время – температура – превращение (ТТТ-диаграммы) β↔ Li 2 Zn. Si. O 4

Кинетические уравнения 1. Формальное описание математической зависимости = f( ). Параметры не имеют конкретного физического смысла. 2. Стандартные уравнения, основанные на определенных физических моделях. Параметры связаны с природой происходящих процессов. 3. Построение оригинальной физической модели. Оптимизация параметров в рамках построенной модели. 1. 1. Формальное уравнение, основанное на применении закона действующих масс: -∂(1 - )/ ∂ = ∂ / ∂ = k(1 - )n Параметры определяются интегральным 1/(1 -n) [1 -(1 - )1 -n] = k или дифференциальным ln (d /d ) =lnk + n ln(1 - ) методами. Полученные значения n (формально аналогично порядку реакции) и k не имеют физического смысла!

Модели зародышеобразования Зародышеобразование Гомогенное – случайный процесс (термическая флуктуация), протекающий в объеме однородной фазы Гетерогенное – процесс на дефектах и позициях с высокой локальной свободной энергией Уравнение Аврами-Ерофеева (+Джонсона-Мела α = 1 - exp(-k n) lnln[1/(1 -a)] = ln(k) – n ln(t) α – степень превращения, – время k – кинетическая константа n – постоянная, зависящая от природы процесса Универсальность, простота использования, но: двойное логарифмирование сглаживает экспериментальные зависимости; формальная применимость часто противоречит физическому смыслу

Значения параметра n в уравнении Аврами-Ерофеева Механизм реакции Полиморфные превращения, рост ядер, контролируемый реакцией на границе раздела фаз: - возрастающая скорость образования ядер - постоянная скорость образования ядер - уменьшающаяся скорость образования ядер - образование ядер на ребрах кристаллов Рост ядер контролируется диффузией: - ядра произвольной формы образуются с возрастающей скоростью - то же, с постоянной скоростью - то же, с уменьшающейся скоростью - то же, с нулевой скоростью образования - ядра имеют форму утолщающихся игл, цилиндров - ядра имеют форму утолщающихся пластин n >4 4 3 -4 1 >2, 5 1, 5 -2, 5 1 0, 5

Уравнение Таплина ∂ /∂ z = k(1 - )m Z – величина, определяемая механизмом взаимодействия; m – величина, зависящая как от механизма, так и от формы частиц k- константа Z m Физическая модель 1 2/3 Сферические частицы, реакция лимитируется процессом на границе фаз 1 1/2 Игольчатые частицы, то же 1 0 1/2 0 0, 29 2/3 >1 1 Тонкие диски, то же Диффузионные модели Механизмы зародышеобразования

Лимитирующие стадии реакции Скорость процесса в целом определяется самой медленной из последовательных стадий. подвод реагента к поверхности твердой фазы → адсорбция на поверхности → переход в объем → диффузия в твердой фазе в границе раздела фаз → акт химической реакции + теплоперенос! - скорость стадий по-разному зависит от степени превращения → лимитирующая стадия может меняться по мере протекания процесса - разные энергии активации у стадий (разная зависимость скорости от температуры) → лимитирующая стадия может меняться с изменением температуры активация процесса должна быть направлена на ускорение лимитирующей стадии - Разные кинетические уравнения в зависимости от лимитирующей стадии

Диффузионные уравнения 1. Уравнение Таммана: для плоских пластин dx/d = k/x k - коэффициент диффузии лимитирующих процесс частиц, x - толщина слоя продукта 2. Уравнение Яндера: для порошков - одинаковые сферические частицы компонента А - R 0 - компонент В благодаря высокой диффузии быстро образует непрерывный слой продукта на поверхности частиц А - реакция лимитируется объемной диффузией компонента В к А через слой продукта - не образуется твердых растворов АВ - нет изменения объема в ходе реакции - коэффициент диффузии не меняется с толщиной слоя - толщина слоя продукта изменяется во времени параболическому закону F(a) = [1 -(1 - )1/3]2 = k 3. Модель анти-Яндера F(a) = [(1+ )1/3 -1]2 = k

Уравнение Гинстлинга-Броунштейна Яндер, но нет параболического закона роста слоя продукта: F(a) = 1 - 2/3 - (1 - )2/3 = k Уравнение Картера-Валенси Вводится различие в эквивалентных объемах реагентов и продукта: Z = VAB/VA F(a) = Z/(Z-1) - (1 - )2/3 - [1+ (Z-1)]2/3 (Z-1)-1 = k Введение поправки Картера - Валенси эффективно, если Z>2 Противодиффузия компонентов - отношение объемов продукта реакции, образовавшихся на внешней и внутренней поверхностях слоя; Z - отношение эквивалентных объемов продукта и компонента А 1. =Z-1 уравнение Картера-Валенси 2. 0< < Z-1 уравнение Картера-Валенси 3. →∞ модель анти-Яндера

Реакции, лимитируемые процессами на границе раздела - скорость определяется величиной поверхности непрореагировавшего А - зародышеобразование на поверхности А и образование сплошного слоя продукта происходит мгновенно. F( ) = 1 - (1 - )1/3 = k F( ) = 1 - (1 - )1/2 = k сферы (уравнение сжимающейся сферы) диски или цилиндры (уравнение сжимающегося цилиндра) Общая форма 1/(1 -n) [1 -(1 - )1 -n] = k n=0. 5 - диски, цилиндры n=0. 67 - сферы n=1 - уравнение первого порядка

Энергия активации скорость = k 0 exp(-Eакт/RT) В твердофазных процессах: - в элементарном акте реакции участвуют неопределенное число частиц, которые оказывают друг на друга взаимное влияние; - дефекты кристаллической структуры (энергетически неравноценные позиции), концентрация их зависит от температуры; - при изменении лимитирующей стадии: линейная зависимость в полулогарифмических координатах не имеет смысла (меняется механизм) Кажущаяся энергия активации Еэфф Указывает на зависимость скорости от температуры Большая Еа не означает низкую скорость!

Факторы, влияющие на кинетику твердофазных реакций - дисперсность образца (размер частиц, размер зерен - кристаллитов); - дефектность (примеси, микронапряжения) механохимическая активация - площадь поверхности (внешней и межфазной) увеличение площади контакта (прессование) - прочность разрушающихся и образующихся связей; - изменение объема твердой фазы; - давление: lg(скорости) = const - ∆VP/RT - механизм: реконструктивные и деформационные; топотаксиальные (объемное сходство структур) и эпитаксиальные (двумерное структурное сходство)

Практические советы при проведении кинетических экспериментов 1. Создать условия, близкие к модельным изотермичность, монодисперсность 2. При выборе уравнения: брать расчетные значения F(a) с минимальным шагом и определять максимальную линейность Только при корректном выборе уравнения его параметры имеют физический смысл! 3. Если условия далеки от модельных, то можно лишь ограничиться математической обработкой, но не вкладывать физический смысл в величины определяемых параметров! Нужна дополнительная независимая информация!
Фазовые переходы.ppt