 Фазовое равновесие Докладчик Уварова Е. В. , ХТТ-02 -1
Фазовое равновесие Докладчик Уварова Е. В. , ХТТ-02 -1
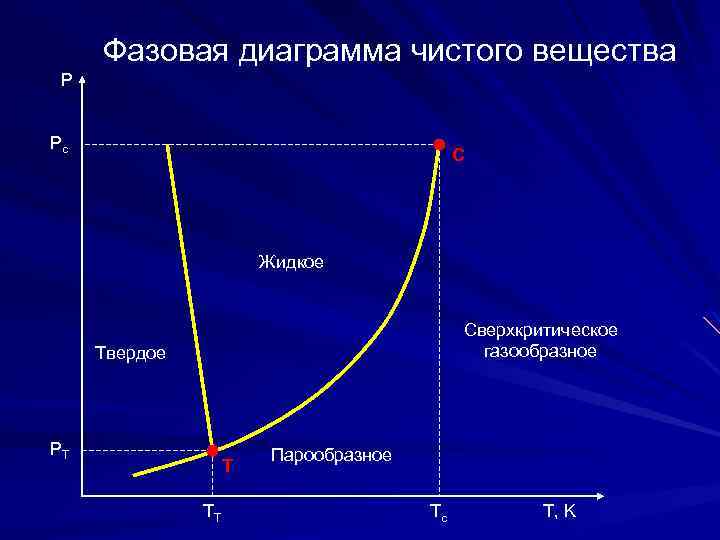 Фазовая диаграмма чистого вещества P Pc С Жидкое Сверхкритическое газообразное Твердое PT Т TT Парообразное Tc T, K
Фазовая диаграмма чистого вещества P Pc С Жидкое Сверхкритическое газообразное Твердое PT Т TT Парообразное Tc T, K
 Тройная точка – точка, где вещество сосуществует в трех агрегатных состояниях. Критическая температура Тс, названная по предложению Д. И. Менделеева абсолютной температурой кипения – температура, при которой исчезает различие между жидким и газообразным состоянием вещества. При температурах выше Тс вещество без кипения и парообразования переходит в сверхкритическое состояние, при котором теплота испарения, поверхностное натяжение и энергия межмолекулярного взаимодействия равны нулю. При сверхкритическом состоянии возникают характерные флуктуации плотности (по высоте сосуда), что приводит к рассеянию света, затуханию звука и другим аномальным явлениям, таким как сверхтекучесть и сверхпроводимость гелия.
Тройная точка – точка, где вещество сосуществует в трех агрегатных состояниях. Критическая температура Тс, названная по предложению Д. И. Менделеева абсолютной температурой кипения – температура, при которой исчезает различие между жидким и газообразным состоянием вещества. При температурах выше Тс вещество без кипения и парообразования переходит в сверхкритическое состояние, при котором теплота испарения, поверхностное натяжение и энергия межмолекулярного взаимодействия равны нулю. При сверхкритическом состоянии возникают характерные флуктуации плотности (по высоте сосуда), что приводит к рассеянию света, затуханию звука и другим аномальным явлениям, таким как сверхтекучесть и сверхпроводимость гелия.
 Для веществ, находящихся в сверхкритическом состоянии, неприменимы закономерности абсорбции, адсорбции, экстракции и ректификации. Критическое давление Рс – давление насыщенных паров при критической температуре.
Для веществ, находящихся в сверхкритическом состоянии, неприменимы закономерности абсорбции, адсорбции, экстракции и ректификации. Критическое давление Рс – давление насыщенных паров при критической температуре.
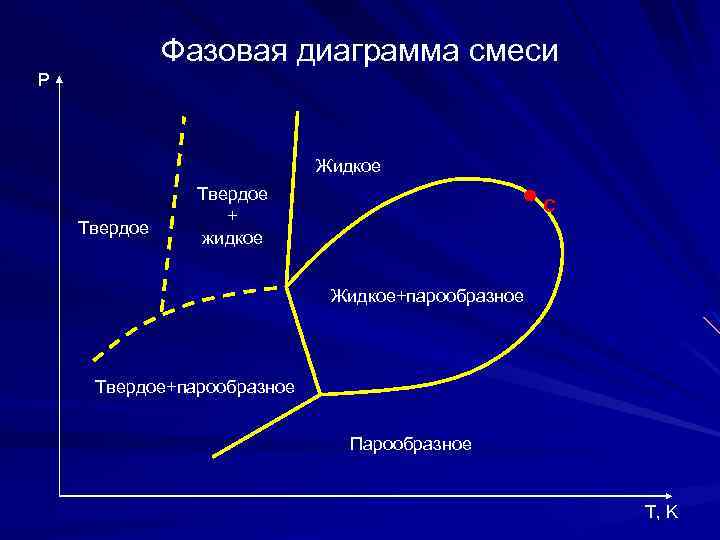 Фазовая диаграмма смеси P Жидкое Твердое + жидкое С Жидкое+парообразное Твердое+парообразное Парообразное T, K
Фазовая диаграмма смеси P Жидкое Твердое + жидкое С Жидкое+парообразное Твердое+парообразное Парообразное T, K
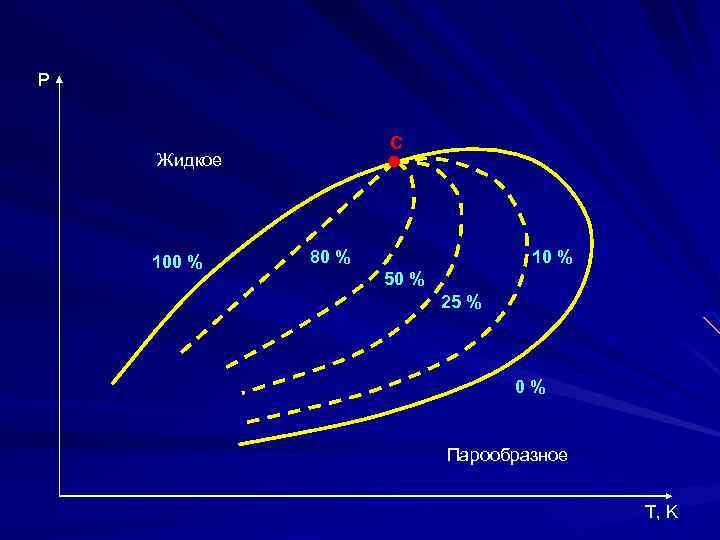 P С Жидкое 100 % 80 % 10 % 50 % 25 % 0% Парообразное T, K
P С Жидкое 100 % 80 % 10 % 50 % 25 % 0% Парообразное T, K
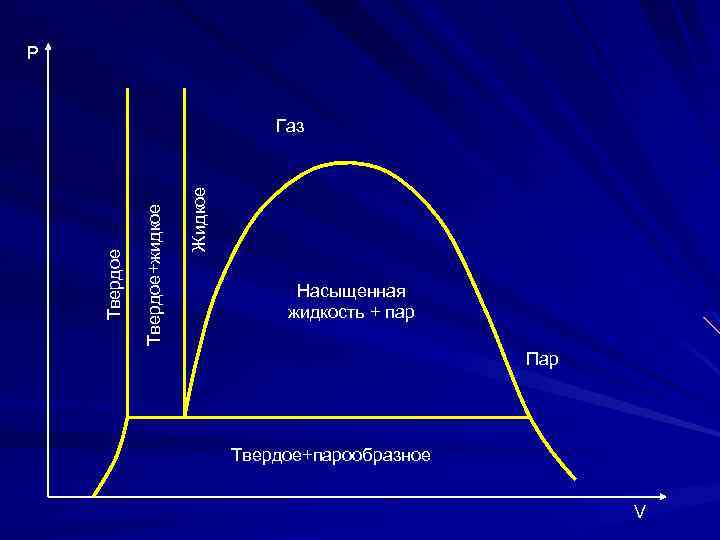 Р Жидкое Твердое+жидкое Твердое Газ Насыщенная жидкость + пар Пар Твердое+парообразное V
Р Жидкое Твердое+жидкое Твердое Газ Насыщенная жидкость + пар Пар Твердое+парообразное V