лекция_6_farmakogenetika_23_09_08.ppt
- Количество слайдов: 35

ФАРМАКОГЕНЕТИКА Лекция СПб. ГУ № 6

ПЛАН ЛЕКЦИИ 1. Определение понятий (фармакотипирование, генотипирование, фармакогенетика, фармакогеномика) 2. Метаболим лекарств 3. Фазы детоксикации 4. Химические реакции биотрансформации 5. Индукция ферментов биотрансформации 6. Генетический полиморфизм ферментов 7. Взаимодействие цитохромов с лекарствами 8. Генетический полиморфизм и фармакотерапия 9. Чиповый метод анализа генетического полиморфизма


ОРГАНИЗМ И ЛЕКАРСТВО Фармакокинетика – абсорбция, распределение, метаболизм и выведение лекарства Фармакодинамика – взаимоотношение между концентрацией, местом действия и эффектом Фенотипирование лекарства- прямой метод определения активности лекарства по фармакокинетике субстрата Генотипирование - анализ полиморфизмов генов, определяющих метаболизм лекарства Генетическая гетерогенность - генный полиморфизм Фармакогенетика – индивидуальная реакция на лекарства Фармакогеномика – союз функциональной геномики и молекулярной фармакологии

Метаболизм лекарств Лекарства с высоким печеночным клиренсом: аминазин, аспирин, кортизон, , морфин, резерпин, метопролол, метилтестостерон, и др. Лекарства с низким печеночным клиренсом: теофеллин, парацетомол По скорости метаболизма лекарств различают: «Экстенсивные » метаболизаторы- норма «Медленные» метаболизаторы – сниженная «Быстрые или сверхактивные» метаболизаторы

ФАЗЫ ДЕТОКСИКАЦИИ Фаза 1 Несинтетические реакции (пролекарство – лекарство) Оксидазы со смешанной функцией Реакции восстановления и гидролиза Фаза II Синтетические реакции Коньюгация ЛС через метаболически активные радикалы (фазы I) Возможен метаболизм ЛС только за счет ферментов Фазы I или Фазы II

ОСНОВНЫЕ ФАЗЫ ДЕТОКСИКАЦИИ ФАЗА I ГЛЮТАТИОН ТРАНСФЕРАЗЫ, ТРАНСФЕРАЗЫ N- АЦЕТИЛАЦЕТИ ТРАНСФЕРАЗЫ, ТРАНСФЕРАЗЫ UDF- ГЛЮКОРОН СУЛЬФОТРАНСФЕРАЗЫ И ДР. ДР ЦИТОХРОМЫ P 450, P 450 ЭЕПОКСИ ДГИДРОЛАЗЫ И ДР. ЛЕКАРСТВА, ПИЩА. КАНЦЕРОГЕНЫ, ЗАГРЯЗНЕНИЕ ВНЕШНЕЙ СРЕДЫ ФАЗА II АКТИВАЦИЯ КСЕНОБИОТИКОВ С ОБРАЗОВАНИЕМ АКТИВНЫХ ПРОМЕЖУТОЧНЫХ ЭЛЕКТРОФИЛЬНЫХ МЕТАБОЛИТОВ ФАЗА III ПРЕОБРАЗОВАНИЕ АКТИВНЫХ ПРОМЕЖУТОЧНЫХ ЭЛЕКТРОФИЛЬНЫХ МЕТАБОЛИТОВ В ВОДОРАСТВОРИМЫЕ НЕТОКСИЧНЫЕ КОМПОНЕНТЫ ВЫВЕДЕНИЕ ВОДОРАСТВОРИМЫХ НЕТОКСИЧНЫХ КОМПОНЕНТОВ ИЗ ОРГАНИЗМА ОКСИДАТИВНЫЙ СТРЕСС, ТОКСИЧНОСТЬ, МУТАЦИИ, РАК Сочетанное действие ферментов системы детоксикации обеспечивает обезвреживание тысяч ксенобиотиков, включая самые разные лекарства, Оно определяет индивидуальную реакцию организма и составляет основу персонифицированной фармакогенетики и фармакогеномики
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ Риск развития патологии
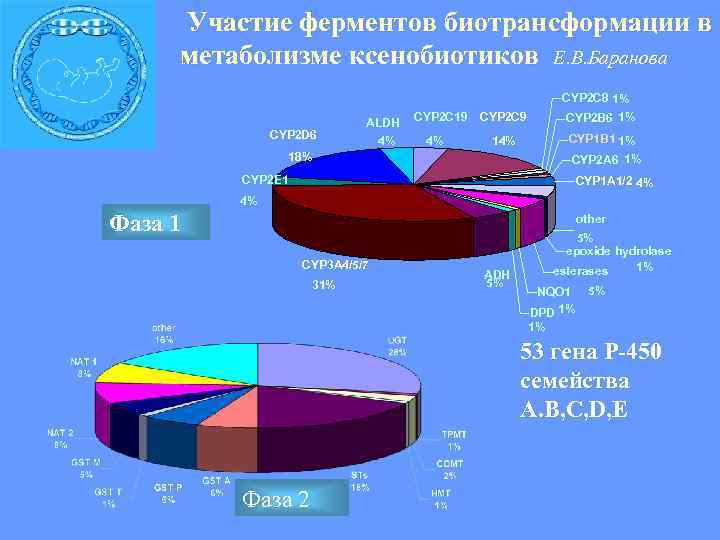
Участие ферментов биотрансформации в метаболизме ксенобиотиков Е. В. Баранова CYP 2 C 8 1% CYP 2 D 6 ALDH 4% CYP 2 C 19 4% CYP 2 C 9 CYP 2 B 6 1% 14% CYP 1 B 1 1% 18% CYP 2 A 6 1% CYP 2 E 1 CYP 1 A 1/2 4% 4% Фаза 1 other CYP 3 A 4/5/7 31% ADH 5% 5% epoxide hydrolase 1% esterases NQO 1 DPD 1% 1% 5% 53 гена Р-450 семейства А. B, C, D, E Фаза 2

Основные химические реакции биотрансформации проканцерогенов с участием генов метаболизма Фаза II Образование (1 -3) или модификация Реакции (4 -8) функциональных групп коньюгирования 1. Гидроксилирование ароматического 1. Перенос ацетильных, кольца, алифатических цепей, метильных, аминов или амидов сульфгидрильных, 2. Эпоксидация ароматического кольца фосфорильных и или ненасыщенных олефинов глюкуронильных групп 3. S-, N- и Р-окисление 2. Конъюгация с 4. 0 -, N- и S-деалкилирование глютатионом 5. Гидролиз эфиров или амидов 6. Окислительное деаминирование 7. Редукция эпоксидов, гидроксиламинов, нитрозосоединений. N- и Sоксидов 8. N- и С-трансоксигенирование

Индукция ферментов метаболизма 1. Фенобарбиталовый путь – активация промотора в регуляторной области гена Аутоиндукция – сам ксенобиотик активатор фермента 2. Рифампицин-дексаметазоновый тип – взаимодействие индуктора с рецепторамирегуляторами транскрипции 3. Этаноловый тип –стабилизация молекулы фермента метаболизма путем образования комплекса с некоторыми ксенобиотиками

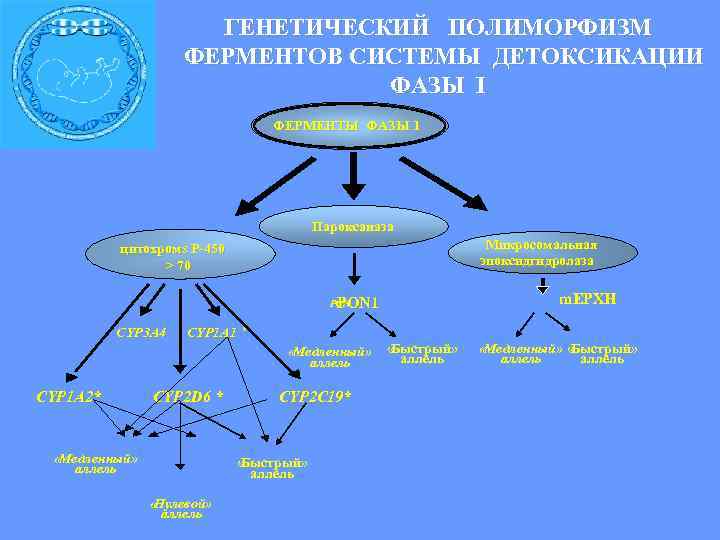
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ФЕРМЕНТОВ CИСТЕМЫ ДЕТОКСИКАЦИИ ФАЗЫ I ФЕРМЕНТЫ ФАЗЫ 1 Пароксаназа Микросомальная эпоксидгидролаза цитохромs Р-450 > 70 m. EPXH PON 1 PON CYP 3 A 4 CYP 1 A 1 * «Медленный» аллель CYP 1 A 2* CYP 2 D 6 * «Медленный» аллель CYP 2 C 19* « Быстрый» аллель «Нулевой» аллель « Быстрый» аллель Быстрый» «Медленный» « аллель
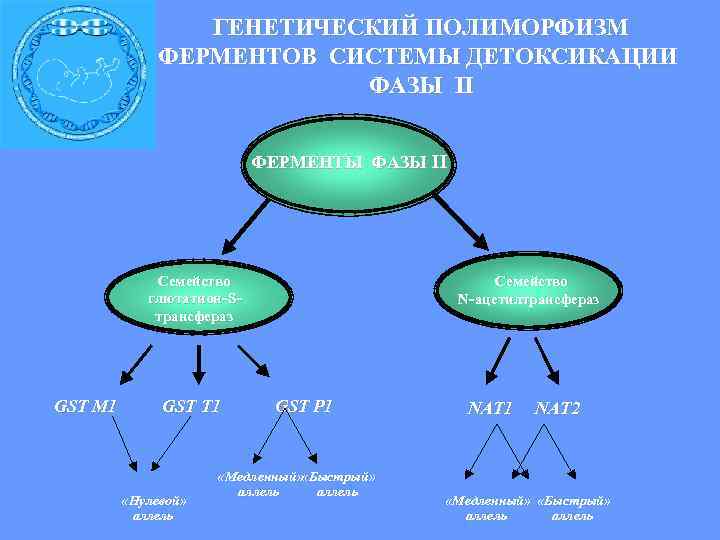
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ФЕРМЕНТОВ СИСТЕМЫ ДЕТОКСИКАЦИИ ФАЗЫ II ФЕРМЕНТЫ ФАЗЫ II Семейство глютатион- Sтрансфераз GST M 1 GST T 1 «Нулевой» аллель Семейство N- ацетилтрансфераз GST P 1 «Медленный» «Быстрый» аллель NAT 1 NAT 2 «Медленный» «Быстрый» аллель

ВЗАИМОДЕЙСТВИЕ РАЗЛИЧНЫХ ЦИТОХРОМОВ С ЛЕКАРСТВАМИ P 450 CYP 2 C 9 & CYP 2 C 19 15% CYP 3 A 4 50% CYP 2 D 6 20% НЕЙРОЛЕПТИКИ АНТИДЕПРЕССАНТЫ БЕТА-БЛОКАТОРЫ АНТИАРИТМИЧЕСКИЕ
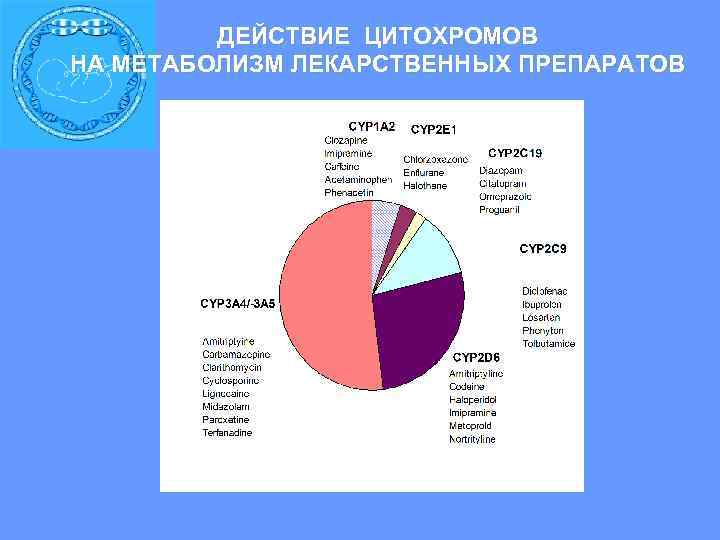
ДЕЙСТВИЕ ЦИТОХРОМОВ НА МЕТАБОЛИЗМ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ

Генетические механизмы индивидуальной чувствительности к лекарствам ФАРМАКОКИНЕТИЧЕСКИЕ: изменение абсорбции - инотиазид – NAT 2 превращение в активную форму кодеин –морфин –CYP 2 D 6 системные особенности метаболизма конкуренция препаратов за фермент индукция ферментов метаболизма индукция/ингибирование пищевыми продуктами ФРАМАКОДИНАМИЧЕСКИЕ: поступление /выведение препарата из клетки изменения в белках рецепторах
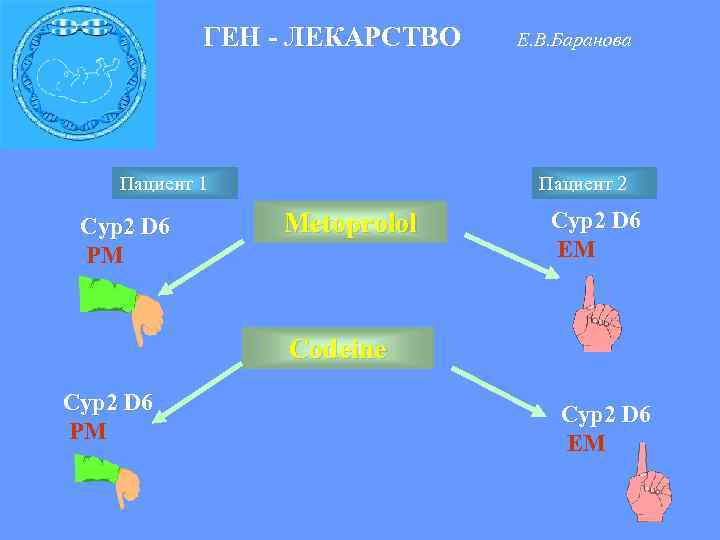
ГЕН - ЛЕКАРСТВО Пациент 1 Сyp 2 D 6 PM Е. В. Баранова Пациент 2 Metoprolol Сyp 2 D 6 EM Сodeine Сyp 2 D 6 PM Сyp 2 D 6 EM
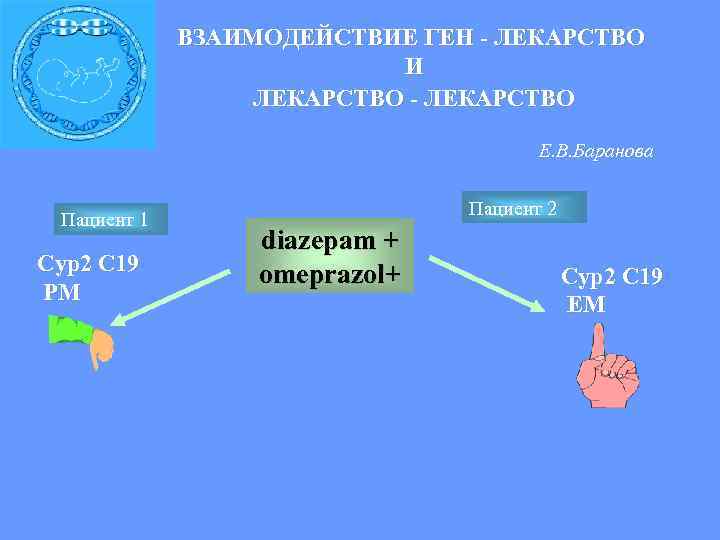
ВЗАИМОДЕЙСТВИЕ ГЕН - ЛЕКАРСТВО И ЛЕКАРСТВО - ЛЕКАРСТВО Е. В. Баранова Пациент 1 Сyp 2 С 19 PM Пациент 2 diazepam + omeprazol+ Сyp 2 С 19 EM
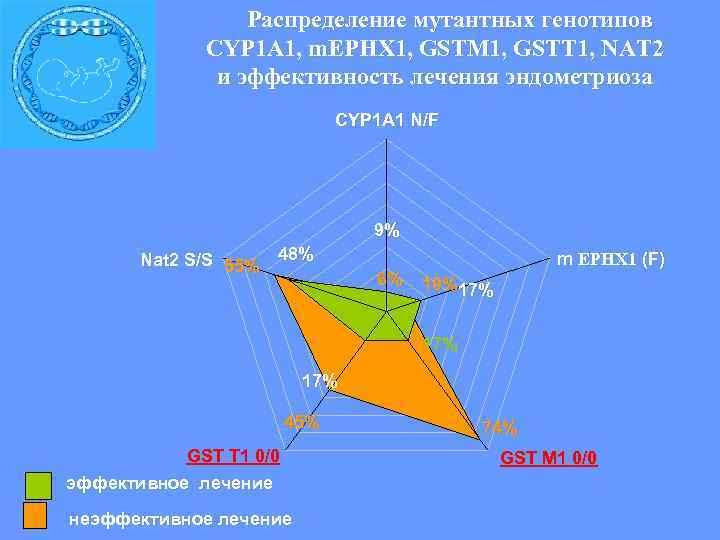
Распределение мутантных генотипов CYP 1 A 1, m. EPHX 1, GSTM 1, GSTT 1, NAT 2 и эффективность лечения эндометриоза CYP 1 A 1 N/F 9% Nat 2 S/S 55% 48% 6% m EPHX 1 (F) 10%17% 17% 45% GST T 1 0/0 эффективное лечение неэффективное лечение 74% GST M 1 0/0

Частоты функционально неполноценных генотипов по генам фазы 2 детоксикации в разных группах больных эндометриозом неэффективное лечение 27, 50% 31, 40% 45, 10% эффективное лечение 4, 30% 0 GSTT 1 0/0, NAT 2 S/S OR 8, 63(CI 95% 2, 17 -34, 229) GSTM 10/0, GSTT 1 0/0 8, 70% OR 10, 5 (CI 95% 1, 81 -60, 912) GSTM 1 0/0, NAT 2 S/S OR 8, 32 (CI 95% 1, 36 -51, 14).
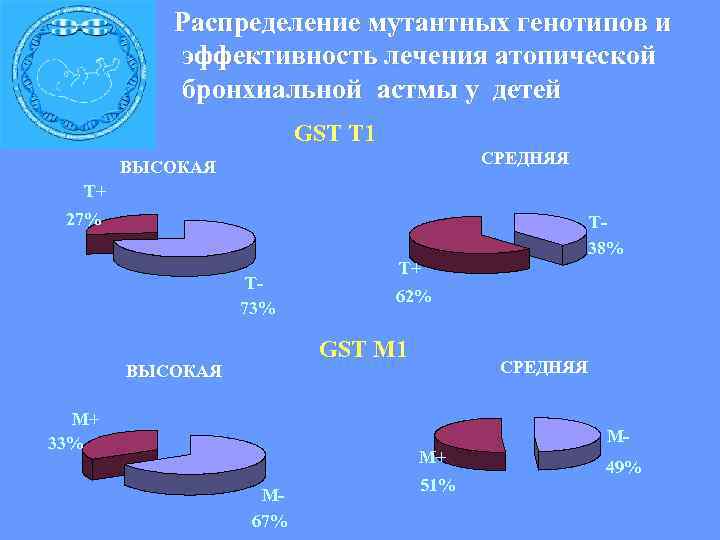
Распределение мутантных генотипов и эффективность лечения атопической бронхиальной астмы у детей GST T 1 СРЕДНЯЯ ВЫСОКАЯ Т+ 27% Т 38% Т 73% Т+ 62% GST M 1 ВЫСОКАЯ М+ 33% СРЕДНЯЯ ММ+ М 67% 51% 49%

Биочип - упорядоченная матрица ячеек, каждая из которых содержит молекулярный зонд (ДНК, РНК, белки, клетки) - Каждая ячейка биочипа – индивидуальная реакционная пробирка Ячейки биочипа содержат ДНК-зонды, способные выявлять наличие определенной ДНК в образце, находить в ней фенотипически значимые мутации (наследственные заболевания, генетическую предрасположенность у человека, лекарственную устойчивость у бактерий и т. д. )

Центр биологических микрочипов ИМБ им. В. А. Энгельгардта РАН: На биочипе размещается несколько тысяч ячеек. Каждая гелевая ячейка содержит уникальную пробу. Диагностические биочипы содержат набор всех проб. 300 мкм гелевые ячейки
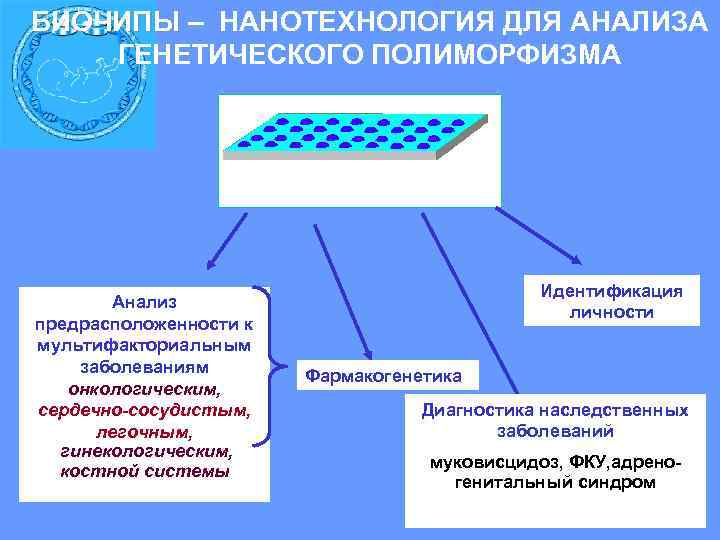
БИОЧИПЫ – НАНОТЕХНОЛОГИЯ ДЛЯ АНАЛИЗА ГЕНЕТИЧЕСКОГО ПОЛИМОРФИЗМА Анализ предрасположенности к мультифакториальным заболеваниям онкологическим, сердечно-сосудистым, легочным, гинекологическим, костной системы Идентификация личности Фармакогенетика Диагностика наследственных заболеваний муковисцидоз, ФКУ, адреногенитальный синдром

Преимущества Биочиповой технологии: - возможность проведения множественного параллельного анализа биологических объектов (тысячи ячеек на 1 кв. см. ) - миниатюрность (удобство эксплуатации, экономия реактивов и т. д. ) - универсальность и дешевизна производства (одна производственная схема для различных микрочипов) - возможность использования в качестве иммобилизованных зондов фрагментов ДНК, РНК, белков (с сохранением ферментативных или антигенных свойств), а также живых клеток-биосенсоров

Производство биочипов Производство микрочипов путем сополимеризации Ячейки геля с иммобилизованными пробами light robot pin Матрица с пробами Высокопроизводительный робот
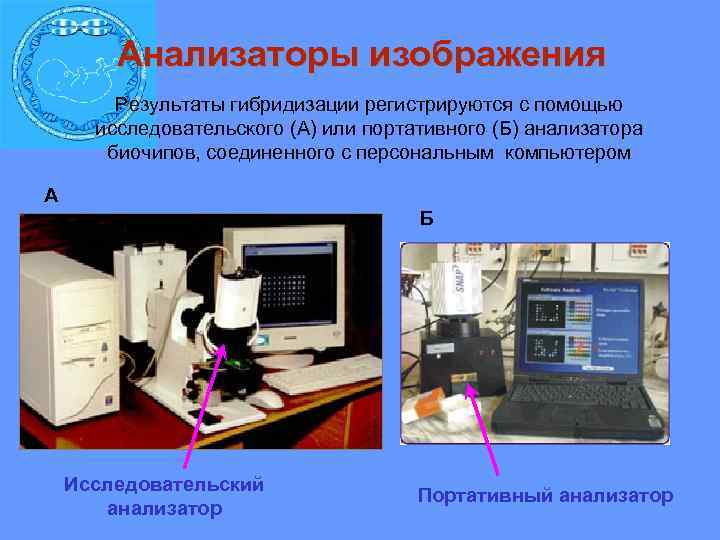
Анализаторы изображения Результаты гибридизации регистрируются с помощью исследовательского (А) или портативного (Б) анализатора биочипов, соединенного с персональным компьютером А A Исследовательский анализатор Б Портативный анализатор
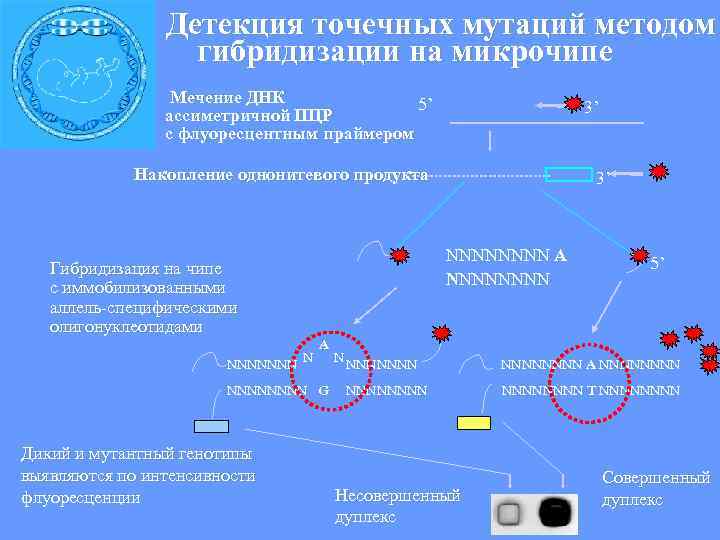
Детекция точечных мутаций методом гибридизации на микрочипе Мечение ДНК 5’ ассиметричной ПЦР с флуоресцентным праймером 3’ Накопление однонитевого продукта NNNN A NNNN Гибридизация на чипе с иммобилизованными аллель-специфическими олигонуклеотидами NNNNNNN N A NNNN G Дикий и мутантный генотипы выявляются по интенсивности флуоресценции 3’ N NNNNNNNN Несовершенный дуплекс 5’ NNNN A NNNNNNNN T NNNN Совершенный дуплекс
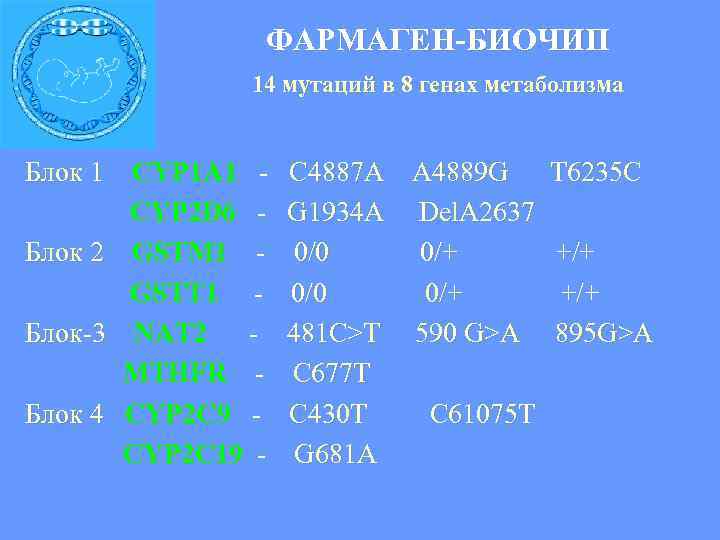
ФАРМАГЕН-БИОЧИП 14 мутаций в 8 генах метаболизма Блок 1 CYP 1 A 1 CYP 2 D 6 Блок 2 GSTM 1 GSTT 1 Блок-3 NAT 2 MTHFR Блок 4 СYP 2 C 9 CYP 2 C 19 - C 4887 A A 4889 G G 1934 A Del. A 2637 0/0 0/+ 481 C>T 590 G>A C 677 T C 430 T C 61075 T G 681 A T 6235 C +/+ 895 G>A
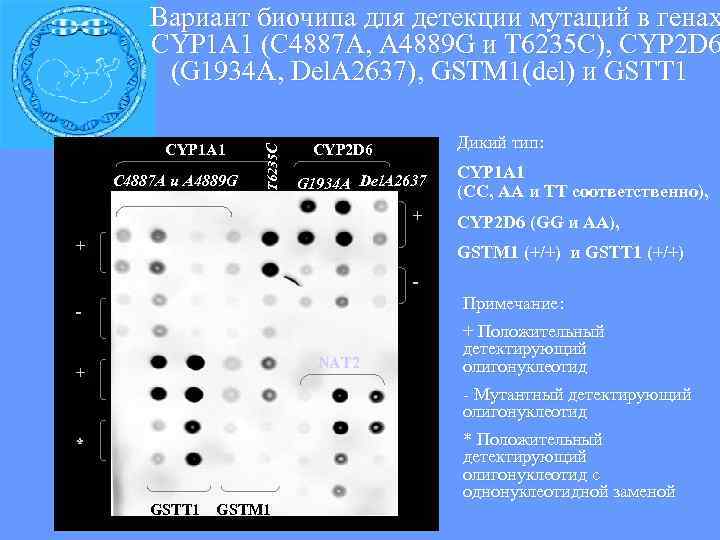
CYP 1 A 1 С 4887 А и A 4889 G T 6235 C Вариант биочипа для детекции мутаций в генах CYP 1 A 1 (С 4887 А, A 4889 G и T 6235 C), CYP 2 D 6 (G 1934 A, Del. A 2637), GSTM 1(del) и GSTT 1 Дикий тип: CYP 2 D 6 G 1934 A Del. A 2637 + + CYP 1 A 1 (СС, AA и TT соответственно), CYP 2 D 6 (GG и AA), GSTM 1 (+/+) и GSTT 1 (+/+) - Примечание: + + Положительный детектирующий олигонуклеотид NAT 2 * GSTT 1 GSTM 1 - Мутантный детектирующий олигонуклеотид * Положительный детектирующий олигонуклеотид с однонуклеотидной заменой

ТПМТ-БИОЧИП Структура и аллельные варианты гена ТРМТ. Ген Thiopurine S-methyltransferase (TPMT) локализован на хромосоме 6 p 22. 3 и состоит из 9 интронов и 10 экзонов. Белковый продукт гена TPMT инактивирует противоопухолевые препараты: меркаптопурин, азатиопурин, тиогуанин. 1 из 300 европейцев является гомозиготой по аллелю с очень низкой ферментной активностью по данному локусу. ~ 10 % индивидов - гетерозиготы по аллелю со средней белковой активностью. ~ 89% людей - гомозиготы по аллелю с высокой белковой активностью.

УЖЕ СУЩЕСТВУЮЩИЕ И РАЗРАБАТЫВАЕМЫЕ МИКРОЧИПЫ 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Фармбиочип Тромбочип Кардиочип ТМПТ-биочип Остеопороз Муковисцидоз Бронхиальная астма 7. Ожирение Онкология

ВЫВОДЫ 1. Чувствительность человека к экзогенным факторам в т. ч. к лекарственным препаратам определяется состоянием и функциональной активностью генов метаболизма 2. Основу индивидуальной чувствительности к лекарственным препаратам составляют особенности генетического полиморфизма 3. Выбор оптимальной индивидуальной дозировки лекарства должен производиться с учетом результатов тестирования соответствующих генов метаболизма 4. Технология биочипов существенно повышает эффективность популяционных и скринирующих программ по фармакогенетике и предиктивной медицине.
лекция_6_farmakogenetika_23_09_08.ppt