Фармакогенетика и фармакогеномика.pptx
- Количество слайдов: 38
 Фармакогенетика и фармакогеномика Выполнила студентка 44 группы 6 курса л/ф Балашова М. С. 2012 г.
Фармакогенетика и фармакогеномика Выполнила студентка 44 группы 6 курса л/ф Балашова М. С. 2012 г.
 Фармакогеномика - направление фармакологии, изучающее влияние генетических изменений на чувствительность к препаратам и связь экспрессии гена или нуклеотидного полиморфизма (SNPs) с эффективностью ЛС или его токсичностью. Фармакогеномика изучает весь генотип человека, в то время как фармакогенетика - взаимодействие единичных генов с ЛС.
Фармакогеномика - направление фармакологии, изучающее влияние генетических изменений на чувствительность к препаратам и связь экспрессии гена или нуклеотидного полиморфизма (SNPs) с эффективностью ЛС или его токсичностью. Фармакогеномика изучает весь генотип человека, в то время как фармакогенетика - взаимодействие единичных генов с ЛС.
 Историческая справка Фридрих Фогель Арно Мотульски За несколько лет до этого практически одновременно были открыты сразу три фармакогенетических феномена, которые впервые были обобщены генетиками Фридрихом Фогелем и американцем польского происхождения Арно Мотульски, а также фармакологом из Канады Вернером Каллоу.
Историческая справка Фридрих Фогель Арно Мотульски За несколько лет до этого практически одновременно были открыты сразу три фармакогенетических феномена, которые впервые были обобщены генетиками Фридрихом Фогелем и американцем польского происхождения Арно Мотульски, а также фармакологом из Канады Вернером Каллоу.
 Первый — дефицит фермента глюкозо-6 фосфатдегидрогеназы, при котором прием противомалярийных препаратов (хинина, плазмохина, примахина) вызывает гемолиз эритроцитов. Второй — феномен применения противотуберкулезного препарата изониазида, который у одних больных вызывал побочные эффекты, у других — нет. Третий — миорелаксант дитилин.
Первый — дефицит фермента глюкозо-6 фосфатдегидрогеназы, при котором прием противомалярийных препаратов (хинина, плазмохина, примахина) вызывает гемолиз эритроцитов. Второй — феномен применения противотуберкулезного препарата изониазида, который у одних больных вызывал побочные эффекты, у других — нет. Третий — миорелаксант дитилин.
 Генетически обусловленные патологические реакции на ЛС: I. Варианты фармакогенетической патологии с доказанной возможностью наследования: - 1)Энзимопатия, обусловленная дефицитом Г-6 -ФД; - 2)Энзимопатия, обусловленная полиморфизмом ацетилтрансферазы; - 3)Энзимопатия, развивающаяся вследствие полиморфизма внутриглазного давления при кортикостероидной терапии; - 4)Энзимопатия, обусловленная дефицитом метгемоглобинредуктазы; - 5)Энзимопатия, обусловленная полиморфизмом холинэстеразы; - 6) прочие энзимопатии, редко наблюдаемые в популяции.
Генетически обусловленные патологические реакции на ЛС: I. Варианты фармакогенетической патологии с доказанной возможностью наследования: - 1)Энзимопатия, обусловленная дефицитом Г-6 -ФД; - 2)Энзимопатия, обусловленная полиморфизмом ацетилтрансферазы; - 3)Энзимопатия, развивающаяся вследствие полиморфизма внутриглазного давления при кортикостероидной терапии; - 4)Энзимопатия, обусловленная дефицитом метгемоглобинредуктазы; - 5)Энзимопатия, обусловленная полиморфизмом холинэстеразы; - 6) прочие энзимопатии, редко наблюдаемые в популяции.
 II. Генетические нарушения, изменяющие чувствительность к лекарствам (подагра, порфирин, периодический паралич, синдром Жильбера и др. ). III. Состояния, при которых генетические факторы могут изменять реакции на лекарства (энзимопатия, связанная с дефицитом a-антитрипсина, болезнь итаи-итаи, болезнь Минмата и др. ).
II. Генетические нарушения, изменяющие чувствительность к лекарствам (подагра, порфирин, периодический паралич, синдром Жильбера и др. ). III. Состояния, при которых генетические факторы могут изменять реакции на лекарства (энзимопатия, связанная с дефицитом a-антитрипсина, болезнь итаи-итаи, болезнь Минмата и др. ).
 Гемолиз эритроцитов наблюдается у больных с недостаточностью глюкозо-6 -фосфатдегидрогеназы приеме ряда лекарственные средств: - Противомалярийные средства: примахин, памахин - Препараты, содержащие сульфоновую группу: дапсон, сульфаниламиды (в частности сульфаметаксозол) - Нитрофурантоин - Анальгетики: ацетанилид, феназопиридин - Другие: менадион, доксорубицин, метиленовый синий, налидиксовая кислота, фуразолидон, ниридазол
Гемолиз эритроцитов наблюдается у больных с недостаточностью глюкозо-6 -фосфатдегидрогеназы приеме ряда лекарственные средств: - Противомалярийные средства: примахин, памахин - Препараты, содержащие сульфоновую группу: дапсон, сульфаниламиды (в частности сульфаметаксозол) - Нитрофурантоин - Анальгетики: ацетанилид, феназопиридин - Другие: менадион, доксорубицин, метиленовый синий, налидиксовая кислота, фуразолидон, ниридазол
 Наследственный дефицит фермента глюкозо-6 фосфатдегидрогеназы (Г-6 -ФД) часто встречается в природных зонах распространения малярии (на карте выделены темным цветом)
Наследственный дефицит фермента глюкозо-6 фосфатдегидрогеназы (Г-6 -ФД) часто встречается в природных зонах распространения малярии (на карте выделены темным цветом)
 Наследование дефицита Г-6 -ФДГ сцеплено с Ххромосомой, поэтому болеют в основном мужчины, реже — гомозиготные женщины. Признаки гемолиза (желтушность склер, темная моча) могут возникнуть на 2 -е — 3 -й сутки после начала приема лекарственного препарата. Если не прекратить прием, то на 4— 5 -е сутки может возникнуть гемолитический криз с выделением мочи черного цвета. Некоторые препараты оказывают гемолитическое действие у людей с недостаточностью Г-6 -ФДГ только при определенных условиях. Предрасполагающими факторами являются инфекции, недостаточность функций печени и почек, диабетический ацидоз и т. д.
Наследование дефицита Г-6 -ФДГ сцеплено с Ххромосомой, поэтому болеют в основном мужчины, реже — гомозиготные женщины. Признаки гемолиза (желтушность склер, темная моча) могут возникнуть на 2 -е — 3 -й сутки после начала приема лекарственного препарата. Если не прекратить прием, то на 4— 5 -е сутки может возникнуть гемолитический криз с выделением мочи черного цвета. Некоторые препараты оказывают гемолитическое действие у людей с недостаточностью Г-6 -ФДГ только при определенных условиях. Предрасполагающими факторами являются инфекции, недостаточность функций печени и почек, диабетический ацидоз и т. д.
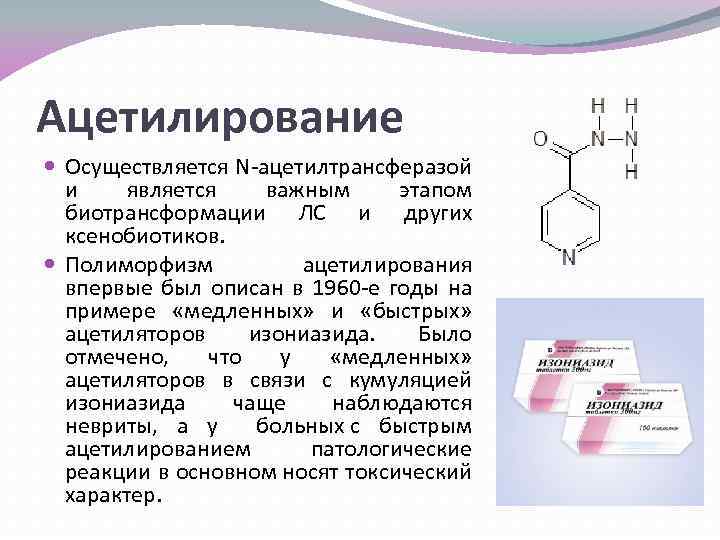 Ацетилирование Осуществляется N-ацетилтрансферазой и является важным этапом биотрансформации ЛС и других ксенобиотиков. Полиморфизм ацетилирования впервые был описан в 1960 -е годы на примере «медленных» и «быстрых» ацетиляторов изониазида. Было отмечено, что у «медленных» ацетиляторов в связи с кумуляцией изониазида чаще наблюдаются невриты, а у больных с быстрым ацетилированием патологические реакции в основном носят токсический характер.
Ацетилирование Осуществляется N-ацетилтрансферазой и является важным этапом биотрансформации ЛС и других ксенобиотиков. Полиморфизм ацетилирования впервые был описан в 1960 -е годы на примере «медленных» и «быстрых» ацетиляторов изониазида. Было отмечено, что у «медленных» ацетиляторов в связи с кумуляцией изониазида чаще наблюдаются невриты, а у больных с быстрым ацетилированием патологические реакции в основном носят токсический характер.
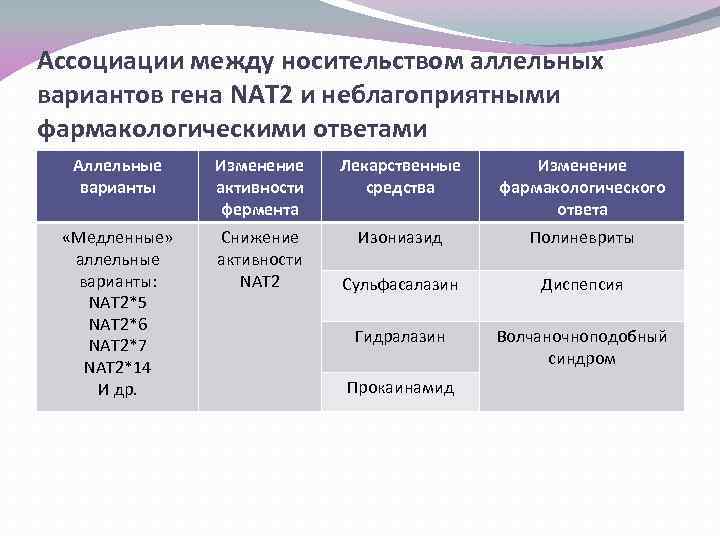 Ассоциации между носительством аллельных вариантов гена NAT 2 и неблагоприятными фармакологическими ответами Аллельные варианты Изменение активности фермента Лекарственные средства Изменение фармакологического ответа «Медленные» аллельные варианты: NAT 2*5 NAT 2*6 NAT 2*7 NAT 2*14 И др. Снижение активности NAT 2 Изониазид Полиневриты Сульфасалазин Диспепсия Гидралазин Волчаночноподобный синдром Прокаинамид
Ассоциации между носительством аллельных вариантов гена NAT 2 и неблагоприятными фармакологическими ответами Аллельные варианты Изменение активности фермента Лекарственные средства Изменение фармакологического ответа «Медленные» аллельные варианты: NAT 2*5 NAT 2*6 NAT 2*7 NAT 2*14 И др. Снижение активности NAT 2 Изониазид Полиневриты Сульфасалазин Диспепсия Гидралазин Волчаночноподобный синдром Прокаинамид
 Тип ацетилирования определяют методами фено- и генотипирования NAT 2. В качестве маркерных субстратов ацетилирования широко используют дапсон и сульфадимезин. Отношение концентраций моноацетилдапсона и дапсона в плазме крови через 6 ч после введения препарата менее 0, 35 характерно для «медленных» , а более 0, 35 — для «быстрых» ацетиляторов. Если в качестве маркерного субстрата используют сульфадимезин, содержание его менее 25% принятой дозы в плазме через 6 ч и менее 70% в моче, собранной через 5 -6 ч после введения, свидетельствует о фенотипе «медленного» ацетилирования.
Тип ацетилирования определяют методами фено- и генотипирования NAT 2. В качестве маркерных субстратов ацетилирования широко используют дапсон и сульфадимезин. Отношение концентраций моноацетилдапсона и дапсона в плазме крови через 6 ч после введения препарата менее 0, 35 характерно для «медленных» , а более 0, 35 — для «быстрых» ацетиляторов. Если в качестве маркерного субстрата используют сульфадимезин, содержание его менее 25% принятой дозы в плазме через 6 ч и менее 70% в моче, собранной через 5 -6 ч после введения, свидетельствует о фенотипе «медленного» ацетилирования.
 Глюкокортикоиды и глаукома Закапывание в глаза раствора глюкокортикоидов у некоторых людей вызывает сильное повышение внутриглазного давления, у других - меньшее, а у третьих внутриглазное давление совсем не повышается (5; 29 и 66% соответственно). Особенно выраженно на глюкокортикоиды реагируют родственники больных открытоугольной глаукомой. ПОУГ относят к генетически обусловленным заболеваниям. Описаны и доминантный, и рецессивный типы наследования, однако в большинстве случаев отмечается полигенная передача заболевания.
Глюкокортикоиды и глаукома Закапывание в глаза раствора глюкокортикоидов у некоторых людей вызывает сильное повышение внутриглазного давления, у других - меньшее, а у третьих внутриглазное давление совсем не повышается (5; 29 и 66% соответственно). Особенно выраженно на глюкокортикоиды реагируют родственники больных открытоугольной глаукомой. ПОУГ относят к генетически обусловленным заболеваниям. Описаны и доминантный, и рецессивный типы наследования, однако в большинстве случаев отмечается полигенная передача заболевания.
 Дефицит метгемоглобинредуктазы Врожденные энзимопенические метгемоглобинемии наследуются по аутосомно-рецессивному типу. В отличие от оксигемоглобина метгемоглобин содержит трехвалентное железо, прочно связывает кислород и поэтому непригоден для его транспорта. В норме метгемоглобин содержится в эритроцитах в небольших количествах (0, 5 -3%).
Дефицит метгемоглобинредуктазы Врожденные энзимопенические метгемоглобинемии наследуются по аутосомно-рецессивному типу. В отличие от оксигемоглобина метгемоглобин содержит трехвалентное железо, прочно связывает кислород и поэтому непригоден для его транспорта. В норме метгемоглобин содержится в эритроцитах в небольших количествах (0, 5 -3%).
 Самая известная семья с синим цветом кожи – семья Фугэйт (Fugates) из Кентукки.
Самая известная семья с синим цветом кожи – семья Фугэйт (Fugates) из Кентукки.
 Многие лекарственные вещества (нитроглицерин, сульфаниламиды, хлорамфеникол, ПАСК, антипирин и т. д. ), особенно при их длительном применении в больших дозах, могут вызвать метгемоглобинемию, однако у большинства людей под влиянием метгемоглобинредуктазы быстро происходит восстановление метгемоглобина. При наследственной недостаточности метгемоглобинредуктазы в крови больных резко повышается (до 30 -40%) концентрация метгемоглобина. Чувствительность таких больных к токсическому действию метгемоглобинобразующих лекарственных средств очень высока. При выраженной метгемоглобинемии внутривенно вводят метиленовый синий (1 -2 мг/кг) и назначают аскорбиновую кислоту по 0, 3 г.
Многие лекарственные вещества (нитроглицерин, сульфаниламиды, хлорамфеникол, ПАСК, антипирин и т. д. ), особенно при их длительном применении в больших дозах, могут вызвать метгемоглобинемию, однако у большинства людей под влиянием метгемоглобинредуктазы быстро происходит восстановление метгемоглобина. При наследственной недостаточности метгемоглобинредуктазы в крови больных резко повышается (до 30 -40%) концентрация метгемоглобина. Чувствительность таких больных к токсическому действию метгемоглобинобразующих лекарственных средств очень высока. При выраженной метгемоглобинемии внутривенно вводят метиленовый синий (1 -2 мг/кг) и назначают аскорбиновую кислоту по 0, 3 г.
 Атипичная холинэстераза Чувствительность к суксаметонию(дитилину) связана с мутацией в локусе сывороточной холинэстеразы. Атипичная холинэстераза не инактивирует дитилин, применяющийся в хирургии как мышечный релаксант, поэтому у обладателей такого фермента возможна длительная остановка дыхания (в течение 1 ч).
Атипичная холинэстераза Чувствительность к суксаметонию(дитилину) связана с мутацией в локусе сывороточной холинэстеразы. Атипичная холинэстераза не инактивирует дитилин, применяющийся в хирургии как мышечный релаксант, поэтому у обладателей такого фермента возможна длительная остановка дыхания (в течение 1 ч).
 Синтез ХЭ в плазме определяют два локуса: Е 1, локализованный на 3 -й хромосоме, и Е 2, локализованный на 16 -й хромосоме. Имеются два патологических аллеля ( Еs и Ef ; норма Eu ), которые отличаются по силе действия. У гетерозигот по аллелям Еs и Еf полностью проявляется патологический эффект, а гетерозиготы типа Eu. Еs или Eu. Еf обладают нормальной активностью холинестеразы.
Синтез ХЭ в плазме определяют два локуса: Е 1, локализованный на 3 -й хромосоме, и Е 2, локализованный на 16 -й хромосоме. Имеются два патологических аллеля ( Еs и Ef ; норма Eu ), которые отличаются по силе действия. У гетерозигот по аллелям Еs и Еf полностью проявляется патологический эффект, а гетерозиготы типа Eu. Еs или Eu. Еf обладают нормальной активностью холинестеразы.
 Атипичную холинестеразу идентифицируют в лабораторных условиях. Определение активности ХЭ у пациента в предоперационный период позволяет избежать внештатной ситуации при операции. Генетические варианты ХЭ выявляют с помощью дибукаинового показателя, основанного на определении процента ингибирования ферментативной активности в присутствии дибукаина. Длительное апноэ, возникшее вследствие недостаточности холинэстеразы в плазме крови, можно устранить (хотя и не всегда) переливанием плазмы или концентрированного раствора изолированной холинэстеразы.
Атипичную холинестеразу идентифицируют в лабораторных условиях. Определение активности ХЭ у пациента в предоперационный период позволяет избежать внештатной ситуации при операции. Генетические варианты ХЭ выявляют с помощью дибукаинового показателя, основанного на определении процента ингибирования ферментативной активности в присутствии дибукаина. Длительное апноэ, возникшее вследствие недостаточности холинэстеразы в плазме крови, можно устранить (хотя и не всегда) переливанием плазмы или концентрированного раствора изолированной холинэстеразы.
 Злокачественная гипертермия – заболевание, которое является состоянием острого гиперметаболизма скелетной мускулатуры и возникает применении местных анестетиков, средств для ингаляционного наркоза, сукцинилхолина. Злокачественная гипертермия наследуется аутосомнодоминантно. При этом дефектен RYR-1 ген, расположенный на длинном плече 19 -й хромосомы (19 q 13. 1) и отвечающий за кодирование рианодинового рецептора (кальциевый канал саркоплазматического ретикулума)[3]. Более 25 мутаций этого гена связаны со злокачественной гипертермией. У больных температура тела повышается до 44 о. С и более, при этом наблюдается тахикардия, учащение дыхания, гипоксия, ацидоз, гиперкалимия, гипокальциемия.
Злокачественная гипертермия – заболевание, которое является состоянием острого гиперметаболизма скелетной мускулатуры и возникает применении местных анестетиков, средств для ингаляционного наркоза, сукцинилхолина. Злокачественная гипертермия наследуется аутосомнодоминантно. При этом дефектен RYR-1 ген, расположенный на длинном плече 19 -й хромосомы (19 q 13. 1) и отвечающий за кодирование рианодинового рецептора (кальциевый канал саркоплазматического ретикулума)[3]. Более 25 мутаций этого гена связаны со злокачественной гипертермией. У больных температура тела повышается до 44 о. С и более, при этом наблюдается тахикардия, учащение дыхания, гипоксия, ацидоз, гиперкалимия, гипокальциемия.

 Первые симптомы ЗГ часто проявляются либо спустя некоторое время после введения провоцирующего препарата, либо в послеоперативном периоде. Самый ранний признак заболевания — быстрый рост уровня СО 2 в выдыхаемом воздухе. Классические признаки ЗГ — тахикардия, тахипноэ, гипертермия, цианоз, генерализованная мышечная ригидность. Лабораторные данные — значительное повышение Ра. СО 2, снижение Ра. О 2, смешанный ацидоз, гиперкалиемия и миоглобинемия. Золотой стандарт диагностики ЗГ - галотан-кофеиновый сократительный тест на разрыв мышечного волокна. Лечение: Дантролен— единственный специфический препарат, действующий прямо на рианодиновые рецепторы, предупреждая высвобождение кальция[.
Первые симптомы ЗГ часто проявляются либо спустя некоторое время после введения провоцирующего препарата, либо в послеоперативном периоде. Самый ранний признак заболевания — быстрый рост уровня СО 2 в выдыхаемом воздухе. Классические признаки ЗГ — тахикардия, тахипноэ, гипертермия, цианоз, генерализованная мышечная ригидность. Лабораторные данные — значительное повышение Ра. СО 2, снижение Ра. О 2, смешанный ацидоз, гиперкалиемия и миоглобинемия. Золотой стандарт диагностики ЗГ - галотан-кофеиновый сократительный тест на разрыв мышечного волокна. Лечение: Дантролен— единственный специфический препарат, действующий прямо на рианодиновые рецепторы, предупреждая высвобождение кальция[.

 Генетический полиморфизм гликопротеина-Р Гликопротеин-Р представляет собой белок-переносчик, локализованный на мембране клеток кишечника и участвующий в выведении из них в просвет кишечника некоторых ЛС (например, дигоксина, верапамила, дилтиазема, ингибиторов ВИЧ-протеазы, колхицина, циклоспорина). Идентифицировано несколько мутаций в гене гликопротеина-Р, приводящих к изменению фармакокинетики ЛС. Наиболее распространённая мутация гликопротеина Р приводит к синтезу гликопротеина-Р со сниженной активностью. У гомозигот по этой мутации создаются высокие концентрации дигоксина в плазме крови, следовательно, чаще развиваются нежелательные лекарственные реакции на препарат. Мутацию наследуют по аутосомнорецессивному типу. Распространённость гомозигот по этой мутации в европейской популяции высока (24%). Внедрение в клиническую практику генотипирования гликопротеина-Р позволит повысить эффективность и безопасность терапии дигоксином и другими субстратами гликопротеина-Р.
Генетический полиморфизм гликопротеина-Р Гликопротеин-Р представляет собой белок-переносчик, локализованный на мембране клеток кишечника и участвующий в выведении из них в просвет кишечника некоторых ЛС (например, дигоксина, верапамила, дилтиазема, ингибиторов ВИЧ-протеазы, колхицина, циклоспорина). Идентифицировано несколько мутаций в гене гликопротеина-Р, приводящих к изменению фармакокинетики ЛС. Наиболее распространённая мутация гликопротеина Р приводит к синтезу гликопротеина-Р со сниженной активностью. У гомозигот по этой мутации создаются высокие концентрации дигоксина в плазме крови, следовательно, чаще развиваются нежелательные лекарственные реакции на препарат. Мутацию наследуют по аутосомнорецессивному типу. Распространённость гомозигот по этой мутации в европейской популяции высока (24%). Внедрение в клиническую практику генотипирования гликопротеина-Р позволит повысить эффективность и безопасность терапии дигоксином и другими субстратами гликопротеина-Р.
 Взаимодействие изоферментов цитохрома Р 450 с лекарственными препаратами
Взаимодействие изоферментов цитохрома Р 450 с лекарственными препаратами
 Полиморфизм CYP 2 C 9 является главным ферментом метаболизма многих НПВС, ингибиторов ангиотензиновых рецепторов, производных сульфонилмочевины, фенитоина, непрямых антикоагулянтов и др. Варианты 144 С (CYP 2 C 9*2) и 359 L (CYP 2 C 9*3) определяют индивидуальную чувствительность пациента к антикоагуляционной терапии варфарином Частота встречаемости варианта CYP 2 C 9*2 составляет 11%, а варианта CYP 2 C 9*3 - 7% в европейских популяциях.
Полиморфизм CYP 2 C 9 является главным ферментом метаболизма многих НПВС, ингибиторов ангиотензиновых рецепторов, производных сульфонилмочевины, фенитоина, непрямых антикоагулянтов и др. Варианты 144 С (CYP 2 C 9*2) и 359 L (CYP 2 C 9*3) определяют индивидуальную чувствительность пациента к антикоагуляционной терапии варфарином Частота встречаемости варианта CYP 2 C 9*2 составляет 11%, а варианта CYP 2 C 9*3 - 7% в европейских популяциях.

 Клинические данные Частота кровотечений у носителей мутаций применении варфарина составляет до 26, 5% , из них больших - требующих переливания крови, хирургического вмешательства -до 4, 2% в год. Необходимая ежедневная доза варфарина у носителей аллелей CYP 2 C 9*2 и CYP 2 C 9*3 существенно ниже, а терапевтический эффект достигается значительно быстрее по сравнению с пациентами, не несущими данных аллельных вариантов.
Клинические данные Частота кровотечений у носителей мутаций применении варфарина составляет до 26, 5% , из них больших - требующих переливания крови, хирургического вмешательства -до 4, 2% в год. Необходимая ежедневная доза варфарина у носителей аллелей CYP 2 C 9*2 и CYP 2 C 9*3 существенно ниже, а терапевтический эффект достигается значительно быстрее по сравнению с пациентами, не несущими данных аллельных вариантов.
 Подбор дозы Для проведения эффективной и безопасной терапии варфарином начальная доза должна составлять: - При выявлении у пациента генотипа CYP 2 C 9* 1/1 -5 мг/сутки; - При выявлении у пациента генотипа CYP 2 C 9* 1/2 - 3, 75 мг/сутки; - При выявлении у пациента генотипа CYP 2 C 9*l/3 - 2, 5 мг/сутки - - Для носителей CYP 2 C 9*2/2, *2/3, *3/3 -предположительно 2, 5 мг/сутки В настоящее время проводятся исследования, цель которых – определить, имеет ли преимущество фармакогенетический подход перед стандартным эмпирическим подбором дозы Варфарина. Однако в рекомендациях АССР 2008 года говорится, что в отсутствие в настоящее время данных специальных рандомизированных исследований использование для всех больных фармакогенетического подхода к назначению АВК не оправдано.
Подбор дозы Для проведения эффективной и безопасной терапии варфарином начальная доза должна составлять: - При выявлении у пациента генотипа CYP 2 C 9* 1/1 -5 мг/сутки; - При выявлении у пациента генотипа CYP 2 C 9* 1/2 - 3, 75 мг/сутки; - При выявлении у пациента генотипа CYP 2 C 9*l/3 - 2, 5 мг/сутки - - Для носителей CYP 2 C 9*2/2, *2/3, *3/3 -предположительно 2, 5 мг/сутки В настоящее время проводятся исследования, цель которых – определить, имеет ли преимущество фармакогенетический подход перед стандартным эмпирическим подбором дозы Варфарина. Однако в рекомендациях АССР 2008 года говорится, что в отсутствие в настоящее время данных специальных рандомизированных исследований использование для всех больных фармакогенетического подхода к назначению АВК не оправдано.
 Полиморфизм CYP 2 D 6 Цитохром CYP 2 D 6 участвует в метаболизме миансерина и других антидепрессантов и нейролептиков . Действие миансерина зависит от перехода из неактивной формы в активную – десметилмиансерин. Кроме того, CYP 2 D 6 ответственен за прочие пути метаболизма миансерина, включая гидроксилирование. У «медленных» метаболизаторов на уровне минимальных терапевтических доз развиваются выраженные побочные реакции, препятствующие увеличению интенсивности фармакологического воздействия и достижению желаемого терапевтического эффекта. Аналогичное действие оказывается приеме тиоридазина, применяющегося при шихофрении.
Полиморфизм CYP 2 D 6 Цитохром CYP 2 D 6 участвует в метаболизме миансерина и других антидепрессантов и нейролептиков . Действие миансерина зависит от перехода из неактивной формы в активную – десметилмиансерин. Кроме того, CYP 2 D 6 ответственен за прочие пути метаболизма миансерина, включая гидроксилирование. У «медленных» метаболизаторов на уровне минимальных терапевтических доз развиваются выраженные побочные реакции, препятствующие увеличению интенсивности фармакологического воздействия и достижению желаемого терапевтического эффекта. Аналогичное действие оказывается приеме тиоридазина, применяющегося при шихофрении.
 Недостаточность гидроксилазы При наличии наследственной недостаточности гидроксилаз смешанного типа снижается интенсивность и меняется характер метаболизма дифенина, непрямых антикоагулянтов и фенацетина. Вследствие снижения интенсивности парагидроксилирования дифенина повторный прием его приводит к кумуляции, проявляющейся рядом побочных реакций и осложнений: головокружением, возбуждением, лихорадкой, нистагмом, тремором, атаксией; возможен полиневрит.
Недостаточность гидроксилазы При наличии наследственной недостаточности гидроксилаз смешанного типа снижается интенсивность и меняется характер метаболизма дифенина, непрямых антикоагулянтов и фенацетина. Вследствие снижения интенсивности парагидроксилирования дифенина повторный прием его приводит к кумуляции, проявляющейся рядом побочных реакций и осложнений: головокружением, возбуждением, лихорадкой, нистагмом, тремором, атаксией; возможен полиневрит.
 Полиморфизм HER 2 Ген ERBB 2 (HER 2) кодирует тирозинкиназу и является членом семейства рецепторов эпидермальных факторов роста (ЭФР). Рецептор HER 2 – один из наиболее значимых молекулярных маркеров при раке молочной железы. Знание HER 2 -статуса важно сразу с нескольких точек зрения: - Позволяет врачу оценить склонность опухоли к прогрессированию; - Позволяет определить реакцию организма на предложенное лечение. Герцептин – эффективный метода лечения HER 2 -позитивного рака молочной железы
Полиморфизм HER 2 Ген ERBB 2 (HER 2) кодирует тирозинкиназу и является членом семейства рецепторов эпидермальных факторов роста (ЭФР). Рецептор HER 2 – один из наиболее значимых молекулярных маркеров при раке молочной железы. Знание HER 2 -статуса важно сразу с нескольких точек зрения: - Позволяет врачу оценить склонность опухоли к прогрессированию; - Позволяет определить реакцию организма на предложенное лечение. Герцептин – эффективный метода лечения HER 2 -позитивного рака молочной железы
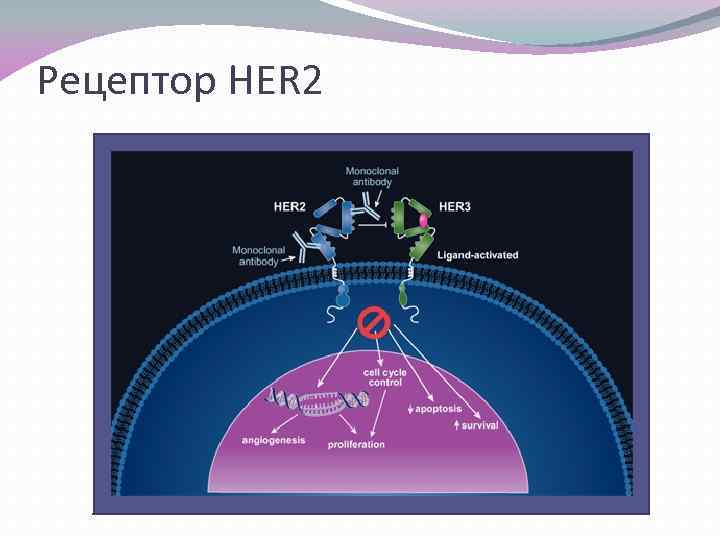 Рецептор HER 2
Рецептор HER 2
 Генетический полиморфизм тиопурин S -метилтрансферазы (ТРМТ) ТРМТ — фермент, катализирующий реакцию S-метилирования производных тиопурина, т. е. основного пути метаболизма цитостатиков из группы антагонистов пурина (меркаптопурина, тиогуанина, азатиоприна). Активность ТРМТ у людей различается. У пациентов с низкой активностью фермента повышена чувствительность к перечисленным цитостатикам, проявляющаяся опасными для жизни гематотоксическими (лейкопенией, тромбоцитопенией, анемией) и гепатотоксическими эффектами. Снижение активности ТРМТ наследуется по аутосомно-рецессивному типу, у гомозигот низкая активность, у гетерозигот промежуточная. Для обеспечения безопасности проводимой химиотерапии перед назначением тиопуринов следует определять активность ТРМТ в эритроцитах пациента (фенотипирование ТРМТ) или генотип пациента с помощью ПЦР (генотипирование ТРМТ). Разработана коррекция дозировок меркаптопурина в зависимости от активности ТРМТ или генотипа этого фермента (безопасные дозы для пациентов с низкой активностью ТРМТ в 10 -15 раз ниже среднетерапевтических).
Генетический полиморфизм тиопурин S -метилтрансферазы (ТРМТ) ТРМТ — фермент, катализирующий реакцию S-метилирования производных тиопурина, т. е. основного пути метаболизма цитостатиков из группы антагонистов пурина (меркаптопурина, тиогуанина, азатиоприна). Активность ТРМТ у людей различается. У пациентов с низкой активностью фермента повышена чувствительность к перечисленным цитостатикам, проявляющаяся опасными для жизни гематотоксическими (лейкопенией, тромбоцитопенией, анемией) и гепатотоксическими эффектами. Снижение активности ТРМТ наследуется по аутосомно-рецессивному типу, у гомозигот низкая активность, у гетерозигот промежуточная. Для обеспечения безопасности проводимой химиотерапии перед назначением тиопуринов следует определять активность ТРМТ в эритроцитах пациента (фенотипирование ТРМТ) или генотип пациента с помощью ПЦР (генотипирование ТРМТ). Разработана коррекция дозировок меркаптопурина в зависимости от активности ТРМТ или генотипа этого фермента (безопасные дозы для пациентов с низкой активностью ТРМТ в 10 -15 раз ниже среднетерапевтических).
 Другие примеры фармакогенетического подхода в онкологии: 5 -фторурацил применяются при опухолях различных локализаций. При мутации фермента DPYD следует уменьшить дозу препарата в 5 -10 раз для избежания выраженных побочных эффектов. Иресса (Гефитиниб) и Тарцева (Эрлотиниб) являются ингибиторами TK EGFR и применяются в современной таргетной терапии немелкоклеточного рака легкого. Наличие мутаций в гене EGFR является показанием к их применению. Эрбитукс и Вектибикс рекомендуется применять только для лечения опухолей (рак толстой кишки), содержащих ген KRAS дикого типа (т. е. без мутаций).
Другие примеры фармакогенетического подхода в онкологии: 5 -фторурацил применяются при опухолях различных локализаций. При мутации фермента DPYD следует уменьшить дозу препарата в 5 -10 раз для избежания выраженных побочных эффектов. Иресса (Гефитиниб) и Тарцева (Эрлотиниб) являются ингибиторами TK EGFR и применяются в современной таргетной терапии немелкоклеточного рака легкого. Наличие мутаций в гене EGFR является показанием к их применению. Эрбитукс и Вектибикс рекомендуется применять только для лечения опухолей (рак толстой кишки), содержащих ген KRAS дикого типа (т. е. без мутаций).
 Заключение Таким образом, в настоящее время наиболее близким к клинической практике направлением развития персонализированной медицины является выбор ЛС на основе изучения генетических особенностей пациентов. При этом фармакогенетический подход наиболее оправдан при лечении пациентов с высоким риском развития нежелательных лекарственных реакций, а также применении ЛС, характеризующихся: - большим спектром и выраженностью нежелательных лекарственных реакций; - длительным применением (сердечно-сосудистые, психотропные ЛС, гормональные препараты и т. д. ); - узким терапевтическим диапазоном; - высокой стоимостью.
Заключение Таким образом, в настоящее время наиболее близким к клинической практике направлением развития персонализированной медицины является выбор ЛС на основе изучения генетических особенностей пациентов. При этом фармакогенетический подход наиболее оправдан при лечении пациентов с высоким риском развития нежелательных лекарственных реакций, а также применении ЛС, характеризующихся: - большим спектром и выраженностью нежелательных лекарственных реакций; - длительным применением (сердечно-сосудистые, психотропные ЛС, гормональные препараты и т. д. ); - узким терапевтическим диапазоном; - высокой стоимостью.
 Для того чтобы фармакогенетический тест стал реальным инструментом персонализированной медицины в клинической практике, он должен отвечать следующим требованиям: - наличие выраженной ассоциации между выявляемым аллелем того или иного гена и неблагоприятным фармакологическим ответом - высокая чувствительность, специфичность, предсказательная ценность положительного (PPV) и отрицательного (NPV) результатов; - четкий алгоритм применения ЛС в зависимости от результатов фармакогенетического теста: выбор ЛС, режима дозирования, «агрессивная» тактика ведения пациента и т. д. - встречаемость выявляемого аллеля в популяции с частотой не менее 1%; - доказанные преимущества применения ЛС с использованием результатов фармакогенетического теста по сравнению с традиционным подходом: повышение эффективности, безопасности фармакотерапии, а также экономическая рентабельность.
Для того чтобы фармакогенетический тест стал реальным инструментом персонализированной медицины в клинической практике, он должен отвечать следующим требованиям: - наличие выраженной ассоциации между выявляемым аллелем того или иного гена и неблагоприятным фармакологическим ответом - высокая чувствительность, специфичность, предсказательная ценность положительного (PPV) и отрицательного (NPV) результатов; - четкий алгоритм применения ЛС в зависимости от результатов фармакогенетического теста: выбор ЛС, режима дозирования, «агрессивная» тактика ведения пациента и т. д. - встречаемость выявляемого аллеля в популяции с частотой не менее 1%; - доказанные преимущества применения ЛС с использованием результатов фармакогенетического теста по сравнению с традиционным подходом: повышение эффективности, безопасности фармакотерапии, а также экономическая рентабельность.
 Использование в повседневной клинической практике высокотехнологичных, инновационных методов персонализированной медицины вместе с достижениями доказательной медицины позволит снизить частоту нежелательных лекарственных реакций, в том числе и смертельных исходов, и повысить качество фармакотерапии.
Использование в повседневной клинической практике высокотехнологичных, инновационных методов персонализированной медицины вместе с достижениями доказательной медицины позволит снизить частоту нежелательных лекарственных реакций, в том числе и смертельных исходов, и повысить качество фармакотерапии.


