12.ФГ феномены.ppt
- Количество слайдов: 35

Фармакогенетические феномены, обусловленные различными белками Лекция 12

Большинство фармакогенетических феноменов можно связать с метаболизирующими или с рецепторными белками. Однако ряд известных генетически зависимых ответов на лекарства не вполне укладывается в эту схему либо не до конца изучен. В качестве примера можно привести резистентность к антикоагулянтному действию производных кумарина (варфарин), индуцируемую стероидами глаукому, глухоту, вызванную аминогликозидными антибиотиками, индуцируемые бериллием болезни легких, резистентность к вакцине против гепатита В, синдром удлинения QT интервала и др.

Глухота, вызванная аминогликозидными антибиотиками n В литературе описано более 200 типов наследственно зависимой потери слуха. Примерно треть из них принадлежит к синдромальным, т. е. связанным с другими аномалиями в организме. Большинство известных типов расстройств является результатом мутаций одного гена. Однако семейная потеря слуха, вызываемая аминогликозидными антибиотиками, не является синдромальной. Молекулярные основы эффекта выявлены недавно. Генетический аспект Большое количество случаев глухоты, вызванной аминогликозидными антибиотиками, описано в Китае, где проанализировано по крайней мере 20 родословных с данным заболеванием.
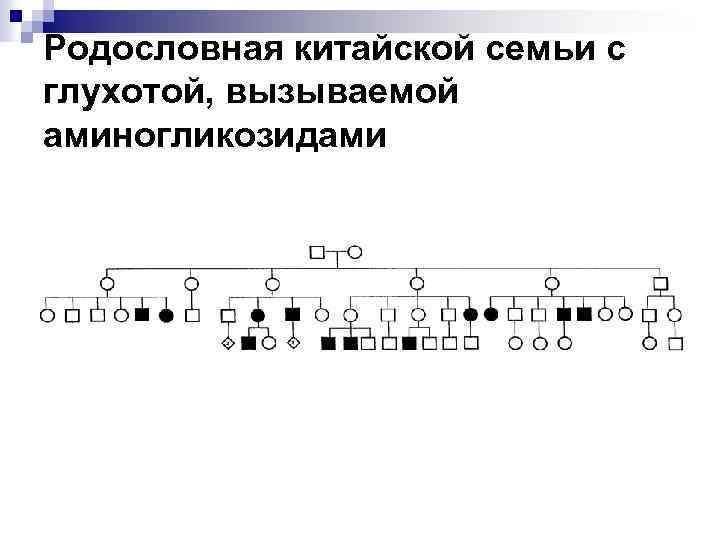
Родословная китайской семьи с глухотой, вызываемой аминогликозидами

n Совокупность фактов, демонстрирующих, что осложнение возникает у обоих полов, мужчины не передают предрасположенность дочерям или внукам через заболевших дочерей, исключает возможность доминантного, рецессивного, либо сцепленного с Ххромосомой наследования и свидетельствует, что поражение связано с митохондриальным геномом. Молекулярные основы Наиболее вероятной мишенью аминогликозидной ототоксичности представляются митохондриальные рибосомы улитки. В микробиологических исследованиях показано, что аминогликозиды способны нарушать процесс трансляции в рибосомах. Таким образом гены митохондриальной ДНК, кодирующие рибосомальные РНК и, в особенности, 12 S р. РНК гены, стали рассматриваться в качестве кандидатов для возможных мутаций при передающейся по материнской линии глухоте, вызванной аминогликозидами.

n Поиск предсказанной мутации в большой арабо израильской родословной выявил замену A→ G в nt 1555 в 12 S р. РНК гене. Несмотря на регистрацию ряда других мутаций, только эта обнаруживалась в 4 -х семьях с индуцированной аминогликозидами глухотой и отсутствовала в 278 контрольных. Мутация возникала в высококонсервативном регионе 12 S р. РНК, который связывает аминогликозиды. Биохимические основы побочного эффекта остаются неясными. Однако функциональный анализ митохондриальной ДНК показал, что ведущие к глухоте мутации возможно происходят также в генах митохондриальных АТФаз 6, 8 и в гене цитохрома b 5 (Сyt b) Значение Глухота, вызванная аминогликозидными антибиотиками, часто встречающийся феномен. Например, в Китае где эти препараты достаточно распространены, только в Шанхайском округе около 25% случаев глухоты могут быть связаны с их использованием. Поэтому практическое значение рассматриваемого феномена на сегодняшний день состоит в анализе случаев возникновения глухоты по материнской линии.

Индуцируемые бериллием заболевания легких Концентрация бериллия в области действия энергетических станций значительно выше, чем в неиндустриальных районах. Профессиональная бериллиевая болезнь может возникать при работе с керамикой, электроникой, в зубопротезной практике в ядерной и космической промышленности. У некоторых индивидуумов заболевание может индуцироваться даже при незначительных контактах с бериллием. Бериллиевая болезнь характеризуется хроническим воспалением нижних отделов респираторного тракта. Ее клиническое развитие может быть очень медленным, но ведет к тяжелым дисфункциям. Открытая форма требует продолжительной иммуносупрессивной терапии и легочной трансплантации.

n Иммунологический аспект контакта с бериллием наиболее важен. У заболевших обнаруживаются расстройства иммунитета, увеличивается уровень основных классов иммуноглобулинов (Ig G, Ig A), и аутоантител против антиядерных (ANA) и антимитохондриальных (АМА) антигенов. Бериллиевая болезнь с хроническим легочным расстройством характеризуется аккумуляцией бериллиум-специфичных Т лимфоцитов класса II главной системы гистосовместимости в легких. Генетический аспект HLA-DPβ 1 -Glu 69 является генетическим маркером бериллиевой болезни. Лимфоциты крови чувствительных лиц в присутствии солей бериллия пролиферируют in vitro. Это свойство используется для ранней диагностики заболевания. Характер наследования маркера не выяснен.

n Молекулярные основы Для выяснения основ индивидуальной предрасположенности к хронической бериллиевой болезни (ХББ) Richeldi с соавторами в 1993 г провели сравнение больных и контрольных лиц. У 32 из 33 пациентов обнаружена экспрессия Glu 69 варианта в регионе D, тогда как у здоровых этот полиморфизм имели только 27%. В дополнение к Glu 69 у больных некоторые редкие аллельные варианты были также сверхэкспрессированы. Вариант с глутаминовой кислотой – не новая мутация, возникающая от контакта с бериллием, а нормальный HLA-DP аллельный вариант, который может быть, обладает большей способностью к ответу на некоторые стимулы, в частности бериллий. Различия в частоте больных – 5% и лиц имевших сверхэкспрессированный маркер Glu 69 - 27%, показывают возможную роль в индивидуальной предрасположенности и других факторов.

Вариант с Glu 69 – мембранный гликопротеин, участвующий в распознавании антигенов. Являясь генетическим маркером заболевания, по локализации в ключевом регионе иммунологически важного локуса он может и обусловливать развитие заболевания. Регион HLA разделен на множество субрегионов как минимум 3 из которых участвуют в презентации антигенов Т-лимфоцитам: HLA-DR, -DQ и DP. Каждый D субрегион содержит гены, кодирующие α и β цепи мембранных гетеродимерных гликопротеинов, которые представляют антигены CD 4+ (helper) T-лимфоцитам. Аминокислоты, αспирального участка этого HLA гетеромера, определяют, какие пептидные антигены могут связываться. У больных с ХББ – несущая отрицательный заряд Glu, вместо положительно заряженного лизина, локализована в позиции 69. Этот глутамат способен усилить представление бериллия антигенным механизмам и генерировать антигенный ответ. Так, HLA-DPβ 1 Glu 69 может быть не только генетическим маркером ХББ, но и ее патогенетическим фактором.

n Значение Выявление генетического маркера предрасположенности к бериллиевой болезни определяет перспективы ранней диагностики заболевания и более эффективного профессионального отбора. Почти все заболевшие ХББ имеют данный признак, однако, обратная зависимость не доказана. Причина и следствия этого – предмет дальнейших исследований.

Резистентность к кумариновым антикоагулянтам Производные кумарина, такие как дикумарол, варфарин, используются в клинике для увеличения времени свертывания крови. Наследственная резистентность к этим лекарствам характеризуется неспособностью вызвать эффект в обычной терапевтической дозе. Резистентность не является абсолютной, поскольку антикоагулянтное действие достигается при увеличении дозы. Факт наследственной резистентности к варфарину был открыт на грызунах, поскольку препарат использовали для борьбы с ними. Установлено моногенное аутосомальное наследование признака. Первый случай наследственной резистентности у человека установлен в 1961 г O'Reilly.

n История болезни У 73 -летнего мужчины диагносцирован инфаркт миокарда. Кроме снижения до 55 -65% от нормы концентрации протромбина, значительных отклонений при лабораторных исследованиях не обнаружено. Из-за низкого уровня протромбина антикоагулянтные препараты не применялись, но через месяц начата терапия варфарином. Вместо ожидаемой повышенной чувствительности пациент проявил чрезвычайную устойчивость к препарату. Поскольку реакции на нормальную терапевтическую дозу 20 мг/день не было суточную дозу довели до 145 мг. Перед началом длительной терапии у больного и его родственников провели ряд фармакокинетических и фармакодинамических исследований. Абсорбция и элиминация варфарина, как и другие фармакокинетические показатели, не отличались от нормы. Предполагалось, что у больного повышено содержание витамина К и vit. K зависимого фактора свертывания крови, или имеются дополнительные пути продукции факторов свертывания крови. Однако этих изменений не обнаружили.

В тоже время исследование рецептора варфарина выявило, что его афинность у резистентных субъектов снижена в 20 раз. Более того, последние были чрезвычайно чувствительны к очень малым дозам витамина К, не вызывающего гипопротромбинемии у лиц с нормальной реакцией на варфарин. Исследуемый больной имел брата, однояйцевого близнеца, у которого инфаркт был диагносцирован на той же неделе. Его реакция на варфарин также была сниженной. Резистентность к варфарину и другим кумариновым антикоагулянтам выявлена у остальных членов семьи.

n Генетический аспект Наследственная резистентность к производным кумарина – редкий фармакогенетический феномен. Наследование – аутосомно-доминантное. n Фармакологические основы Фармакологические исследования выявили нарушение афинности общего для варфарина и вит. К рецептора. Резистентные к варфарину лица оказались чрезвычайно чувствительными к низким дозам вит. К. На основе проведенных исследований сделан вывод о мутации в гене, кодирующем участок связывания варфарина и вит. К. Однако молекулярно-генетического анализа этого феномена не проводилось.

Синдром увеличения QT- интервала Семейные случаи синдрома удлиненного QT-интервала – редкий признак, характеризующийся увеличением интервала QT на ЭКГ, что связано с ненормальной сердечной реполяризацией, обусловливает синкопальные состояния, судороги, внезапную смерть от желудочковой аритмии. Синдром впервые описан Romano и Ward в 1960 -е годы как аутосомно-доминантный признак. Сходный синдром охарактеризован в 1957 г Jervell и Lange-Nielsen у детей с глухотой, обмороками, аномалиями в ЭКГ при отсутствии других признаков заболеваний сердца. Однако при этом установлено аутосомно-рецессивное наследование. В дополнение у подверженных лиц имеется предрасположенность к аритмиям, индуцируемым антигистаминными средствами и некоторыми другими лекарствами.

n История болезни У 19 -летней женщины при плавании возникла одышка. Она упала при выходе из бассейна. Немедленно была начата кардиореспираторная реанимация. Установлена желудочковая фибрилляция. Проведена успешная дефибрилляция. Больная была доставлена в госпиталь и через несколько дней полностью восстановилась. Анализ показал, что больная страдала бронхиальной астмой, но вентиляционная функция легких была нормальной. Тест на провокацию гистамином был отрицательным. Лечащий врач назначил ей антигистаминный препарат астемизол для устранения симптомов сенной лихорадки дважды в день в суточной дозе 20 мг.

На нескольких ЭКГ QT-интервал был существенно увеличен (406 -557 мс, при норме – 370 -540 мс). Через 2 месяца после окончания приема астемизола интервал QT оставался увеличенным. В истории семьи не было случаев потерь сознания (синкопов) или внезапной смерти, глухоты. У отца и сестры QT интервал был удлинен, но они оба принимали антигистаминный препарат терфенадин. В периоде после окончания приема лекарства, их QT также был удлинен. Пациентам был назначен атенолол 50 мг дважды в день. Через 6 мес ЭКГ нормализовалась. Был поставлен диагноз Romano-Ward синдром. Женщине и членам ее семьи не рекомендовали антигистаминные препараты.

n Генетический аспект Клинические исследования и семейный анализ показали, что выделенный тип увеличения QT интервала (LQT) наследуется аутосомно-доминантно с высокой пенетрантностью. Обнаружена связь с ДНК маркером на 11 -й хромосоме. По этому маркеру носители генов LQT отделены от неносителей в трех родословных. В исследованиях на другой большой родословной показана связь LQT с H-ras-1 локусом на коротком плече 11 -й хромосомы. В последующем исследовании в Израиле показано менделевское наследование LQT и отсутствие связи с H-ras-1. Затем на основе выявленной связи в 7 семьях из 11 с H-ras-1 (онкоген) и отсутствием такового в 4 -х из 11 сделан вывод, что LQT генетически гетерогенен.

В более поздних исследованиях установлен новый ген на 11 -й хромосоме, связанный с LQT, который картирован на участке 11 р 15. 5 был обозначен KVLQT. Генетические маркеры LQT также обнаружены на хромосомах 7 и 3, а анализ HLA ситемы и предрасположенности к LQT показал, что гены в HLA регионе хромосомы 6 могут быть еще одним этиологическим элементом LQT синдрома. Другая позитивная связь получена с 5 -ю маркерами на хромосоме 4 q 25 -27. Семьи, анализ которых привел к этим данным, фенотипически отличались от предыдущих – имели выраженную синусовую брадикардию, у 12 членов семьи обнаружена фибрилляция предсердий и необычная морфология Тволн.

Имеются данные, хотя и противоречивые о половых различиях в ассоциации с LQTs. Разночтения возможны, поскольку в одних исследованиях рассматривались только клинические фенотипы, а в других, более поздних, изучались носители LQT гена, идентифицированного по генным маркерам. Таким образом, имеются доказательства, что LQTs является генетическим комплексным расстройством, на которое влияют гены хромосом 11, 7, 3, 6 и 4, возможно, со специфическим для пола эффектом.
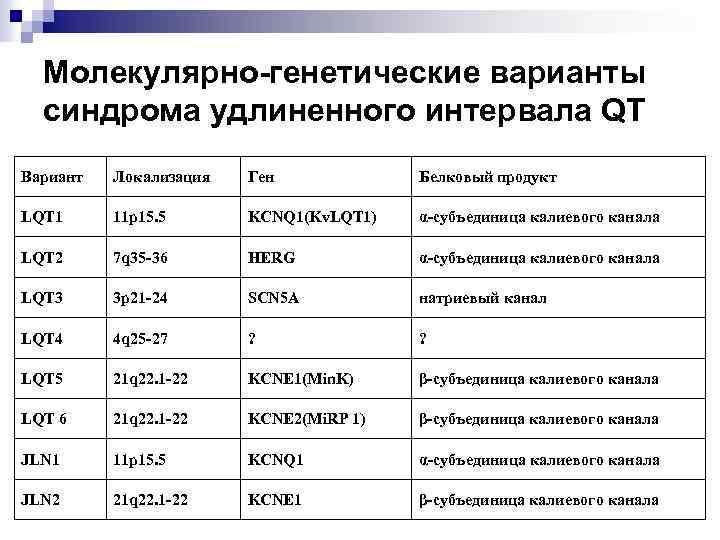
Молекулярно-генетические варианты синдрома удлиненного интервала QT Вариант Локализация Ген Белковый продукт LQT 1 11 p 15. 5 KCNQ 1(Kv. LQT 1) α-субъединица калиевого канала LQT 2 7 q 35 -36 HERG α-субъединица калиевого канала LQT 3 3 p 21 -24 SCN 5 A натриевый канал LQT 4 4 q 25 -27 ? ? LQT 5 21 q 22. 1 -22 KCNE 1(Min. K) β-субъединица калиевого канала LQT 6 21 q 22. 1 -22 KCNE 2(Mi. RP 1) β-субъединица калиевого канала JLN 1 11 p 15. 5 KCNQ 1 α-субъединица калиевого канала JLN 2 21 q 22. 1 -22 KCNE 1 β-субъединица калиевого канала

n Молекулярные основы Идентификация гена KVLQT, определила смысл выяснения функции кодируемого им белка. Молекулярный анализ показал, что последний является калиевым каналом, участвующим в реполяризации сердца. Мутации в гене KVLQT ведут к ненормальной сердечной реполяризации и увеличению подверженности желудочковым аритмиям. Другие кандидаты в гены LQT 2, 3 картированы в 3 й и 7 -й хромосомах. Ген LQT 2 контролирует хлорный канал скелетной мышцы и мускариновый ацетилхолиновый рецептор. Однако гипотеза об их связи с LQT не была подтверждена. Для LQT 3 Участок 3 р 21 -23 может быть связан с α 1 субъединицей кальциевого канала L-типа.

Новый ген, обнаруженный в 7 -й хромосоме в 1994 г ( HERG, human "ether-a-go-go") контролирует синтез калиевого канала. Получены веские доказательства связи HERG и LQT 2. Этот ген локализован в 7 q 35 -36. HERG экспрессируется в сердце. Имеется 6 мутаций, связанных с LQT. Еще один кандидат на локус LQT идентифицирован в 4 q 25 -27. эта область не содержит генов, кодирующих ионные каналы, но возможно, что этой последовательностью кодируется Са 2+ / кальмодулин зависимая протеинкиназа II. Генетические модификации данной киназы могут вести к нарушениям реполяризации. Таким образом, по-видимому различные формы LQT определяются различными генетическим механизмами. Увеличение потенциала действия в сердечных миоцитах или дисперсия деполяризации – представляют собой две возможности формирования синдрома. Автономная нервная система является важным фактором реполяризации сердца. Гены, включенные в ее развитие и регуляцию, также могут быть рассмотрены в аспекте LQTs.

n Значение Лица с наследственным LQTs предрасположены к спонтанным желудочковым аритмиям, внезапной смерти, связанной со стрессом. Подверженные индивидуумы склонны к вентрикулярным аритмиям, индуцируемым некоторыми лекарствами и токсинами. Такие эффекты вызывает хинидин, различные психотропные средства, включая хлорпромазин и трициклические антидепрессанты, антагонисты Н 1 рецептора - терфенадин, астемизол. Синдром проявляется у лиц молодого возраста, часто приводит к смерти, что естественно требует своевременной диагностики и эффективной терапии. LQTs труден для диагностики, т. к. отсутствует семейная информация. QT интервал весьма вариабелен и не может быть использован для диагностики генетического варианта. Генотипирование значительно повышает шансы правильной постановки диагноза. Изучение разных механизмов формирования синдрома дает основу для их патогенетической терапии.

Резистентность к ретиноевой кислоте и острая промиелоцитарная анемия Гены лейкемии возникают из нормальных генов, подвергшихся мутациям и различным перестройкам, хотя имеются некоторые наследуемые генетические дефекты, ассоциированные с семейной предрасположенностью к раку, мутации ведущие к лейкемии представляются в большей степени приобретенными, однако средовые факторы, их обусловливающие недостаточно известны. Один из вариантов, ведущих к острой промиелоцитарной лейкемии (APL) - аберрантное слияние (fussion) генов рецептора α-ретиноевой кислоты и промиелоцитарной лейкемии (PML). Это хорошо клинически, морфологически и цитогенетически изученный подвид острой миелоцитарной лейкемии. Результатом образования химерного гена является аберрантное слияние белков.

n Рецепторы ретиноевой кислоты (RAR) принадлежат к стероидтиреоидному суперсемейству ядерных рецепторов. Описано две группы RAR и 9 -cis рецепторы, RXR. Оба включают три подсемейства членов – α, β и γ. RAR рецепторы RAR α, RAR β, RAR γ – имеют существенную гомологию в последовательности, молекулярную массу около 50 к. Д и картированы на хромосомах 17, 3, 12 соответственно. Все они существуют в многочисленных изомерах, которые, по-видимому, возникают вследствие действия различных промоторов или механизмов альтернативного сплайсинга в 5' области м. РНК. Изоформы RAR проявляют тканеспецифичность и соответствующую разным стадиям развития экспрессию, что предполагает различные функциональные роли каждой изоформы. Экспрессия RARα происходит в ряде областей мозга, надпочечников, семенников, в коже, в слизистой оболочке полости рта и представляется прямо вовлеченной в дифференцировку миелоидных клеток. Функциональным изменением бластах при острой промиелоцитарной лейкемии является их чувствительность к индукции дифференцировки ретиноевой кислотой, что впервые наблюдалось Breitman с соавт в 1981 г в первичной культуре APL клеток. Исходя из этого открытия, группа Huang и др в Шанхае в 1988 г продемонстрировала ремиссию у больных, вызванную транс-ретиноевой кислотой (ATRA). Позже это наблюдение было подтверждено в США и во Франции.

n Генетический аспект Цитогенетический анализ выявил транслокацию в APL клетках между 15 и 17 хромосомами. Эта специфическая транслокация (q 15; 17) (q 22; q 11. 2 -12) не наблюдалась при других подтипах миелогенной лейкопении или при других злокачественных болезнях. RARα ген картирован на длинном плече хромосомы 17 q 21. Рядом исследователей обнаружено, что разлом 17 -й хромосомы при APL связан с реорганизацией и аберрантной экспрессией RARα. Одновременно несколько областей разрывов связано с транслокацией хромосом 15 ; 17, характеризующей APL.

n Молекулярные основы На стадии озлокачествления при канцерогенезе возникают генные изменения в виде точковых мутаций, делеций, амплификаций, транслокаций, митотических рекомбинаций, которые дополняют развивитие в раковой опухоли. У больных APL транслокация 15; 17 нарушает ген рецептора ретиноевой кислоты (RARα). Транслокация является результатом слияния локуса промиелоцитарной лейкемии (PML) на 17 -й хромосоме с локусом RARα, в результате чего образуется химерный ген PML-RAR под транскрипционным контролем промотора PML. Вероятно, что гибридный белок PML-RAR, в связи с изменениями локализации и возможности реализовывать собственные функции существующих в норме отдельных белков, не позволяет завершить дифференцировку APL клеток.

n Поскольку ATRA вызывает полную ремиссию у больных APL, можно думать, что образование слившегося белка является процессом, который зависит от гормоноподобного воздействия ретиноевой кислоты. По-видимому, данный фармакогенетический вариант специфичен именно для описанной транслокации, поскольку при других транслокациях, например 11; 17, не вызывающих реорганизации гена PML, терапия ATRA была неэффективна. Значение Молекулярное определение транслокации 15; 17 – относительно хороший прогноз для терапии ATRA у больных APL. Описаны случаи других раковых заболеваний, чувствительных к ретиноидам, что определяет интерес к этим веществам.

Гены рецепторов и астма По данными W. Cookson, опубликованным в 1999 г в Nature, семейный генетический анализ в семьях показывает, что астма контролируется только небольшим количеством генов с умеренно сильным эффектом, нежели многочисленными генами с незначительным эффектом. Несколько рецепторных генов представляются существенными для астматического фенотипа. Два из них хорошо изучены. Это β-адренергический рецептор и высокоафинный рецептор Ig. E (Fc RI-β). Также хорошо известно влияние рецептора I l-4 (хромосома 16) на атопию и уровень Ig. E в сыворотке. Совсем недавно в α субъединице этого рецептора, была обнаружена мутация, однако ее связь с предрасположенностью к бронхиальной астме еще не ясна. β 2 – адренергический рецептор изучается более 30 лет со времени возникновения β-адренергической теории атопии и в связи с исследованиями механизмов сопряжения с G-белками.

На начальной стадии молекулярных исследований в кодирующей зоне рецептора было обнаружено 9 полиморфизмов. 4 из них приводили к изменениям аминокислотной последовательности рецептора, из которых 3 (Arg 16 Gly, Gln 27 Glu, Thr 164 Ile) нарушали его распространенность и функцию. Значительными оказались этнические различия в частоты аллелей Gly 16 у белых, черных и азиатов составило 0, 61, 0, 5 и 0, 41. В позиции 27 аллельные частоты для Gln 27 = 0, 57, 0, 73 и 0, 8, соответственно. Изолейцин 164 редкий полиморфизм, в гетерозиготном состоянии встречается у ≈ 6% популяции. Гомозиготы по данному признаку идентифицированы не были.

Несколько исследований проведено для выяснения влияния этих полиморфизмов на астматический фенотип. Оказалось, что частота каждого из них одинакова для больных астмой и здоровых, поэтому выявленные первичные вариации в структуре рецептора не рассматриваются как основная причина заболевания. Однако Gly 16 форма рецептора в отличие от Glu 27 подвергается down-регуляции при агонистическом воздействии. Дополнительно, Gly 16 полиморфизм характерен для более тяжелых больных. Далее было обнаружено, что Gly 16 связан с ночной астмой. Еще позже было показано, что Glu 27 форма рецептора предотвращает бронхиальную гиперактивность. Из этих наблюдений следует, что Gly 16 Arg Gln 27 Glu полиморфизмы могут модифицировать астматический фенотип. Однако не исключено, что эти полиморфизмы являются связанными, поэтому для дальнейших заключений необходимы более широкие популяционные исследования.

Другая группа исследований посвящена анализу зависимости от полиморфных вариантов эффективности β-адренергических агонистов и глюкокортикостероидов, хотя проведенные исследования трудно анализировать, поскольку разные препараты тестировались в неодинаковых условиях и терапевтический эффект оценивался по-разному. В нескольких работах обнаружено, что пациенты с астмой, гомозиготные по Arg 16 форме рецептора, лучше отвечали на сальбутамол, чем больные, гомозиготные по Gly 16 форме. Другими авторами при данных полиморфизмах, наоборот, не обнаружено зависимости ответа на изопротенерол или защитного действия форметерола по отношению к метахолину. Два дополнительных исследования реакций больных на ингаляционные кортикостероиды также не дали различий. Рецепторы с Ile изолейцином в позиции 164, который локализован в районе связывания агонистов, не сопрягались эффективно с G-белками.

Таким образом, изменение в первичной структуре в 164 позиции ведет к заметной дисфункции рецептора. Однако редкость этого полиморфизма, требует его дальнейшего изучения у гомозигот и в клинически важных случаях. Высокоафинный рецептор для Ig. E играет центральную роль в дегрануляции тучных клеток и в патогенезе Ig. E опосредованой атопической астмы. Идентифицировано несколько изменений в кодирующей последовательности этого рецептора. Миссенс мутация в β- субъединице Glu 237 Gly возможно увеличивает риск для индивидуумов с Gly формой заболеть астмой в 2, 3 раза, что дает основания для предположения о том, что варианты Fcε R 1 рецептора могут обусловливать предрасположенность к атопической астме. Проблема находится в стадии интенсивной разработки.
12.ФГ феномены.ppt