1 Эталонные растворы.ppt
- Количество слайдов: 17

Фармацевтический анализ. Фармакопейный анализ. Общие фармакопейные методы определения примесей посторонних веществ в ЛС (испытания на чистоту). Общие и специфические примеси. Эталонные растворы.

Фармацевтический анализ • Фармакопейный анализ • Постадийный контроль производства • Анализ лекарственных форм индивидуального изготовления • Биофармацевтический анализ

Фармакопейный анализ Объекты контроля : сырье растительного, животного, минерального происхождения, ЛС и ЛП промышленного производства Методы анализа : физические, физикохимические, биологические, микробиологические НД, методики: ФС, ОФС, ГФ, ФСП, ГОСТ Критерии оценки: Соответствие требованиям НД

Операционный (постадийный) контроль Объекты контроля : Полупродукты производства Методы анализа : Физические, физикохимические, химические НД, методики: Промышленные регламенты, спецификации Критерии оценки: Соответствие требованиям регламентов, спецификаций

Экспресс-анализ Объекты контроля : ЛС , изготовленные в аптеках, в т. ч. гомеопатических Методы анализа : Физические, физикохимические, химические НД, методики ГФ, ФС, приказы МЗ, инструкции, методические руководства Критерии оценки Соответствие требованиям ГФ, ФС, приказов, инструкций

Биофармацевтический анализ Объекты контроля : Биожидкости (слюна, моча, кровь и др. ) и ткани Методы анализа : Физические, физикохимические, биологические НД, методики : Экспериментально разработанные методики Критерии оценки: Многократность повторов и статистическая обработка результатов

требующие защиты от факторов внешней среды: • от света 2 Н 2 О 2 → 2 Н 2 О + О 2 • от действия влаги воздуха Кислота ацетилсалициловая + Н 2 О → Кислота салициловая + СН 3 СООН • от газов воздуха Zn. O + CO 2 → Zn. CO 3 Mg. O + CO 2 → Mg. CO 3
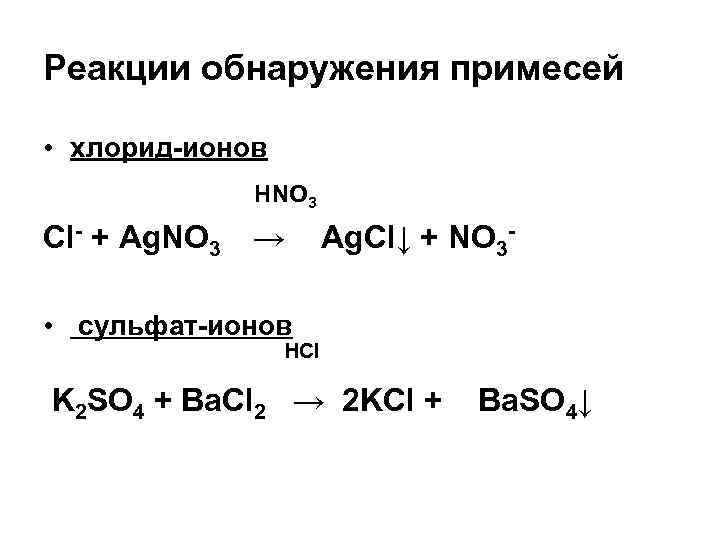
Реакции обнаружения примесей • хлорид-ионов HNO 3 Сl- + Ag. NO 3 → Ag. Cl↓ + NO 3 - • сульфат-ионов HCl K 2 SO 4 + Ba. Cl 2 → 2 KCl + Ba. SO 4↓

• ионов аммония 1. С реактивом Несслера (щелочной раствор терайодмеркурата калия) NH 4 Cl + 2 K 2[Hg. I 4] +2 KOH → → [NH 2(Hg. I)2]I↓ + 5 KI + KCl + 2 H 2 O 2. NH 4 Cl + Na. OH → NH 3 ↑ + Na. Cl + H 2 O
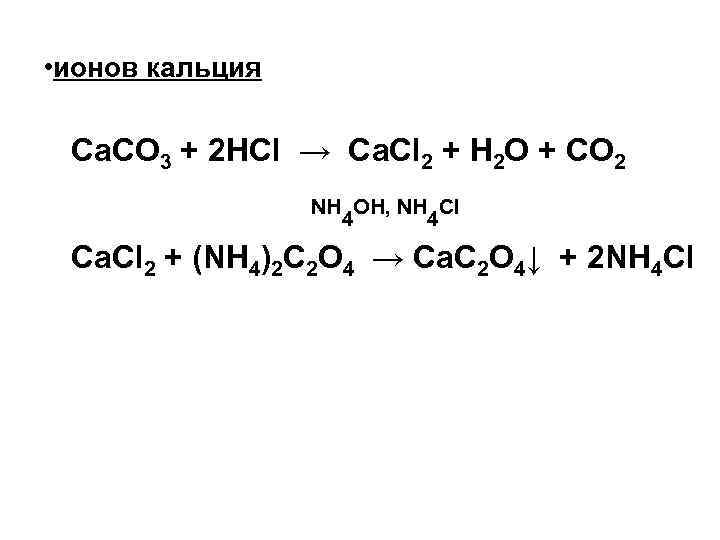
• ионов кальция Ca. CO 3 + 2 HCl → Ca. Cl 2 + H 2 O + CO 2 NH OH, NH Cl 4 4 Ca. Cl 2 + (NH 4)2 C 2 O 4 → Ca. C 2 O 4↓ + 2 NH 4 Cl
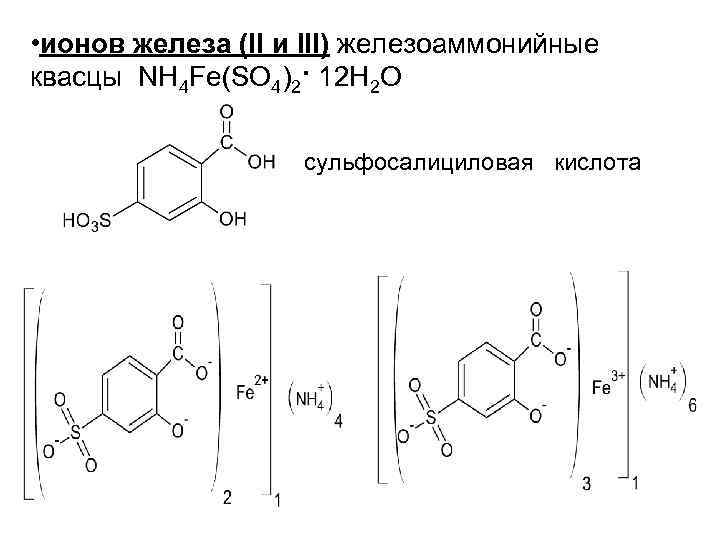
• ионов железа (II и III) железоаммонийные квасцы NH 4 Fe(SO 4)2· 12 H 2 O сульфосалициловая кислота
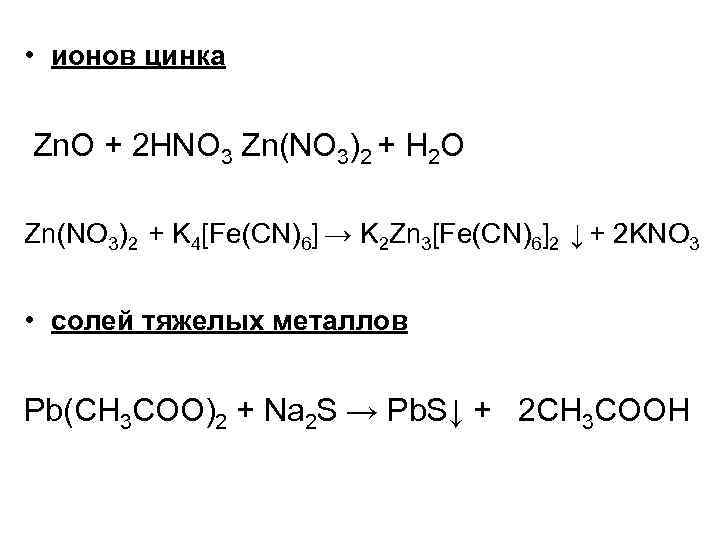
• ионов цинка Zn. O + 2 HNO 3 Zn(NO 3)2 + H 2 O Zn(NO 3)2 + K 4[Fe(CN)6] → K 2 Zn 3[Fe(CN)6]2 ↓ + 2 KNO 3 • солей тяжелых металлов Pb(CH 3 COO)2 + Na 2 S → Pb. S↓ + 2 CH 3 COOH

• Мышьяка 1. реакция Зангера-Блека As 2 O 3 + 6 Zn + 12 HCl → 2 As. H 3 ↑ + 6 Zn. Cl 2 + 3 H 2 O As. H 3 + Hg. Cl 2 → As. H 2(Hg. Cl) + HCl As. H 3 + 2 Hg. Cl 2 → As. H(Hg. Cl)2 + 2 HCl As. H 3 + 3 Hg. Cl 2 → As(Hg. Cl)3 +3 HCl As. H 3 + As(Hg. Cl)3 → As 2 Hg 3 + 3 HCl Чувствительность – 0, 0005 мг в реакционной смеси.

2. реакция Буго-Тиле Na. H 2 PO 2 + HCl → H 3 PO 2 + Na. Cl As 2 O 3 + 3 H 3 PO 2 → 2 As↓ + H 3 PO 3 As 2 O 5 + 5 H 3 PO 2 → 2 As↓+ 5 H 3 PO 3 Чувствительность – 0, 01 мг в 10 мл объекта.

исходные вещества для изготовления эталонов при определении окраски жидкости Co. Cl 2 · 6 H 2 O – розовый (раствор А) K 2 Cr 2 O 7 - желто-оранжевый (раствор Б) Cu. SO 4 · 5 H 2 O – синий (раствор В) Fe. Cl 3 · 6 H 2 O – желто-бурый (раствор Г)

исходные вещества для изготовления эталонов при определении прозрачности и степени мутности жидкости Гидразина сульфат Гексаметилентетрамин (метенамин)
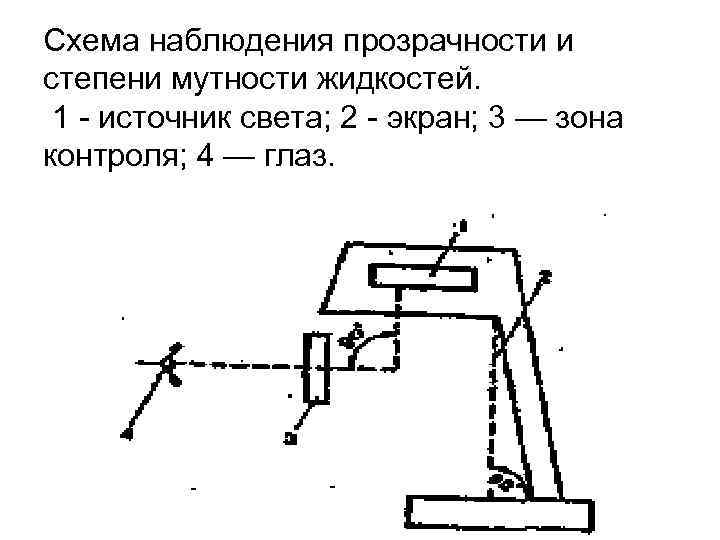
Схема наблюдения прозрачности и степени мутности жидкостей. 1 - источник света; 2 - экран; 3 — зона контроля; 4 — глаз.
1 Эталонные растворы.ppt