84bc3474e1f4295581b54c919963aa5d.ppt
- Количество слайдов: 56

ФАРМАЦЕВТИЧЕСКАЯ РАЗРАБОТКА ICH Q 8 (R 2) А. П. Мешковский ПМГМУ им. Сеченова meshkvskijj@mail. ru

Кратко об истории вопроса • В странах ЕС существовал раздел регистрационных требований «фармацевтические аспекты разработки» (Development pharmaceutics) • В США также требовалось представить пояснения о ходе создания продукта (лекформы) • Требование о наличии документа в составе досье - пояснительной записки к прописи и технологии

В отличие от этого теперь: • Соответствующие регистрационные требования изложены в другом документе: раздел 3. 2. P. 2 «Общего технического документа» (ICH M 4) • А фармацевтическая разработка – скорее методические указания относительно проведения определенных исследований

Американская инициатива в сфере GMP - 2002 г. • Сближение регистрации, производства по GMP и инспектирования по GMP • Качество через дизайн, пространство дизайна, РАТ • Управление рисками • Системы качества • Совершенствование практики инспектирования по GMP • Международная гармонизация требований GMP • Международное сотрудничество по всем направлениям 4

Ответ ЕС и Японии: 2003 -2007 новые документы ICH Q 8, Q 9 и Q 10 Компоненты Американской инициативы Ответ международных организаций Качество через дизайн Фармацевтическая разработка (ICH Q 8) Управление рисками качества (ICH Q 9) Управление рисками Системы качества (ICH Q 10) Пространство дизайна Элемент Фармацевтической разработки (ICH Q 8) РАТ (Технология анализа процессов) Совершенствование практики инспектирования по GMP Рабочие группы в ЕС Все основные компоненты Обсуждение в рамках FIP (Нордвайк, Каир, Лондон, Пекин) Вступление США в PIC/S

Гармонизированное трехстороннее руководство • МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ ПО ГАРМОНИЗАЦИИ ТЕХНИЧЕСКИХ ТРЕБОВАНИЙ ДЛЯ РЕГИСТРАЦИИ лекарственных продуктов медицинского назначения (ICH ) • Рекомендовано Руководящим комитетом ICH для принятия на этапе 4 Процесса ICH 10 ноября 2005

Статус документа Q 8 • Текст, утвержденный в ноябре 2005 г. , рассматривался как первая часть будущего документа. • В 2008 г. принято дополнение Q 8(R 1) • В 2009 г. принято дополнение Q 8(R 2) • Одновременно пересматривается обзор раздела «Качество» (Quality Overall Summary - QOS) ОТД. • Возможен также пересмотр других документов ICH

Дополнения к Q 8 • • - Приняты в 2008 (R 1) и в 2009 (R 2) гг. дальнейшие разъяснения новых понятий: “качество через дизайн” “пространство дизайна” “целевой профиль продукта” “критические свойства материалов” “критические параметры процессов” “стратегия контроля качества”

Рекомендации ВОЗ • Документ ВОЗ “Фармацевтическая разработка для дженериков” 2008 г. • Рассматриваются вопросы: - стратегии разработки воспроизведенных препаратов - перичная оценка рисков качества - выбор компараторов для испытания биоэквивалентности - те же разделы, что и для инновационных препаратов - практические подходы (если не использовать Q 8)

Фармацевтическая разработка • Это действия, выполнение которых необходимо для подтверждения того, что выбранная лекформа отвечает своему назначению • Позволяет выявить аспекты прописи и процесса, критические для воспроизводимости серий (внутрипроизводственный контроль ВПК) • Помогает лучше понять дизайн продукта • Является его научной базой

Цели руководства • Описывает содержание раздела 3. 2. P. 2 заявки на регистрацию в формате ICH M 4 «Общий технический документ» (CTD). • Дает возможность представить информацию, полученную путем применения научных подходов и управления рисками качества (Q 9) в разработке продукта и производственного процесса. • Первоначально эти данные готовятся для включения в регистрационное досье; • Они могут обновляться с тем, чтобы отражать новые знания, полученные в течение жизненного цикла продукта. • Данные предназначены для обеспечения всестороннего понимания продукта и производственного процесса теми, кто рассматривает материалы заявки на регистрацию и инспекторами.

Стратегические цели • Создать продукт высокого качества и соответствующий производственный процесс, • Обеспечивать клиническое действие продукта, предусмотренное его дизайном. • Информация и знания, полученные в результате исследований в рамках фармацевтической разработки, а также опыт производства позволяют достичь научного понимания, достаточного для обоснования установленного пространства дизайна, спецификаций, и методов производственного контроля. • Информация, полученная в результате исследований по фармацевтической разработке, может быть основанием для управления рисками качества.

Связь с GMP Национальный конгресс в Харькове: “Настоящее и будущее фармации”, апрель 2008 г. В числе выводов: GMP без фармацевтической разработки – евроремонт (не более того) 13

Q 8: содержание • Первая часть документа основана на Руководстве ЕС по фармацевтическим исследованиям (Development Pharmaceutics). • Напоминает о тезисе «Качество не может быть вложено в продукт путем его тестирования после завершения производственного цикла. Оно должно быть «встроено» (built in) в него, начиная с концепции проекта и на протяжении всех этапов производства» . • Тезис сформулирован в США в 60 -х годах прошлого века, в период введения правил GMP

Качество должно быть «встроено» ? • Первоначально понималось, что качество должно быть «встроено» в процессе производства (GMP) • Теперь считается, что встраивать нужно начиная с дизайна продукта (концепции, проекта, задумки) и в ходе фармацевтической (и аналитической) разработки • В дальнейшем качество фиксируется через процедуру регистрации продуктов • И поддерживается на всех этапах оборота путем соблюдения правил GMP, GDP, GPP, GSP и др.

Новые понятия • Целевой профиль качества: желаемые (фармакокинетические) свойства продукта (ориентир - фармакопея или потребитель? ) • Качество через дизайн • Пространство дизайна (PAR & NOR) • Гибкие регуляторные подходы • Уточнение понятий: «критические характеристики и параметры» 16

О качестве • Важно признать, что качество не может быть достигнуто путем испытания продуктов, иначе говоря, качество должно cоздаваться, начиная с дизайна (проекта, задумки) продукта • Изменения в прописи и в производственных процессах в ходе разработки и управления жизненным циклом должны рассматриваться как возможность получать дополнительные знания, поддерживающие установление пространства дизайна.

Гибкие регуляторные подходы • регуляторные решения на основе анализа риска (рассмотрение заявки и инспектирование); • усовершенствование производственного процесса в пределах одобренного пространства дизайна, описанного в досье, без дальнейшего рассмотрения; • сокращение заявок на изменение регистрационных условий; • проверка качества в реальном времени, ведущая к сокращению испытаний при выпуске конечного продукта.

Обосновать выбор лекформы, прописи и технолгии • Этот раздел должен содержать данные, подтверждающие, что выбранная дозированная форма и предложенная пропись подходят для предназначенного использования. • Могут прилагаться таблицы и графики, облегчающие рассмотрение заявки. • Должны быть определенны те аспекты лекарственных субстанций, вспомогательных веществ, упаковочно-укупорочной системы и производственных процессов, которые являются критическими для качества продукта. • Критические характеристики прописи и параметры процесса выявляются через оценку степени влияния их изменений на качество лекарственного продукта.

Кроме того • Заявитель может проводить исследования по фармацевтической разработке, ведущие к увеличению знаний о действии продукта в более широком диапазоне свойств материалов, вариантов выбора процессов и их параметров. • Включение этой дополнительной информации дает возможность демонстрировать более высокую степень понимания свойств материалов, характеристик производственных процессов и их контроля. • В этих ситуациях имеется возможность для введения более гибких регуляторных подходов.

Лекарственная субстанция • Физико-химические и биологические свойства лекарственной субстанции, могущие повлиять на действие продукта и его технологичность, или специально заложенные в проект (например, свойства твердого тела), должны быть идентифицированы и обсуждены. • Примеры: физико-химические и биологические свойства - растворимость, содержание влаги, размер частиц, свойства кристаллов, биологическая активность, и способность проникать сквозь биологические мембраны. • Эти свойства могут быть взаимосвязаны, в связи с чем может потребоваться их совместное рассмотрение.

Вспомогательные вещества • Необходимо оценить совместимость лекарственной субстанции с вспомогательными веществами в прописи, • Обсуждение функций каждого вспомогательного вещества, их концентрации, характеристик, могущих влиять на действие лекарственного продукта (например, стабильность, биодоступность) или технологичность, • Должна также быть продемонстрирована способность вспомогательных веществ (например, антиоксидантов, веществ увеличивающих всасывание, способствующих распадаемости, контролирующих высвобождение) обеспечить их предназначенные функциональные возможности, и действовать в течение всего предполагаемого срока годности продукта.

Лекарственный продукт • • Необходимо представить резюме (обзор) с описанием разработки прописи, включая идентификацию тех характеристик, которые являются критическими в отношении качества лекарственного продукта, учитывая (его) предназначенное использование и способ введения. Акцент на ходе разработки дизайна прописи, от первоначального проекта до окончательного варианта. Выбор компонентов лекарственного продукта (например, свойства лекарственной субстанции, вспомогательных веществ, упаковочноукупорочной системы и любых дозирующих устройств), производственный процесс, Обоснования интервалов в закладке вспомогательных веществ, вошедших в регламент производства (3. 2. P. 3. 2). Это обоснование часто может базироваться на опыте, полученном в процессе разработки или производства.

Избыток • Как правило, не рекомендуется использование избытка лекарственной субстанции для компенсации разрушения в процессе производства или хранения продукта, либо для продления срока годности. • Любые избытки в производстве лекарственного продукта, появляются ли они в готовой дозированной форме или нет, должны быть обоснованы с точки зрения безопасности и эффективности продукта. • Должна быть предоставлена информация о 1) количестве избытка, 2) причинах использования (например, чтобы компенсировать ожидаемые и документированные производственные потери), и 3) обоснование величины избытка. • Избыток должен быть включен в указанное в описании технологии количество лекарственной субстанции

Производственный процесс • Объяснение выбора производственного процесса и видов контроля. • Рассмотрение критических характеристик прописи, вместе с возможными вариантами производственного процесса, чтобы выбрать производственный процесс и подтвердить пригодность компонентов. • Пригодность оборудования применительно к запланированным продуктам. • Исследования по разработке производственного процесса должны обеспечить основание для усовершенствования процесса, его валидации, непрерывной верификации процесса (где это применимо) и любых требований в отношении контроля процесса.

Производственный процесс -2 • В соответствующих случаях такие исследования должны быть направлены на микробиологические, а также на физические и химические характеристики. Знания, полученные в результате исследований по разработке производственного процесса, могут использоваться, при необходимости, для обоснования спецификации лекарственного продукта • Программа разработки (или усовершенствования) производственного процесса должна выделять любые критические параметры процесса, подлежащие мониторингу или контролю (например, время окончания грануляции) с тем, чтобы гарантировать желаемое качество продукта.

Упаковочно-укупорочная система • Выбор и основания для выбора упаковочно-укупорочной системы закрытия. • Внимание намечаемому использованию лекарственного продукта и пригодности соответствующей упаковки для хранения и транспортировки, включая, при необходимости, хранение и транспортную упаковку для нерасфасованного лекарственного продукта (балк-продукта). • Выбор материалов для первичной упаковки должен быть обоснован. Обсуждение должно описать исследования, выполненные, чтобы продемонстрировать целостность упаковки (контейнера) и её укупорки. Должно быть рассмотрено возможное взаимодействие между продуктом и упаковкой или этикеткой.

Выбор упаковочных материалов • Выбор первичных упаковочных материалов должен быть обоснован, например, выбор материалов, защищающих от влажности и света, совместимость упаковки с дозированной формой (включая сорбцию, извлечение); также необходимо принять во внимание безопасность материалов упаковки. • В случаях, когда это имеет значение, необходимо обосновать выбор вторичной упаковки.

Микробиологические свойства • В соответствующих случаях в этом разделе должны быть рассмотрены микробиологические свойства лекарственного продукта. Необходимо обосновать, например: - для нестерильных форм выполнение или невыполнение испытаний на микробиологическую чистоту - выбор и эффективность систем консервантов в продуктах содержащих антимикробный агент или антибактериальная эффективность для продуктов, обладающих естественными антибактериальными свойствами; • Для стерильных продуктов целостность упаковки, в связи с предотвращением микробного загрязнения.

Совместимость окончательной лекформы • Необходимо обратить внимание на совместимость активного вещества с растворами для приготовления лекарственной формы перед применением (например, осаждение, стабильность), чтобы предоставить соответствующую подтверждающую информацию для маркировка. • Эта информация должна отображать рекомендованный срок хранения приготовленной перед использованием лекформы, при рекомендованной температуре хранения и возможных максимальных концентрациях. • Может возникнуть необходимость рассмотреть варианты с добавкой (например, «подкалыванием» в инъекционные растворы большого объема) или разведением перед применением.

Разработка методов контроля • Отправная точка: желаемые (фармакокинетические) свойства продукта • Лабораторный и полупроизводственный масштаб • Решение вопросов: Ø (Состав) Ø Параметры процесса и ВПК Ø Спецификация готового продукта Ø Аналитические методы

ФАРМАЦЕВТИЧЕСКАЯ РАЗРАБОТКА Практические аспекты: опыт производителей

Обсуждение руководства • Практические аспекты • Опыт производителей

Фармацевтическая разработка: три вида подхода Ø Инновационные препараты Ø Дженерики с улучшенными свойствами Ø Дженерики – точные копии инновационных препаратов 34
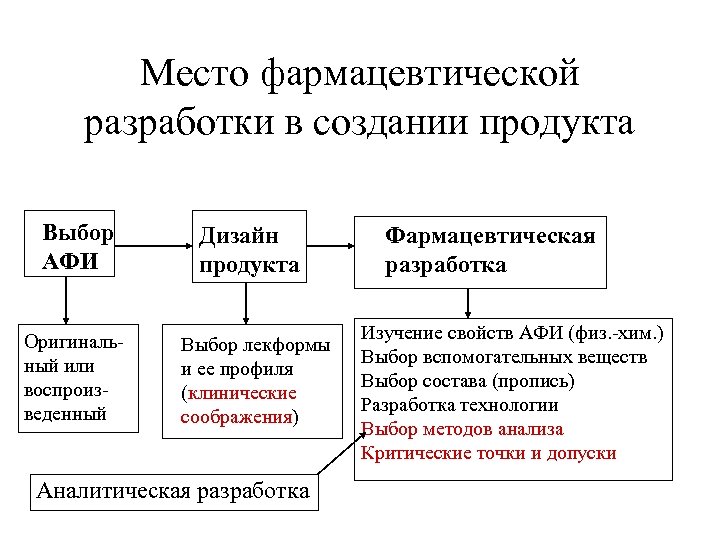
Место фармацевтической разработки в создании продукта Выбор АФИ Оригинальный или воспроизведенный Дизайн продукта Выбор лекформы и ее профиля (клинические соображения) Аналитическая разработка Фармацевтическая разработка Изучение свойств АФИ (физ. -хим. ) Выбор вспомогательных веществ Выбор состава (пропись) Разработка технологии Выбор методов анализа Критические точки и допуски

Информация, получаемая в ходе фармацевтической разработки, • Условно делится на три части: Ø Раздел «Характеризация» (изучение свойств) Ø Раздел «Оптимизация» Ø Раздел «Верификация»

Раздел «Характеризация» (изучение свойств) Ø Предварительное изучение субстанции (preformulation - физико-химические свойства АФИ ) Ø Совместимость (compatibility – выбор вспомогательных веществ) Ø Пропись (состав) Ø Процесс (технология и контроль – ВПК) Ø Аналитические методы

Раздел «Оптимизация» Ø Устойчивость Ø Критические параметры Ø Реалистичные допуски

Раздел «Верификация» Ø Валидация (включая квалификацию) Ø Масштабирование Ø Перенос технологии (на другую площадку) Ø Текущее усовершенствование технологии (оптимизация)

Варианты оптимизации прописи и технологии • Целенаправленные исследования по отработке технологии, включая уточнение прописи (ограниченное время, до валидации) • Непрерывное совершенствование на основе накопляемого опыта, в т. ч. за счет выявления и устранения причин инцидентов (после валидации, постоянно, через систему управления изменениями)

Валидация и фармацевтическая разработка Фармацевтическая разработка позволяет получить обоснованные исходные данные для валидации технологических процессов и аналитических методик

Пример изучения свойств активной субстанции Х (preformulation) • Форма и размер кристаллов: кубическая; D 10 - 2, 6 μm; D 50 -15 μm; D 90 - 48 μm • Удельная поверхность – 1, 5 м 2/г • Сыпучесть: слабая • Прессуемость: плохая • Угол контакта: 77º • Скорость растворения: 1, 5 μг/см 2/мин. • Полиморфизм: нет • Термическая взрывоопасность: нет

Изучение свойств активной субстанции (раствор) • Профиль растворимости: макс. 10 μг/мл при р. Н 1 -4 (добавление буферного р-ра) • Зависимость стабильности от р. Н: деградация выше р. Н 5, 5 • Влияние растворителей: добавка ПЭГ 400 (20/80) при р. Н 4 – 150 μг/мл • Стерилизация: термическая стерилизация невозможна – только γ-стерилизация

От свойств АФИ к выбору вспомогательных веществ • Для твердых пероральных форм: если растворимость АФИ менее 1% - требуются комплексообразующие или поверхностно активные вещества (циклодекстрины) • При недостаточной стабильности – использование антиоксидантов 44

Вспомогательные вещества добавляются в целях: • Увеличения стабильности лекформы (антиоксиданты) • Оптимизации биофармацевтических свойств (дезинтегранты, оболочка) • Улучшения технологичности (наполнители, скользящие в-ва) • Улучшение принятия пациентами (вкусовые добавки, красители) 45

Стресс-испытания субстанций и прописи: примеры • Температура: в открытом виде увлажненный материал – 4 недели при 80°C, анализ еженедельно • Влажность: в открытом виде 4 недели при 40°C /100% о. в. , анализ через 2 недели • Окисление: 24 часа, через насыщенный водный раствор (суспензию) материала пропускается кислород при перемешивании, анализ каждые 8 часов. 46

Стресс-испытания субстанций и прописи: примеры • Температура: в открытом виде увлажненный материал – 4 недели при 80°C, анализ еженедельно • Влажность: в открытом виде 4 недели при 40°C /100% о. в. , анализ через 2 недели • Окисление: 24 часа, через насыщенный водный раствор (суспензию) материала пропускается кислород при перемешивании, анализ каждые 8 часов. 47
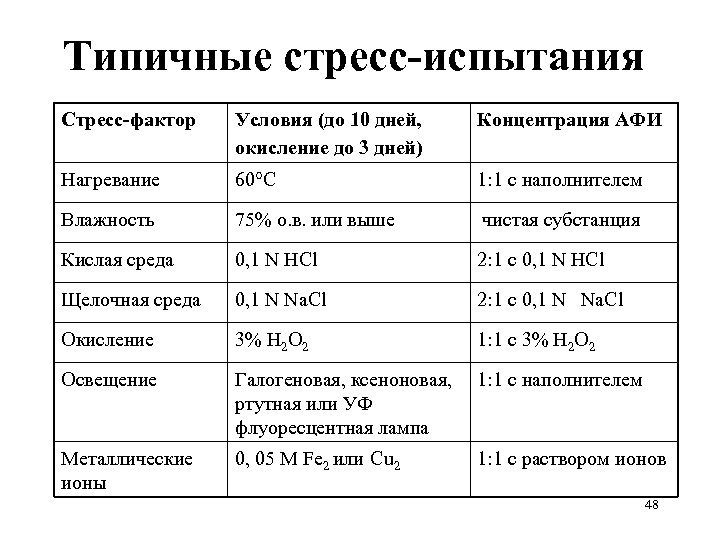
Типичные стресс-испытания Стресс-фактор Условия (до 10 дней, окисление до 3 дней) Концентрация АФИ Нагревание 60°С 1: 1 с наполнителем Влажность 75% о. в. или выше чистая субстанция Кислая среда 0, 1 N HCl 2: 1 с 0, 1 N HCl Щелочная среда 0, 1 N Na. Cl 2: 1 с 0, 1 N Na. Cl Окисление 3% Н 2 О 2 1: 1 с 3% Н 2 О 2 Освещение Галогеновая, ксеноновая, ртутная или УФ флуоресцентная лампа 1: 1 с наполнителем Металлические ионы 0, 05 М Fe 2 или Cu 2 1: 1 с раствором ионов 48
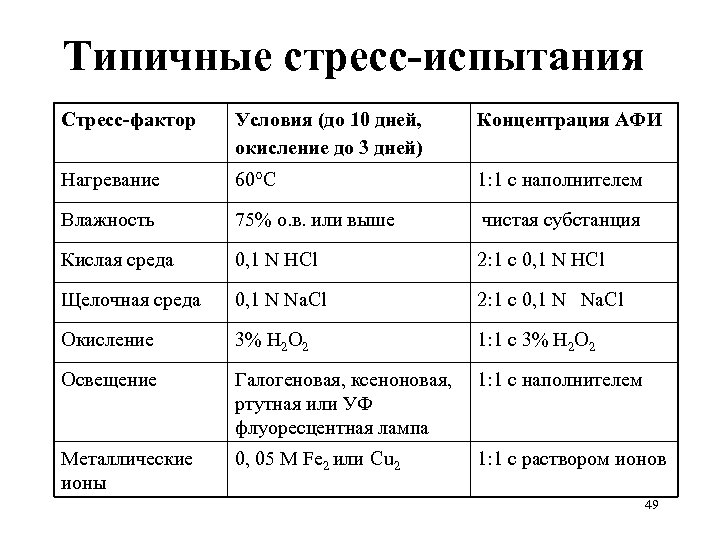
Типичные стресс-испытания Стресс-фактор Условия (до 10 дней, окисление до 3 дней) Концентрация АФИ Нагревание 60°С 1: 1 с наполнителем Влажность 75% о. в. или выше чистая субстанция Кислая среда 0, 1 N HCl 2: 1 с 0, 1 N HCl Щелочная среда 0, 1 N Na. Cl 2: 1 с 0, 1 N Na. Cl Окисление 3% Н 2 О 2 1: 1 с 3% Н 2 О 2 Освещение Галогеновая, ксеноновая, ртутная или УФ флуоресцентная лампа 1: 1 с наполнителем Металлические ионы 0, 05 М Fe 2 или Cu 2 1: 1 с раствором ионов 49
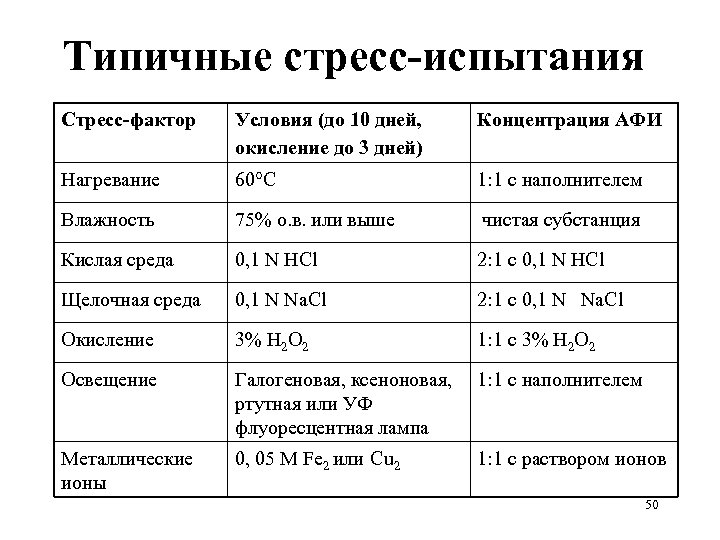
Типичные стресс-испытания Стресс-фактор Условия (до 10 дней, окисление до 3 дней) Концентрация АФИ Нагревание 60°С 1: 1 с наполнителем Влажность 75% о. в. или выше чистая субстанция Кислая среда 0, 1 N HCl 2: 1 с 0, 1 N HCl Щелочная среда 0, 1 N Na. Cl 2: 1 с 0, 1 N Na. Cl Окисление 3% Н 2 О 2 1: 1 с 3% Н 2 О 2 Освещение Галогеновая, ксеноновая, ртутная или УФ флуоресцентная лампа 1: 1 с наполнителем Металлические ионы 0, 05 М Fe 2 или Cu 2 1: 1 с раствором ионов 50
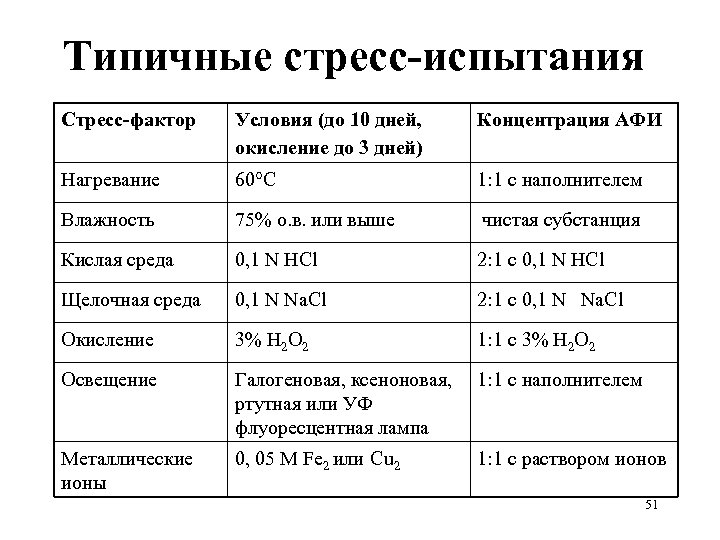
Типичные стресс-испытания Стресс-фактор Условия (до 10 дней, окисление до 3 дней) Концентрация АФИ Нагревание 60°С 1: 1 с наполнителем Влажность 75% о. в. или выше чистая субстанция Кислая среда 0, 1 N HCl 2: 1 с 0, 1 N HCl Щелочная среда 0, 1 N Na. Cl 2: 1 с 0, 1 N Na. Cl Окисление 3% Н 2 О 2 1: 1 с 3% Н 2 О 2 Освещение Галогеновая, ксеноновая, ртутная или УФ флуоресцентная лампа 1: 1 с наполнителем Металлические ионы 0, 05 М Fe 2 или Cu 2 1: 1 с раствором ионов 51

Лабораторный уровень • Предварительные исследования (preformulation) • Масштаб – 1 х • Изучение физико-химических характеристик активной субстанции и вспомогательных веществ (раздельно) • Выбор и отработка аналитических методик • Определение критических характеристик • Выбор стратегии контроля 52

Крупно-лабораторный уровень • • • Выбор прописи (formulation) Масштаб – 10 х Совместимость (изучение смесей) Стресс-испытания выбранной прописи Стабильность – скрининг (открытое состояние, 4 недели при 40°С/75% о. в. ) • Выбор и оптимизация процесса (технологии) • Наработка серий для испытания стабильности 53

Уровень опытнонаработочного цеха • Масштаб – от 100 х до 1/10 серийного производства; не меньше 100 тыс. таблеток (капсул) • Оборудование – того же типа, что в серийном производстве • Отработка технологии (оптимизация) • Наработка «биосерий» (для клиники, испытания биоэквивалентности) • Наработка серий для испытания стабильности (до 12 мес. при 25ºC/60% о. в. и до 6 -9 мес. при 30ºC/60% о. в. по 2 -3 сериям) • Предварительная валидация процесса (десятки серий) 54

Серийное производство • Первые три (две) серии – валидационные (подтверждающие – conformance batches) • Отчет о валидации, утверждение отчета • Утверждение/отклонение прописи и технологии • Для регистрационного досье (если не сделано ранее): результаты анализа серий по предлагаемой спецификации (5 серий или меньше) с указанием объема, даты и цели производства • Оптимизация процесса (постоянно) 55
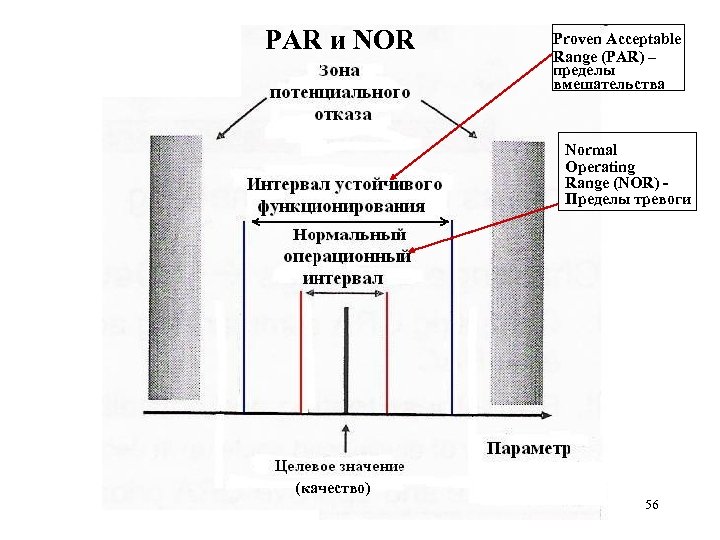
PAR и NOR Proven Acceptable Range (PAR) – пределы вмешательства Normal Operating Range (NOR) Пределы тревоги (качество) 56
84bc3474e1f4295581b54c919963aa5d.ppt