10.Галогенопроизводные 24.08.09.ppt
- Количество слайдов: 33
 Фарм. Ф Лекция 10 Органическая химия ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Фарм. Ф Лекция 10 Органическая химия ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
 Фарм. Ф Органическая химия Среди галогенопроизводных различаются: 1) соединения с одним или несколькими атомами одного галогена:
Фарм. Ф Органическая химия Среди галогенопроизводных различаются: 1) соединения с одним или несколькими атомами одного галогена:
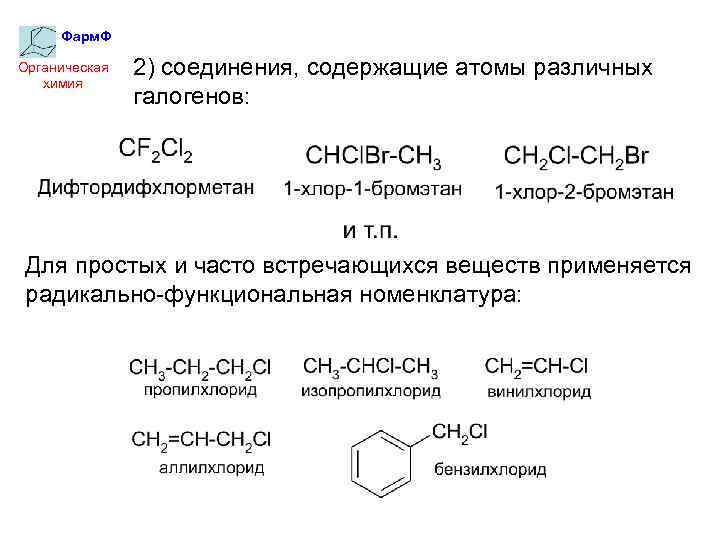 Фарм. Ф Органическая химия 2) соединения, содержащие атомы различных галогенов: Для простых и часто встречающихся веществ применяется радикально-функциональная номенклатура:
Фарм. Ф Органическая химия 2) соединения, содержащие атомы различных галогенов: Для простых и часто встречающихся веществ применяется радикально-функциональная номенклатура:
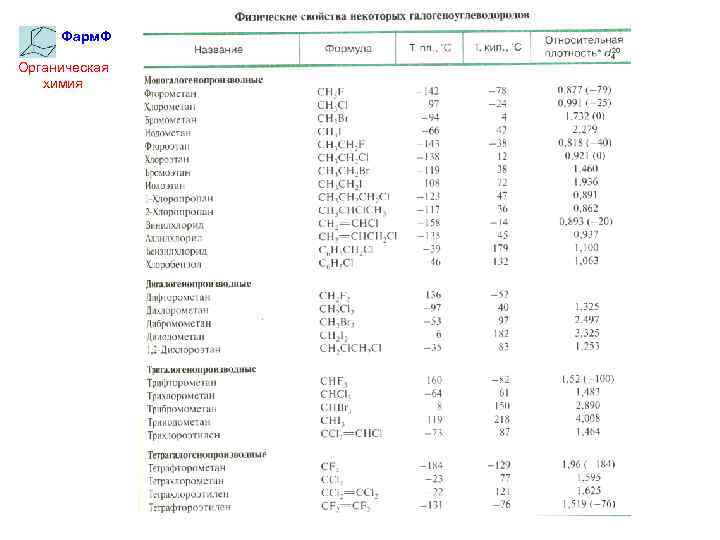
 Фарм. Ф Органическая химия Физические свойства галогенопроизводных Низшие производные – газы или низко кипящие жидкости с характерным сладковатым запахом. С увеличением массы галогенов (F→Cl→Br→I) и количества их атомов увеличивается плотность и температура кипения, а также снижается горючесть вещества.
Фарм. Ф Органическая химия Физические свойства галогенопроизводных Низшие производные – газы или низко кипящие жидкости с характерным сладковатым запахом. С увеличением массы галогенов (F→Cl→Br→I) и количества их атомов увеличивается плотность и температура кипения, а также снижается горючесть вещества.
 Фарм. Ф Органическая химия
Фарм. Ф Органическая химия
 Фарм. Ф Органическая химия Способы получения галогенопроизводных 1. Галогенирование углеводородов а) Для получения хлор- и бромпроизводных широко применяется радикальное галогенирование алканов (см. "Алканы"). С йодом эта реакция не идет. Прямое фторирование углеводородов из-за его высокой экзотермичности приводит к разрыву С-Ссвязей и деструкции углеродных цепей, и во всех случаях продуктами реакции являются CF 4 и HF:
Фарм. Ф Органическая химия Способы получения галогенопроизводных 1. Галогенирование углеводородов а) Для получения хлор- и бромпроизводных широко применяется радикальное галогенирование алканов (см. "Алканы"). С йодом эта реакция не идет. Прямое фторирование углеводородов из-за его высокой экзотермичности приводит к разрыву С-Ссвязей и деструкции углеродных цепей, и во всех случаях продуктами реакции являются CF 4 и HF:
 Фарм. Ф Органическая химия б) Для получения хлор- и бромпроизводных ароматических углеводородов применяется прямое галогенирование в присутствии катализаторов – кислот Льюса (см. "Ароматические углеводороды"). в) Присоединение галогенов и галогеноводородов к непредельным соединениям (см. "Алкены" и Алкины").
Фарм. Ф Органическая химия б) Для получения хлор- и бромпроизводных ароматических углеводородов применяется прямое галогенирование в присутствии катализаторов – кислот Льюса (см. "Ароматические углеводороды"). в) Присоединение галогенов и галогеноводородов к непредельным соединениям (см. "Алкены" и Алкины").
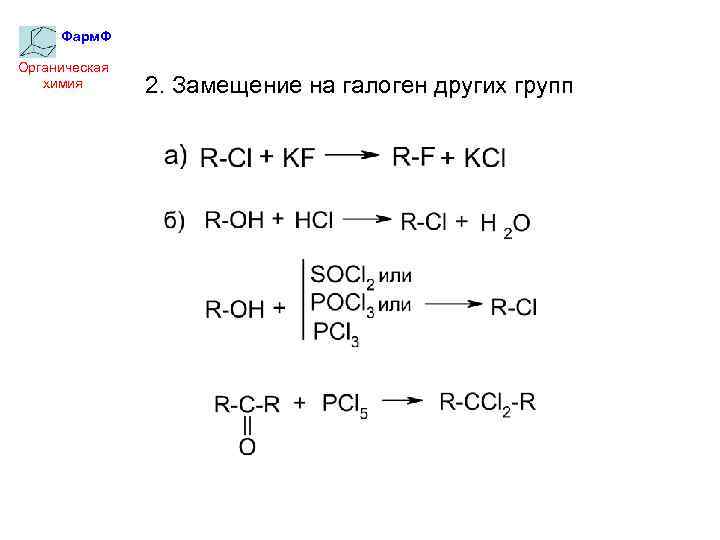 Фарм. Ф Органическая химия 2. Замещение на галоген других групп
Фарм. Ф Органическая химия 2. Замещение на галоген других групп
 Фарм. Ф Органическая химия Химические свойства галогенопроизводных В синтетическом отношении галогенопроизводные – один из наиболее важных классов.
Фарм. Ф Органическая химия Химические свойства галогенопроизводных В синтетическом отношении галогенопроизводные – один из наиболее важных классов.
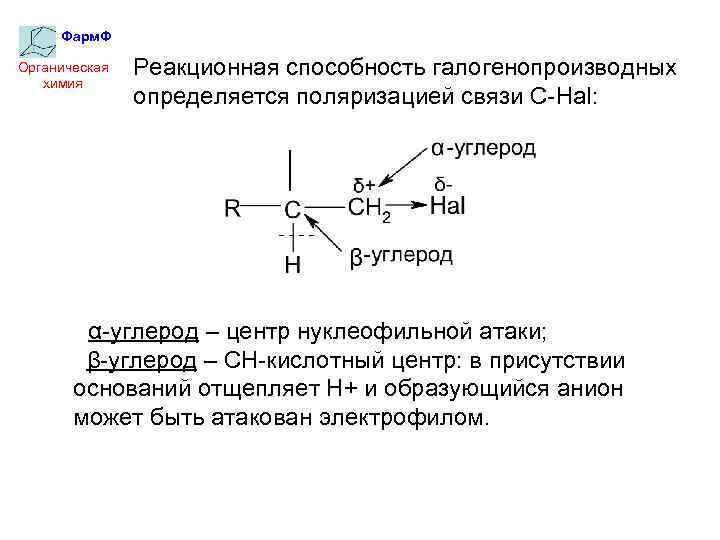 Фарм. Ф Органическая химия Реакционная способность галогенопроизводных определяется поляризацией связи С-Hal: α-углерод – центр нуклеофильной атаки; β-углерод – СН-кислотный центр: в присутствии оснований отщепляет Н+ и образующийся анион может быть атакован электрофилом.
Фарм. Ф Органическая химия Реакционная способность галогенопроизводных определяется поляризацией связи С-Hal: α-углерод – центр нуклеофильной атаки; β-углерод – СН-кислотный центр: в присутствии оснований отщепляет Н+ и образующийся анион может быть атакован электрофилом.
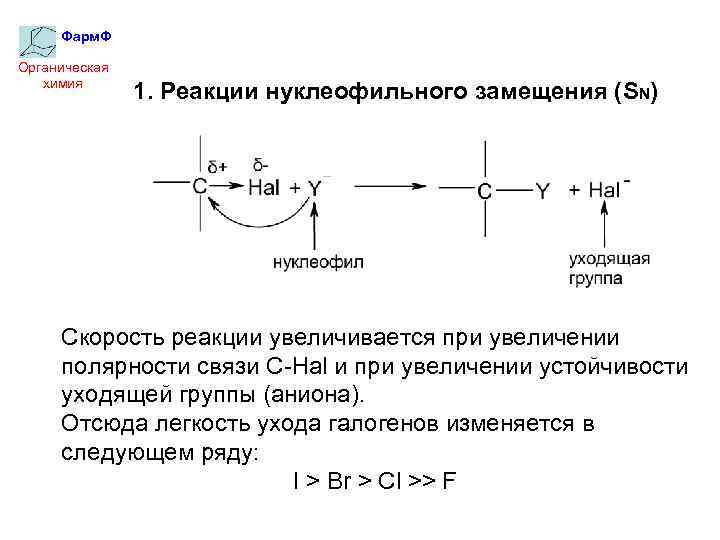 Фарм. Ф Органическая химия 1. Реакции нуклеофильного замещения (SN) Скорость реакции увеличивается при увеличении полярности связи C-Hal и при увеличении устойчивости уходящей группы (аниона). Отсюда легкость ухода галогенов изменяется в следующем ряду: I > Br > Cl >> F
Фарм. Ф Органическая химия 1. Реакции нуклеофильного замещения (SN) Скорость реакции увеличивается при увеличении полярности связи C-Hal и при увеличении устойчивости уходящей группы (аниона). Отсюда легкость ухода галогенов изменяется в следующем ряду: I > Br > Cl >> F
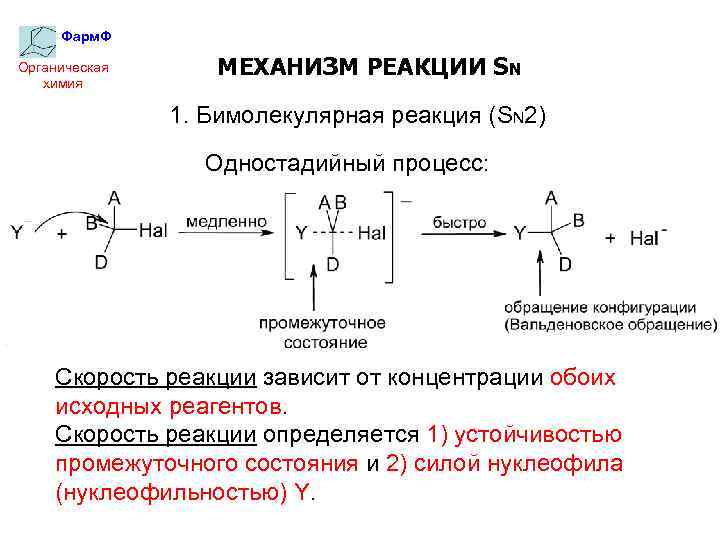 Фарм. Ф Органическая химия МЕХАНИЗМ РЕАКЦИИ SN 1. Бимолекулярная реакция (SN 2) Одностадийный процесс: Скорость реакции зависит от концентрации обоих исходных реагентов. Скорость реакции определяется 1) устойчивостью промежуточного состояния и 2) силой нуклеофила (нуклеофильностью) Y.
Фарм. Ф Органическая химия МЕХАНИЗМ РЕАКЦИИ SN 1. Бимолекулярная реакция (SN 2) Одностадийный процесс: Скорость реакции зависит от концентрации обоих исходных реагентов. Скорость реакции определяется 1) устойчивостью промежуточного состояния и 2) силой нуклеофила (нуклеофильностью) Y.
 Фарм. Ф Органическая химия Нуклеофильность – это способность отдавать неподелённую пару электронов другому атому (кроме протона). Нуклеофильность и основность чаще всего изменяются параллельно, но в отличие от основности нуклеофильность зависит от поляризуемости: с увеличением поляризуемости нуклеофильность увеличивается. Поэтому:
Фарм. Ф Органическая химия Нуклеофильность – это способность отдавать неподелённую пару электронов другому атому (кроме протона). Нуклеофильность и основность чаще всего изменяются параллельно, но в отличие от основности нуклеофильность зависит от поляризуемости: с увеличением поляризуемости нуклеофильность увеличивается. Поэтому:
 Фарм. Ф Органическая химия Факторы, способствующие реакциям SN 2: По механизму SN 2 реагируют 1) сильные нуклеофилы и 2) производные первичных и простых вторичных алкилов: в случае третичных и объемных вторичных алкилов из-за пространственных затруднений значительно снижается устойчивость промежуточного состояния. 3) Реакциям SN 2 способствуют полярные апротонные растворители, повышающие устойчивость промежуточного состояния.
Фарм. Ф Органическая химия Факторы, способствующие реакциям SN 2: По механизму SN 2 реагируют 1) сильные нуклеофилы и 2) производные первичных и простых вторичных алкилов: в случае третичных и объемных вторичных алкилов из-за пространственных затруднений значительно снижается устойчивость промежуточного состояния. 3) Реакциям SN 2 способствуют полярные апротонные растворители, повышающие устойчивость промежуточного состояния.
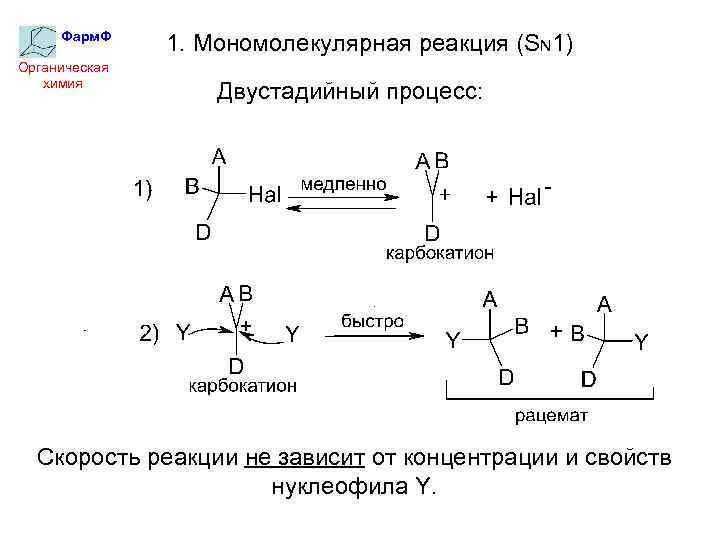 Фарм. Ф Органическая химия 1. Мономолекулярная реакция (SN 1) Двустадийный процесс: Скорость реакции не зависит от концентрации и свойств нуклеофила Y.
Фарм. Ф Органическая химия 1. Мономолекулярная реакция (SN 1) Двустадийный процесс: Скорость реакции не зависит от концентрации и свойств нуклеофила Y.
 Фарм. Ф Органическая химия Факторы, способствующие реакциям SN 1: 1) По механизму SN 1 реагируют производные третичных и объемных вторичных алкилов, в карбокатионе которых (+)-заряд значительно делокализован и устойчивость карбокатиона повышена. 2) В ряду производных F → Cl → Br → I возрастает полярность и поляризуемость связи С-Hal и способность к диссоциации с образованием карбокатиона. Поэтому реакции SN 1 идут преимущественно с бром- и иодпроизводными, реже с хлорпроизводными, практически не идут с фторпроизводными. 3) Реакциям SN 1 способствуют полярные протонные растворители, которые "разрыхляют" связь С-Hal и сольватируют образующийся карбокатион.
Фарм. Ф Органическая химия Факторы, способствующие реакциям SN 1: 1) По механизму SN 1 реагируют производные третичных и объемных вторичных алкилов, в карбокатионе которых (+)-заряд значительно делокализован и устойчивость карбокатиона повышена. 2) В ряду производных F → Cl → Br → I возрастает полярность и поляризуемость связи С-Hal и способность к диссоциации с образованием карбокатиона. Поэтому реакции SN 1 идут преимущественно с бром- и иодпроизводными, реже с хлорпроизводными, практически не идут с фторпроизводными. 3) Реакциям SN 1 способствуют полярные протонные растворители, которые "разрыхляют" связь С-Hal и сольватируют образующийся карбокатион.
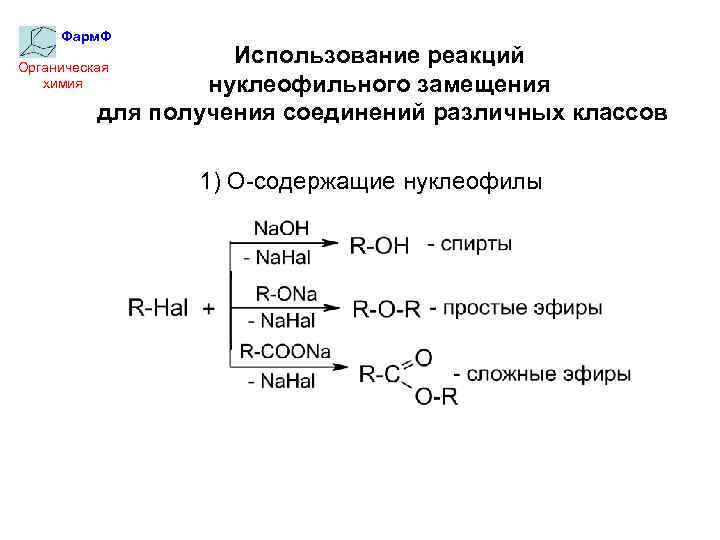 Фарм. Ф Использование реакций нуклеофильного замещения для получения соединений различных классов Органическая химия 1) О-содержащие нуклеофилы
Фарм. Ф Использование реакций нуклеофильного замещения для получения соединений различных классов Органическая химия 1) О-содержащие нуклеофилы
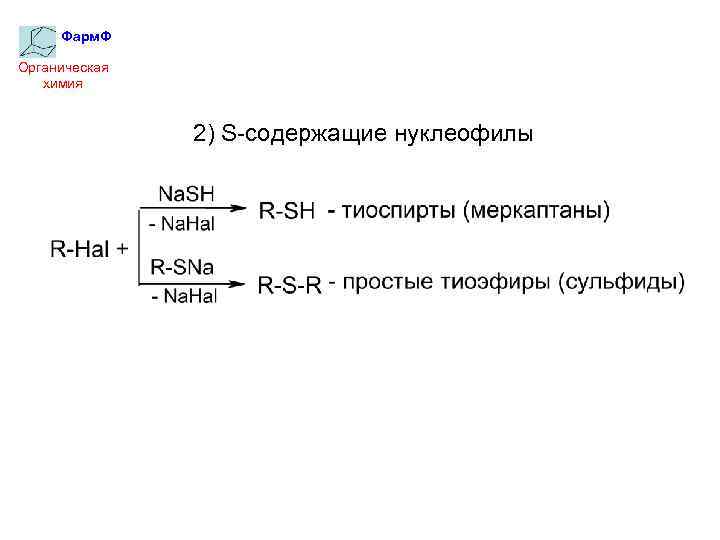 Фарм. Ф Органическая химия 2) S-содержащие нуклеофилы
Фарм. Ф Органическая химия 2) S-содержащие нуклеофилы
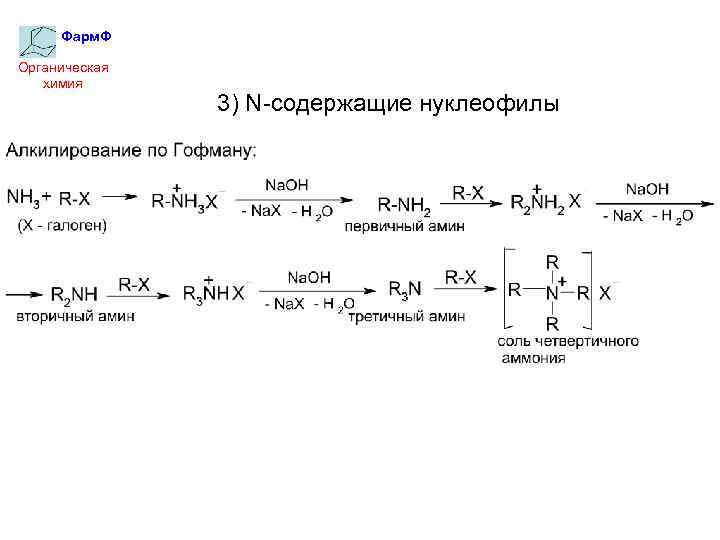 Фарм. Ф Органическая химия 3) N-содержащие нуклеофилы
Фарм. Ф Органическая химия 3) N-содержащие нуклеофилы
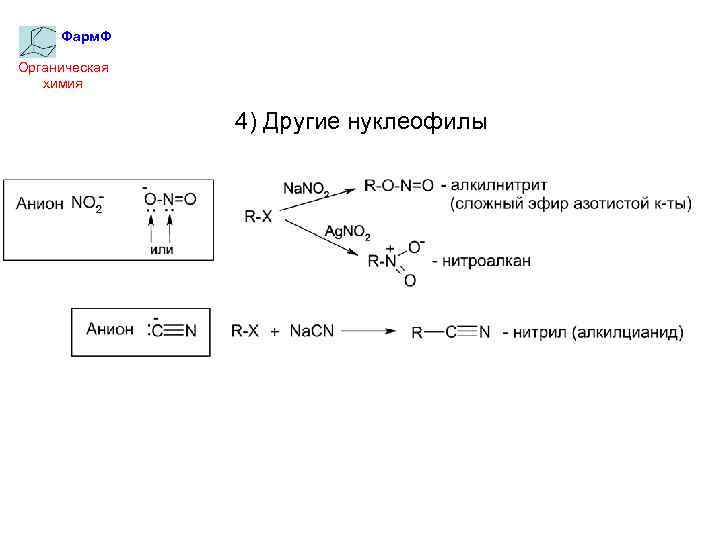 Фарм. Ф Органическая химия 4) Другие нуклеофилы
Фарм. Ф Органическая химия 4) Другие нуклеофилы
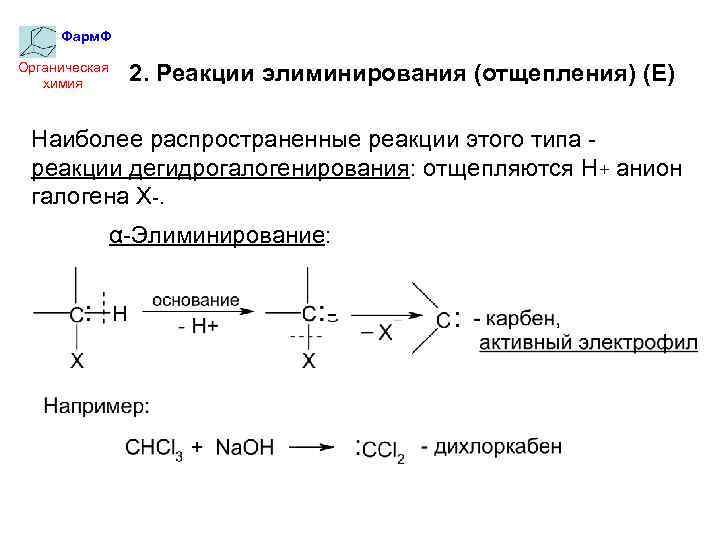 Фарм. Ф Органическая химия 2. Реакции элиминирования (отщепления) (Е) Наиболее распространенные реакции этого типа реакции дегидрогалогенирования: отщепляются Н+ анион галогена Х-. α-Элиминирование:
Фарм. Ф Органическая химия 2. Реакции элиминирования (отщепления) (Е) Наиболее распространенные реакции этого типа реакции дегидрогалогенирования: отщепляются Н+ анион галогена Х-. α-Элиминирование:
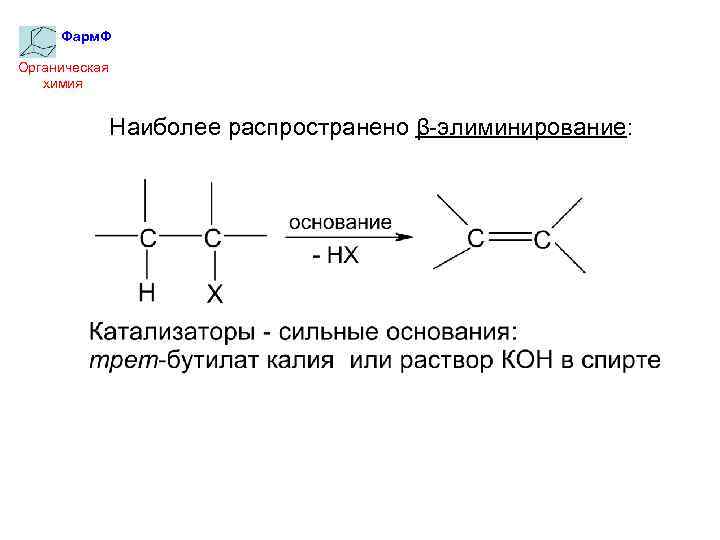 Фарм. Ф Органическая химия Наиболее распространено β-элиминирование:
Фарм. Ф Органическая химия Наиболее распространено β-элиминирование:
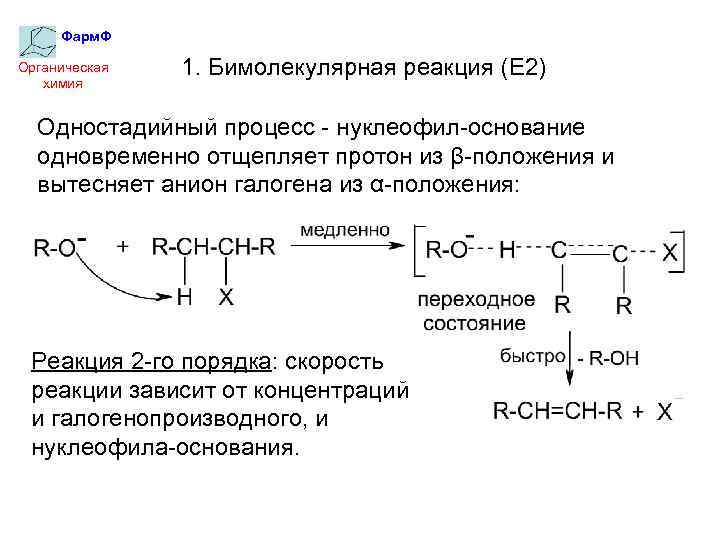 Фарм. Ф Органическая химия 1. Бимолекулярная реакция (Е 2) Одностадийный процесс - нуклеофил-основание одновременно отщепляет протон из β-положения и вытесняет анион галогена из α-положения: Реакция 2 -го порядка: скорость реакции зависит от концентраций и галогенопроизводного, и нуклеофила-основания.
Фарм. Ф Органическая химия 1. Бимолекулярная реакция (Е 2) Одностадийный процесс - нуклеофил-основание одновременно отщепляет протон из β-положения и вытесняет анион галогена из α-положения: Реакция 2 -го порядка: скорость реакции зависит от концентраций и галогенопроизводного, и нуклеофила-основания.
 Фарм. Ф Органическая химия По механизму Е 2 происходит дегидрогалогенирование первичных и небольших по объему вторичных алкилгалогенидов. Правило Зайцева При дегидрогалогенировании алкилгалогенидов водород отщепляется от наименее гидрогенизированного атома углерода. В результате образуются продукты, содержащие у двойной связи наибольшее количество заместителей (более разветвленные), т. е. термодинамически наиболее устойчивые.
Фарм. Ф Органическая химия По механизму Е 2 происходит дегидрогалогенирование первичных и небольших по объему вторичных алкилгалогенидов. Правило Зайцева При дегидрогалогенировании алкилгалогенидов водород отщепляется от наименее гидрогенизированного атома углерода. В результате образуются продукты, содержащие у двойной связи наибольшее количество заместителей (более разветвленные), т. е. термодинамически наиболее устойчивые.
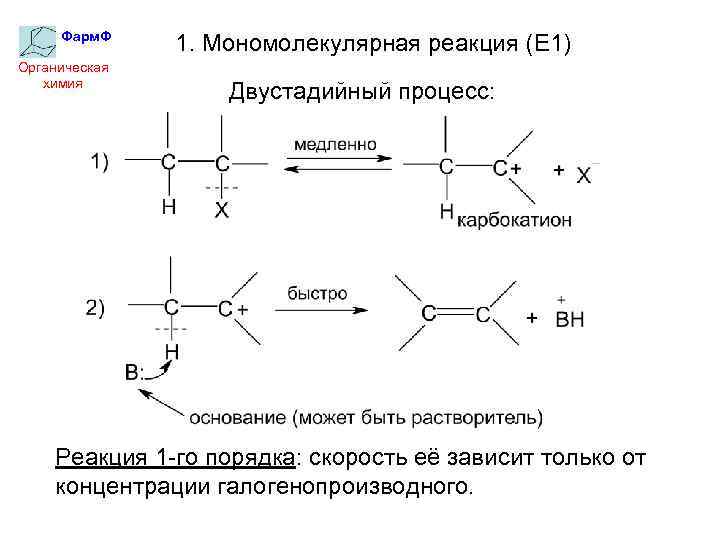 Фарм. Ф Органическая химия 1. Мономолекулярная реакция (Е 1) Двустадийный процесс: Реакция 1 -го порядка: скорость её зависит только от концентрации галогенопроизводного.
Фарм. Ф Органическая химия 1. Мономолекулярная реакция (Е 1) Двустадийный процесс: Реакция 1 -го порядка: скорость её зависит только от концентрации галогенопроизводного.
 Фарм. Ф Органическая химия Скорость реакций Е 1 определяется устойчивостью промежуточно образующегося карбкатиона. Поэтому: 1) По механизму Е 1 происходит дегидрогалогенирование алкилгалогенидов с разветвленными алкилами – третичными и некоторыми вторичными. 2) Реакциям Е 1 способствуют растворители, хорошо сольватирующие карбкатионы: спирты, водноспиртовые смеси, карбоновые кислоты.
Фарм. Ф Органическая химия Скорость реакций Е 1 определяется устойчивостью промежуточно образующегося карбкатиона. Поэтому: 1) По механизму Е 1 происходит дегидрогалогенирование алкилгалогенидов с разветвленными алкилами – третичными и некоторыми вторичными. 2) Реакциям Е 1 способствуют растворители, хорошо сольватирующие карбкатионы: спирты, водноспиртовые смеси, карбоновые кислоты.
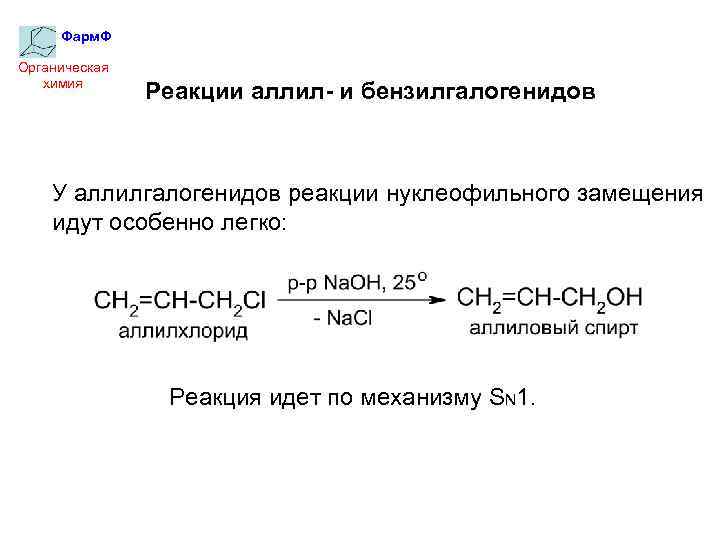 Фарм. Ф Органическая химия Реакции аллил- и бензилгалогенидов У аллилгалогенидов реакции нуклеофильного замещения идут особенно легко: Реакция идет по механизму SN 1.
Фарм. Ф Органическая химия Реакции аллил- и бензилгалогенидов У аллилгалогенидов реакции нуклеофильного замещения идут особенно легко: Реакция идет по механизму SN 1.
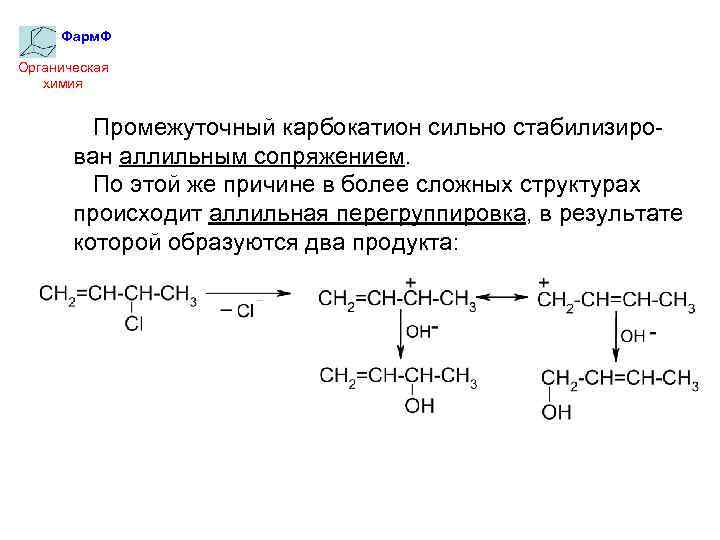 Фарм. Ф Органическая химия Промежуточный карбокатион сильно стабилизирован аллильным сопряжением. По этой же причине в более сложных структурах происходит аллильная перегруппировка, в результате которой образуются два продукта:
Фарм. Ф Органическая химия Промежуточный карбокатион сильно стабилизирован аллильным сопряжением. По этой же причине в более сложных структурах происходит аллильная перегруппировка, в результате которой образуются два продукта:
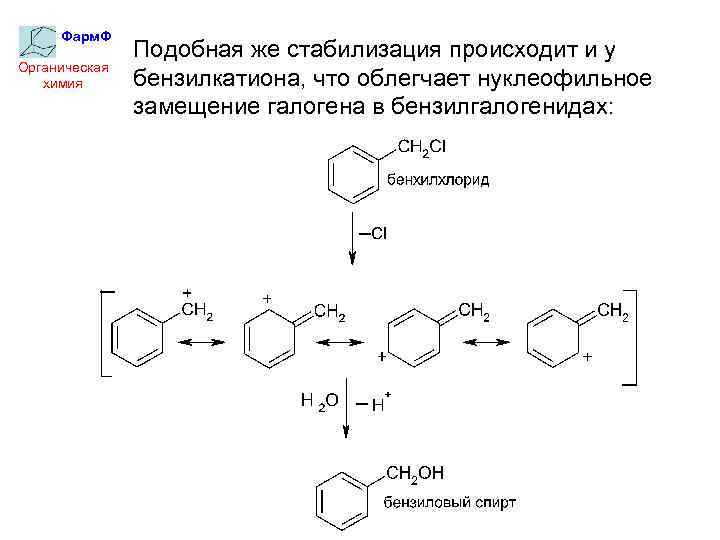 Фарм. Ф Органическая химия Подобная же стабилизация происходит и у бензилкатиона, что облегчает нуклеофильное замещение галогена в бензилгалогенидах:
Фарм. Ф Органическая химия Подобная же стабилизация происходит и у бензилкатиона, что облегчает нуклеофильное замещение галогена в бензилгалогенидах:
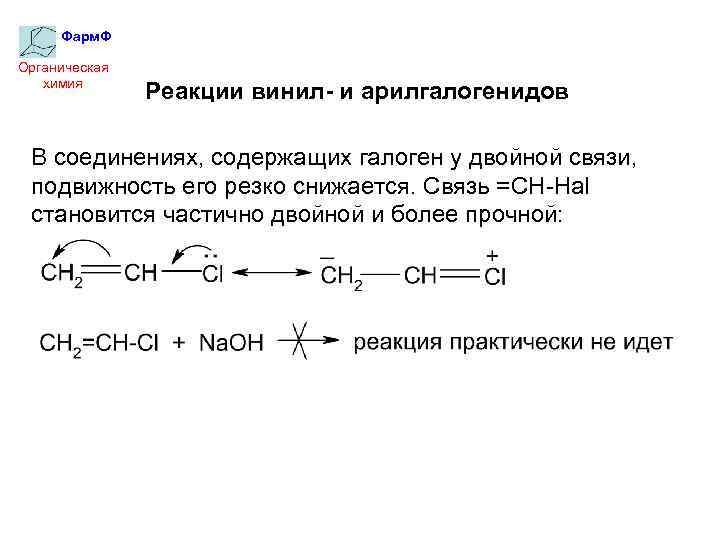 Фарм. Ф Органическая химия Реакции винил- и арилгалогенидов В соединениях, содержащих галоген у двойной связи, подвижность его резко снижается. Связь =CH-Hal становится частично двойной и более прочной:
Фарм. Ф Органическая химия Реакции винил- и арилгалогенидов В соединениях, содержащих галоген у двойной связи, подвижность его резко снижается. Связь =CH-Hal становится частично двойной и более прочной:
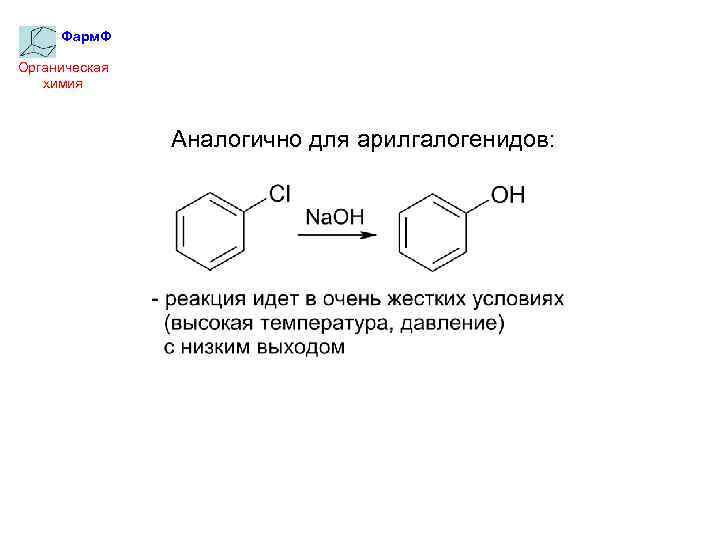 Фарм. Ф Органическая химия Аналогично для арилгалогенидов:
Фарм. Ф Органическая химия Аналогично для арилгалогенидов:
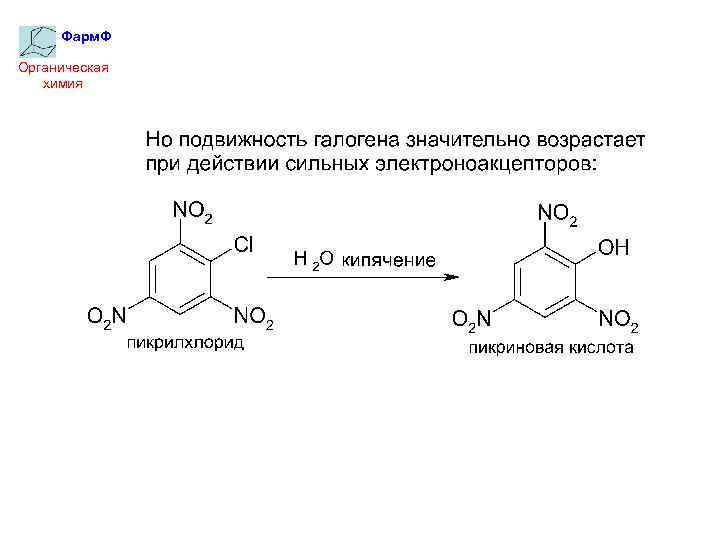 Фарм. Ф Органическая химия
Фарм. Ф Органическая химия
 Фарм. Ф Органическая химия Отдельные представители галогенопроизводных – см. учебник ЛИТЕРАТУРА: 1. Белобородов В. Л. , Зурабян С. Э. , Лузин А. П. , Тюкавкина Н. А. – Органическая химия (основной курс) – Дрофа, М. , 2003 г. , с. 298 – 336. 24. 08. 09
Фарм. Ф Органическая химия Отдельные представители галогенопроизводных – см. учебник ЛИТЕРАТУРА: 1. Белобородов В. Л. , Зурабян С. Э. , Лузин А. П. , Тюкавкина Н. А. – Органическая химия (основной курс) – Дрофа, М. , 2003 г. , с. 298 – 336. 24. 08. 09


