Презентация3.pptx
- Количество слайдов: 26
 Факторы влияющие на скорость химической реакции природа вещества, концентрация температура, катализатор и др. реагентов, Природа реагирующих веществ 2 NO + O 2 = 2 NO 2 2 CO + O 2 = 2 CO 2 Концентрация реагентов (Закон действующих масс) а. А + в. В = с. С v = k[A]a[B]b v = k[C]c 2 NO(г) + O 2(г) = 2 NO 2(г) v=k×[NO]2·[O 2]. С(тв. ) + О 2(г) = СО 2(г) v=k×[O 2].
Факторы влияющие на скорость химической реакции природа вещества, концентрация температура, катализатор и др. реагентов, Природа реагирующих веществ 2 NO + O 2 = 2 NO 2 2 CO + O 2 = 2 CO 2 Концентрация реагентов (Закон действующих масс) а. А + в. В = с. С v = k[A]a[B]b v = k[C]c 2 NO(г) + O 2(г) = 2 NO 2(г) v=k×[NO]2·[O 2]. С(тв. ) + О 2(г) = СО 2(г) v=k×[O 2].
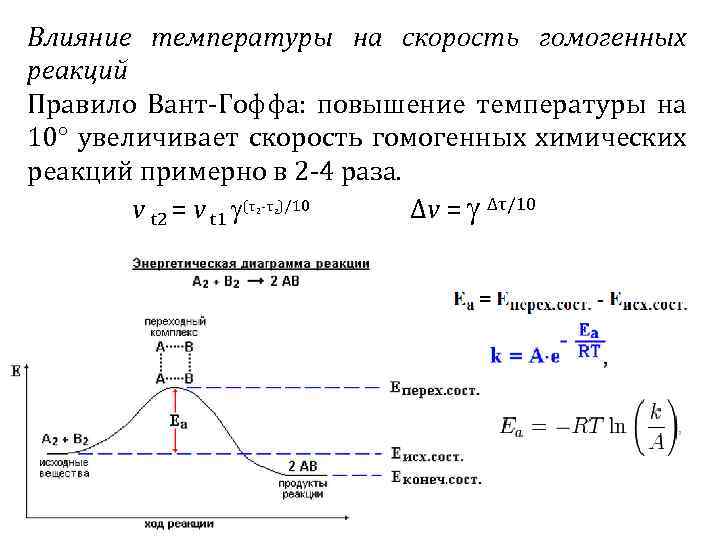 Влияние температуры на скорость гомогенных реакций Правило Вант-Гоффа: повышение температуры на 10° увеличивает скорость гомогенных химических реакций примерно в 2 -4 раза. v t 2 = v t 1 (τ -τ )/10 Δv = Δτ/10 2 2
Влияние температуры на скорость гомогенных реакций Правило Вант-Гоффа: повышение температуры на 10° увеличивает скорость гомогенных химических реакций примерно в 2 -4 раза. v t 2 = v t 1 (τ -τ )/10 Δv = Δτ/10 2 2
 Обратимые и необратимые химические реакции Химическое равновесие - состояние системы, при котором скорость образования продуктов реакции равна скорости их превращения в исходные реагенты. а. А + в. В = с. С + d. D v = k[A]a[B]b v = k[C]c[D]d v = v k k[A]a[B]b = k[C]c[D]d / k = ([C]c[D]d)/([A]a[B]b )= K 2 NO(г) + O 2(г) = 2 NO 2(г) K=[NO 2]2 / [NO]2·[O 2] С(тв. ) + CО 2(г) = 2 СО (г) K= [CO]2 / [CO 2]
Обратимые и необратимые химические реакции Химическое равновесие - состояние системы, при котором скорость образования продуктов реакции равна скорости их превращения в исходные реагенты. а. А + в. В = с. С + d. D v = k[A]a[B]b v = k[C]c[D]d v = v k k[A]a[B]b = k[C]c[D]d / k = ([C]c[D]d)/([A]a[B]b )= K 2 NO(г) + O 2(г) = 2 NO 2(г) K=[NO 2]2 / [NO]2·[O 2] С(тв. ) + CО 2(г) = 2 СО (г) K= [CO]2 / [CO 2]
 Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции. Признаки истинного химического равновесия: 1. состояние системы остается неизменным во времени при отсутствии внешних воздействий; 2. состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были; 3. состояние системы не зависит от того, с какой стороны она подходит к равновесию.
Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции. Признаки истинного химического равновесия: 1. состояние системы остается неизменным во времени при отсутствии внешних воздействий; 2. состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были; 3. состояние системы не зависит от того, с какой стороны она подходит к равновесию.
 Смещение химического равновесия Принцип Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются те процессы, которые стремятся свести это воздействие к минимуму. V = 1+3 V = 2 N 2 (г) + 3 H 2 (г) 2 NH 3 (г) Δ H = -92. 4 Q = +92. 4 T↑ (-Q или +ΔН) эндотермической реакции T↓ (+Q или -ΔН) эндотермической реакции P↑ (Vmin) меньшего объема P↓ (Vmax) большего объема С↑исх. в-в продуктов С↑продук исходных С↓исх. в-в исходных в-в С↓продук продуктов
Смещение химического равновесия Принцип Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются те процессы, которые стремятся свести это воздействие к минимуму. V = 1+3 V = 2 N 2 (г) + 3 H 2 (г) 2 NH 3 (г) Δ H = -92. 4 Q = +92. 4 T↑ (-Q или +ΔН) эндотермической реакции T↓ (+Q или -ΔН) эндотермической реакции P↑ (Vmin) меньшего объема P↓ (Vmax) большего объема С↑исх. в-в продуктов С↑продук исходных С↓исх. в-в исходных в-в С↓продук продуктов
 РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ Раствор - гомогенная система, состоящая из двух или более независимых компонентов, соотношение между которыми может изменяться. Растворителем считается то вещество, количество которого преобладает в данной системе и определяет агрегатное состояние раствора. По агрегатному состоянию растворы делятся: • газообразные растворы: воздух • твердые растворы: сплавы металлов; • жидкие растворы в свою очередь делятся: растворы твердых веществ в жидкостях: соль+Н 2 О, растворы газообразных веществ в жидкостях: лимонады растворы жидких веществ в жидкостях: уксус, водка
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ Раствор - гомогенная система, состоящая из двух или более независимых компонентов, соотношение между которыми может изменяться. Растворителем считается то вещество, количество которого преобладает в данной системе и определяет агрегатное состояние раствора. По агрегатному состоянию растворы делятся: • газообразные растворы: воздух • твердые растворы: сплавы металлов; • жидкие растворы в свою очередь делятся: растворы твердых веществ в жидкостях: соль+Н 2 О, растворы газообразных веществ в жидкостях: лимонады растворы жидких веществ в жидкостях: уксус, водка
 Устойчивость раствора определяется размером растворенных частиц: истинные растворы (10 -9 – 10 -10 м); растворы электролитов (ионные); растворы неэлектролитов (молекулярные); коллоидные растворы (10 -6 – 10 -8 м); суспензии (Т+Ж), эмульсии (Ж+Ж) (10 -4 – 10 -5 м). Истинный раствор - устойчивая гомогенная система переменного количественного состава, состоящая из двух или более компонентов, между которыми существуют достаточно сильные взаимодействия.
Устойчивость раствора определяется размером растворенных частиц: истинные растворы (10 -9 – 10 -10 м); растворы электролитов (ионные); растворы неэлектролитов (молекулярные); коллоидные растворы (10 -6 – 10 -8 м); суспензии (Т+Ж), эмульсии (Ж+Ж) (10 -4 – 10 -5 м). Истинный раствор - устойчивая гомогенная система переменного количественного состава, состоящая из двух или более компонентов, между которыми существуют достаточно сильные взаимодействия.
 Классификация растворов: • по относительным количествам растворенного вещества и растворители: разбавленные и концентрированные; • по соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора: насыщенные, ненасыщенные, перенасыщенные. Насыщенный раствор - это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества. Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость.
Классификация растворов: • по относительным количествам растворенного вещества и растворители: разбавленные и концентрированные; • по соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора: насыщенные, ненасыщенные, перенасыщенные. Насыщенный раствор - это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества. Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость.
 Способы характеристики растворимости Коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Р 20 H 2 O(Na. Cl) = 36. Молярная растворимость вещества (S) - число молей вещества, способное при данной температуре раствориться в 1 л указанного растворителя с образованием насыщенного раствора. S(Na. CI) = 6, 154 моль/л Коэффициент поглощения газа –наибольший объем газа, который может раствориться в единице объема растворителя при данной температуре и парциальном давлении газа 1 атм.
Способы характеристики растворимости Коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Р 20 H 2 O(Na. Cl) = 36. Молярная растворимость вещества (S) - число молей вещества, способное при данной температуре раствориться в 1 л указанного растворителя с образованием насыщенного раствора. S(Na. CI) = 6, 154 моль/л Коэффициент поглощения газа –наибольший объем газа, который может раствориться в единице объема растворителя при данной температуре и парциальном давлении газа 1 атм.
 Способы выражения состава раствора Массовая доля Мольная доля Молярная концентрация (молярность) Моляльная концентрация (моляльность) Титр
Способы выражения состава раствора Массовая доля Мольная доля Молярная концентрация (молярность) Моляльная концентрация (моляльность) Титр
 Способы выражения состава раствора Молярная концентрация (молярность) Нормальная концентрация (нормальность) n(Р. В. )=nf(Р. В. )* f
Способы выражения состава раствора Молярная концентрация (молярность) Нормальная концентрация (нормальность) n(Р. В. )=nf(Р. В. )* f
 КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными: • осмотическое давление • давление насыщенного пара р-ля над р-ром • температура кристаллизации раствора • температура кипения раствора
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными: • осмотическое давление • давление насыщенного пара р-ля над р-ром • температура кристаллизации раствора • температура кипения раствора
 ОСМОС – односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую перегородку из раствора с низкой концентрацией в раствор с более высокой концентрацией. Осмотическое давление (π) - избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью. π= i*Cm*R*T к. Па R = 8, 314 Дж/моль* К
ОСМОС – односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую перегородку из раствора с низкой концентрацией в раствор с более высокой концентрацией. Осмотическое давление (π) - избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью. π= i*Cm*R*T к. Па R = 8, 314 Дж/моль* К
 Закон Вант-Гоффа Осмотическое давление разбавленного идеального раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы при той же температуре находилось бы в газообразном состоянии и занимало бы объем, равный объему раствора. i = число частиц р. в. /число частиц исх. в. i(Na. CI)=2 i(Ca. CI 2)=3 i(Na 3 PO 4)=4 Изотонические растворы – имеют равное осмотическое давление. Гипертонические растворы– имеют большее осмотическое давление по сравнению с другим раствором. Гипотонические растворы – имеют меньшее осмотическое давление по сравнению с другим раствором.
Закон Вант-Гоффа Осмотическое давление разбавленного идеального раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы при той же температуре находилось бы в газообразном состоянии и занимало бы объем, равный объему раствора. i = число частиц р. в. /число частиц исх. в. i(Na. CI)=2 i(Ca. CI 2)=3 i(Na 3 PO 4)=4 Изотонические растворы – имеют равное осмотическое давление. Гипертонические растворы– имеют большее осмотическое давление по сравнению с другим раствором. Гипотонические растворы – имеют меньшее осмотическое давление по сравнению с другим раствором.
 Закон Рауля I : Относительное понижение давление насыщенного пара растворителя над раствором равно молярной доле растворенного вещества. P = N(р-ля)*P 0 Закон Рауля II. Понижение температуры замерзания и повышение температуры кипения не зависят от природы растворенного вещества и прямопропорциональны моляльной концентрации раствора. ∆t кип = i*Кэб*Сm ∆t кип = t кип р-ра - t кип р-ля ∆t зам = i*Kкр*Сm ∆t зам = t зам р-ля - t зам р-ра
Закон Рауля I : Относительное понижение давление насыщенного пара растворителя над раствором равно молярной доле растворенного вещества. P = N(р-ля)*P 0 Закон Рауля II. Понижение температуры замерзания и повышение температуры кипения не зависят от природы растворенного вещества и прямопропорциональны моляльной концентрации раствора. ∆t кип = i*Кэб*Сm ∆t кип = t кип р-ра - t кип р-ля ∆t зам = i*Kкр*Сm ∆t зам = t зам р-ля - t зам р-ра
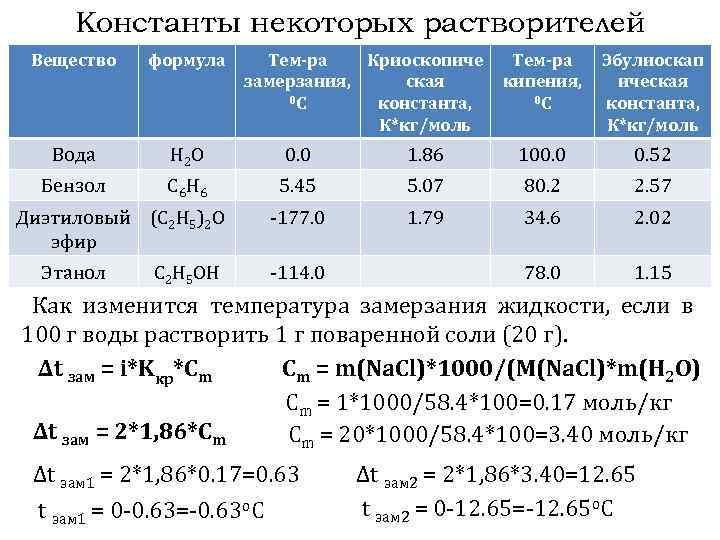 Константы некоторых растворителей Вещество формула Тем-ра Криоскопиче замерзания, ская 0 С константа, К*кг/моль Вода H 2 O 0. 0 1. 86 100. 0 0. 52 Бензол C 6 H 6 5. 45 5. 07 80. 2 2. 57 -177. 0 1. 79 34. 6 2. 02 78. 0 1. 15 Диэтиловый (C 2 H 5)2 O эфир Этанол C 2 H 5 OH -114. 0 Тем-ра Эбулиоскап кипения, ическая 0 С константа, К*кг/моль Как изменится температура замерзания жидкости, если в 100 г воды растворить 1 г поваренной соли (20 г). ∆t зам = i*Kкр*Сm Cm = m(Na. Cl)*1000/(M(Na. Cl)*m(H 2 O) Cm = 1*1000/58. 4*100=0. 17 моль/кг ∆t зам = 2*1, 86*Сm Cm = 20*1000/58. 4*100=3. 40 моль/кг ∆t зам 1 = 2*1, 86*0. 17=0. 63 t зам 1 = 0 -0. 63=-0. 63 o. C ∆t зам 2 = 2*1, 86*3. 40=12. 65 t зам 2 = 0 -12. 65=-12. 65 o. C
Константы некоторых растворителей Вещество формула Тем-ра Криоскопиче замерзания, ская 0 С константа, К*кг/моль Вода H 2 O 0. 0 1. 86 100. 0 0. 52 Бензол C 6 H 6 5. 45 5. 07 80. 2 2. 57 -177. 0 1. 79 34. 6 2. 02 78. 0 1. 15 Диэтиловый (C 2 H 5)2 O эфир Этанол C 2 H 5 OH -114. 0 Тем-ра Эбулиоскап кипения, ическая 0 С константа, К*кг/моль Как изменится температура замерзания жидкости, если в 100 г воды растворить 1 г поваренной соли (20 г). ∆t зам = i*Kкр*Сm Cm = m(Na. Cl)*1000/(M(Na. Cl)*m(H 2 O) Cm = 1*1000/58. 4*100=0. 17 моль/кг ∆t зам = 2*1, 86*Сm Cm = 20*1000/58. 4*100=3. 40 моль/кг ∆t зам 1 = 2*1, 86*0. 17=0. 63 t зам 1 = 0 -0. 63=-0. 63 o. C ∆t зам 2 = 2*1, 86*3. 40=12. 65 t зам 2 = 0 -12. 65=-12. 65 o. C
 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. Электролитами являются вещества, которые способны проводить электрический ток в растворах или расплавах (кислоты, основания, соли). Электролитическая диссоциация - процесс распада молекул электролитов на ионы в растворе или расплаве. An+Bm- n. A+ + m. BH+Cl- H+ + Cl. Ступенчатая диссоциация: на примере двухосновной кислоты. I H 2+(CO 3)-2 H+ + (H+CO 3 -2)II (H+CO 3 -2)- H+ + CO 32 H 2 CO 3 2 H+ + CO 32 -
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. Электролитами являются вещества, которые способны проводить электрический ток в растворах или расплавах (кислоты, основания, соли). Электролитическая диссоциация - процесс распада молекул электролитов на ионы в растворе или расплаве. An+Bm- n. A+ + m. BH+Cl- H+ + Cl. Ступенчатая диссоциация: на примере двухосновной кислоты. I H 2+(CO 3)-2 H+ + (H+CO 3 -2)II (H+CO 3 -2)- H+ + CO 32 H 2 CO 3 2 H+ + CO 32 -
 Количественно процесс диссоциации характеризуют две величины: степень и константа диссоциации. Степень диссоциации (α) – число, показывающее, какая часть молекул распадается на ионы: α=n/N*100%, n- число молекул, распавшихся на ионы N- общее число молекул в растворе Константа диссоциации (Кд) – количественная хааоактеристика слабых электролитов. Величина Кдис электролита зависит от природы электролита и растворителя, температуры, но не зависит от концентрации раствора. An+Bm- n. A+ + m. BКд = [A+]n[B-]m [An. Bm] H 2 SO 3 2 H+ + SO 32 Kд = [H+]2[SO 32 -] [H 2 SO 3]
Количественно процесс диссоциации характеризуют две величины: степень и константа диссоциации. Степень диссоциации (α) – число, показывающее, какая часть молекул распадается на ионы: α=n/N*100%, n- число молекул, распавшихся на ионы N- общее число молекул в растворе Константа диссоциации (Кд) – количественная хааоактеристика слабых электролитов. Величина Кдис электролита зависит от природы электролита и растворителя, температуры, но не зависит от концентрации раствора. An+Bm- n. A+ + m. BКд = [A+]n[B-]m [An. Bm] H 2 SO 3 2 H+ + SO 32 Kд = [H+]2[SO 32 -] [H 2 SO 3]
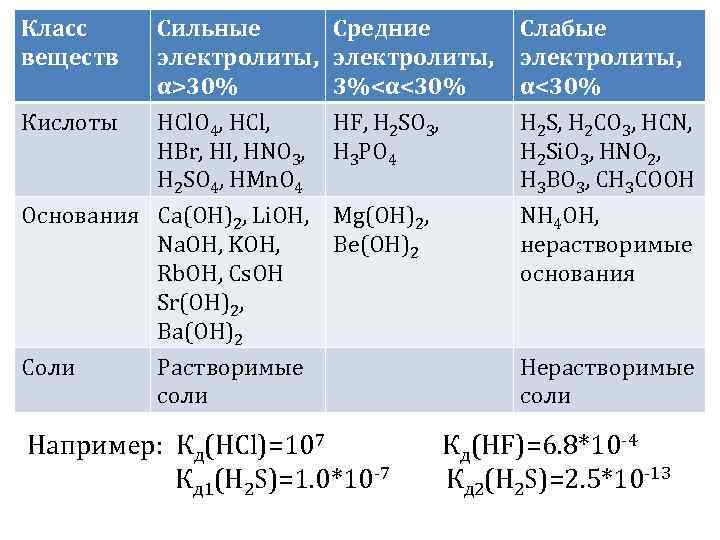 Класс веществ Кислоты Сильные электролиты, α>30% HCl. O 4, HCl, HBr, HI, HNO 3, H 2 SO 4, HMn. O 4 Средние электролиты, 3%<α<30% HF, H 2 SO 3, H 3 PO 4 Слабые электролиты, α<30% H 2 S, H 2 CO 3, HCN, H 2 Si. O 3, HNO 2, H 3 BO 3, CH 3 COOH Основания Ca(OH)2, Li. OH, Mg(OH)2, Na. OH, KOH, Be(OH)2 Rb. OH, Cs. OH Sr(OH)2, Ba(OH)2 NH 4 OH, нерастворимые основания Соли Нерастворимые соли Растворимые соли Например: Кд(HCl)=107 Кд(HF)=6. 8*10 -4 Кд 1(H 2 S)=1. 0*10 -7 Кд 2(H 2 S)=2. 5*10 -13
Класс веществ Кислоты Сильные электролиты, α>30% HCl. O 4, HCl, HBr, HI, HNO 3, H 2 SO 4, HMn. O 4 Средние электролиты, 3%<α<30% HF, H 2 SO 3, H 3 PO 4 Слабые электролиты, α<30% H 2 S, H 2 CO 3, HCN, H 2 Si. O 3, HNO 2, H 3 BO 3, CH 3 COOH Основания Ca(OH)2, Li. OH, Mg(OH)2, Na. OH, KOH, Be(OH)2 Rb. OH, Cs. OH Sr(OH)2, Ba(OH)2 NH 4 OH, нерастворимые основания Соли Нерастворимые соли Растворимые соли Например: Кд(HCl)=107 Кд(HF)=6. 8*10 -4 Кд 1(H 2 S)=1. 0*10 -7 Кд 2(H 2 S)=2. 5*10 -13
 Закон разбавления Оствальда степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации. при α<1% Кд=α 2*c 0 Зависимость степени диссоциации от концентрации слабого электролита Повышение концентрации ведет к снижению степени диссоциации. При бесконечном разбавлении (когда концентрация электролита стремится к 0) степень диссоциации стремится к 1
Закон разбавления Оствальда степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации. при α<1% Кд=α 2*c 0 Зависимость степени диссоциации от концентрации слабого электролита Повышение концентрации ведет к снижению степени диссоциации. При бесконечном разбавлении (когда концентрация электролита стремится к 0) степень диссоциации стремится к 1
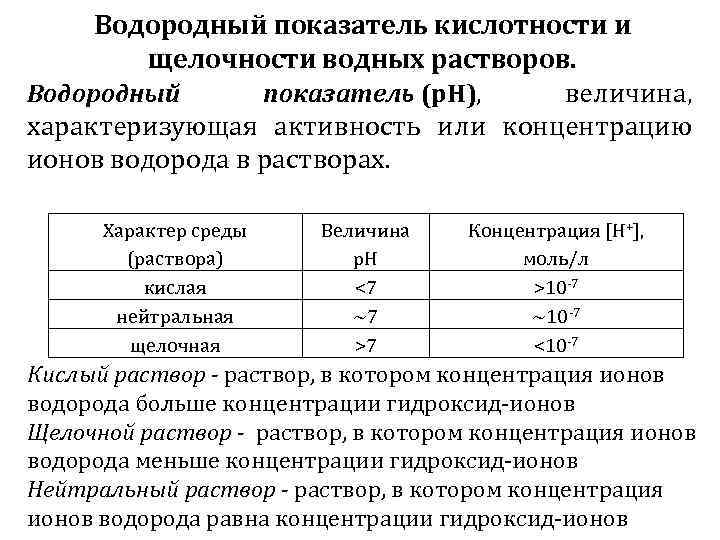 Водородный показатель кислотности и щелочности водных растворов. Водородный показатель (р. Н), величина, характеризующая активность или концентрацию ионов водорода в растворах. Характер среды (раствора) кислая нейтральная щелочная Величина р. Н <7 ~7 >7 Концентрация [Н+], моль/л >10 -7 ~10 -7 <10 -7 Кислый раствор - раствор, в котором концентрация ионов водорода больше концентрации гидроксид-ионов Щелочной раствор - раствор, в котором концентрация ионов водорода меньше концентрации гидроксид-ионов Нейтральный раствор - раствор, в котором концентрация ионов водорода равна концентрации гидроксид-ионов
Водородный показатель кислотности и щелочности водных растворов. Водородный показатель (р. Н), величина, характеризующая активность или концентрацию ионов водорода в растворах. Характер среды (раствора) кислая нейтральная щелочная Величина р. Н <7 ~7 >7 Концентрация [Н+], моль/л >10 -7 ~10 -7 <10 -7 Кислый раствор - раствор, в котором концентрация ионов водорода больше концентрации гидроксид-ионов Щелочной раствор - раствор, в котором концентрация ионов водорода меньше концентрации гидроксид-ионов Нейтральный раствор - раствор, в котором концентрация ионов водорода равна концентрации гидроксид-ионов
 Ионное произведение воды Процесс электролитической диссоциации воды протекает в две стадии: 1. образование ионов водорода и гидроксид–ионов: Н 2 О <=> Н+ + ОН 2. гидратация иона водорода с образованием иона гидроксония: Н+ + Н 2 О <=> Н 3 О+. KH 2 O=const=[Н+]·[ОН-] KH 2 O – ионное произведение воды для чистой воды при 25 о. С [Н+]=[ОН-]=10 -7 моль/л, KH 2 O=10 -7· 10 -7=10 -14 р[Н+]+р[ОН-]=14 сумма водородного и гидроксильного показателей в водных растворах при 25°С равна 14.
Ионное произведение воды Процесс электролитической диссоциации воды протекает в две стадии: 1. образование ионов водорода и гидроксид–ионов: Н 2 О <=> Н+ + ОН 2. гидратация иона водорода с образованием иона гидроксония: Н+ + Н 2 О <=> Н 3 О+. KH 2 O=const=[Н+]·[ОН-] KH 2 O – ионное произведение воды для чистой воды при 25 о. С [Н+]=[ОН-]=10 -7 моль/л, KH 2 O=10 -7· 10 -7=10 -14 р[Н+]+р[ОН-]=14 сумма водородного и гидроксильного показателей в водных растворах при 25°С равна 14.
 Водородный показатель Для выражения кислотности или щелочности раствора используют величину водородного показателя (р. Н), равную десятичному логарифму концентрации ионов водорода [H+], взятому с обратным знаком: Для сильной к-ты р. Н=-lg[H+], где [H+]=[моль/л]. Для сильного о-ния р. OН=-lg[OH-] или p. H=14+lg[OH-] Для слабой к-ты р. Н=0, 5(p. Ka - lg[H+]) Для слабого о-ния р. Н=14 - 0, 5(p. Kb - lg[OH-]) Для слабых электролитов [H+] = (Kд*C)0. 5 Вычислите p. H раствора соляной кислоты (уксусной кислоты) с концентрацией 0, 01 моль/л. (Кд(СН 3 СООН)=1, 74*10 -5 p. H (HCl) = -lg 0. 01 = 2 p. H(CH 3 COOH) = -lg 4. 17*10 -4 = 3. 4 [H+] = (1. 74*10 -5*0. 01)0. 5= 4. 17*10 -4 p. H(CH 3 COOH) = 0. 5(-lg 1. 74*10 -5 -lg 0. 01) = 0. 5(4. 76+2)=3. 4
Водородный показатель Для выражения кислотности или щелочности раствора используют величину водородного показателя (р. Н), равную десятичному логарифму концентрации ионов водорода [H+], взятому с обратным знаком: Для сильной к-ты р. Н=-lg[H+], где [H+]=[моль/л]. Для сильного о-ния р. OН=-lg[OH-] или p. H=14+lg[OH-] Для слабой к-ты р. Н=0, 5(p. Ka - lg[H+]) Для слабого о-ния р. Н=14 - 0, 5(p. Kb - lg[OH-]) Для слабых электролитов [H+] = (Kд*C)0. 5 Вычислите p. H раствора соляной кислоты (уксусной кислоты) с концентрацией 0, 01 моль/л. (Кд(СН 3 СООН)=1, 74*10 -5 p. H (HCl) = -lg 0. 01 = 2 p. H(CH 3 COOH) = -lg 4. 17*10 -4 = 3. 4 [H+] = (1. 74*10 -5*0. 01)0. 5= 4. 17*10 -4 p. H(CH 3 COOH) = 0. 5(-lg 1. 74*10 -5 -lg 0. 01) = 0. 5(4. 76+2)=3. 4
 Гидролиз – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. по КАТИОНУ по АНИОНУ Сил. К-та + сл. О-ние Сл. К-та + сил. О-ние по КАТИОНУ и АНИОНУ Сл. К-та + сл. О-ние Не идет Сил. К-та + сил. О-ние NH 4 NO 3 NH 4+ + NO 3 - NH 4+ +H+(OH-) NH 4 OH + H+ среда кислая p. H<7 NH 4 NO 3 + H 2 O NH 4 OH + HNO 3 Cu. Cl 2 Cu 2+ + 2 Cl- Cu 2+ + H+(OH-) Cu. OH+ + H+ среда кислая p. H<7 Cu. Cl 2 + H 2 O Cu. OHCl + HCl
Гидролиз – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. по КАТИОНУ по АНИОНУ Сил. К-та + сл. О-ние Сл. К-та + сил. О-ние по КАТИОНУ и АНИОНУ Сл. К-та + сл. О-ние Не идет Сил. К-та + сил. О-ние NH 4 NO 3 NH 4+ + NO 3 - NH 4+ +H+(OH-) NH 4 OH + H+ среда кислая p. H<7 NH 4 NO 3 + H 2 O NH 4 OH + HNO 3 Cu. Cl 2 Cu 2+ + 2 Cl- Cu 2+ + H+(OH-) Cu. OH+ + H+ среда кислая p. H<7 Cu. Cl 2 + H 2 O Cu. OHCl + HCl
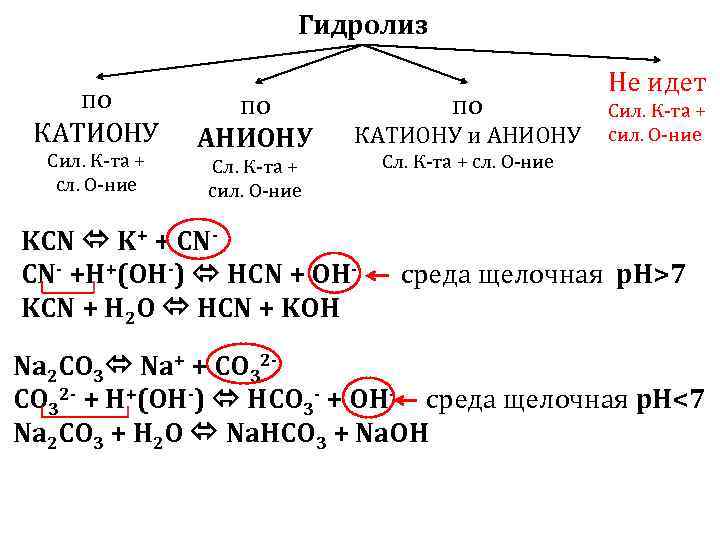 Гидролиз по КАТИОНУ Сил. К-та + сл. О-ние по АНИОНУ Сл. К-та + сил. О-ние по КАТИОНУ и АНИОНУ Не идет Сил. К-та + сил. О-ние Сл. К-та + сл. О-ние KCN K+ + CN- +H+(OH-) HCN + OH- среда щелочная p. H>7 KCN + H 2 O HCN + KOH Na 2 CO 3 Na+ + CO 32 - + H+(OH-) HCO 3 - + OH- среда щелочная p. H<7 Na 2 CO 3 + H 2 O Na. HCO 3 + Na. OH
Гидролиз по КАТИОНУ Сил. К-та + сл. О-ние по АНИОНУ Сл. К-та + сил. О-ние по КАТИОНУ и АНИОНУ Не идет Сил. К-та + сил. О-ние Сл. К-та + сл. О-ние KCN K+ + CN- +H+(OH-) HCN + OH- среда щелочная p. H>7 KCN + H 2 O HCN + KOH Na 2 CO 3 Na+ + CO 32 - + H+(OH-) HCO 3 - + OH- среда щелочная p. H<7 Na 2 CO 3 + H 2 O Na. HCO 3 + Na. OH
 Гидролиз по КАТИОНУ Сил. К-та + сл. О-ние по АНИОНУ Сл. К-та + сил. О-ние Не идет по КАТИОНУ и АНИОНУ Сил. К-та + сил. О-ние Сл. К-та + сл. О-ние (NH 4)2 S = 2 NH 4+ +S 2 NH 4+ +HOH = NH 4 OH + H+ по катиону S 2 - + HOH = HS- + OH- I ступень по аниону HS- + H 2 O = H 2 S + OH II ступень. Без нагревания гидролиз идет, в основном, по I ступени. NH 4+ +S 2 - + 2 H 2 O = NH 3*H 2 O + HS- + H+ + OH(NH 4)2 S + H 2 O = NH 3*H 2 O + NH 4 HS При нагревании гидролиз сульфида аммония идет до конца (т. е. необратим): 2 NH 4 + +S 2 - + 4 H 2 O = 2 NH 3*H 2 O + H 2 S +2 H 2 O (NH 4)2 S + 2 H 2 O = 2 NH 3*H 2 O + H 2 S = 2 NH 3 + H 2 S + 2 H 2 O
Гидролиз по КАТИОНУ Сил. К-та + сл. О-ние по АНИОНУ Сл. К-та + сил. О-ние Не идет по КАТИОНУ и АНИОНУ Сил. К-та + сил. О-ние Сл. К-та + сл. О-ние (NH 4)2 S = 2 NH 4+ +S 2 NH 4+ +HOH = NH 4 OH + H+ по катиону S 2 - + HOH = HS- + OH- I ступень по аниону HS- + H 2 O = H 2 S + OH II ступень. Без нагревания гидролиз идет, в основном, по I ступени. NH 4+ +S 2 - + 2 H 2 O = NH 3*H 2 O + HS- + H+ + OH(NH 4)2 S + H 2 O = NH 3*H 2 O + NH 4 HS При нагревании гидролиз сульфида аммония идет до конца (т. е. необратим): 2 NH 4 + +S 2 - + 4 H 2 O = 2 NH 3*H 2 O + H 2 S +2 H 2 O (NH 4)2 S + 2 H 2 O = 2 NH 3*H 2 O + H 2 S = 2 NH 3 + H 2 S + 2 H 2 O


