BioE (2013-14 L3)1.ppt
- Количество слайдов: 40

Эволюционная концепция биоэнергетических систем (по В. П. Скулачеву)

Универсальная функция всех живых систем - использование внешних энергетических ресурсов для совершения полезной работы. Химия современной жизни живых систем базируется, прежде всего, на процессах, осуществляемых белками и нуклеиновыми кислотами. Роль белков в жизненных явлениях объясняется необычайным разнообразием свойств молекул этого класса, обусловленным наличием в их структуре самых различных химических группировок, которые удается уникальным образом расположить в пространстве. Но важнейшие функции клетки, такие, как хранение и реализация генетической информации, обеспечиваются, прежде всего, нуклеиновыми кислотами, а составляющие их мономеры-нуклеотиды используются клеткой в качестве коферментов и "конвертируемой энергетической валюты". Современные биохимические механизмы несут на себе отпечаток эволюционного прошлого.

На этой лекции мы рассмотрим общебиологическую гипотезу эволюции биоэнергетики и возможные пути возникновения основных энергетических механизмов современных живых существ. I. Путь от смеси органических и неорганических молекул к первой живой клетке был долог, поэтому требовался некий постоянный источник энергии, доступный в течение всего периода возникновения жизни. Предпочтительнее всего ультрафиолетовый свет. Почему: - поглощается любыми химическими веществами, резко повышая их реакционную способность благодаря большому запасу энергии ультрафиолетового кванта; - на заре биологической эволюции УФ свободно достигали поверхности Земли, лишенной современной кислородсодержащей атмосферы с ее поглощающим УФ свет озоновым слоем.

Основные простые компоненты атмосферы древнейшей Земли (Н 2 О, СН 4, NH 3, СО 2, СО и HCN) поглощают свет короче 240 нм, а формальдегид, также входивший в ее состав, имеет максимум поглощения длиннее 290 нм. К. Саган пришел к выводу, что в атмосфере древнейшей Земли существовало "окно" в области 240 -290 нм, прозрачное для УФ света, именно в области 240 -290 нм располагаются спектральные максимумы пуринов и пиримидинов. При зарождении жизни азотистые основания нуклеотидов (а именно - Аденин) служили антенной, которая улавливала УФ кванты, ответственные, как предполагается, за энергообеспечение первичных биохимических реакций.

Экспериментально доказано (С. Понамперума с сотрудниками, 1960 гг. ), что облучение УФ светом синильной кислоты ведет к химическому синтезу аденина и гуанина; облучение смеси метана, аммиака, водорода и воды вызывает образование как пуринов, так и пиримидинов, причем с наибольшим выходом для аденина; облучение УФ светом аденина и рибозы можно использовать для синтеза аденозина и далее из аденозина и этилметафосфата - аденозинмоно- и дифосфатов. Облучение УФ светом смеси АДФ и этилметафосфата дает АТФ (с достаточно хорошим выходом), причем этот процесс демонстрируется в отсутствие каких-либо белков в строго стерильных условиях. Доводы (К. Саган и С. Понамперума) в пользу «Аденина как антенны для УФ света» по сравнению с другими пуринами и пиримидинами: 1) наибольшее поглощение света в области 240 -290 нм; 2) наибольшая стабильность к разрушительному действию УФ света; 3) большее время жизни возбужденного состояния, возникающего в ответ на поглощение УФ кванта. Величины изменения свободной энергии при нарушении ароматической структуры аденина близки к энергии реакции синтеза АТФ из АДФ и неорганического фосфата (по расчетам Л. А Блюменфельда и М. И. Темкина)

Механизм фосфорилирования за счет ультрафиолетового света в первичных живых клетках с учетом вышеперечисленных фактов (стадии 2 и 3 гипотетичны): 1) квант ультрафиолетового света поглощается адениновой частью АДФ, переводя ее в возбужденное состояние. Возбуждение облегчает присоединение неорганического фосфата к аминогруппе аденина (аминогруппа аденина претерпевает электрофильную атаку атомом фосфора неорганического фосфата); 2) возбужденный аденин аденозиндифосфата фосфорилируется с образованием ФАДФ (изомера аденозинтрифосфата), где третий фосфат присоединен не к пирофосфатному "хвосту", а к аминогруппе аденина АДФ.

3) фосфорил переносится с аденина на конечный (второй) фосфат АДФ с образованием обычного АТФ. Такой перенос облегчается тем, что расстояние между аминогруппой аденина и вторым фосфатом в АДФ равно размеру еще одного (третьего) фосфатного остатка. Перенос фосфорила с адениновой части нуклеотида на фосфатный "хвост" сопровождается его стабилизацией, поскольку весьма лабильный фосфоамид заменяется на менее лабильный фосфоангидрид.

Аденин и реже другие пурины или пиримидины входят в состав ключевых коферментов и простетических групп ферментов, таких, как никотинамидаде-ниндинуклеотид (НАД+), никотинамидадениндинуклеотидфосфат (НАДФ+), флавинадениндинуклеотид (ФАД), кофермент А (Ко. А), тиаминопирофосфат, витамин В 12. Все эти соединения, как правило, построены по одному и тому же принципу. Они содержат: 1) ту или иную функциональную группу, непосредственно участвующую в катализе, 2) пурин или реже пиримидин и 3) гибкую связку, позволяющую сблизить две другие части молекулы. Особенно наглядно устройство динуклеотидов: в них плоские остатки никотинамида (в НАД+ и НАДФ+) или изоаллоксазина (в ФАД) лежат на плоском остатке аденина. В ответ на поглощение аденином ультрафиолетового кванта было продемонстрирован перенос энергии от остатка аденина к остатку никотинамида (или изоаллоксазина). Гипотетический механизм: аденин, возбуждаясь ультрафиолетовым светом, передавал энергию на функциональную группу кофермента, который использовал эту энергию для проведения энергоемких химических реакций (например, восстановления простых веществ среды до более сложных соединений первичной клетки).

II. Не слишком специфичный и нерегулируемый катализ, осуществляемый низкомолекулярными коферментами, был дополнен (а затем и вытеснен) процессами с участием высокомолекулярных катализаторов-ферментов, отличающихся огромной избирательностью в отношении субстратов и возможностью регулировать катализ. Первыми ферментами были рибонуклеиновые кислоты. Адениновый фотосинтез катализировался комплексами РНК с магниевыми солями АДФ и фосфата, при этом РНК могла выполнять также роль антенны, собирающей ультрафиолетовый свет и передающей возбуждение на АДФ. На сегодняшний день некоторые (немногочисленные) биохимические реакции могут катализироваться рибозимами (т. е. рибонуклеиновыми кислотами) в искусственных условиях (искусственные рибозимы типа РНК-полимеразы, способные при определенных условиях катализировать свою собственную сборку), рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК; кроме того, образование пептидной связи в белках происходит при помощи р. РНК рибосомы.

На сегодняшний день некоторые (немногочисленные) биохимические реакции могут катализироваться рибозимами (т. е. рибонуклеиновыми кислотами) в искусственных условиях (искусственные рибозимы типа РНК-полимеразы, способные при определенных условиях катализировать свою собственную сборку), рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК; кроме того, образование пептидной связи в белках происходит при помощи р. РНК рибосомы. Но, в основном, каталитические функции современных организмов осуществляются белками, обладающими гораздо большим, чем РНК, разнообразием химических группировок и их сочетаний. Первоначально синтез белков, включая кодирование их структуры, осуществлялся рибонуклеиновыми кислотами. Затем функция кодирования была передана ДНК, а сам катализ стал обслуживаться комплексами РНК и специальных белков (рибосомами и факторами трансляции), информационными и транспортными РНК и соответствующими ферментами.

III. В ходе биологической эволюции возникла потребность в более прочной изоляции внутренней среды от внешних воздействий по сравнению с той, которой могла обеспечить водная оболочка. На этом этапе важнейшим изобретением биологической эволюции стали жиры и жироподобные вещества, прежде всего фосфолипиды. Функциональная роль фосфолипидов - способность самопроизвольно, без какого-либо воздействия извне, образовывать тончайшую пленку (мембрану), непроницаемую для гидрофильных веществ (это: нуклеотиды-коферменты, РНК, ДНК, белки и углеводы). Мембрана представляет собой бислой, образованный двумя рядами молекул фосфолипидов, соприкасающихся гидрофобными (углеводородными) "хвостами". При этом гидрофильные "головы" (фосфатные остатки) фосфолипидов оказываются на двух противоположных поверхностях мембраны. С образованием мембран стало возможно говорить о первичной живой клетке, содержимое которой было отделено от внешней среды достаточно надежным барьером. Появление клетки как обособленного мельчайшего пузырька могло играть роль в защите от неблагоприятных эффектов УФ облучения.

IV. УФ свет хорош тем, что способен развязать разнообразные химические реакции (например, фосфорилирование адениновой аминогруппы АДФ), но в то же время (и по той же причине) УФ может разрушить уже синтезированные молекулы живой клетки. Как избежать разрушительных эффектов УФ света? 1) энергетические ресурсы - запасные вещества, образуемые на свету, использованные затем в темноте. УФ свет, достигающий поверхности океана, не мог проникать на значительную глубину изза мутности, наличия растворенных веществ, поглощающих УФ, флуктуации плотности морской воды. Гипотеза 1. Под действием движения слоев жидкости в океане клетки постоянно циркулировали между тонкой верхней пленкой воды, доступной для УФ света, и более глубокими слоями, которых он не достигал. Вблизи поверхности происходил синтез АТФ (короткие экспозиции на УФ), использовавшегося для образования резервных соединений (дополнительное преимущество - запасные вещества на темное время суток); которые затем расщеплялись на глубине (длительные периоды без УФ), поддерживая ресинтез АТФ.

Гипотеза 1. Под действием движения слоев жидкости в океане клетки постоянно циркулировали между тонкой верхней пленкой воды, доступной для УФ света, и более глубокими слоями, которых он не достигал. Вблизи поверхности происходил синтез АТФ (короткие экспозиции на УФ), использовавшегося для образования резервных соединений (дополнительное преимущество - запасные вещества на темное время суток); которые затем расщеплялись на глубине (длительные периоды без УФ), поддерживая ресинтез АТФ.

Роль энергетического резерва первичных клеток осуществляли: 1 - неорганические пиро- и полифосфаты. На сегодняшний день они сохранили свою роль у некоторых видов живых существ (например, в клетках грибов полифосфаты образуются из АТФ в условиях избытка энергетических ресурсов и расщепляются, давая АТФ, при дефиците источников энергии). 2 - Углеводы. На сегодняшний день - это легко мобилизуемый энергетический резерв в подавляющем большинстве дошедших до нас организмов. Гликогенез (их синтез за счет энергии АТФ) - это длинная последовательность реакций, намного более сложная, чем синтез полифосфатов из АТФ. Преимущество углеводов перед полифосфатами - в них запасены не только энергия, но и "строительный материал". Гликолиз (расщепление углеводов) дает помимо АТФ карбоновые кислоты, например, пировиноградную кислоту, которая может использоваться клеткой для биосинтеза др. соединений. .

Два основных типа гликолиза. - Спиртовое брожение, при котором конечными продуктами расщепления углеводов оказываются этиловый спирт и углекислый газ - вещества, легко проникающие через мембрану клетки. Преимущества - нет проблемы переполнения клетки конечными продуктами гликолиза, недостатки - как вернуться назад, к углеводу, если конечные продукты вышли из клетки и разбавились в океане внешней среды. - Конечный продукт - молочная или какая-либо другая карбоновая кислота, в этом типе гликолиза отсутствует недостаток, встречающийся в первом: молочная кислота не проникает через мембрану, не покидает пределы клетки и может быть использована клеткой для ресинтеза углеводов, когда возникает такая возможность. Этот тип гликолиза на сегодняшний день более распространен. Недостаток - молекулы молочной кислоты диссоциируют с образованием ионов лактата и водорода; последние не могут пройти через мембрану, остаются в клетке и закисляют ее содержимое, что приведет к гибели клетки из-за кислотной денатурации белков.

V. Как предотвратить закисление клетки? Проблема проникновения через клеточную мембрану веществ, которые сами по себе не могут сквозь нее пройти, может быть решена с помощью встроенных в мембрану белков-переносчиков, в частности, белков - переносчивков ионов Н+. У современных это фактор F 0 - белок, входящий в состав Н+-АТФ -синтазы. У первичных гликолизирующих клеток фактор F 0 функционировал при отсутствии фактора F 1, второго компонента Н+-АТФ-синтазы, разрешая ионам Н+, образующимся при гликолизе, покинуть пределы клетки, предотвращая закисление внутриклеточной среды. В результате достигалось равновесие по ионам Н+ между внутри- и внеклеточной средой. Недостаток - закисление внеклеточной среды, что автоматически вело к закислению содержимого клетки.

VI. Как предотвратить закисление внеклеточной среды и закисление клетки? Достроить белок - переносчик ионов Н+ (фактор F 0) другим белком, называемым фактором F 1, способным использовать энергию АТФ для активной откачки из клетки ионов Н+ через фактор F 0. Н+-АТФ-синтаза (комплекс факторов F 0 и F 1) способна катализировать как синтез АТФ, так и гидролиз АТФ, сопряженный с откачкой ионов Н+ - Н+-АТФазнойая реакция. С образованием Н+АТФазы завершилось формирование первичной клетки, использовавшей УФ свет в качестве источника энергии для жизнедеятельности.


VII. Бактериородопсиновый фотосинтез. Образование озонового слоя атмосферы в условиях повышения в ней концентрации кислорода (образовывался вследствие фотолиза паров воды под действием УФ облучения) привело к тому, что все меньше УФ квантов достигало поверхности Земли. Для жизни стал нужен иной источник энергии, доступный для клеток в новых условиях. Таким источником стал видимый свет с использованием «нового» фотосинтеза, использующего видимый свет. Гипотеза 2. Возникновение фотосинтеза, использующего видимый свет, произошло еще до помутнения атмосферы - при проникновении жизни в более глубокие уровни океана, лишенные УФ. Замена УФ на безопасный видимый свет могла бы быть основой естественного отбора на данном этапе эволюции. В результате фотолиза воды системой хлорофилльного фотосинтеза зеленых бактерий и цианобактерий произошло создание озонового слоя (биогенная природа озонового слоя).

Задача фотосинтеза, использующего видимый свет: образовывать АТФ (центр метаболической карты - "конвертируемая энергетическая валюта" клетки) без использования аденина в роле улавливающей свет антенны. Два типа фотосинтетических устройств, использующих видимый свет (которые сохранились до наших времен). 1) В качестве антенны служит хлорофилл (у зеленых растений и почти у всех фото-синтезирующих бактерий, исключение составляет одна группа соле- и теплоустойчивых архебактерий). 2) В качестве антенны служит производное витамина А - ретиналь, соединение с особым белком - бактериородопсином (группа соле- и теплоустойчивых архебактерий). Это эволюционно первичный механизм запасания клеткой энергии видимого света. Устройство бактериородопсина намного проще системы хлорофилльного фотосинтеза. Бактериородопсиновый фотосинтез был оттеснен эволюцией, он сохранился только у бактерий, живущих в экстремальных условиях, где более сложный и менее устойчивый хлорофилльный фотосинтез, по-видимому, просто не может существовать.

Бактериородопсин - светозависимый протонный насос. Он способен активно откачивать ионы Н+ из клетки за счет энергии видимого света, поглощенного ретиналевой частью его молекулы. В результате световая энергия превращается в трансмембранную разность электрохимических потенциалов ионов Н+ (ΔμН+). Для бактерий ΔμН+ - это свободная энергия ионов Н+, откачанных из клетки во внешнюю среду. Ионы Н+ стремятся вернуться в клетку, где их стало меньше и где возник недостаток положительных электрических зарядов из-за действия бактериородопсинового Н+-насоса. Энергия света, запасенная таким образом в виде ΔμН+, освободится, если позволить ионам Н+ войти обратно в клетку.

Белковая часть бактериородопсина представляет собой одну полипептидную цепь средней длины, которая не содержит других коферментов и простетических групп, кроме ретиналя. Бактериородопсин чрезвычайно устойчив: без потери активности его можно кипятить в автоклаве при + 130°С, изменять содержание Na. Cl в омывающем мембрану растворе от нуля до насыщения, в широких пределах менять р. Н этого раствора. Можно удалить выступающие из мембраны концевые участки полипептидной цепи и расщепить эту цепь в одном месте по середине без ущерба для активности насоса. В то же время эффективность бактериородопсина как преобразователя энергии сравнительно низка: всего 20% энергии светового кванта превращается в ΔμН+. При этом на один поглощенный квант через мембрану переносится один ион Н+. У микробов, имеющих бактериородопсин, ионы Н+ входят через комплекс факторов F 0 и F 1 таким образом, что освобождающаяся энергия, используется для синтеза АТФ.
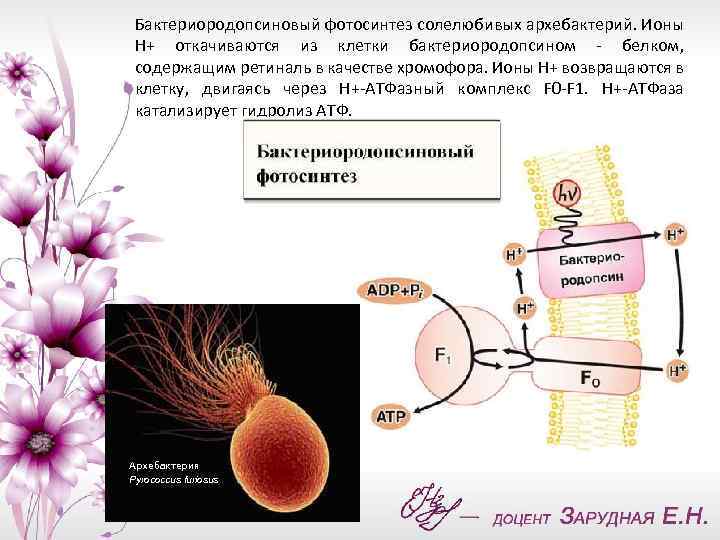
Бактериородопсиновый фотосинтез солелюбивых архебактерий. Ионы Н+ откачиваются из клетки бактериородопсином - белком, содержащим ретиналь в качестве хромофора. Ионы Н+ возвращаются в клетку, двигаясь через Н+-АТФазный комплекс F 0 -F 1. Н+-АТФаза катализирует гидролиз АТФ. Архебактерия Pyrococcus furiosus

С появлением бактериородопсина клетка научилась создавать ΔμН+ за счет видимого света, а эта ΔμН+, что развернуло вспять Н+-АТФазную реакцию, существовавшую ранее в качестве механизма откачки из клетки гликолитических ионов Н+. Комплекс F 0 -F 1 превратился из АТФазы в АТФ-синтетазу.

VIII. Хлорофилльный фотосинтез отличается от бактериородопсинового большей эффективностью использования светового кванта. На каждый квант переносится через мембрану не один, а два иона Н+, либо помимо транспорта Н+ происходит запасание энергии в форме углеводов, синтезируемых из СО 2 и Н 2 О. Хлорофилльный фотосинтез катализируется ферментной системой, включающей несколько белков. Квант света поглощается хлорофиллом, молекула которого, перейдя в возбужденное состояние, передает один из своих электронов в фотосинтетическую цепь переноса электронов. Цепь представляет собой последовательность окислительно-восстановительных ферментов и коферментов, находящихся во внутренней мембране бактерий или хлоропластов растений, где локализованы также белки, связанные с хлорофиллом. Компоненты цепи содержат, как правило, ионы металлов с переменной валентностью (железо, медь, реже марганец или никель). При этом железо может входить в состав тема (белки цитохромы), негемовые железопротеиды, где ион железа связан с белком через серу цистеина или азот гистидина. Помимо ионов металлов роль переносчиков электронов играют производные хинонов, такие, как убихинон, пластохинон и витамины группы К.

Перенос по цепи электрона, отнятого от возбужденного хлорофилла, завершается по-разному в зависимости от типа фотосинтеза. У зеленых серных бактерий, использующих комплекс хлорофилла и белка (фотосистема 1 продуктом оказывается НАДН). В дальнейшем НАДН окисляется, передавая свой водород на различные субстраты биосинтезов, а окисленный хлорофилл получит недостающий электрон от сероводорода(H 2 S).
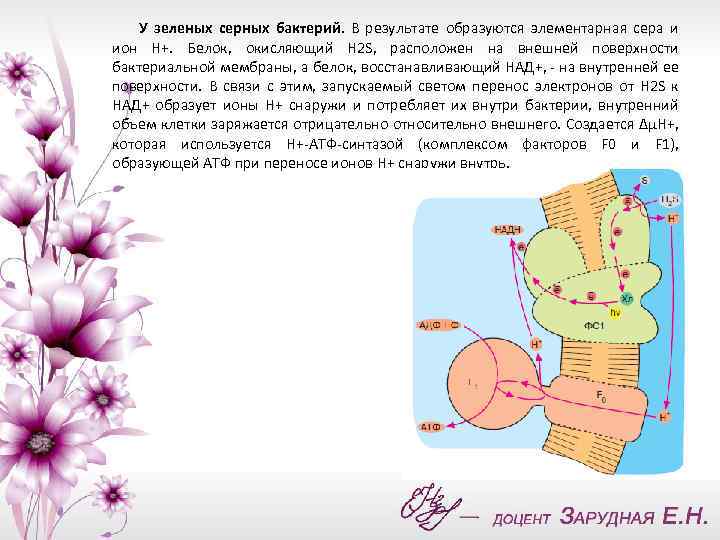
У зеленых серных бактерий. В результате образуются элементарная сера и ион Н+. Белок, окисляющий H 2 S, расположен на внешней поверхности бактериальной мембраны, а белок, восстанавливающий НАД+, - на внутренней ее поверхности. В связи с этим, запускаемый светом перенос электронов от H 2 S к НАД+ образует ионы Н+ снаружи и потребляет их внутри бактерии, внутренний объем клетки заряжается отрицательно относительно внешнего. Создается ΔμН+, которая используется Н+-АТФ-синтазой (комплексом факторов F 0 и F 1), образующей АТФ при переносе ионов Н+ снаружи внутрь.

У пурпурных бактерий - другой тип бактериального фотосинтеза (это несущая хлорофилл фотосистема 2 и комплекс III) - эволюционно более усовершенствованная форма фотосинтеза Как и в предыдущем случае, процесс начинается с поглощения кванта хлорофиллом.
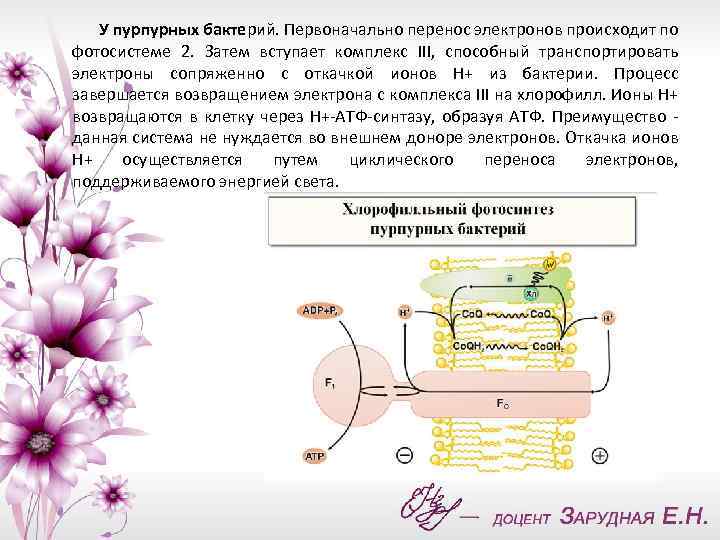
У пурпурных бактерий. Первоначально перенос электронов происходит по фотосистеме 2. Затем вступает комплекс III, способный транспортировать электроны сопряженно с откачкой ионов Н+ из бактерии. Процесс завершается возвращением электрона с комплекса III на хлорофилл. Ионы Н+ возвращаются в клетку через Н+-АТФ-синтазу, образуя АТФ. Преимущество - данная система не нуждается во внешнем доноре электронов. Откачка ионов Н+ осуществляется путем циклического переноса электронов, поддерживаемого энергией света.
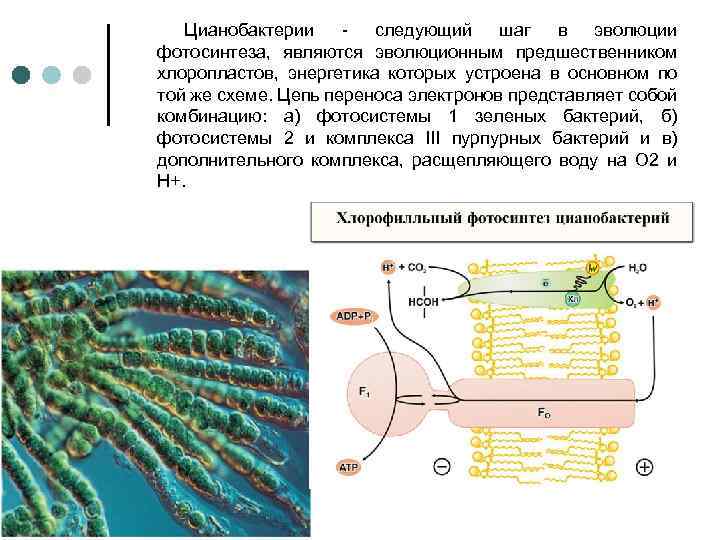
Цианобактерии следующий шаг в эволюции фотосинтеза, являются эволюционным предшественником хлоропластов, энергетика которых устроена в основном по той же схеме. Цепь переноса электронов представляет собой комбинацию: а) фотосистемы 1 зеленых бактерий, б) фотосистемы 2 и комплекса III пурпурных бактерий и в) дополнительного комплекса, расщепляющего воду на О 2 и Н+.
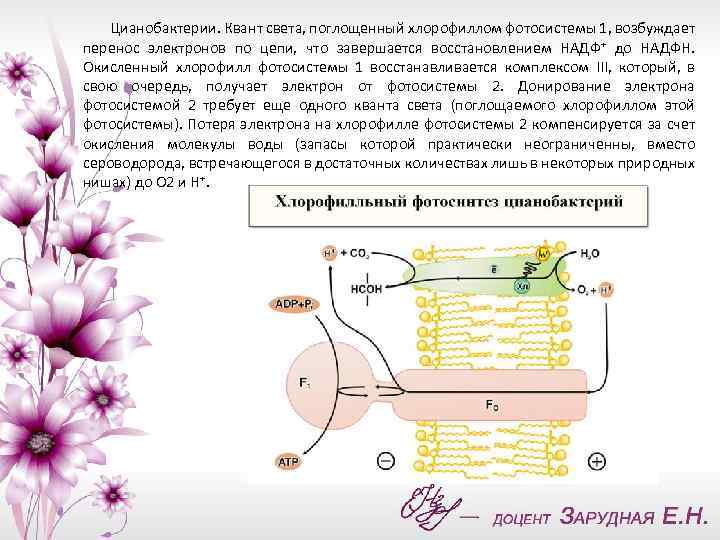
Цианобактерии. Квант света, поглощенный хлорофиллом фотосистемы 1, возбуждает перенос электронов по цепи, что завершается восстановлением НАДФ+ до НАДФН. Окисленный хлорофилл фотосистемы 1 восстанавливается комплексом III, который, в свою очередь, получает электрон от фотосистемы 2. Донирование электрона фотосистемой 2 требует еще одного кванта света (поглощаемого хлорофиллом этой фотосистемы). Потеря электрона на хлорофилле фотосистемы 2 компенсируется за счет окисления молекулы воды (запасы которой практически неограниченны, вместо сероводорода, встречающегося в достаточных количествах лишь в некоторых природных нишах) до О 2 и Н+.
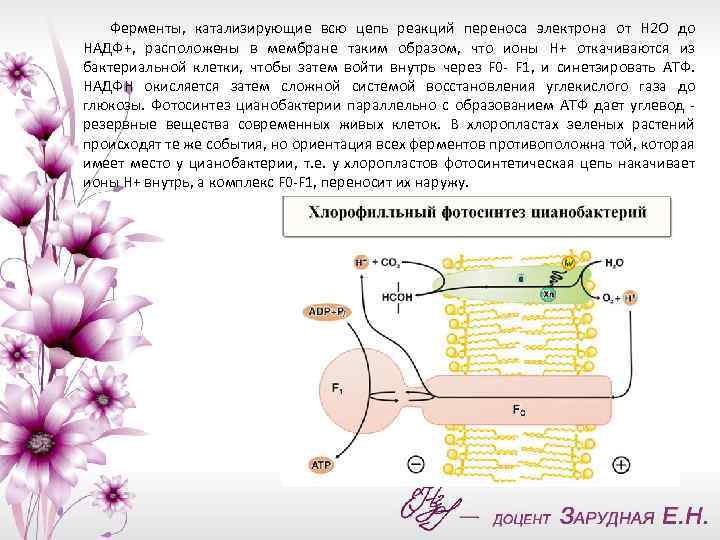
Ферменты, катализирующие всю цепь реакций переноса электрона от Н 2 О до НАДФ+, расположены в мембране таким образом, что ионы Н+ откачиваются из бактериальной клетки, чтобы затем войти внутрь через F 0 - F 1, и синетзировать АТФ. НАДФН окисляется затем сложной системой восстановления углекислого газа до глюкозы. Фотосинтез цианобактерии параллельно с образованием АТФ дает углевод - резервные вещества современных живых клеток. В хлоропластах зеленых растений происходят те же события, но ориентация всех ферментов противоположна той, которая имеет место у цианобактерии, т. е. у хлоропластов фотосинтетическая цепь накачивает ионы Н+ внутрь, а комплекс F 0 -F 1, переносит их наружу.

IX. Дыхательный механизм энергообеспечения. Побочным продуктом фотосинтеза у цианобактерии и растений служит молекулярный кислород, нарастание его концентрации в атмосфере привело к появлению ферментов, убирающих этот сильный окислитель, опасный для жизнедеятельности. Первая функция ферментов, восстанавливающих О 2 до Н 2 О - снижение внутриклеточной концентрации кислорода. Но, в дальнейшем аэробная клетка научилась извлекать пользу из этого процесса, создав дыхательную цепь электронного транспорта, сопряженного с откачкой ионов Н+. Дыхательная цепь некоторых современных бактерий включает знакомый комплекс III, служащий связующим звеном между двумя другими белковыми комплексами. Однако это уже не фотосистемы 1 и 2, а ферменты, выполняющие функции, противоположные таковым фотосистем 1 и 2. Ферменты, о которых идет речь, были названы комплекс I и комплекс IV. Митохондрии животных, растений и грибов ведут свое происхождение от аэробных бактерий, а митохондриальная дыхательная цепь описывается той же схемой.

Комплекс I не восстанавливает никотинамидный нуклеотид, а окисляет его. Комплекс IV не окисляет воду до О 2, а восстанавливает О 2 до воды. Т. е. , это сложная цепь реакций, начинающихся с окисления НАДН и кончающихся восстановлением О 2. Все три комплекса дыхательной цепи способны откачивать из клетки ионы Н+, что сопряжено с переносом электронов. Механизм дыхательного фосфорилирования в аэробных бактериях и митохондриях. Ферментные комплексы I, III и IV катализируют перенос электронов от НАДН к О 2 с образованием воды. Перенос электронов сопряжен с откачкой ионов Н+. Возвращение ионов Н+ через F 0 - F 1 приводит к синтезу АТФ

Классификация процессов окисления и их локализация в клетке: 1. Свободное окисление. Это окисление не связано с образованием АТФ или других макроэргических соединений. При свободном окислении высвобождающаяся энергия переходит в тепловую и рассеивается. Процессы свободного окисления сосредоточены в цитозоле, в мембранах эндоплазматического ретикулума, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. 1) Свободное окисление при участии оксидаз. Оксидазы – ферменты, переносящие электроны на кислород, например, аскорбатоксидаза: аскорбиновая кислота дегидроаскорбиновая кислота

Классификация процессов окисления и их локализация в клетке: 2) Свободное окисление при участии монооксигеназ. Эти ферменты ускоряют включение в окисляемый субстрат одного атома молекулярного кислорода. Характеризуются коферментами флавиновой природы и требуют участия парного донора, от которого поступают атомы водорода на второй атом молекулярного кислорода. Монооксигеназы принимают большое участие в обезвреживании ксенобиотиков, например, фенолгидроксилаза: фенол пирокатехин
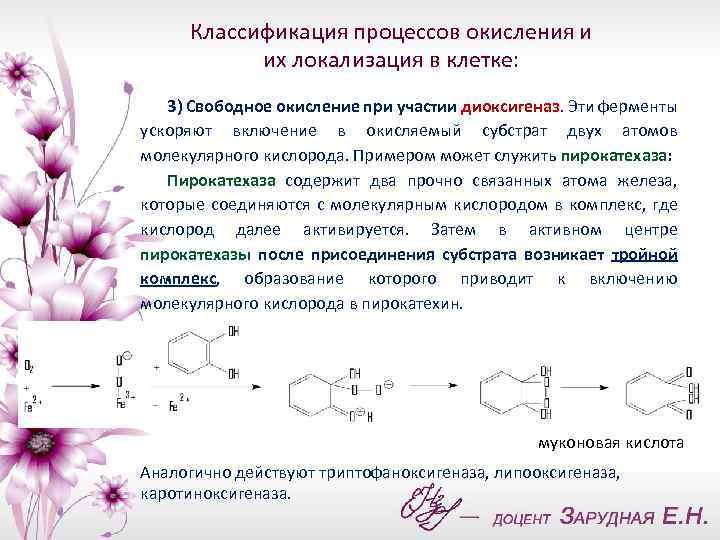
Классификация процессов окисления и их локализация в клетке: 3) Свободное окисление при участии диоксигеназ. Эти ферменты ускоряют включение в окисляемый субстрат двух атомов молекулярного кислорода. Примером может служить пирокатехаза: Пирокатехаза содержит два прочно связанных атома железа, которые соединяются с молекулярным кислородом в комплекс, где кислород далее активируется. Затем в активном центре пирокатехазы после присоединения субстрата возникает тройной комплекс, образование которого приводит к включению молекулярного кислорода в пирокатехин. муконовая кислота Аналогично действуют триптофаноксигеназа, липооксигеназа, каротиноксигеназа.

Классификация процессов окисления и их локализация в клетке: Биологическое окисление – совокупность реакций окисления, протекающих во всех животных клетках и направленных на обеспечение организма энергией в доступной для использования форме (прежде всего в форме АТФ). 2. Окисление, сопряженное с образованием АТФ. 1) Субстратное фосфорилирование. 2) Окислительное фосфорилирование. 3) Фотосинтетическое фосфорилирование. Это сопряжение окисления воды или других доноров электронов с синтезом АТФ на уровне электронотранспортной цепи внутренней мембраны хлоропластов за счет энергии света.

Пути потребления кислорода в реакциях окисления в клетке: 1) Оксидазный – продуктами его являются окисленный субстрат и вода. Эти реакции локализованы в дыхательной цепи и выполняют энергетическую функцию: SH 2 + 1/2 O 2 → S + H 2 O 2) Пероксидазный – продуктами являются окисленный субстрат и перекись водорода. Эти реакции протекают в пероксисомах растений, макрофагах и нейтрофилах и осуществляют окисление растворимых веществ: SH 2 + O 2 → S + H 2 O 2

Пути потребления кислорода в реакциях окисления: 3) Оксигеназный – продуктами являются окисленные природные органические вещества в ходе синтеза желчных кислот, стероидных гормонов из холестерина, а также обезвреживание ксенобиотиков, Эти реакции протекают на эндоплазматическом ретикулуме и осуществляют окисление липофильных соединений: AH 2 + S + O 2 → A + SO + H 2 O (для монооксигеназ), S + O 2 → SO 2 (для диоксигеназ) 4) Перекисное окисление ненасыщенных жирных кислот – продуктами являются гидроперекиси липидов, спирты, альдегиды, кетоны, диальдегиды, эпоксиды. Эти реакции протекают на мембранах и осуществляют обновление и распад ненасыщенных структурных липидов: RH + O 2 → ROOH
BioE (2013-14 L3)1.ppt