
 Это углеводороды с открытой цепью , в молекулах которых между атомами углерода имеются двойные или тройные связи.
Это углеводороды с открытой цепью , в молекулах которых между атомами углерода имеются двойные или тройные связи.
 К непредельным углеводородам принадлежит несколько гомологических рядов : § Этилена(алкены) Сn. H 2 n § Ацетилена(алкины) Cn. H 2 n-2 § Бутадиена (алкадиены )
К непредельным углеводородам принадлежит несколько гомологических рядов : § Этилена(алкены) Сn. H 2 n § Ацетилена(алкины) Cn. H 2 n-2 § Бутадиена (алкадиены )
 Ответьте, пожалуйста, на следующие вопросы: 1. Какие углеводороды называются алкенами? 2. Какова общая формула алкенов? 3. Какова структурная формула первого представителя гомологического ряда алкенов? Назовите его.
Ответьте, пожалуйста, на следующие вопросы: 1. Какие углеводороды называются алкенами? 2. Какова общая формула алкенов? 3. Какова структурная формула первого представителя гомологического ряда алкенов? Назовите его.

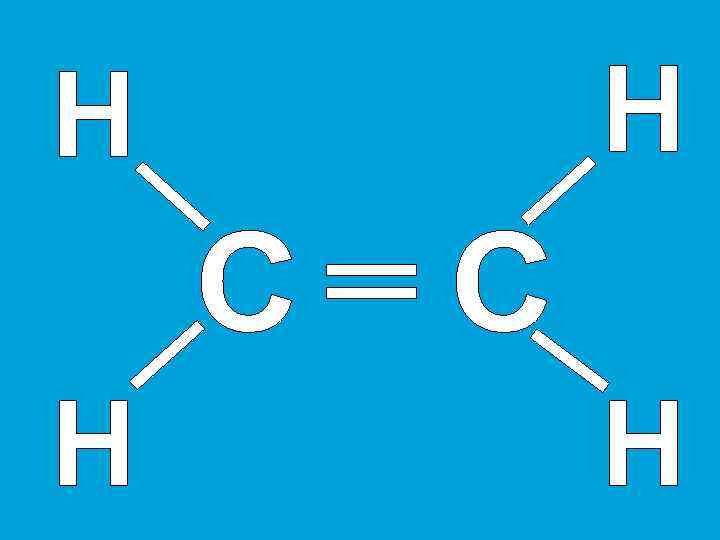
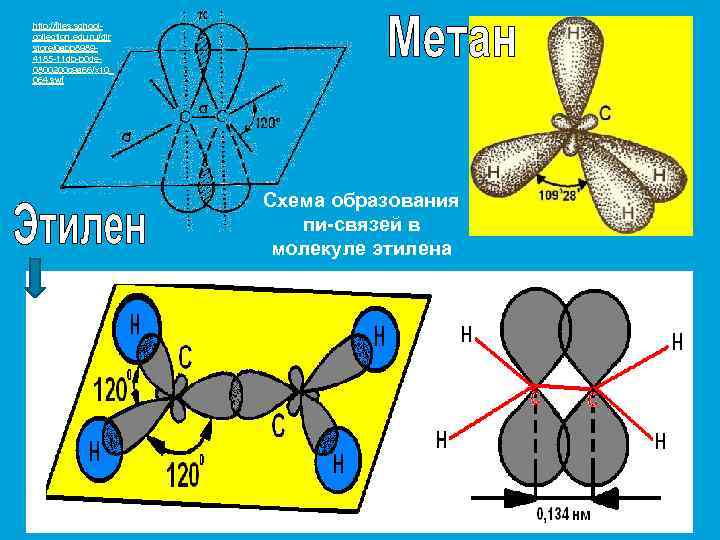 http: //files. schoolcollection. edu. ru/dlr store/0 abb 89894185 -11 db-b 0 de 0800200 c 9 a 66/x 10_ 064. swf Схема образования пи-связей в молекуле этилена
http: //files. schoolcollection. edu. ru/dlr store/0 abb 89894185 -11 db-b 0 de 0800200 c 9 a 66/x 10_ 064. swf Схема образования пи-связей в молекуле этилена
 Гомологический ряд АЛКЕНЫ этен (этилен) пропен бутен пентен гексен гептен октен нонен децен C 2 H 4 C 3 H 6 C 4 H 8 C 5 H 10 C 6 H 12 C 7 H 14 C 8 H 16 C 9 H 18 C 10 H 20
Гомологический ряд АЛКЕНЫ этен (этилен) пропен бутен пентен гексен гептен октен нонен децен C 2 H 4 C 3 H 6 C 4 H 8 C 5 H 10 C 6 H 12 C 7 H 14 C 8 H 16 C 9 H 18 C 10 H 20
 Номенклатура алкенов
Номенклатура алкенов
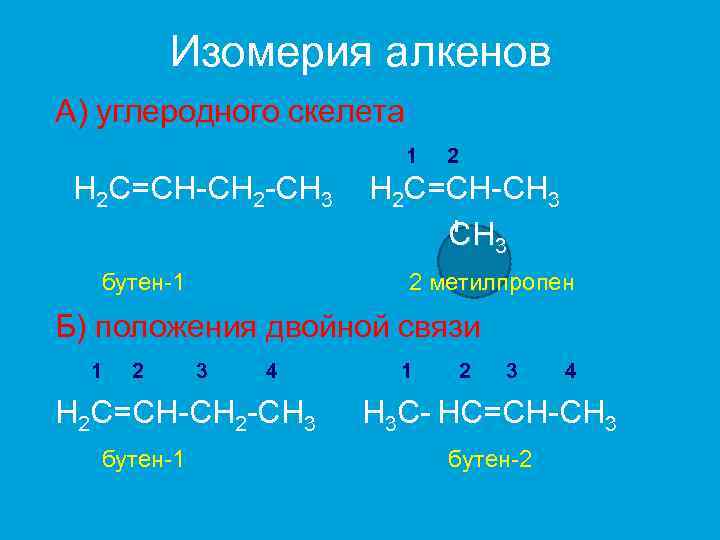 Изомерия алкенов А) углеродного скелета 1 H 2 C=CH-CH 2 -CH 3 бутен-1 2 H 2 C=CH-CH 3 2 метилпропен Б) положения двойной связи 1 2 3 4 H 2 C=CH-CH 2 -CH 3 бутен-1 1 2 3 4 H 3 C- HC=CH-CH 3 бутен-2
Изомерия алкенов А) углеродного скелета 1 H 2 C=CH-CH 2 -CH 3 бутен-1 2 H 2 C=CH-CH 3 2 метилпропен Б) положения двойной связи 1 2 3 4 H 2 C=CH-CH 2 -CH 3 бутен-1 1 2 3 4 H 3 C- HC=CH-CH 3 бутен-2
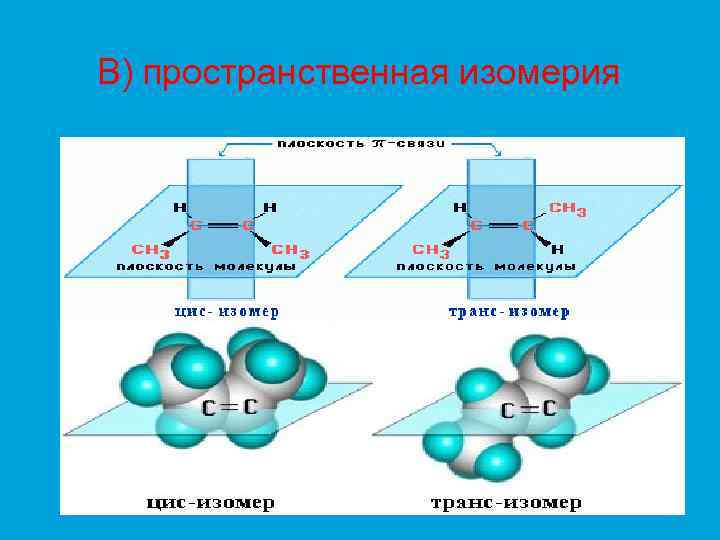 В) пространственная изомерия
В) пространственная изомерия
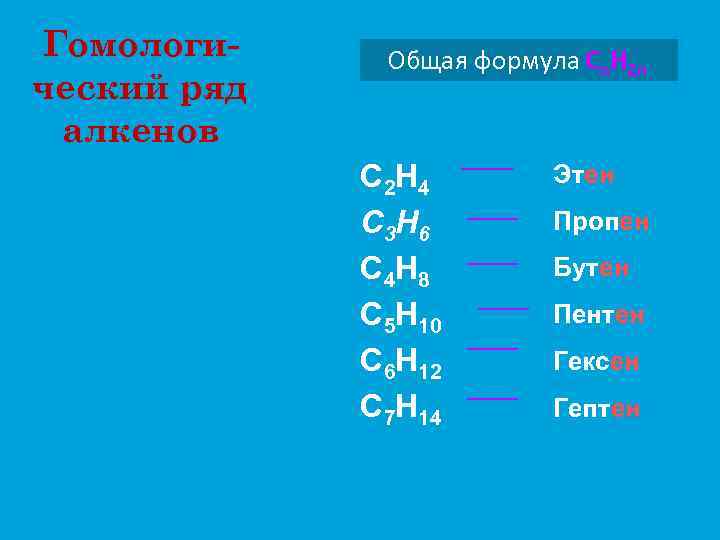 Гомологический ряд алкенов Общая формула Сn. Н 2 n C 2 H 4 C 3 H 6 C 4 H 8 C 5 H 10 C 6 H 12 C 7 H 14 Этен Пропен Бутен Пентен Гексен Гептен
Гомологический ряд алкенов Общая формула Сn. Н 2 n C 2 H 4 C 3 H 6 C 4 H 8 C 5 H 10 C 6 H 12 C 7 H 14 Этен Пропен Бутен Пентен Гексен Гептен
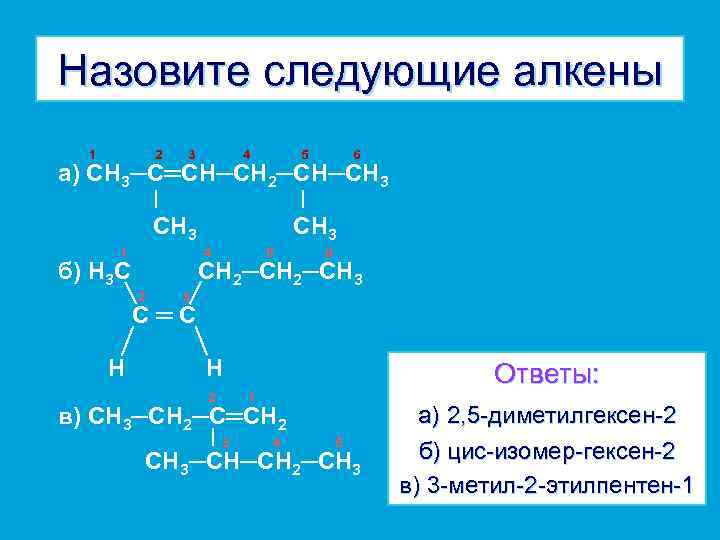 Назовите следующие алкены 1 2 3 4 5 6 а) СН 3─С═СН─СН 2─СН─СН 3 1 СН 3 4 б) Н 3 С 5 6 СН 2─СН 3 2 3 С═С Н Н 2 Ответы: 1 в) СН 3─СН 2─С═СН 2 3 4 5 СН 3─СН─СН 2─СН 3 а) 2, 5 -диметилгексен-2 б) цис-изомер-гексен-2 в) 3 -метил-2 -этилпентен-1
Назовите следующие алкены 1 2 3 4 5 6 а) СН 3─С═СН─СН 2─СН─СН 3 1 СН 3 4 б) Н 3 С 5 6 СН 2─СН 3 2 3 С═С Н Н 2 Ответы: 1 в) СН 3─СН 2─С═СН 2 3 4 5 СН 3─СН─СН 2─СН 3 а) 2, 5 -диметилгексен-2 б) цис-изомер-гексен-2 в) 3 -метил-2 -этилпентен-1
 СПОСОБЫ ПОЛУЧЕНИЯ этилена 1) ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥ 140 C, Н Н Н 2 SO 4(конц. ) Н-С – С-Н → Н 2 С = СН 2 + Н 2 О Н ОН этен (этилен)
СПОСОБЫ ПОЛУЧЕНИЯ этилена 1) ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥ 140 C, Н Н Н 2 SO 4(конц. ) Н-С – С-Н → Н 2 С = СН 2 + Н 2 О Н ОН этен (этилен)

 СПОСОБЫ ПОЛУЧЕНИЯ этилена 2) ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД АЛК ПРИМЕР: t 550°C, Ni Н 3 С – СН 3 → Н 2 С = СН 2 + Н 2 этан этен эт эт 3) На производстве этилен получают из природного газа, крекингом и пиролизом нефти.
СПОСОБЫ ПОЛУЧЕНИЯ этилена 2) ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД АЛК ПРИМЕР: t 550°C, Ni Н 3 С – СН 3 → Н 2 С = СН 2 + Н 2 этан этен эт эт 3) На производстве этилен получают из природного газа, крекингом и пиролизом нефти.

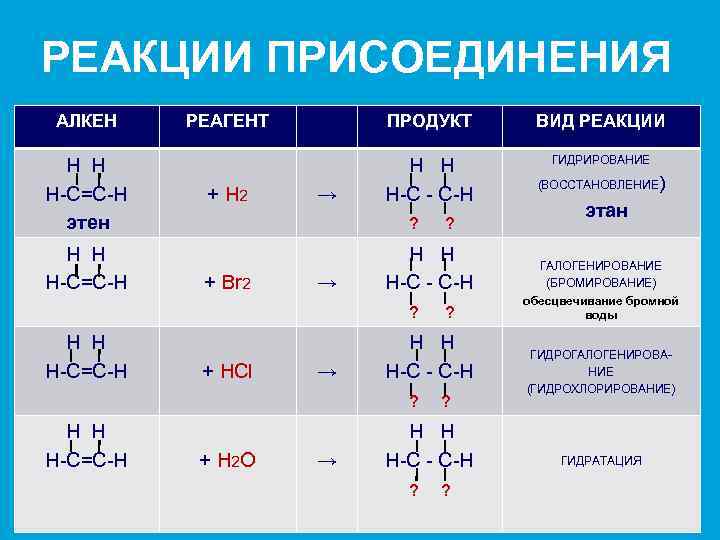 РЕАКЦИИ ПРИСОЕДИНЕНИЯ АЛКЕН Н Н Н-С=С-Н этен Н Н Н-С=С-Н РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦИИ ГИДРИРОВАНИЕ + Н 2 Н Н Н-С - С-Н → ? + Br 2 → Н Н Н-С - С-Н ? Н Н Н-С=С-Н + HCl → + H 2 O → ? Н Н Н-С - С-Н ? Н Н Н-С=С-Н ? ? Н Н Н-С - С-Н ? ? (ВОССТАНОВЛЕНИЕ) этан ГАЛОГЕНИРОВАНИЕ (БРОМИРОВАНИЕ) обесцвечивание бромной воды ГИДРОГАЛОГЕНИРОВАНИЕ (ГИДРОХЛОРИРОВАНИЕ) ГИДРАТАЦИЯ
РЕАКЦИИ ПРИСОЕДИНЕНИЯ АЛКЕН Н Н Н-С=С-Н этен Н Н Н-С=С-Н РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦИИ ГИДРИРОВАНИЕ + Н 2 Н Н Н-С - С-Н → ? + Br 2 → Н Н Н-С - С-Н ? Н Н Н-С=С-Н + HCl → + H 2 O → ? Н Н Н-С - С-Н ? Н Н Н-С=С-Н ? ? Н Н Н-С - С-Н ? ? (ВОССТАНОВЛЕНИЕ) этан ГАЛОГЕНИРОВАНИЕ (БРОМИРОВАНИЕ) обесцвечивание бромной воды ГИДРОГАЛОГЕНИРОВАНИЕ (ГИДРОХЛОРИРОВАНИЕ) ГИДРАТАЦИЯ
 Правило В. В. Марковникова Водород галогенводорода присоединяется к более гидрогенизированному атому углерода при двойной связи, а галоген – к менее гидрогенизированному H 3 C—CH=CH 2 + H—Br → H 3 C—CH—CH 3 | Br § Реакция идет по ионному механизму.
Правило В. В. Марковникова Водород галогенводорода присоединяется к более гидрогенизированному атому углерода при двойной связи, а галоген – к менее гидрогенизированному H 3 C—CH=CH 2 + H—Br → H 3 C—CH—CH 3 | Br § Реакция идет по ионному механизму.
 Используя правило Марковникова, напишите уравнения следующих реакций присоединения: а) СН 3 -СН=СН 2 + НСl ? б) СН 2=СН-СН 2 -СН 3 + НBr ? В) СН 3 -СН 2 -СН=СН 2 + НОН ? Ответы: а) СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 б) СН 2=СН-СН 2 -СН 3 + НBr СН 3 -СНBr-СН 2 -СН 3 в) СН 3 -СН 2 -СН=СН 2 + НОН СН 3 -СН 2 -СН-СН 3 ОН
Используя правило Марковникова, напишите уравнения следующих реакций присоединения: а) СН 3 -СН=СН 2 + НСl ? б) СН 2=СН-СН 2 -СН 3 + НBr ? В) СН 3 -СН 2 -СН=СН 2 + НОН ? Ответы: а) СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 б) СН 2=СН-СН 2 -СН 3 + НBr СН 3 -СНBr-СН 2 -СН 3 в) СН 3 -СН 2 -СН=СН 2 + НОН СН 3 -СН 2 -СН-СН 3 ОН
 РЕАКЦИИ ОКИСЛЕНИЯ 1) ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2 С 2 Н 6 + 7 О 2 4 СО 2 + 6 Н 2 О
РЕАКЦИИ ОКИСЛЕНИЯ 1) ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2 С 2 Н 6 + 7 О 2 4 СО 2 + 6 Н 2 О
 Реакция Е. Е. Вагнера 2) МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ KMn. O 4 Н 2 С=СН 2 + [O] + H 2 O H 2 C - CH 2 OH OH этиленгликоль ! Качественная реакция на непредельность углеводорода – на кратную связь.
Реакция Е. Е. Вагнера 2) МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ KMn. O 4 Н 2 С=СН 2 + [O] + H 2 O H 2 C - CH 2 OH OH этиленгликоль ! Качественная реакция на непредельность углеводорода – на кратную связь.
 РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n n CH 2=CH 2 этилен (мономер) один (-CH 2 -)n полиэтилен (полимер) много – степень полимеризации, показывает число молекул, вступивших в реакцию -CH 2 - структурное звено
РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n n CH 2=CH 2 этилен (мономер) один (-CH 2 -)n полиэтилен (полимер) много – степень полимеризации, показывает число молекул, вступивших в реакцию -CH 2 - структурное звено
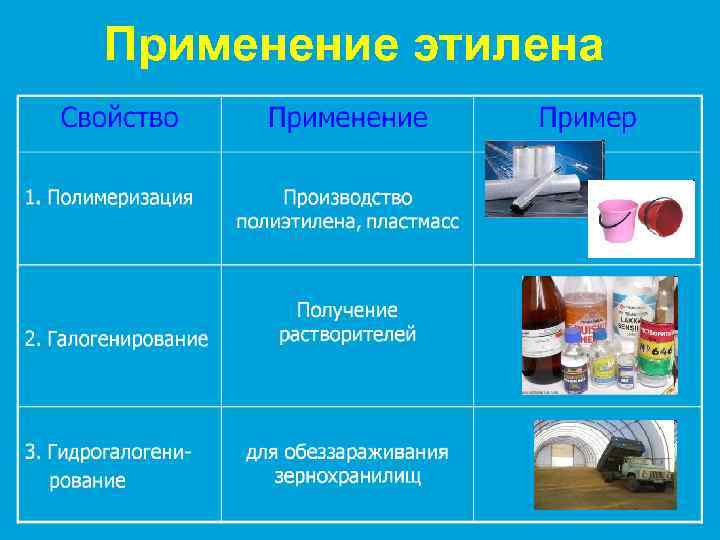 Применение этилена
Применение этилена

 Выводы § Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Атомы углерода находятся в состоянии sp 2 гибридизации. Общая формула – Сn. H 2 n. В названии алкенов используется суффикс –ен. § Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) и изомерия между классами. § Алкены обладают большой химической активностью. За счёт наличия π-связи алкены вступают в реакции присоединения, окисления, полимеризации.
Выводы § Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Атомы углерода находятся в состоянии sp 2 гибридизации. Общая формула – Сn. H 2 n. В названии алкенов используется суффикс –ен. § Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) и изомерия между классами. § Алкены обладают большой химической активностью. За счёт наличия π-связи алкены вступают в реакции присоединения, окисления, полимеризации.


