атомные спектры и дуализм.pptx
- Количество слайдов: 41

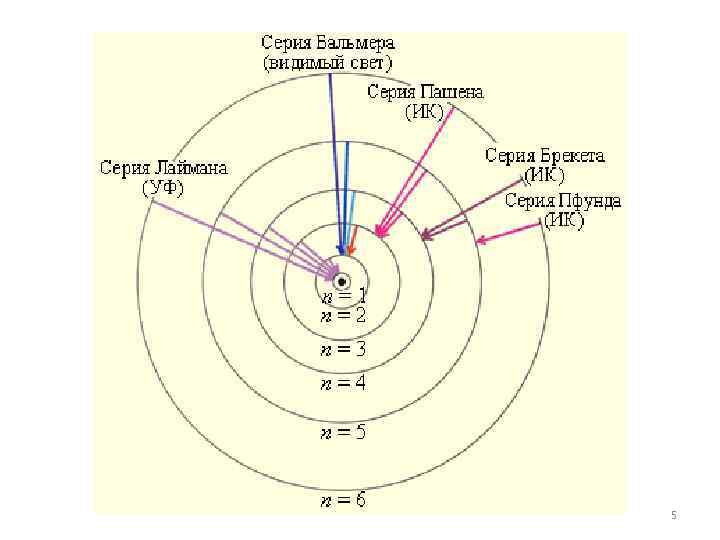
Еще в начале XIX века были открыты дискретные спектральные линии в излучении атома водорода в видимой области (так называемый линейчатый спектр). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. 1

В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий: Для серии Бальмера m = 2, n = 3, 4, 5, . . Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4, . . Постоянная R в этой формуле называется постоянной Ридберга. Ее R = 3, 29· 1015 Г численное значение ц. 2

Иоганн Якоб Бальмер ( Johann Jakob Balmer, 1825 - 1898) — швейцарский математик и физик. Читал лекции в Базельском университете. В основном занимался научной деятельностью в области геометрии, но известность получил благодаря открытию в 1885 г. спектральной серии водорода, названной в его 3 честь. В честь Бальмера

Йоханнес Роберт Ридберг (Johannes Robert Rydberg, 1854 - 1919) — шведский физик. С 1901 - профессор университета в Лунде. занимался изучением периодической системы элементов и атомных спектров. Ридберг показал, что расположение линий в атомных эмиссионных спектрах может быть описано формулами, аналогичными формуле Бальмера для спектра водорода. Постоянная используемая в этих формулах, названа его именем. Один из кратеров на Луне был назван 4 в честь Йоханнеса Ридберга.
5

6

Первая попытка создания модели атома принадлежит Дж. Томсону (1903 г. ). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 1010 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся 7
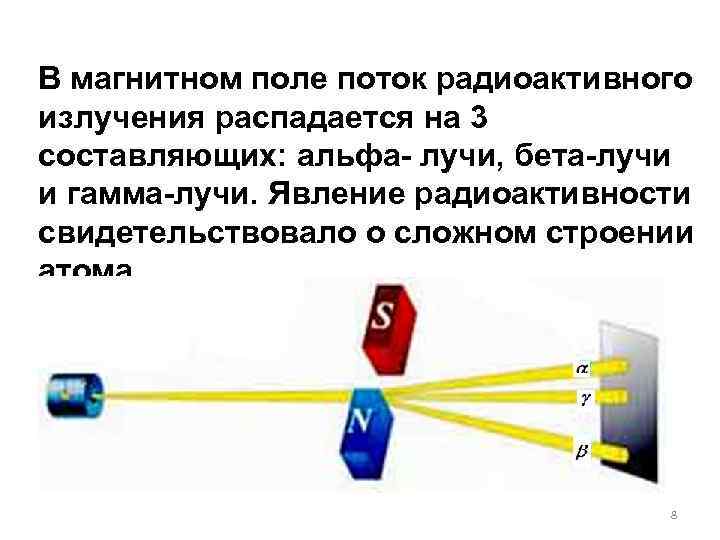
В магнитном поле поток радиоактивного излучения распадается на 3 составляющих: альфа- лучи, бета-лучи и гамма-лучи. Явление радиоактивности свидетельствовало о сложном строении атома. 8

Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909– 1911 годах. Резерфорд предложил применить зондирование атома с помощью αчастиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. 9

Эрне ст Ре зерфорд (Ernest Rutherford; 1871 - 1937, Спринг Грув ) — британский физик и новозеландского происхождения. Создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 г. Открыл альфа- и бета-излучение и множество изотопов. Открыл и объяснил радиоактивное превращение химических элементов, создал теорию радиоактивного распада, Доказал, что расщепил атом азота, обнаружил протон. альфа-частица — ядро гелия. Первым открыл образование новых химических элементов при распаде тяжелых химических радиоактивных элементов. Уточнил на 30 % отношение заряда к массе электрона. 12 учеников Резерфорда стали лауреатами Нобелевской премии по физике и химии. 10

Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 Мэ. В (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это 11

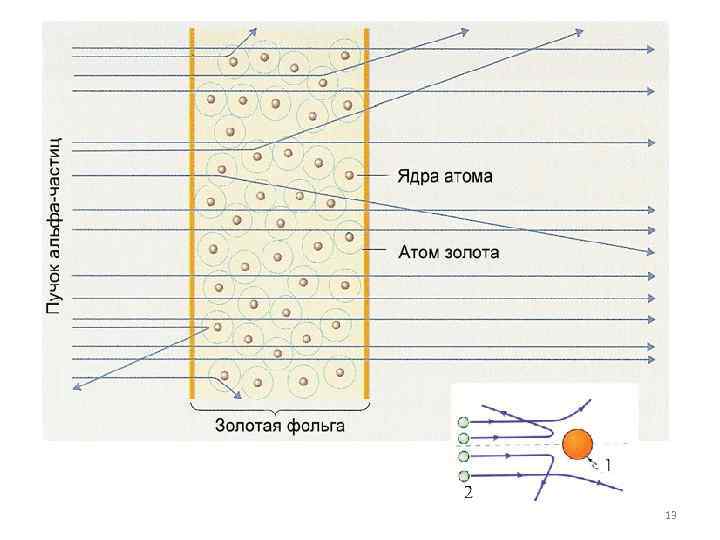
Пучок aльфа-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Некоторые альфа-частицы проходили сквозь фольгу, образуя на экране размытое пятно, а следы от других альфа-частиц были зафиксированы на боковых 12
13

Опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10– 14– 10– 15 м. Это ядро занимает только 10– 12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Веществу, составляющему ядро атома, следовало приписать плотность порядка ρ ≈ 1015 г/см 3. Заряд ядра должен быть равен суммарному заряду всех электронов, 14

Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. 15

Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году датский физик Н. Бор. Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не 16

Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна h – разности энергий постоянная стационарных состояний: Планка, равная 6. 626 10 -34 Дж с 17

Третий постулат (Правило квантования). Бор предположил, что из всех возможных орбит электрона осуществляются только те для которых момент импульса равен целому кратному постоянной планка h, деленной на 2π: Число n – называется квантовым числом. главным 18

n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 19

Нильс Хе нрик Дави д Бор (Niels Henrik David Bohr 1885 - 1962 , Копенгаген) — датский физик-теоретик и общественный деятель, один из создателей современной физики. Лауреат нобелевской премии по физике (1922) Бор известен как создатель активный участник разработки основ квантовой первой квантовой теории механики. Также он внёс значительный вклад в атома и развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой. 20

Применим полуклассический подход Бора к описанию движения электрона в поле ядра с зарядом Ze. При Z=1 такая система соответствует атому водорода. Произведение массы электрона на его центростремительное ускорение должно равняться силе Кулона, действующей на электрон: 21

Радиус может принимать только дискретные значения. Внутренняя энергия атома складывается из энергии взаимодействия электрона с ядром и кинетической электрона: Кинетическую энергию находим следующим образом: 22

Тогда внутренняя энергия атома Окончательно 23

При переходе атома водорода (Z=1) из состояния n в состояние m излучается квант Частота испущенного свет равна: 24
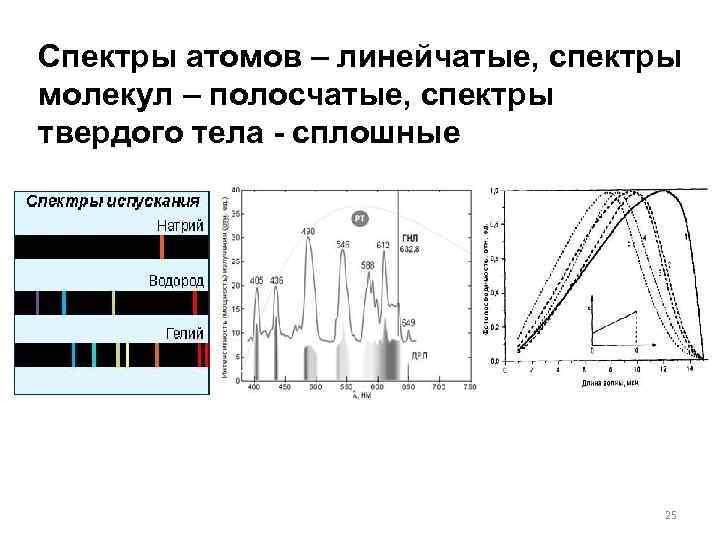
Спектры атомов – линейчатые, спектры молекул – полосчатые, спектры твердого тела - сплошные 25

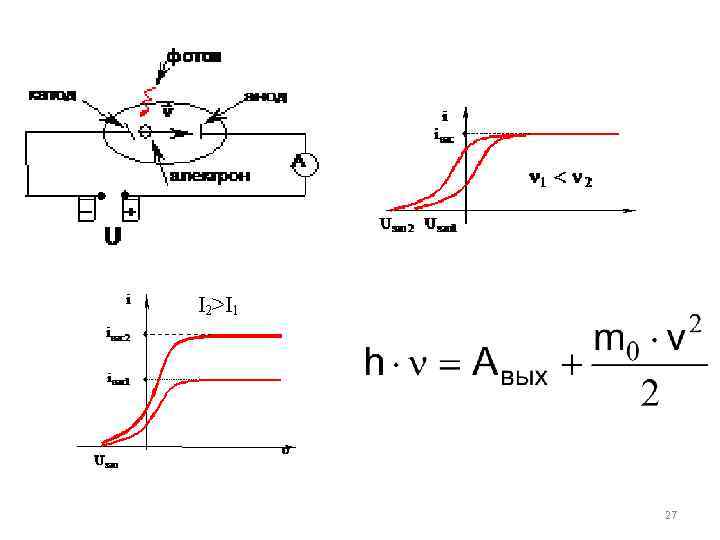
Фотоэффект – это явление вырывания электронов из твердых и жидких тел под действием света. Обнаружил явление фотоэффекта Генрих Герц в 1887 году. В 1889 году фотоэффект исследовал Александр Григорьевич Столетов (1839 – 1896). Параллельно со Столетовым фотоэффект исследовал немецкий ученый Филипп Ленард. В 1905 г. А. Эйнштейн вывел уравнение фотоэффекта. Он же высказал предположение, что взаимодействуют с электронами квазичастицы – фотоны (кванты света). 26
27

В 1923 году французский физик Л. де Бройль выдвинул гипотезу об универсальности корпускулярно-волнового дуализма: не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также и волновыми свойствами. Согласно де Бройлю, с каждым микрообъектом связаны, с одной стороны, корпускулярные характеристики – энергия E и импульс p, а с другой стороны, 28

Корпускулярные и волновые характеристики микрообъектов связаны такими же количественными соотношениями, как и у фотона: 29

Любой частице, обладающей импульсом, сопоставлялся волновой процесс с длиной волны λ = h / p. Для частиц, имеющих массу, 30
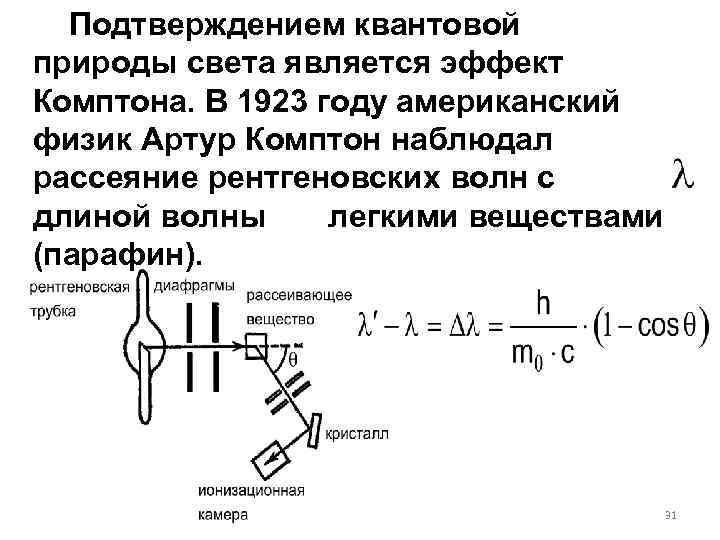
Подтверждением квантовой природы света является эффект Комптона. В 1923 году американский физик Артур Комптон наблюдал рассеяние рентгеновских волн с длиной волны легкими веществами (парафин). 31

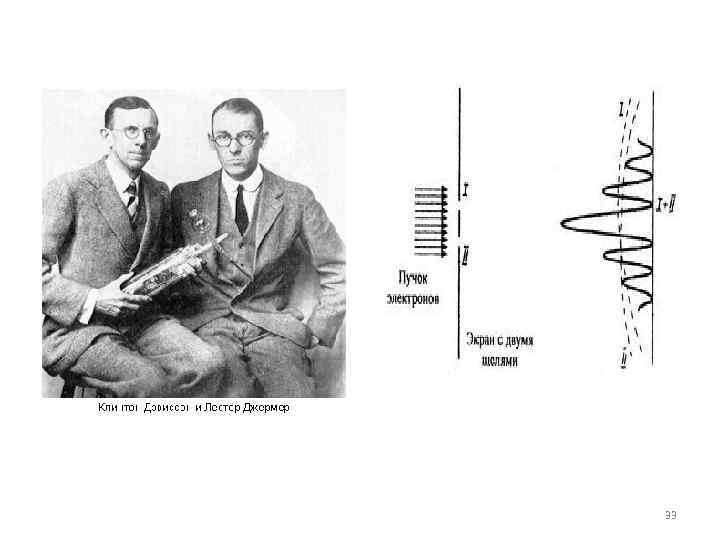
Первое экспериментальное подтверждение гипотезы де Бройля было получено в 1927 году американскими физиками К. Девиссоном и Л. Джермером. Они обнаружили, что пучок электронов, рассеивающийся на кристалле никеля, дает отчетливую дифракционную картину, подобную той, которая возникает при рассеянии на кристалле коротковолнового рентгеновского излучения. В этих экспериментах кристалл играл роль естественной дифракционной решетки. По положению дифракционных максимумов была определена длина волны электронного 32
33

В 1928 году английский физик Дж. Томсон получил новое подтверждение гипотезы де Бройля. Томсон наблюдал дифракционную картину, возникающую при прохождении пучка электронов через тонкую поликристаллическую фольгу из золота. На фотопластинке отчетливо наблюдались концентрические светлые и темные кольца, радиусы которых изменялись с изменением скорости 34

Микрочастица – это образование особого рода: частица+волна. Все это привело к необходимости построения непротиворечивой теории, объясняющей процессы, происходящие в микромире. За короткий период с июня 1925 го года и по июнь 1926 -го года, были опубликованы сразу три оригинальных и независимо сделанных варианта полной квантовой теории. Первая – матричная квантовая механика – Вернером Гейзенбергом (1901 -76). Вторая – волновая механика – Эрвином Шредингером (1887 -1961). Третья – квантовая алгебра – Паулем Дираком (1902 - 1984). 35

Состояние микрочастицы описывается в квантовой механике волновой функцией Ψ. Она является функцией координат и времени и может быть найдена путем решения уравнения: Это уравнение было установлено Шредингером в 1926 г. И называется общим уравнением Шредингера. i – мнимая единица, m – масса частицы, - оператор Лапласа, U – потенциальная 36

- оператор Лаплас Это соотношение называется уравнением Шредингера для стационарных состояний. 37

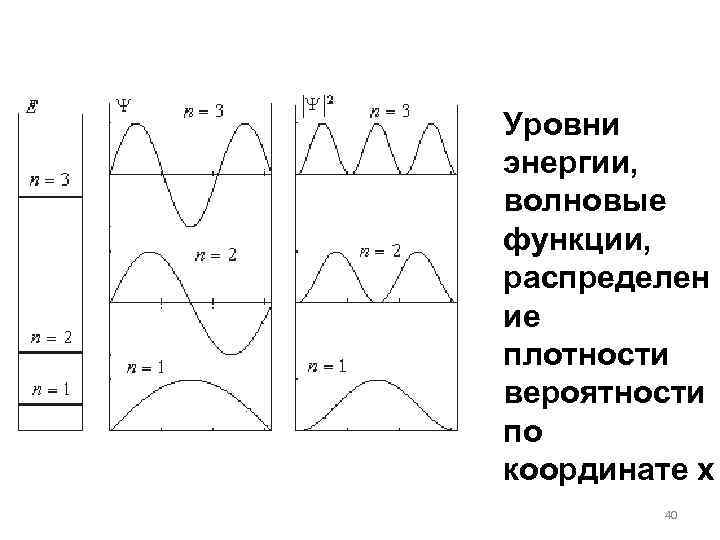
Физический смысл Ψ функции состоит в следующем: квадрат модуля Ψ определяет вероятность d. P того, что частица будет обнаружена в пределах объема d. V: Волновые функции должны всегда быть нормированы таким образом, чтобы: 38

Волновые функции, получаемые из решений уравнения Шредингера должны удовлетворять следующим условиям: 1) однозначность; 2) конечность; 3) непрерывность. Эти условия должны выполняться во всей области изменения переменных x, y, z. Они являются следствием того факта, что волновая функция по своему физическому смыслу 39
Уровни энергии, волновые функции, распределен ие плотности вероятности по координате х 40

Соотношения неопределенностей, установлены В. Гейзенбергом. Первое из них ограничивает точности одновременного измерения координат и соответствующих проекций импульса частицы. Для проекции, например на ось Х оно выглядит следующим образом: Второе соотношение устанавливает неопределенность измерения энергии, ΔЕ, за данный промежуток времени Δt: 41
атомные спектры и дуализм.pptx