Ermilov A. Yu. E-mail: sanchik-u@yandex. ru










































Квантовая химия лекция 1-2015.ppt
- Количество слайдов: 57
 Ermilov A. Yu. E-mail: sanchik-u@yandex. ru Квантовая химия Презентации к курсу лекция для группы биофизиков и биоинженеров (317, 326) (417 и 426 и … may be) Вот мы и встретились
Ermilov A. Yu. E-mail: sanchik-u@yandex. ru Квантовая химия Презентации к курсу лекция для группы биофизиков и биоинженеров (317, 326) (417 и 426 и … may be) Вот мы и встретились
 НЕ МОГУ ПРОМОЛЧАТЬ – (11. 06. 2014, ФХ-практика) o «магические» способности прорезались: Я вам задавал три контрольных вопроса и предупредил: o Если не будете знать - я не буду вести у вас Квантовую химию o Не ожидал, что так подействует: КХ перенесли на год , потом еще на месяц
НЕ МОГУ ПРОМОЛЧАТЬ – (11. 06. 2014, ФХ-практика) o «магические» способности прорезались: Я вам задавал три контрольных вопроса и предупредил: o Если не будете знать - я не буду вести у вас Квантовую химию o Не ожидал, что так подействует: КХ перенесли на год , потом еще на месяц
 КТО ПОМНИТ ТЕ ТРИ ВОПРОСА? o
КТО ПОМНИТ ТЕ ТРИ ВОПРОСА? o
 Но вы поняли… o Иногда пророчества сбываются… o Хорошо ли стало? Мы с вами – подопытные кролики. o Но теперь вы – выпускной курс(бакалавры) и оценка по КХ для вас финальная, не пересдаваемая .
Но вы поняли… o Иногда пророчества сбываются… o Хорошо ли стало? Мы с вами – подопытные кролики. o Но теперь вы – выпускной курс(бакалавры) и оценка по КХ для вас финальная, не пересдаваемая .
 Что такое квантовая химия? Специальность 02. 00. 17 Математическая и квантовая химия I. Расчеты, алгоритмы, параллельные вычисления, «Чебышев» & «Ломоносов» etc ( «Ломоносов-2» ) Почти разные направления: «ИНДУСТРИЯ» и «НАУКА» II. Теоретическая химия, приближения и модели, понятия и концепции
Что такое квантовая химия? Специальность 02. 00. 17 Математическая и квантовая химия I. Расчеты, алгоритмы, параллельные вычисления, «Чебышев» & «Ломоносов» etc ( «Ломоносов-2» ) Почти разные направления: «ИНДУСТРИЯ» и «НАУКА» II. Теоретическая химия, приближения и модели, понятия и концепции
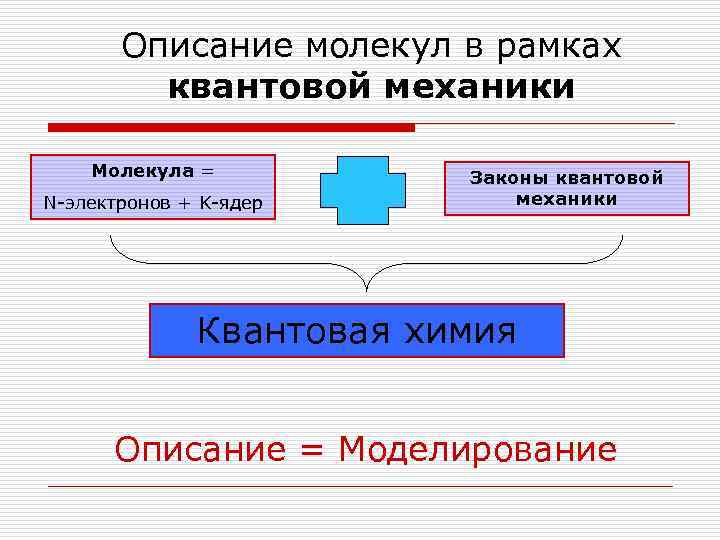
 Описание молекул в рамках квантовой механики Молекула = Законы квантовой N-электронов + K-ядер механики Квантовая химия Описание = Моделирование
Описание молекул в рамках квантовой механики Молекула = Законы квантовой N-электронов + K-ядер механики Квантовая химия Описание = Моделирование
 Программа курса (вариант 2010) o 1 Основные постулаты квантовой механики. Уравнение Шредингера. Оператор Гамильтона. Построение гамильтониана для конкретных систем. Волновая функция. o 2 Волновая функция для систем со многими степенями свободы. Разделение переменных. o 3 Атом водорода. Разделение переменных в задаче о водородоподобном атоме. Радиальное уравнение и задача о моменте импульса. Асимптотическое поведение решений радиального уравнения при r 0 и r . Энергетические уровни и собственные функции атома водорода. o 4. Разделение электронного и ядерного движений. Адиабатическое приближение (приближение Борна-Опенгеймера). Электронные и ядерные функции. Потенциальные поверхности. o 5 Спин. Операторы спина многоэлектронной системы. Чистые спиновые состояния двухэлектронной системы. Операторы повышения и понижения. Спин системы с замкнутыми электронными оболочками. Построение спиновых состояний многоэлектронных систем с максимальным квадратом спина и произвольной проекцией на ось. o 6 Волновая функция для системы тождественных частиц. Принцип Паули. o 7. Одноэлектронное приближение. Представление волновой функции в виде определителя Слэтера. o 8 Приближенные методы решения уравнения Шредингера. Вариационный принцип. Вариационный метод. Теория возмущений. o 9. Линейный вариационный метод Ритца. Применение линейного вариационного метода для описания возбужденных состояний. Теорема об окаймлении (формулировка). o 10. Метод Хартри - Фока для систем с замкнутыми оболочками. Спин-орбитали. Понятие о кулоновском и обменном операторах. Фокиан. Уравнения метода Хартри-Фока (без вывода). o 11. Основы применения теории симметрии в молекулярных задачах. -Электронное приближение. - и -Орбитали. o 12. Качественные модели МО. Метод Хюккеля. Граничные орбитали. o 13. Сопряженные углеводороды. Циклические полиены и правило 4 n+2. Ароматичность. Энергетические уровни циклического полиена. o 14. Альтернантные углеводороды. Правило Лонге-Хиггинса. Определение активных центров радикалов с альтернантной структурой. o Теоретические задачи o Поиск -МО простейших полиенов. Энергия -системы заданной электронной конфигурации, энергия сопряжения. Оценки потенциала ионизации, сродства к электрону. o Заряды на атомах как индексы реакционной способности. Заселенности и порядки связей по Коулсону. Электрофильное присоединение в бутадиене. o Определение активных центров радикалов с альтернантной структурой по правилу Лонге-Хиггинса.
Программа курса (вариант 2010) o 1 Основные постулаты квантовой механики. Уравнение Шредингера. Оператор Гамильтона. Построение гамильтониана для конкретных систем. Волновая функция. o 2 Волновая функция для систем со многими степенями свободы. Разделение переменных. o 3 Атом водорода. Разделение переменных в задаче о водородоподобном атоме. Радиальное уравнение и задача о моменте импульса. Асимптотическое поведение решений радиального уравнения при r 0 и r . Энергетические уровни и собственные функции атома водорода. o 4. Разделение электронного и ядерного движений. Адиабатическое приближение (приближение Борна-Опенгеймера). Электронные и ядерные функции. Потенциальные поверхности. o 5 Спин. Операторы спина многоэлектронной системы. Чистые спиновые состояния двухэлектронной системы. Операторы повышения и понижения. Спин системы с замкнутыми электронными оболочками. Построение спиновых состояний многоэлектронных систем с максимальным квадратом спина и произвольной проекцией на ось. o 6 Волновая функция для системы тождественных частиц. Принцип Паули. o 7. Одноэлектронное приближение. Представление волновой функции в виде определителя Слэтера. o 8 Приближенные методы решения уравнения Шредингера. Вариационный принцип. Вариационный метод. Теория возмущений. o 9. Линейный вариационный метод Ритца. Применение линейного вариационного метода для описания возбужденных состояний. Теорема об окаймлении (формулировка). o 10. Метод Хартри - Фока для систем с замкнутыми оболочками. Спин-орбитали. Понятие о кулоновском и обменном операторах. Фокиан. Уравнения метода Хартри-Фока (без вывода). o 11. Основы применения теории симметрии в молекулярных задачах. -Электронное приближение. - и -Орбитали. o 12. Качественные модели МО. Метод Хюккеля. Граничные орбитали. o 13. Сопряженные углеводороды. Циклические полиены и правило 4 n+2. Ароматичность. Энергетические уровни циклического полиена. o 14. Альтернантные углеводороды. Правило Лонге-Хиггинса. Определение активных центров радикалов с альтернантной структурой. o Теоретические задачи o Поиск -МО простейших полиенов. Энергия -системы заданной электронной конфигурации, энергия сопряжения. Оценки потенциала ионизации, сродства к электрону. o Заряды на атомах как индексы реакционной способности. Заселенности и порядки связей по Коулсону. Электрофильное присоединение в бутадиене. o Определение активных центров радикалов с альтернантной структурой по правилу Лонге-Хиггинса.
 Рекомендуемая литература o Фларри Р. Квантовая химия, М. : “Мир”. 1985 o Заградник Р. , Полак Р. Основы квантовой химии, М. : “Мир”. 1979 o Цюлике Л. Квантовая химия, т. 1, М. : “Мир”. 1976 o Минкин В. И. , Симкин Б. Я. , Миняев Р. М. Теория строения молекул. Ростов-Дон: “Феникс” 1997. o Абаренков И. В. , Братцев В. Ф. , Тулуб А. В. Начала квантовой химии, М. : “Высшая школа”. 1989. o Степанов Н. Ф. , Пупышев В. И. Квантовая механика молекул и квантовая химия. М. : Изд-во МГУ. 1991. o Степанов Н. Ф. Квантовая механика и квантовая химия. М. : Изд-во Мир, Изд-во МГУ. 2001. o Введение в квантовую химию /под. ред. С. Нагакура, Т. Накадзима, М. , Изд-во Мир, 1982.
Рекомендуемая литература o Фларри Р. Квантовая химия, М. : “Мир”. 1985 o Заградник Р. , Полак Р. Основы квантовой химии, М. : “Мир”. 1979 o Цюлике Л. Квантовая химия, т. 1, М. : “Мир”. 1976 o Минкин В. И. , Симкин Б. Я. , Миняев Р. М. Теория строения молекул. Ростов-Дон: “Феникс” 1997. o Абаренков И. В. , Братцев В. Ф. , Тулуб А. В. Начала квантовой химии, М. : “Высшая школа”. 1989. o Степанов Н. Ф. , Пупышев В. И. Квантовая механика молекул и квантовая химия. М. : Изд-во МГУ. 1991. o Степанов Н. Ф. Квантовая механика и квантовая химия. М. : Изд-во Мир, Изд-во МГУ. 2001. o Введение в квантовую химию /под. ред. С. Нагакура, Т. Накадзима, М. , Изд-во Мир, 1982.
 Какая квантовая химия будет у Вас? o Абсолютно серьезный ответ: Поживем-увидим, но… на экзамене вы будете отвечать теоретические вопросы, на зачете - … задачки на один CPU(голову) o А кто Вам на экзамене по органике синтез даст?
Какая квантовая химия будет у Вас? o Абсолютно серьезный ответ: Поживем-увидим, но… на экзамене вы будете отвечать теоретические вопросы, на зачете - … задачки на один CPU(голову) o А кто Вам на экзамене по органике синтез даст?
 Итак, квантовая механика… o Что вы помните из этой науки? Поиграем в игру: Перечислим(назовем) квантовые явления Простая ( )такая наука: уравнение Шредингера, волновая функция, операторы да матрицы, …
Итак, квантовая механика… o Что вы помните из этой науки? Поиграем в игру: Перечислим(назовем) квантовые явления Простая ( )такая наука: уравнение Шредингера, волновая функция, операторы да матрицы, …
 Квантовая механика как головоломка Перечислим, что необъяснимо из классической теории
Квантовая механика как головоломка Перечислим, что необъяснимо из классической теории
 Ну вот как-то так: 1. Спектры 2. Фотоэффект 3. Черное излучение 4. Комптоновское рассеяние 5. Неклассическая двузначность(спин) 6. Неразличимость одинаковых частиц 7. Диффракция электронов
Ну вот как-то так: 1. Спектры 2. Фотоэффект 3. Черное излучение 4. Комптоновское рассеяние 5. Неклассическая двузначность(спин) 6. Неразличимость одинаковых частиц 7. Диффракция электронов
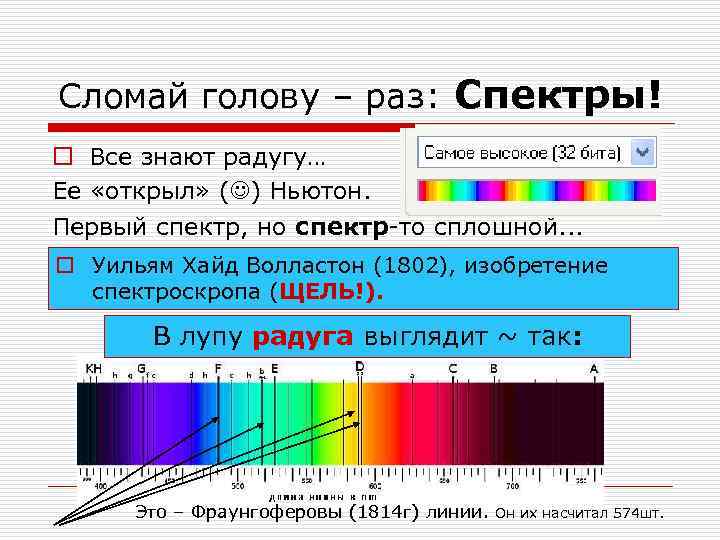
 Сломай голову – раз: Спектры! o Все знают радугу… Ее «открыл» ( ) Ньютон. Первый спектр, но спектр-то сплошной. . . o Уильям Хайд Волластон (1802), изобретение спектроскропа (ЩЕЛЬ!). В лупу радуга выглядит ~ так: Это – Фраунгоферовы (1814 г) линии. Он их насчитал 574 шт.
Сломай голову – раз: Спектры! o Все знают радугу… Ее «открыл» ( ) Ньютон. Первый спектр, но спектр-то сплошной. . . o Уильям Хайд Волластон (1802), изобретение спектроскропа (ЩЕЛЬ!). В лупу радуга выглядит ~ так: Это – Фраунгоферовы (1814 г) линии. Он их насчитал 574 шт.
 Спектры! o Что означают Фраунгоферовы линии Знаменитая двойная желтая D-линия натрия…. Это тоже обнаружил Фраунгофер(~1819) Фраунгофер, кстати, приспособил свое открытие для контроля качества линз. Его телескопы славились по всей Европе
Спектры! o Что означают Фраунгоферовы линии Знаменитая двойная желтая D-линия натрия…. Это тоже обнаружил Фраунгофер(~1819) Фраунгофер, кстати, приспособил свое открытие для контроля качества линз. Его телескопы славились по всей Европе
 Каждый элемент поглощает ту же Спектры! линию, что и испускает! o А все-таки, что означают Фраунгоферовы линии? Не забудем штрих-код Блестяший эксперимент (Жансенн, 1868 г): спектр солнечной короны во время полного затмения Все Фраунгоферовы линии, в точности на своих местах, но яркие, на темном фоне Впрочем, это уже следствие-доказательство: спектральный анализ открыли Кирхгоф и Бунзен(1859 г)
Каждый элемент поглощает ту же Спектры! линию, что и испускает! o А все-таки, что означают Фраунгоферовы линии? Не забудем штрих-код Блестяший эксперимент (Жансенн, 1868 г): спектр солнечной короны во время полного затмения Все Фраунгоферовы линии, в точности на своих местах, но яркие, на темном фоне Впрочем, это уже следствие-доказательство: спектральный анализ открыли Кирхгоф и Бунзен(1859 г)
 Absorption Спектральный анализ Emission o Кирхгоф, Бунзен(1859) 4 открытия на 2 страницы текста: 1. Каждому элементу присущ свой линейчатый спектр 2. Спектральные линии можно использовать для анализа вещества не только на Земле, но и на звездах 3. Солнце состоит из горячего ядра и атмосферы сравнительно холодных газов 4. На солнце есть натрий
Absorption Спектральный анализ Emission o Кирхгоф, Бунзен(1859) 4 открытия на 2 страницы текста: 1. Каждому элементу присущ свой линейчатый спектр 2. Спектральные линии можно использовать для анализа вещества не только на Земле, но и на звездах 3. Солнце состоит из горячего ядра и атмосферы сравнительно холодных газов 4. На солнце есть натрий
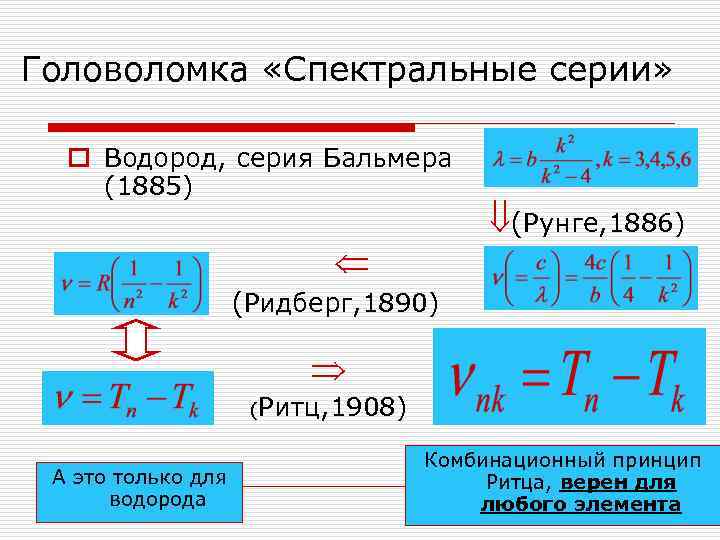
 Головоломка «Спектральные серии» o Водород, серия Бальмера (1885) О! А кто помнит формулу энергетических уровней атома водорода? И в этом(и в прошлом) году на экзамене никто не сознался… Ладно
Головоломка «Спектральные серии» o Водород, серия Бальмера (1885) О! А кто помнит формулу энергетических уровней атома водорода? И в этом(и в прошлом) году на экзамене никто не сознался… Ладно
 Головоломка «Спектральные серии» o Водород, серия Бальмера (1885) (Рунге, 1886) (Ридберг, 1890) (Ритц, 1908) Комбинационный принцип А это только для Ритца, верен для водорода любого элемента
Головоломка «Спектральные серии» o Водород, серия Бальмера (1885) (Рунге, 1886) (Ридберг, 1890) (Ритц, 1908) Комбинационный принцип А это только для Ритца, верен для водорода любого элемента
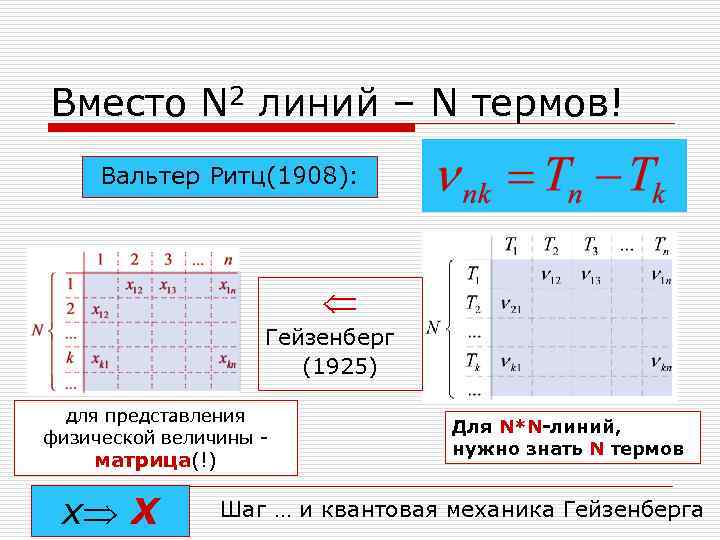
 Вместо N 2 линий – N термов! Вальтер Ритц(1908): Гейзенберг (1925) для представления Для N*N-линий, физической величины - нужно знать N термов матрица(!) x X Шаг … и квантовая механика Гейзенберга
Вместо N 2 линий – N термов! Вальтер Ритц(1908): Гейзенберг (1925) для представления Для N*N-линий, физической величины - нужно знать N термов матрица(!) x X Шаг … и квантовая механика Гейзенберга
 Задачка внутри задачки «Периодический закон-Порядковый номер» А как зависят энергетические уровни атома водорода от … заряда ядра (H-like атом)? Правильно(!) речь о внутренних электронах, их энергия монотонно(непериодически) зависит от атомного номера Это «Рентген» , А как линеаризовать? рентгеновский спектр Очевидно: Возьмем 1 s
Задачка внутри задачки «Периодический закон-Порядковый номер» А как зависят энергетические уровни атома водорода от … заряда ядра (H-like атом)? Правильно(!) речь о внутренних электронах, их энергия монотонно(непериодически) зависит от атомного номера Это «Рентген» , А как линеаризовать? рентгеновский спектр Очевидно: Возьмем 1 s
 Закон Генри Мозли(1913) Связь рентгеновского излучения атома химического элемента с его порядковым номером Собственно, закон Мозли (есть еще константа экранирования Sn, n) И… сразу нашлись пустые клетки Периодической таблицы До Бора, до квантовой механики, до «электронных оболочек» …Погиб в 1 -ю мировую войну(1915 г)
Закон Генри Мозли(1913) Связь рентгеновского излучения атома химического элемента с его порядковым номером Собственно, закон Мозли (есть еще константа экранирования Sn, n) И… сразу нашлись пустые клетки Периодической таблицы До Бора, до квантовой механики, до «электронных оболочек» …Погиб в 1 -ю мировую войну(1915 г)
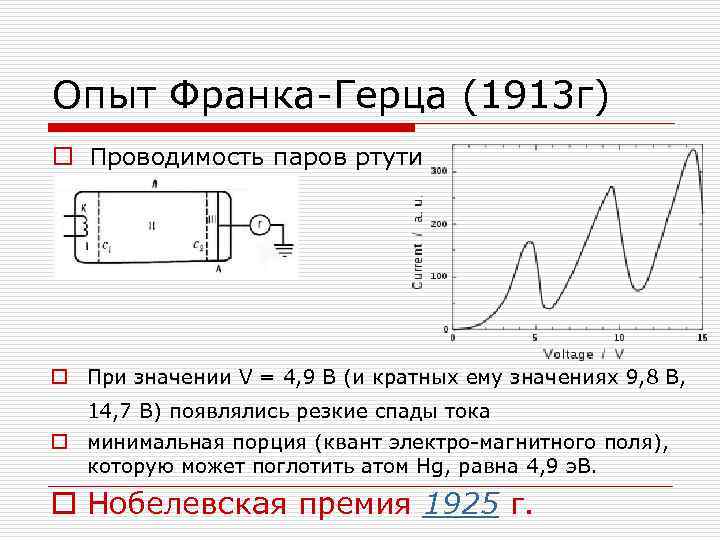
 Опыт Франка-Герца (1913 г) o Проводимость паров ртути o При значении V = 4, 9 В (и кратных ему значениях 9, 8 В, 14, 7 В) появлялись резкие спады тока o минимальная порция (квант электро-магнитного поля), которую может поглотить атом Hg, равна 4, 9 э. В. o Нобелевская премия 1925 г.
Опыт Франка-Герца (1913 г) o Проводимость паров ртути o При значении V = 4, 9 В (и кратных ему значениях 9, 8 В, 14, 7 В) появлялись резкие спады тока o минимальная порция (квант электро-магнитного поля), которую может поглотить атом Hg, равна 4, 9 э. В. o Нобелевская премия 1925 г.
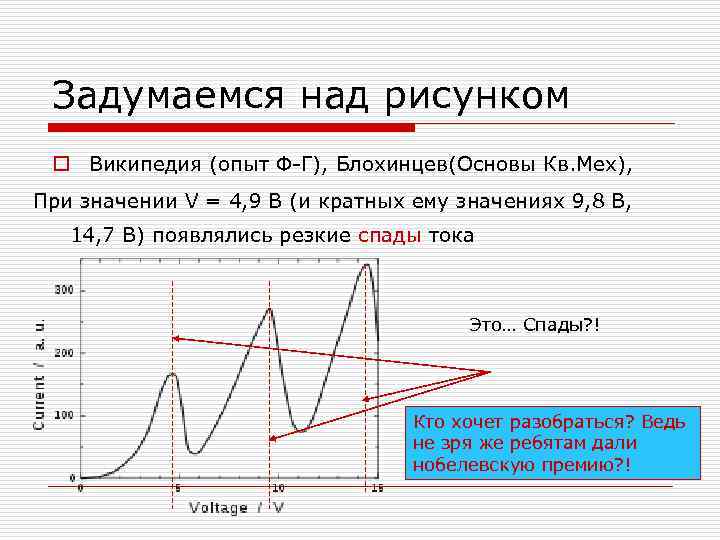
 Задумаемся над рисунком o Википедия (опыт Ф-Г), Блохинцев(Основы Кв. Мех), При значении V = 4, 9 В (и кратных ему значениях 9, 8 В, 14, 7 В) появлялись резкие спады тока Это… Спады? ! Кто хочет разобраться? Ведь не зря же ребятам дали нобелевскую премию? !
Задумаемся над рисунком o Википедия (опыт Ф-Г), Блохинцев(Основы Кв. Мех), При значении V = 4, 9 В (и кратных ему значениях 9, 8 В, 14, 7 В) появлялись резкие спады тока Это… Спады? ! Кто хочет разобраться? Ведь не зря же ребятам дали нобелевскую премию? !
 Головоломка «ЧЕРНОЕ ИЗЛУЧЕНИЕ» o Раскаленное тело излучает свет (+ИК, УФ) с четким максимумом: (до «красного каления» , до «белого каления» и максимум как-то связан с температурой разогретого тела) o Классическая теория излучения предсказывала «тепловую смерть вселенной» : Чем больше нагрето тело, тем быстрее(!) оно должно остывать o Макс Планк, формула излучения абсолютно черного тела(1900) Введение постоянной Планка, Рождение квантовой теории
Головоломка «ЧЕРНОЕ ИЗЛУЧЕНИЕ» o Раскаленное тело излучает свет (+ИК, УФ) с четким максимумом: (до «красного каления» , до «белого каления» и максимум как-то связан с температурой разогретого тела) o Классическая теория излучения предсказывала «тепловую смерть вселенной» : Чем больше нагрето тело, тем быстрее(!) оно должно остывать o Макс Планк, формула излучения абсолютно черного тела(1900) Введение постоянной Планка, Рождение квантовой теории
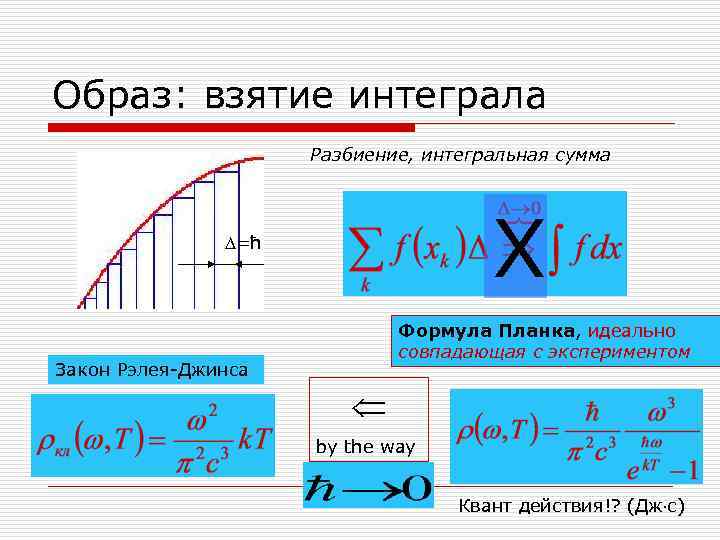
 Образ: взятие интеграла Разбиение, интегральная сумма =ħ X Формула Планка, идеально совпадающая с экспериментом Закон Рэлея-Джинса by the way Квант действия!? (Дж с)
Образ: взятие интеграла Разбиение, интегральная сумма =ħ X Формула Планка, идеально совпадающая с экспериментом Закон Рэлея-Джинса by the way Квант действия!? (Дж с)
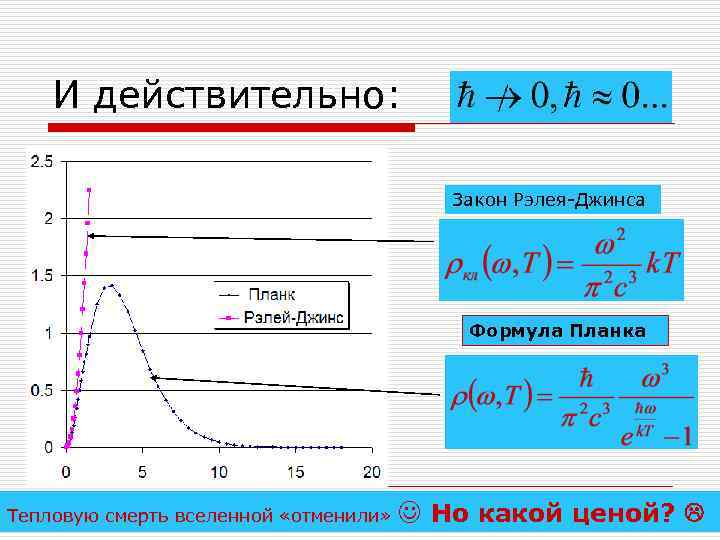
 И действительно: Закон Рэлея-Джинса Формула Планка Тепловую смерть вселенной «отменили» Но какой ценой?
И действительно: Закон Рэлея-Джинса Формула Планка Тепловую смерть вселенной «отменили» Но какой ценой?
 «…Планк посадил в ухо физикам блоху» А. Эйнштейн(~1920 г. ) o Как и Бальмер, Планк получил блестящее решение задачи, но чудовищным по тому времени приемом: И тут в квантовой теории отметился сам Эйнштейн (1905), ФОТОЭФФЕКТ
«…Планк посадил в ухо физикам блоху» А. Эйнштейн(~1920 г. ) o Как и Бальмер, Планк получил блестящее решение задачи, но чудовищным по тому времени приемом: И тут в квантовой теории отметился сам Эйнштейн (1905), ФОТОЭФФЕКТ
 Головоломка «фотоэффект» ЯВЛЕНИЕ: Появление(протекание) электрического тока под действием света o Само явление – не неожиданно: «Световые волны выбивают электроны с поверхности металла» ОБРАЗ: «Морские волны вымывают песок с побережья» Парадоксальны законы ФЭ
Головоломка «фотоэффект» ЯВЛЕНИЕ: Появление(протекание) электрического тока под действием света o Само явление – не неожиданно: «Световые волны выбивают электроны с поверхности металла» ОБРАЗ: «Морские волны вымывают песок с побережья» Парадоксальны законы ФЭ
 Законы фотоэффекта: 1 -й закон фотоэффекта: количество электронов, вырываемых светом с поверхности металла за единицу времени на данной частоте, прямо пропорционально световому потоку, освещающему металл. Согласно 2 -му закону фотоэффекта, максимальная кинетическая энергия вырываемых светом электронов линейно возрастает с частотой света и не зависит от его интенсивности. 3 -й закон фотоэффекта: для каждого вещества существует красная граница фотоэффекта, то есть минимальная частота света 0, при которой ещё возможен фотоэффект, и если < 0 , то фотоэффект уже не происходит. • Нет, с ростом освещенности фототок растет… • А ЭДС зависит только от длины волны (!) падающего света
Законы фотоэффекта: 1 -й закон фотоэффекта: количество электронов, вырываемых светом с поверхности металла за единицу времени на данной частоте, прямо пропорционально световому потоку, освещающему металл. Согласно 2 -му закону фотоэффекта, максимальная кинетическая энергия вырываемых светом электронов линейно возрастает с частотой света и не зависит от его интенсивности. 3 -й закон фотоэффекта: для каждого вещества существует красная граница фотоэффекта, то есть минимальная частота света 0, при которой ещё возможен фотоэффект, и если < 0 , то фотоэффект уже не происходит. • Нет, с ростом освещенности фототок растет… • А ЭДС зависит только от длины волны (!) падающего света
 Догадка-озарение А. Эйнштейна: (Формула Планка) Энергия кванта расходуется на работу выхода электрона – остаток его кинетическая энергия. ТОЧКА! (1905 г) Это-уравнение Эйнштейна для фотоэффекта, Нобелевская премия 1921 г. Эйнштейна поругали все, включая Планка(!) Планк убеждал министерство образования пригласить Эйнштейна в Берлин и «не слишком ставить ему в упрек гипотезу относительно фотоэффекта»
Догадка-озарение А. Эйнштейна: (Формула Планка) Энергия кванта расходуется на работу выхода электрона – остаток его кинетическая энергия. ТОЧКА! (1905 г) Это-уравнение Эйнштейна для фотоэффекта, Нобелевская премия 1921 г. Эйнштейна поругали все, включая Планка(!) Планк убеждал министерство образования пригласить Эйнштейна в Берлин и «не слишком ставить ему в упрек гипотезу относительно фотоэффекта»
 Головоломка «фотоэффект» смена образа! o ОБРАЗ: «Световые волны вымывают электроны с поверхности металла» o ОБРАЗ: «Поток квантов(фотонов) выбивает электроны с поверхности металла» o Свет - поток фотонов! Это уже ПОНЯТИЕ Свет - и волна и частица… Бор: «Даже если Эйнштейн окончательно докажет, что свет-поток частиц, он пришлет мне это известие по телеграфу, который использует функции света, как волны. . . »
Головоломка «фотоэффект» смена образа! o ОБРАЗ: «Световые волны вымывают электроны с поверхности металла» o ОБРАЗ: «Поток квантов(фотонов) выбивает электроны с поверхности металла» o Свет - поток фотонов! Это уже ПОНЯТИЕ Свет - и волна и частица… Бор: «Даже если Эйнштейн окончательно докажет, что свет-поток частиц, он пришлет мне это известие по телеграфу, который использует функции света, как волны. . . »
 Головоломка Комптоновское рассеяние o Бывает прямой свет, а бывает o Эффект Комптона(1923 г. ) – рассеянный рентгеновские лучи рассеиваются на электронах с изменением длины волны o Речь о свойствах света, рассеянного Нобелевская премия 1927 г. под разными углами Значение Комптоновского сдвига:
Головоломка Комптоновское рассеяние o Бывает прямой свет, а бывает o Эффект Комптона(1923 г. ) – рассеянный рентгеновские лучи рассеиваются на электронах с изменением длины волны o Речь о свойствах света, рассеянного Нобелевская премия 1927 г. под разными углами Значение Комптоновского сдвига:
 Головоломка Комптоновское рассеяние o Свет – поток «фотонов» ! Энергия Импульс Вывод формулы сдвига Комптона считать домашним заданием (правильная формула получается при учете релятивисткого поведения электрона)
Головоломка Комптоновское рассеяние o Свет – поток «фотонов» ! Энергия Импульс Вывод формулы сдвига Комптона считать домашним заданием (правильная формула получается при учете релятивисткого поведения электрона)
 Головоломка Комптоновское рассеяние o Свет – поток «фотонов» ! Энергия Импульс Вывод формулы сдвига Комптона считать домашним заданием (правильная формула получается при учете релятивисткого поведения электрона)
Головоломка Комптоновское рассеяние o Свет – поток «фотонов» ! Энергия Импульс Вывод формулы сдвига Комптона считать домашним заданием (правильная формула получается при учете релятивисткого поведения электрона)
 Думай, голова думай. . . Квантовые объекты противоречивы(!), совмещают несовместимое! (необъяснимо из классической теории. . . )
Думай, голова думай. . . Квантовые объекты противоречивы(!), совмещают несовместимое! (необъяснимо из классической теории. . . )
 Дифракция электронов o Это уже «ответ» головоломки: Пучок электронов может рассеиваться, образуя интерференционную картину. Опыт Дэвиссона-Джермера (1927 г. ): Проводилось исследование отражения электронов от монокристалла никеля При различных значениях углов и скоростей, в отражённых лучах наблюдаются максимумы и минимумы интенсивности. Условие максимума:
Дифракция электронов o Это уже «ответ» головоломки: Пучок электронов может рассеиваться, образуя интерференционную картину. Опыт Дэвиссона-Джермера (1927 г. ): Проводилось исследование отражения электронов от монокристалла никеля При различных значениях углов и скоростей, в отражённых лучах наблюдаются максимумы и минимумы интенсивности. Условие максимума:
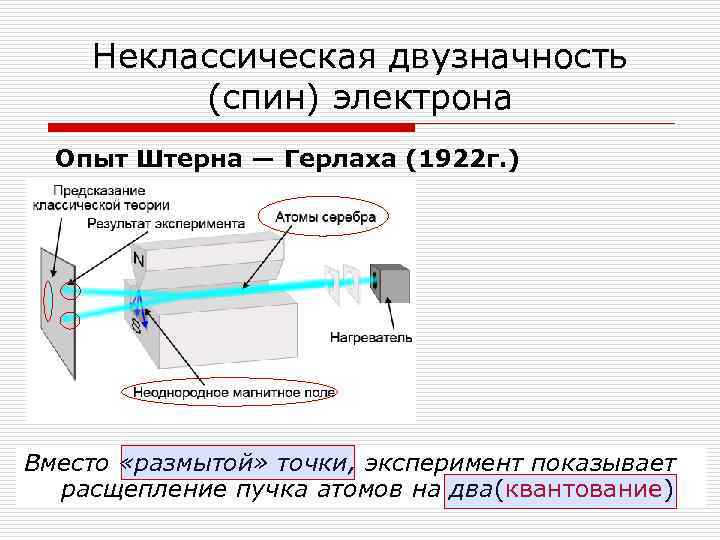
 Неклассическая двузначность (спин) электрона Опыт Штерна — Герлаха (1922 г. ) Вместо «размытой» точки, эксперимент показывает расщепление пучка атомов на два(квантование)
Неклассическая двузначность (спин) электрона Опыт Штерна — Герлаха (1922 г. ) Вместо «размытой» точки, эксперимент показывает расщепление пучка атомов на два(квантование)
 Неклассическая двузначность (спин) электрона Опыт Штерна — Герлаха (1922 г. ) Электрон имеет собственный угловой момент (спин)! Проекция спина на любую ось принимает два значения (+ħ/2 и -ħ/2) И ось – любая (!!!) Т. е. результат не зависит от выбора оси! Головоломка о спине – одна из самых «головоломных» . У спина просто нет аналога в классической механике.
Неклассическая двузначность (спин) электрона Опыт Штерна — Герлаха (1922 г. ) Электрон имеет собственный угловой момент (спин)! Проекция спина на любую ось принимает два значения (+ħ/2 и -ħ/2) И ось – любая (!!!) Т. е. результат не зависит от выбора оси! Головоломка о спине – одна из самых «головоломных» . У спина просто нет аналога в классической механике.
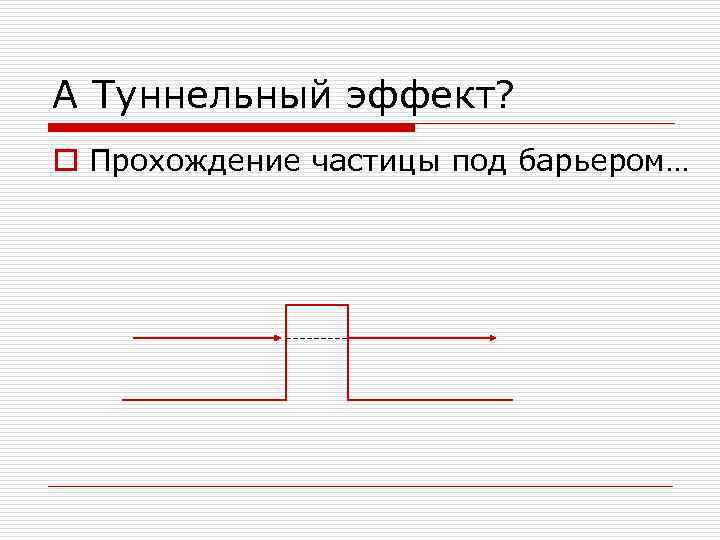
 А Туннельный эффект? o Прохождение частицы под барьером…
А Туннельный эффект? o Прохождение частицы под барьером…
 Холодная эмиссия (Роберт Вуд, 1897) o Испускание электронов при очень высоких (~107 В/см) напряженностях внешнего поля Милликен с сотр. (1928 г) обнаружил линейную зависимость логарифма плотности тока j от обратной напряжённости электрического поля 1/Е.
Холодная эмиссия (Роберт Вуд, 1897) o Испускание электронов при очень высоких (~107 В/см) напряженностях внешнего поля Милликен с сотр. (1928 г) обнаружил линейную зависимость логарифма плотности тока j от обратной напряжённости электрического поля 1/Е.
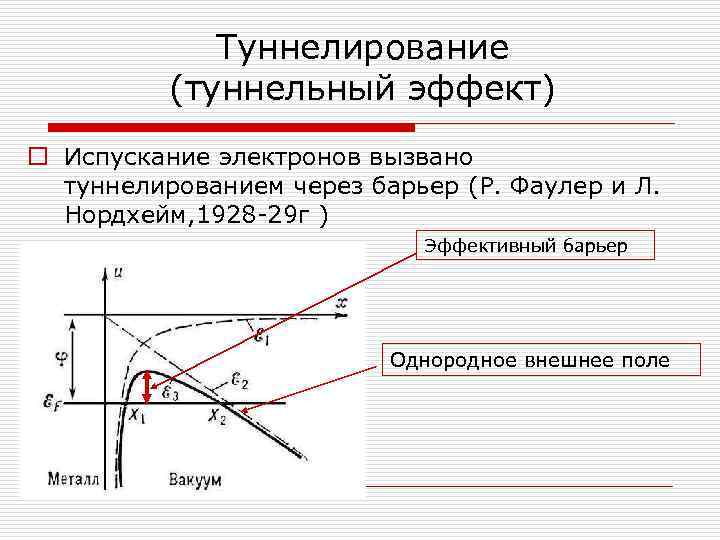
 Туннелирование (туннельный эффект) o Испускание электронов вызвано туннелированием через барьер (Р. Фаулер и Л. Нордхейм, 1928 -29 г ) Эффективный барьер Однородное внешнее поле
Туннелирование (туннельный эффект) o Испускание электронов вызвано туннелированием через барьер (Р. Фаулер и Л. Нордхейм, 1928 -29 г ) Эффективный барьер Однородное внешнее поле
 Головоломка: тождественные частицы У тождественных частиц. . . «нет номера» , они неразличимы Никакими экспериментами нельзя пометить выбранный электрон и проследить его эволюцию. Он всегда «просто» электрон. Его нумерация - дань традиции и неумению работать с тождественными частицами.
Головоломка: тождественные частицы У тождественных частиц. . . «нет номера» , они неразличимы Никакими экспериментами нельзя пометить выбранный электрон и проследить его эволюцию. Он всегда «просто» электрон. Его нумерация - дань традиции и неумению работать с тождественными частицами.
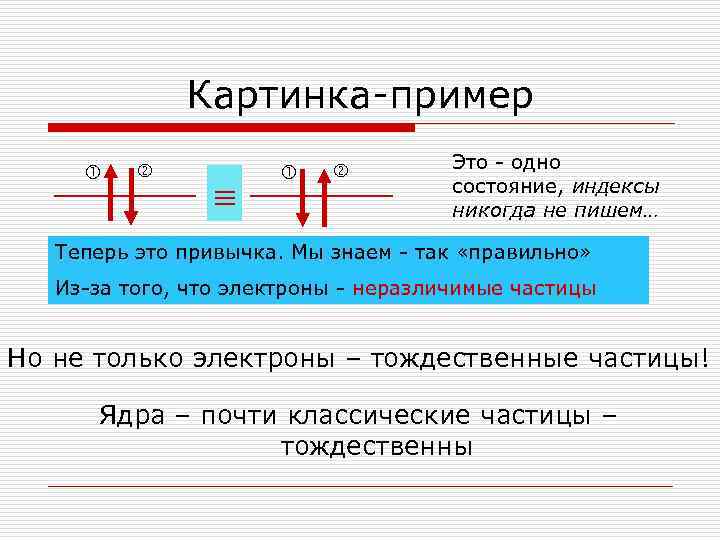
 Картинка-пример Это - одно состояние, индексы никогда не пишем… Теперь это привычка. Мы знаем - так «правильно» Из-за того, что электроны - неразличимые частицы Но не только электроны – тождественные частицы! Ядра – почти классические частицы – тождественны
Картинка-пример Это - одно состояние, индексы никогда не пишем… Теперь это привычка. Мы знаем - так «правильно» Из-за того, что электроны - неразличимые частицы Но не только электроны – тождественные частицы! Ядра – почти классические частицы – тождественны
 Неразличимые состояния!!! Пример: CO и N 2 – молекулы с близкими параметрами. (CO)=1, (N 2)=2 Два ядра азота одинаковы … и неразличимы! Никакими средствами нельзя их «пометить» и различить. А последствия – на энтропию( )
Неразличимые состояния!!! Пример: CO и N 2 – молекулы с близкими параметрами. (CO)=1, (N 2)=2 Два ядра азота одинаковы … и неразличимы! Никакими средствами нельзя их «пометить» и различить. А последствия – на энтропию( )
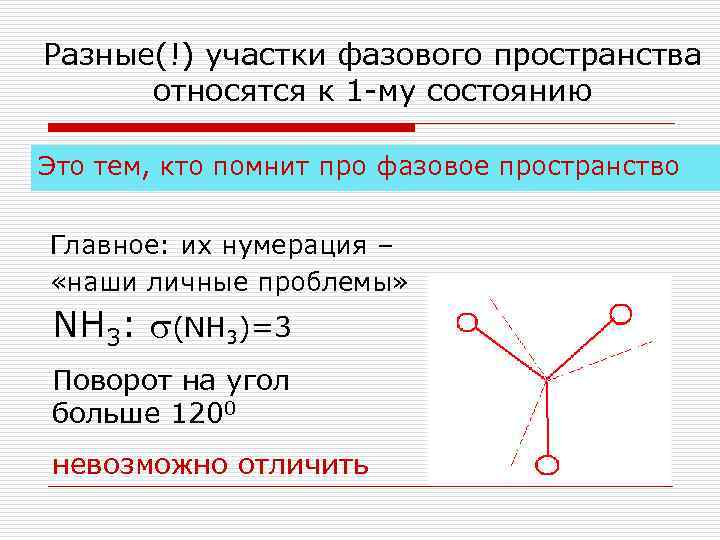
 Разные(!) участки фазового пространства относятся к 1 -му состоянию Это тем, кто помнит про фазовое пространство Главное: их нумерация – «наши личные проблемы» NH 3: (NH 3)=3 Поворот на угол больше 1200 невозможно отличить
Разные(!) участки фазового пространства относятся к 1 -му состоянию Это тем, кто помнит про фазовое пространство Главное: их нумерация – «наши личные проблемы» NH 3: (NH 3)=3 Поворот на угол больше 1200 невозможно отличить
 Энтропия – странная штука Мы все помним формулу Больцмана Энтропия. . . А как это далеко от квантовой физики Только не говорите, что у вас не было физхимии… Давно, но уж это все равно знаете:
Энтропия – странная штука Мы все помним формулу Больцмана Энтропия. . . А как это далеко от квантовой физики Только не говорите, что у вас не было физхимии… Давно, но уж это все равно знаете:
 Одинаковые молекулы – тоже неразличимы! o Неразличимость - первое обнаруженное квантовое свойство (Больцман, 1878 г(? )) o У 1 -й молекулы – Q состояний. Сколько состояний будет у N молекул? Нет, получается неверно. . . Нужно поделить на N!
Одинаковые молекулы – тоже неразличимы! o Неразличимость - первое обнаруженное квантовое свойство (Больцман, 1878 г(? )) o У 1 -й молекулы – Q состояний. Сколько состояний будет у N молекул? Нет, получается неверно. . . Нужно поделить на N!
 Больцман и классическая физика o Классическая физика…- серьезная наука o Чтобы правильно считать (энтропию) надо не QN, а QN/N! А как Больцман его предложил, объяснить… но объяснить…. 1878 год! Абсурд? !
Больцман и классическая физика o Классическая физика…- серьезная наука o Чтобы правильно считать (энтропию) надо не QN, а QN/N! А как Больцман его предложил, объяснить… но объяснить…. 1878 год! Абсурд? !
 И правда … В то время еще сомневались в существовании атомов Больцман: «я последний, кто отрицает возможность построения другой картины мира, кроме атомистической» …Работы Ломоносова в этой области стали известны лишь 1904 году
И правда … В то время еще сомневались в существовании атомов Больцман: «я последний, кто отрицает возможность построения другой картины мира, кроме атомистической» …Работы Ломоносова в этой области стали известны лишь 1904 году
 И правда … абсурд Джоуль(1851 г): «скорости атомов 1800 м/с» В это уже трудно было поверить… А Больцман предложил еще и состояния считать «не все» , а делить на N! Чтобы было понятно: Вот братья близнецы… Так на них и паспорт только один надо выписывать Или «с одним и тем же номером»
И правда … абсурд Джоуль(1851 г): «скорости атомов 1800 м/с» В это уже трудно было поверить… А Больцман предложил еще и состояния считать «не все» , а делить на N! Чтобы было понятно: Вот братья близнецы… Так на них и паспорт только один надо выписывать Или «с одним и тем же номером»
 … Больцман покончил с собой в 1906 году… Его идеи были не признаны, И еще ему не повезло с начальством: Мах и Оствальд – были убежденные антиатомисты
… Больцман покончил с собой в 1906 году… Его идеи были не признаны, И еще ему не повезло с начальством: Мах и Оствальд – были убежденные антиатомисты
 Reference o Пономарев Л. И. Под знаком кванта. — М. : Сов. Россия, 1984. — 352 с. , ил. + o Википедия
Reference o Пономарев Л. И. Под знаком кванта. — М. : Сов. Россия, 1984. — 352 с. , ил. + o Википедия
 И резюме o То что показано в лекции – тот айсберг, составляющий экспериментальную основу квантовой механики Все без математики Важно понимать – под курьезной и непонятной математикой стоят строгие экспериментальные факты. Противоречивые, головоломные. . . Но - факты Ermilov A. Yu. E-mail: sanchik-u@yandex. ru
И резюме o То что показано в лекции – тот айсберг, составляющий экспериментальную основу квантовой механики Все без математики Важно понимать – под курьезной и непонятной математикой стоят строгие экспериментальные факты. Противоречивые, головоломные. . . Но - факты Ermilov A. Yu. E-mail: sanchik-u@yandex. ru
 Важно: «Knabenphysik» или ФИЗИКА ДЛЯ МАЛЬЧИКОВ Гейзенберг, Дирак, Паули (22 -24 года) Макс Борн (руководитель Гейзенберга) аж 42(!) Шредингер - «Старик» (38 лет) Луи Де Бройль -31
Важно: «Knabenphysik» или ФИЗИКА ДЛЯ МАЛЬЧИКОВ Гейзенберг, Дирак, Паули (22 -24 года) Макс Борн (руководитель Гейзенберга) аж 42(!) Шредингер - «Старик» (38 лет) Луи Де Бройль -31
 Из чего состоит мозаика?
Из чего состоит мозаика?
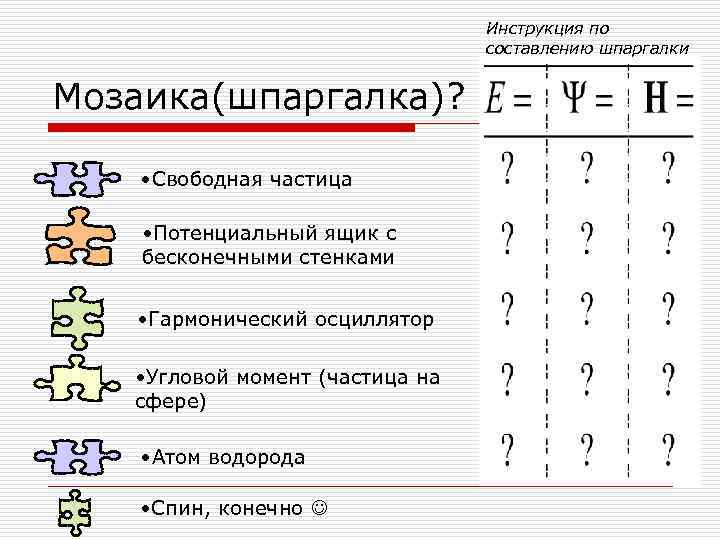
 Инструкция по составлению шпаргалки Мозаика(шпаргалка)? • Свободная частица • Потенциальный ящик с бесконечными стенками • Гармонический осциллятор • Угловой момент (частица на сфере) • Атом водорода • Спин, конечно
Инструкция по составлению шпаргалки Мозаика(шпаргалка)? • Свободная частица • Потенциальный ящик с бесконечными стенками • Гармонический осциллятор • Угловой момент (частица на сфере) • Атом водорода • Спин, конечно
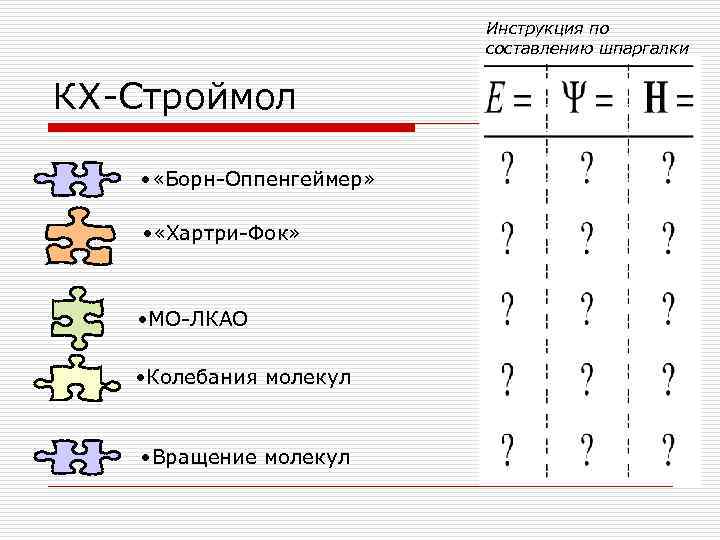
 Инструкция по составлению шпаргалки КХ-Строймол • «Борн-Оппенгеймер» • «Хартри-Фок» • МО-ЛКАО • Колебания молекул • Вращение молекул
Инструкция по составлению шпаргалки КХ-Строймол • «Борн-Оппенгеймер» • «Хартри-Фок» • МО-ЛКАО • Колебания молекул • Вращение молекул

