ерис тика









 ерис тика хар акт об щая
ерис тика хар акт об щая
 Заполните таблицу: «Общая характеристика элементов главной подгруппы I группы Периодической системы Д. И. Менделеева» . ЧИСЛО ХАРАКТЕРНЫЕ НАЗВАНИЕ И СИМВОЛ СОСТАВ ЯДРА ЧИСЛО ХАРАКТЕРНЫЕ НАЗВАНИЕ И СИМВОЛ СОСТАВ ЯДРА ВАЛЕНТНЫХ ЭЛЕКТРОННЫХ СТЕПЕНИ ЭЛЕМЕНТА АТОМА ВАЛЕНТНЫХ ЭЛЕКТРОННЫХ СТЕПЕНИ ЭЛЕМЕНТА АТОМА ЭЛЕКТРОНОВ СЛОЕВ ОКИСЛЕНИЯ ЭЛЕКТРОНОВ СЛОЕВ) ОКИСЛЕНИЯ Li p=+3 1 )) 0, +1 n= 4 Na p=+11 1 ))) 0, +1 n= 12 K p=+19 1 ))) 0, +1 n= 20 Rb p=+37 1 )))) 0, +1 n= 48 Cs p=+ 55 1 ))))) 0, +1 n= 78
Заполните таблицу: «Общая характеристика элементов главной подгруппы I группы Периодической системы Д. И. Менделеева» . ЧИСЛО ХАРАКТЕРНЫЕ НАЗВАНИЕ И СИМВОЛ СОСТАВ ЯДРА ЧИСЛО ХАРАКТЕРНЫЕ НАЗВАНИЕ И СИМВОЛ СОСТАВ ЯДРА ВАЛЕНТНЫХ ЭЛЕКТРОННЫХ СТЕПЕНИ ЭЛЕМЕНТА АТОМА ВАЛЕНТНЫХ ЭЛЕКТРОННЫХ СТЕПЕНИ ЭЛЕМЕНТА АТОМА ЭЛЕКТРОНОВ СЛОЕВ ОКИСЛЕНИЯ ЭЛЕКТРОНОВ СЛОЕВ) ОКИСЛЕНИЯ Li p=+3 1 )) 0, +1 n= 4 Na p=+11 1 ))) 0, +1 n= 12 K p=+19 1 ))) 0, +1 n= 20 Rb p=+37 1 )))) 0, +1 n= 48 Cs p=+ 55 1 ))))) 0, +1 n= 78
 Назовите закономерности в строении атомов щелочных металлов: Сходство внешнего электронного слоя. Последовательное изменение атомных радиусов. Увеличение числа электронных слоев в атоме. Радиусы атомов увеличиваются от Li к Cs, следовательно увеличиваются и восстановительные свойства металлов от Li к Cs.
Назовите закономерности в строении атомов щелочных металлов: Сходство внешнего электронного слоя. Последовательное изменение атомных радиусов. Увеличение числа электронных слоев в атоме. Радиусы атомов увеличиваются от Li к Cs, следовательно увеличиваются и восстановительные свойства металлов от Li к Cs.
 Проверь себя (работа с таблицей Д. И. Менделеева) n Сравните атомы элементов, поставив знаки <, > или = вместо *: а) заряд ядра: Li * Rb, Na * Al, Ca * К; б) число электронных слоев: Li * Rb, Na * Al, Ca * К; в) число электронов на внешнем уровне: Li * Rb, Na * Al, Ca * К; г) радиус атома: Li * Rb, Na * Al, Ca * K; д) восстановительные свойства: Li * Rb, Na * Al, Ca * K.
Проверь себя (работа с таблицей Д. И. Менделеева) n Сравните атомы элементов, поставив знаки <, > или = вместо *: а) заряд ядра: Li * Rb, Na * Al, Ca * К; б) число электронных слоев: Li * Rb, Na * Al, Ca * К; в) число электронов на внешнем уровне: Li * Rb, Na * Al, Ca * К; г) радиус атома: Li * Rb, Na * Al, Ca * K; д) восстановительные свойства: Li * Rb, Na * Al, Ca * K.
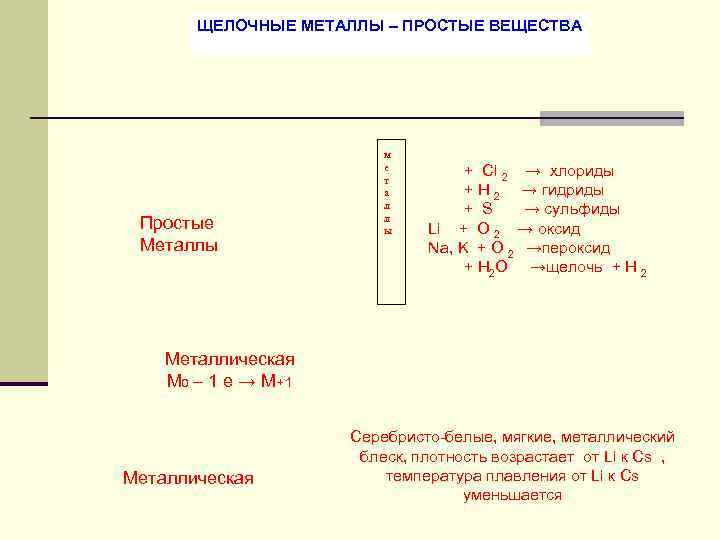
 ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА м е + Cl 2 → хлориды т а + H 2 → гидриды л + S → сульфиды Простые ы Li + O 2 → оксид Металлы Na, K + O 2 →пероксид + H 2 O →щелочь + Н 2 Металлическая М 0 – 1 е → М+1 Серебристо белые, мягкие, металлический блеск, плотность возрастает от Li к Cs , Металлическая температура плавления от Li к Cs уменьшается
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА м е + Cl 2 → хлориды т а + H 2 → гидриды л + S → сульфиды Простые ы Li + O 2 → оксид Металлы Na, K + O 2 →пероксид + H 2 O →щелочь + Н 2 Металлическая М 0 – 1 е → М+1 Серебристо белые, мягкие, металлический блеск, плотность возрастает от Li к Cs , Металлическая температура плавления от Li к Cs уменьшается
 Проверь себя 1. Составьте уравнения реакций с кислородом: а) лития ________ ; б) натрия ________ Расставьте степени окисления элементов, покажите стрелкой переход электронов. Назовите продукты реакций. 2. Дайте характеристику реакции лития с кислородом: 1) по числу и составу исходных веществ и продуктов реакции _______ 2) по изменению степеней окисле ния атомов ________ 3) по направлению ____________ 4) по тепловому эффекту __________ 5) по агрегатному состоянию веществ ________
Проверь себя 1. Составьте уравнения реакций с кислородом: а) лития ________ ; б) натрия ________ Расставьте степени окисления элементов, покажите стрелкой переход электронов. Назовите продукты реакций. 2. Дайте характеристику реакции лития с кислородом: 1) по числу и составу исходных веществ и продуктов реакции _______ 2) по изменению степеней окисле ния атомов ________ 3) по направлению ____________ 4) по тепловому эффекту __________ 5) по агрегатному состоянию веществ ________
 Проверь себя (самостоятельная работа ) Дополните схемы взаимодействия щелочных металлов с неметаллами общими формулами и названиями продуктов реакции. Запишите конкретные уравнения реакций, расставив коэффициенты в них методом электронного баланса. а) М+ Н 2 _______ в) М+ С 12 __________ Пример: __________ Пример: _____________ б) М+ S ______ г) М+ N 2 ____________________________ Пример: _______________ Допишите уравнения реакций. Как изменяется скорость реакций, расположенных в указанной стрелкой последовательно сти? а) Li + H 2 O→ ……………. ……………………… б) Na + H 2 O→……………. ……………………… в) К + Н 2 О→……………. . ……………………… Объясните, от какого фактора зависит скорость реакции взаимо действия щелочных металлов с водой ……………. . Назовите продукты реакций. Опишите, как доказать их образование. ……………. . .
Проверь себя (самостоятельная работа ) Дополните схемы взаимодействия щелочных металлов с неметаллами общими формулами и названиями продуктов реакции. Запишите конкретные уравнения реакций, расставив коэффициенты в них методом электронного баланса. а) М+ Н 2 _______ в) М+ С 12 __________ Пример: __________ Пример: _____________ б) М+ S ______ г) М+ N 2 ____________________________ Пример: _______________ Допишите уравнения реакций. Как изменяется скорость реакций, расположенных в указанной стрелкой последовательно сти? а) Li + H 2 O→ ……………. ……………………… б) Na + H 2 O→……………. ……………………… в) К + Н 2 О→……………. . ……………………… Объясните, от какого фактора зависит скорость реакции взаимо действия щелочных металлов с водой ……………. . Назовите продукты реакций. Опишите, как доказать их образование. ……………. . .
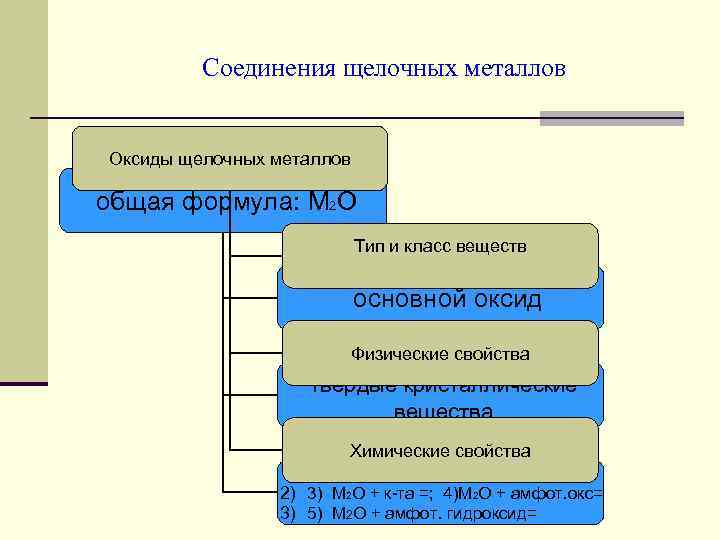
 Соединения щелочных металлов Оксиды щелочных металлов общая формула: М 2 О Тип и класс веществ основной оксид Физические свойства твердые кристаллические вещества Химические свойства 1) М 2 О + Н 2 О= ; 2) М 2 О + кисл. окс= 2) 3) М 2 О + к та =; 4)М 2 О + амфот. окс= 3) 5) М 2 О + амфот. гидроксид=
Соединения щелочных металлов Оксиды щелочных металлов общая формула: М 2 О Тип и класс веществ основной оксид Физические свойства твердые кристаллические вещества Химические свойства 1) М 2 О + Н 2 О= ; 2) М 2 О + кисл. окс= 2) 3) М 2 О + к та =; 4)М 2 О + амфот. окс= 3) 5) М 2 О + амфот. гидроксид=
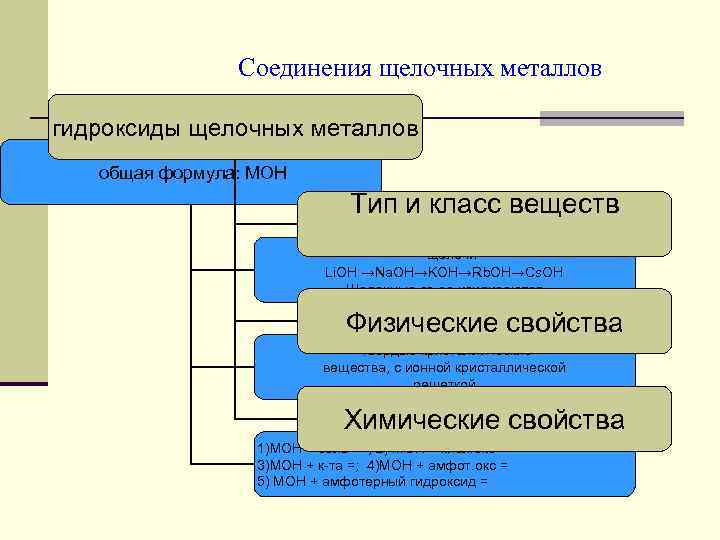
 Соединения щелочных металлов гидроксиды щелочных металлов общая формула: МОН Тип и класс веществ щелочи Li. OH →Na. OH→KOH→Rb. OH→Cs. OH Щелочные св ва усиливаются Физические свойства твердые кристаллические вещества, с ионной кристаллической решеткой Химические свойства 1)МОН + соль = ; 2) МОН + кисл. окс = 3)МОН + к та =; 4)МОН + амфот. окс = 5) МОН + амфотерный гидроксид =
Соединения щелочных металлов гидроксиды щелочных металлов общая формула: МОН Тип и класс веществ щелочи Li. OH →Na. OH→KOH→Rb. OH→Cs. OH Щелочные св ва усиливаются Физические свойства твердые кристаллические вещества, с ионной кристаллической решеткой Химические свойства 1)МОН + соль = ; 2) МОН + кисл. окс = 3)МОН + к та =; 4)МОН + амфот. окс = 5) МОН + амфотерный гидроксид =
 Распознавание ионов щелочных металлов по окраске пламени Горение натрия Горение лития
Распознавание ионов щелочных металлов по окраске пламени Горение натрия Горение лития
 Домашнее задание: n § 44. упр. № 2, 3 стр. 200
Домашнее задание: n § 44. упр. № 2, 3 стр. 200

