Epiduralnaya_anestezia.ppt
- Количество слайдов: 116

ЭПИДУРАЛЬНАЯ АНЕСТЕЗИЯ И АНАЛЬГЕЗИЯ: КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ И БЕЗОПАСНОСТЬ

Определение показаний к ЭА n ЭА (при отсутствии противопоказаний) показана в тех случаях, когда планируется ее пролонгация на послеоперационный период n В остальных случая показана спинальная анестезия

Абсолютные противопоказания для ЭА Отказ пациента Без комментариев Недостаточный опыт анестезиолога Без комментариев Наличие гнойничковых поражений кожи в месте пункции Шок Без комментариев Наличие или последствия перенесенных неврологических заболеваний Без комментариев В дальнейшем пациент может связать прогрессирование заболевания с перенесенной анестезией

Относительные противопоказания для ЭА Сепсис с бактериемией Выраженная гиповолемия Инъекция НМГ менее, чем за 10 часов до пункции Выраженная гипокоагуляция, тромбоцитопения Неспособность идентифицировать эпидуральное пространство после 3 -5 попыток При высоком риске общей анестезии возможна ЭА на фоне мощной АБТ При высоком риске общей анестезии возможно проведение ЭА опытным анестезиологом в режиме «step-by-step» Опасность развития эпидуральной гематомы Абсолютно противопоказана при тробоцитопении <50. 000, относительно противопоказана при 50. 000 -100. 000 ?

Оперативные вмешательства, при которых показана продленная ЭА Ортопедия Тотальное эндопротезирование коленного и тазобедренного суставов Урология Аденомэктомия, нефрэктомия, пиелолитотомия, радикальная цистпростатэктомия Абдоминальная хирургия Резекция желудка, гастрэктомия, резекция пищевода, резекция печени, панкреато-дуоденальная резекция, гемиколонэктомия Сердечно-сосудистая Аорто-коронарное

Алгоритм проведения эпидуральной анестезии / анальгезии

Оснащение и препараты Одноразовый набор n Игла Туохи 16 -18 G n Поисковый шприц n Катетер n Бактериальный фильтр n Замок типа Луэр Препараты n Ропивакаин 0, 21% n Бупивакаин 0, 250, 5% n Лидокаин 2% n Фентанил 0, 005% n Морфин 1%
Условия пункции и катетеризации ЭП Операционная n Чистая перевязочная n Палата ОРИТ _________ Наличие оборудования для сердечнолегочной n
Условия пункции и катетеризации ЭП n Измерить АД, ЧСС, ЧД n Обеспечить надежный венозный доступ n Начать инфузию физраствора

Асептика n n Двукратная обработка кожи 0, 5% раствором хлоргексидина в 70% спирте (до и после обкладывания стерильным бельем) Экспозиция 2 минуты Полупроницаемая наклейка Не менять наклейку в течение 4 -х суток (при отсутствии признаков смещения катетера) (Argyra E. // XIII Annual ESRA Congress, Athens, Greece, 8 -11 Sept. 2004)
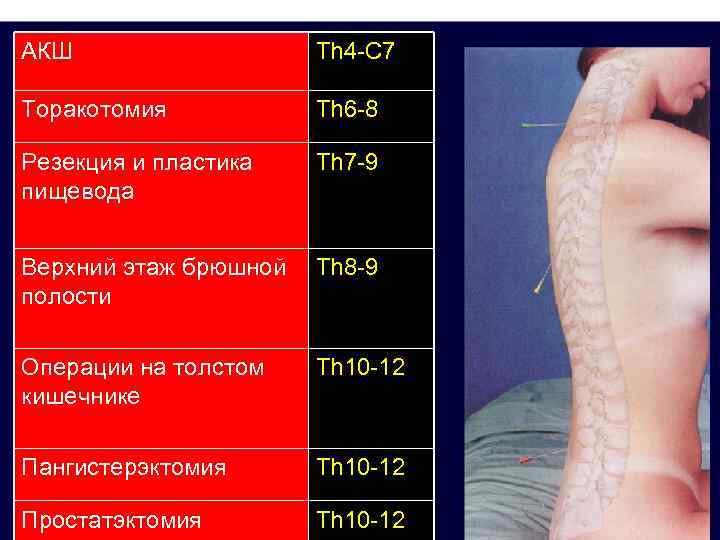
АКШ Th 4 -C 7 Торакотомия Th 6 -8 Резекция и пластика пищевода Th 7 -9 Верхний этаж брюшной полости Th 8 -9 Операции на толстом кишечнике Th 10 -12 Пангистерэктомия Th 10 -12 Простатэктомия Th 10 -12

Осложненная пункция эпидурального пространства – пункция сосуда Вытекающий из иглы Туохи физраствор имеет геморрагическую окраску Ввести в эпидуральное пространство 4 -5 мл физраствора Интенсивность окраски вытекающего раствора убывает – травма мягких тканей Продолжить манипуляцию Сохраняется интенсивное геморрагическое окрашивание – пункция сосуда Удалить иглу Туохи и повторить пункцию на 1 промежуток выше или ниже
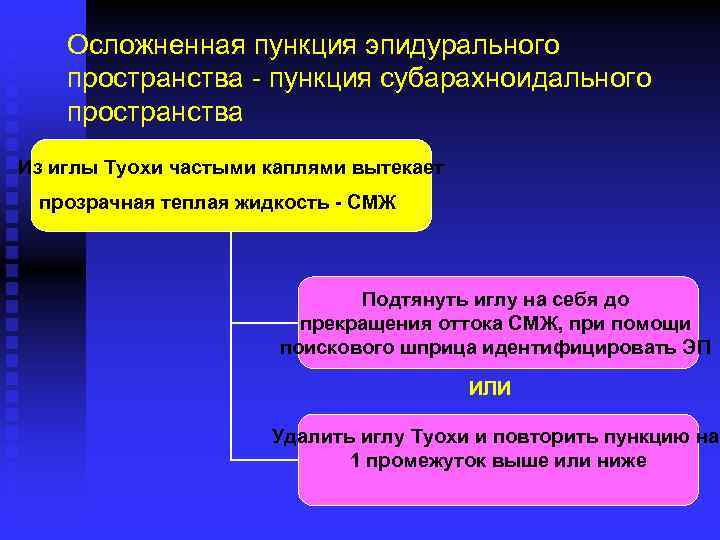
Осложненная пункция эпидурального пространства - пункция субарахноидального пространства Из иглы Туохи частыми каплями вытекает прозрачная теплая жидкость - СМЖ Подтянуть иглу на себя до прекращения оттока СМЖ, при помощи поискового шприца идентифицировать ЭП ИЛИ Удалить иглу Туохи и повторить пункцию на 1 промежуток выше или ниже
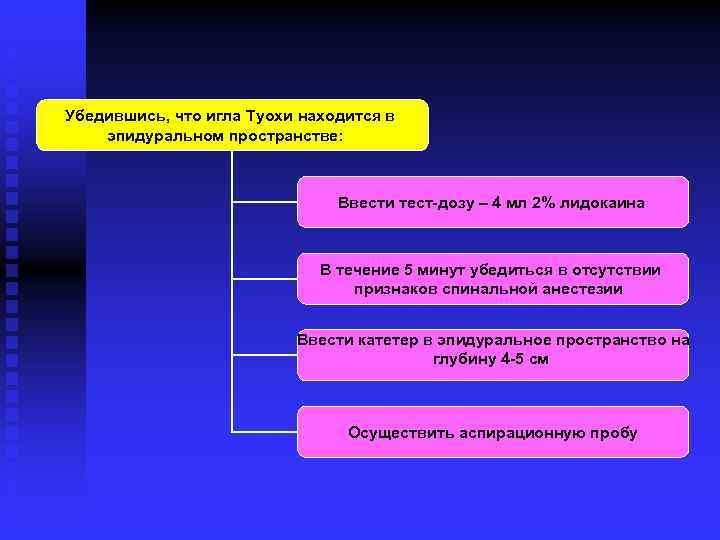
Убедившись, что игла Туохи находится в эпидуральном пространстве: Ввести тест-дозу – 4 мл 2% лидокаина В течение 5 минут убедиться в отсутствии признаков спинальной анестезии Ввести катетер в эпидуральное пространство на глубину 4 -5 см Осуществить аспирационную пробу
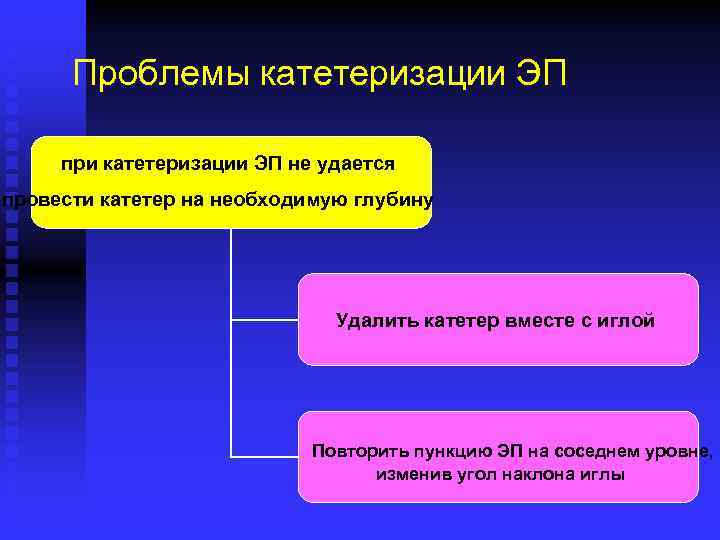
Проблемы катетеризации ЭП при катетеризации ЭП не удается провести катетер на необходимую глубину Удалить катетер вместе с иглой Повторить пункцию ЭП на соседнем уровне, изменив угол наклона иглы
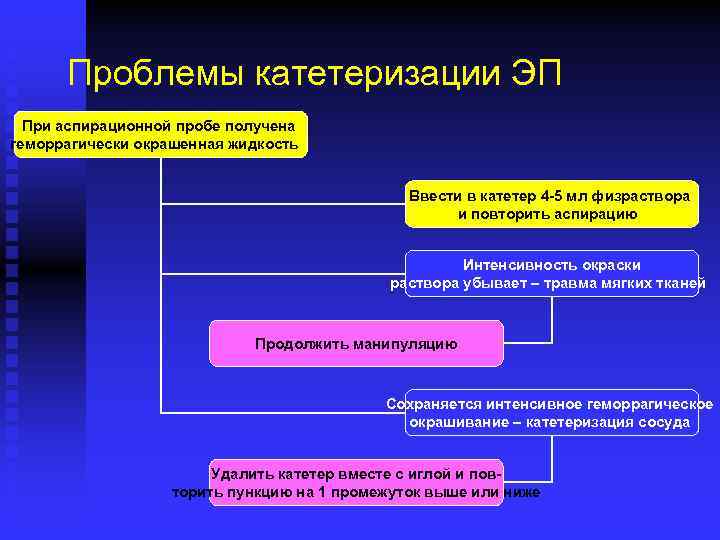
Проблемы катетеризации ЭП При аспирационной пробе получена геморрагически окрашенная жидкость Ввести в катетер 4 -5 мл физраствора и повторить аспирацию Интенсивность окраски раствора убывает – травма мягких тканей Продолжить манипуляцию Сохраняется интенсивное геморрагическое окрашивание – катетеризация сосуда Удалить катетер вместе с иглой и повторить пункцию на 1 промежуток выше или ниже
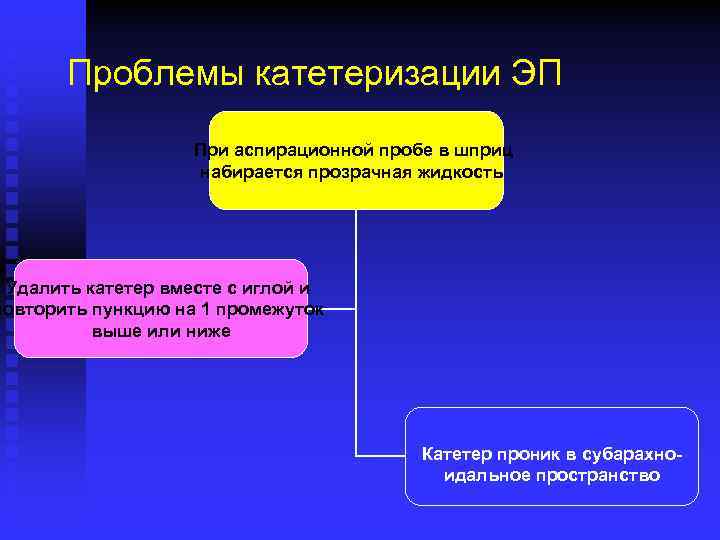
Проблемы катетеризации ЭП При аспирационной пробе в шприц набирается прозрачная жидкость Удалить катетер вместе с иглой и повторить пункцию на 1 промежуток выше или ниже Катетер проник в субарахноидальное пространство
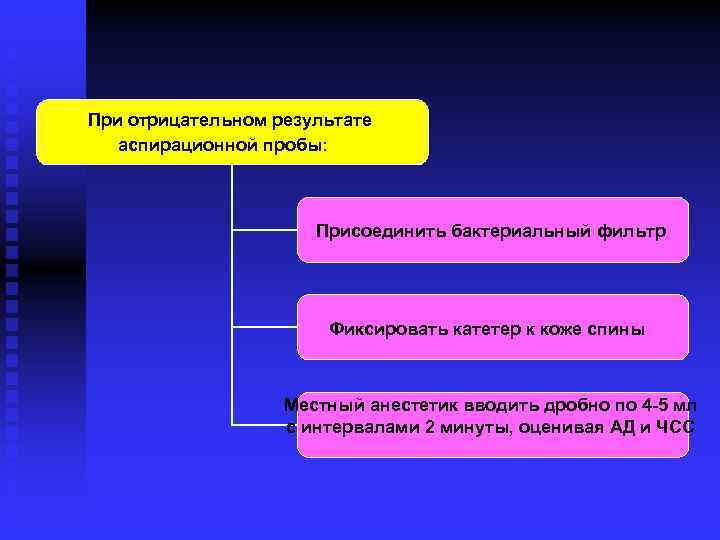
При отрицательном результате аспирационной пробы: Присоединить бактериальный фильтр Фиксировать катетер к коже спины Местный анестетик вводить дробно по 4 -5 мл с интервалами 2 минуты, оценивая АД и ЧСС

Способы фиксации эпидурального катетера
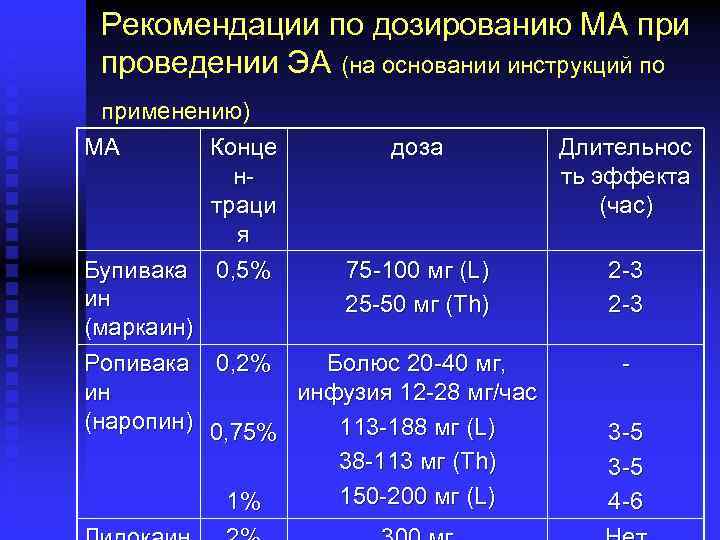
Рекомендации по дозированию МА при проведении ЭА (на основании инструкций по применению) МА Конце доза нтраци я Бупивака 0, 5% 75 -100 мг (L) ин 25 -50 мг (Th) (маркаин) Ропивака 0, 2% Болюс 20 -40 мг, ин инфузия 12 -28 мг/час (наропин) 0, 75% 113 -188 мг (L) 38 -113 мг (Th) 150 -200 мг (L) 1% Длительнос ть эффекта (час) 2 -3 3 -5 4 -6
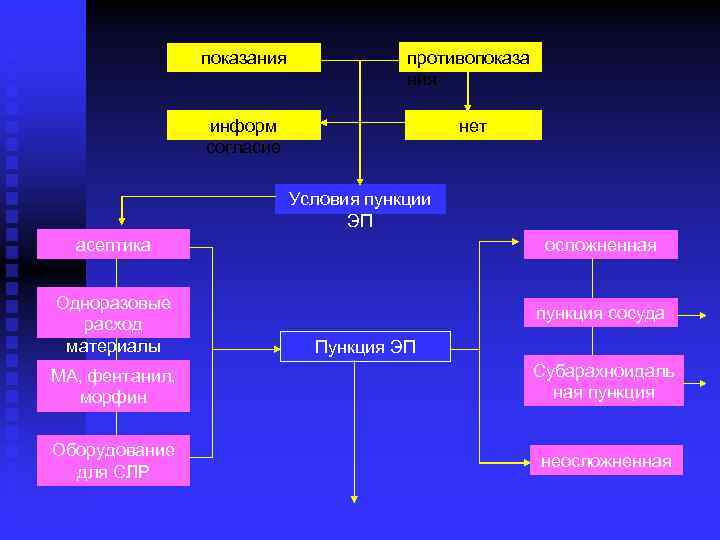
показания противопоказа ния информ согласие нет Условия пункции ЭП асептика Одноразовые расход материалы осложненная пункция сосуда Пункция ЭП МА, фентанил, морфин Субарахноидаль ная пункция Оборудование для СЛР неосложненная
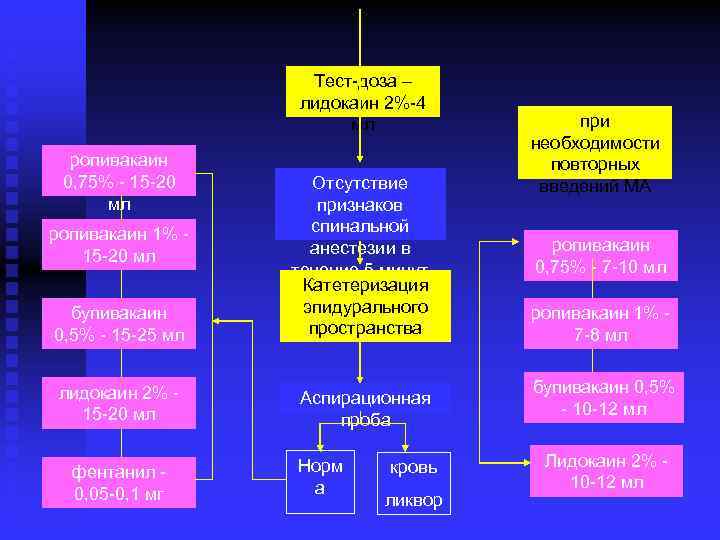
Тест-доза – лидокаин 2%-4 мл ропивакаин 0, 75% - 15 -20 мл бупивакаин 0, 5% - 15 -25 мл Отсутствие признаков спинальной анестезии в течение 5 минут Катетеризация эпидурального пространства лидокаин 2% 15 -20 мл Аспирационная проба ропивакаин 1% 15 -20 мл фентанил 0, 05 -0, 1 мг Норм а кровь ликвор при необходимости повторных введений МА ропивакаин 0, 75% - 7 -10 мл ропивакаин 1% 7 -8 мл бупивакаин 0, 5% - 10 -12 мл Лидокаин 2% 10 -12 мл

Начало длительной послеоперационной ЭА Убедиться в полном восстановлении сознания и появлении боли >3 баллов Убедиться в проходимости и правильном расположении катетера (аспирация, тест-доза Болюсная нагрузочная доза 3 -4 мл 0, 75% наропина или 0, 5% маркаина в грудном отделе и 5 -6 мл в поясничном Подключение мешка с 0, 2% наропином, начало инфузии с необходимой скоростью
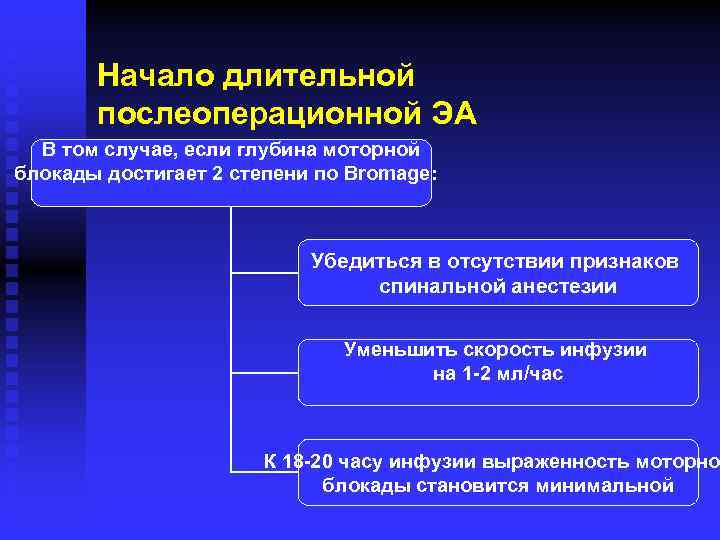
Начало длительной послеоперационной ЭА В том случае, если глубина моторной блокады достигает 2 степени по Bromage: Убедиться в отсутствии признаков спинальной анестезии Уменьшить скорость инфузии на 1 -2 мл/час К 18 -20 часу инфузии выраженность моторно блокады становится минимальной

Длительная послеоперационная ЭА В том случае, если на фоне инфузии сист. АД снижается > 30% от исходного : Уменьшить скорость эпидуральной инфузии на 2 -3 мл/час Расширить объем в/в инфузии и / или добавить вазопрессоры В эпидуральное пространство ввести 1 -2 мл фентанила, разведенного 3 -4 мл физ. р-ра
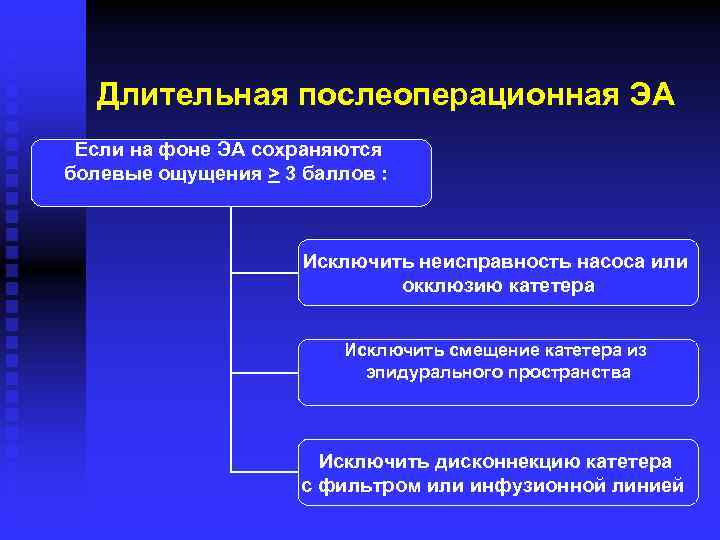
Длительная послеоперационная ЭА Если на фоне ЭА сохраняются болевые ощущения > 3 баллов : Исключить неисправность насоса или окклюзию катетера Исключить смещение катетера из эпидурального пространства Исключить дисконнекцию катетера с фильтром или инфузионной линией

Длительная послеоперационная ЭА При исключении технических проблем и неадекватной ЭА : Увеличить скорость эпидуральной инфузии на 1 -2 мл/час (не более 14 мл/час) Или ввести в эпидуральный катетер 2 мл фентанила в 3 -4 мл физ. р-ра Или ввести в эпидуральный катетер болюс 3 -4 мл 0, 75% наропина

Длительная послеоперационная ЭА В тех случаях, когда болевые ощущения возникают на фоне ранее адекватной ЭА : Исключить технические проблемы Исключить развитие острых хирургических осложнений Ввести в эпидуральный катетер болюс 3 -4 мл 0, 75% наропина
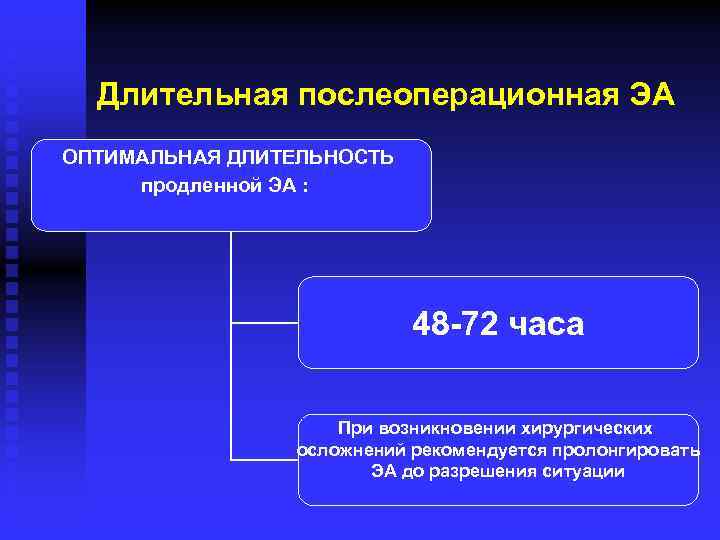
Длительная послеоперационная ЭА ОПТИМАЛЬНАЯ ДЛИТЕЛЬНОСТЬ продленной ЭА : 48 -72 часа При возникновении хирургических осложнений рекомендуется пролонгировать ЭА до разрешения ситуации

мониторинг Интенсивность боли Первые 2 часа инфузии контроль АД и ЧСС каждые 30 минут, затем раз в 2 часа, а также после введения болюсов Каждые 2 -3 часа, а также после введения болюсов Моторная блокада Каждые 2 -3 часа, а также после введения болюсов Гемодинамика

Основные методики грудной эпидуральной анестезии и анальгезии 1. Непрерывная эпидуральная инфузия ропивакаина (2 мг/мл), фентанила (2 мкг/мл) и адреналина (2 мкг/мл), начатая до разреза со скоростью 3 -14 мл/час, пролонгируемая на интра- и послеоперационный период (методика Ниеми-Брейвика) 2. Непрерывная эпидуральная инфузия ропивакаина вышеуказанной смеси (адреналин ±) с периодическими введениями болюсов 0, 375%-0, 5%

Недостатки методики Ниеми. Брейвика n Недостаточная «плотность» сенсорного блока (0, 2% ропивакаин предназначен для послеоперационного обезболивания n Отсутствие эффекта «предупреждающей» анальгезии n Потенциальный риск применения адреналин -содержащих растворов

Основные методики грудной эпидуральной анестезии и анальгезии 3. «Шаговая» индукция эпидурального блока – введение болюсов 0, 5% бупивакаина или 0, 75% ропивакаина (1522, 5 мг) с интервалом 15 -20 минут (суммарно не более 50 мг) + 50 -100 мкг фентанила до кожного разреза. Во время операции – болюсы по 20 -25 мг с интервалом 1, 5 -2 часа ± 50 -100 мкг фентанила. После операции – эпидуральная инфузия 0, 2% ропивакаина

Основные методики грудной эпидуральной анестезии и анальгезии 4. При исходной некорригированной гиповолемии, высоком риске значительной интраоперационной кровопотери эпидуральное введение 50 -100 мкг фентанила до кожного разреза. После окончания основного этапа операции, при условии стабилизации гемодинамики – болюсы 0, 375% ропивакаина по 15 -20 мг, после операции инфузия 0, 2% ропивакаина 6 -10 мл/час + фентанил до 300 мкг/сут

n Факторы, которые необходимо учитывать для достижения максимального влияния ЭА на исходы хирургического лечения. Положительное влияние оказывает ЭА местными анестетиками (в т. ч. в комбинации с опиоидами), но не опиоидами в «чистом» виде n Преждевременное прекращение ЭА снижает до минимума ее позитивный эффект n Целесообразно использовать мультимодальный подход – комбинировать ЭА с в/м или в/в введением НПВС (Wu C. Из доклада на XXIV конгрессе ESRA, Берлин, сентябрь 2005)
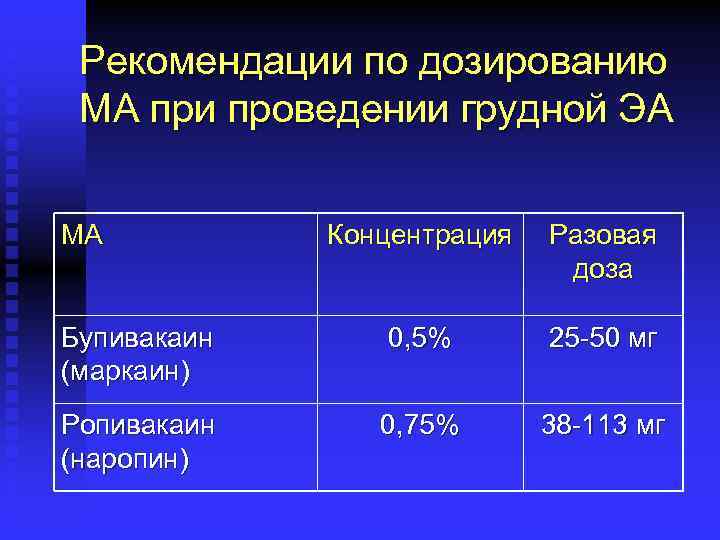
Рекомендации по дозированию МА при проведении грудной ЭА МА Концентрация Разовая доза Бупивакаин (маркаин) 0, 5% 25 -50 мг Ропивакаин (наропин) 0, 75% 38 -113 мг

Сочетанное эпидуральное введение местных анестетиков и опиоидов обеспечивает более высокое качество анестезии и анальгезии, чем раздельное введение тех же препаратов (Доказательства I-го уровня) (Curatolo M et al. // Acta Anaesth. Scand. – 1998 – V. 42 - P. 910920)

Рекомендуемые препараты для продленной эпидуральной анальгезии (Европейские Рекомендации-2005) Местные анестетики + опиоиды Ропивакаин 0, 2% Фентанил Дозы для продленной 4 -12 мл/час (8 0, 1 -0, 3 мг/сут ЭА -24 мг/час) (Postoperative Pain Management – Good Clinical Practice. General recommendations and principles for successful pain management. Project chairman N. Rawal, 2005)

Послеоперационная эпидуральная анальгезия

Мета-анализ 100 контролируемых рандомизированных исследований, посвященных оценке эффективности послеоперационной ЭА n Во всех исследованиях эффективность ЭА достоверно превышала анальгетический эффект внутривенного введения опиоидных анальгетиков (Block B. , Liu S. , Rowlingson A. Efficacy of postoperative epidural analgesia: a meta-analysis. // JAMA. – 2003. – V. 290. – P. 2455 -2463)

Распространение опиоидных анальгетиков при эпидуральном введении Сегментарное – Фентанил Обширное – Морфин

Влияние продленной ЭА на исход хирургического лечения

Влияние ГЭА на исход хирургического лечения (симпозиум 15 -го Всемирного конгресса анестезиологов, Буэнос-Айрес, 30. 03. 12) проф. F. Carli. , Монреаль, Канада проф. O. de Leon. Casasola, Баффало, США проф. A. Alvarez, Буэнос. Айрес, Аргентина проф. H. Van Aken, Mюнстер, Германия

n ГЭА в наибольшей степени отвечает тем требованиям, которые мы предъявляем к послеоперационной На анальгезии фоне ГЭА снижается частота послеоперационных осложнений и летальных исходов n За счет сокращения сроков реабилитации ГЭА снижает расходы на лечение пациентов n Качественная подготовка специалистов и соблюдение протоколов снижают до минимума риск побочных эффектов ГЭА

n Сердечно-сосудистые осложнения являются причиной послеоперационной летальности в 63% случаев у пациентов групп высокого риска и 30% - у групп низкого риска (Bangalore S et al. // Lancet; 2008; 372; 19621976)

• Частота инфарктов миокарда у пациентов с ИБС, перенесших обширные полостные операции, составляет от 4 до 18% ! • Чаще всего инфаркт развивается на 3 -и сутки после операции (Hugo van Aken. “Thoracic epidural anesthesia and analgesia and outcome”, Кейптаун, 2 -7 марта 2008 г )

Необходима функциональная защита кардиомиоцитов, которая требует ограничения периоперационной β-адренергической стимуляции n Общая анестезия с использованием ГЭА в качестве компонента n Послеоперационная продленная ГЭА местными анестетиками + опиоды (Hugo van Aken. “Thoracic epidural anesthesia and analgesia and outcome”, Кейптаун, 2 -7 марта 2008 г )

n n n Расширяет стенозированные коронарные артерии (≈ на 15%). Снижает потребление кислорода миокардом. Снижает частоту случаев ишемии и периоперационных инфарктов миокарда. Улучшает функцию легких и оксигенацию. Улучшает перфузию стенок ЖКТ, моторику желудка и кишечника.

“Грудная эпидуральная анальгезия – не просто способ обезболивания, это эффективное лечебное средство, в особенности у пациентов высокого риска при сердечных, торакальных и абдоминальных операциях”. Президент ЕАА, проф. Hugo van Aken в докладе: “Thoracic epidural anesthesia and analgesia and outcome”

Влияние послеоперационной ЭА на течение послеоперационного периода и летальность в большой хирургии n n n - Анализ за 1997 -2001 гг. , обширные абдоминальные и торакальные операции (68. 273 пациента) Сравнение пациентов, которым проводилась и не проводилась продленная ЭА На фоне ЭА снижение 7–суточной летальности на 48% снижение 30 -суточной летальности на 26% (Wu C et al. , Reg. Anesth. Pain Med. ; 2004; 29; 525 -533)

Анализ влияния послеоперационной ГЭА на летальность пациентов после гемиколонэктомии n Всего 12. 817 пациентов (2. 253 – ГЭА, 10. 564 – опиоидная анальгезия) На фоне ГЭА снижение риска летального исхода: 7 -суточного – на 65% 30 -суточного – на 46% (Wu C et al. // J. Clin. Anesth; 2006; 18; 594 n 599)
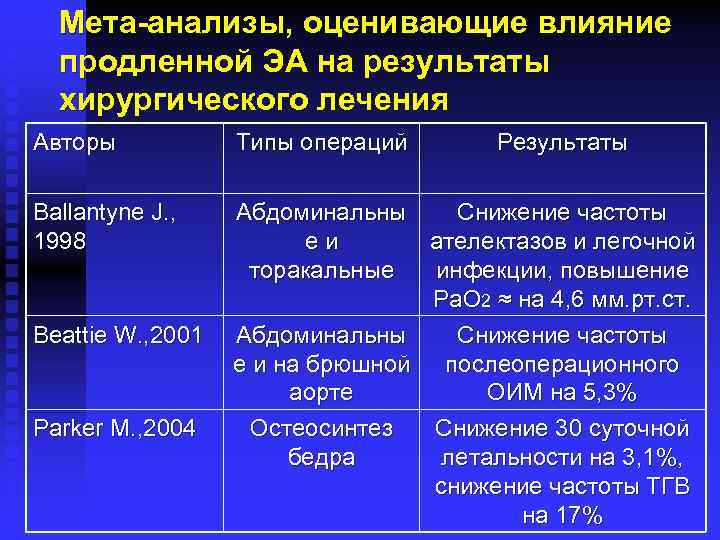
Мета-анализы, оценивающие влияние продленной ЭА на результаты хирургического лечения Авторы Типы операций Ballantyne J. , 1998 Абдоминальны Снижение частоты еи ателектазов и легочной торакальные инфекции, повышение Ра. О 2 ≈ на 4, 6 мм. рт. ст. Абдоминальны Снижение частоты е и на брюшной послеоперационного аорте ОИМ на 5, 3% Остеосинтез Снижение 30 суточной бедра летальности на 3, 1%, снижение частоты ТГВ на 17% Beattie W. , 2001 Parker M. , 2004 Результаты

Респираторные осложнения являются основной причиной послеоперационной летальности пациентов, перенесших операции на легких Только послеоперационная грудная ЭА способна снизить их частоту (Доказательства I-го уровня) (мета-анализ Ballantyne J. // Anesth. Analg. -
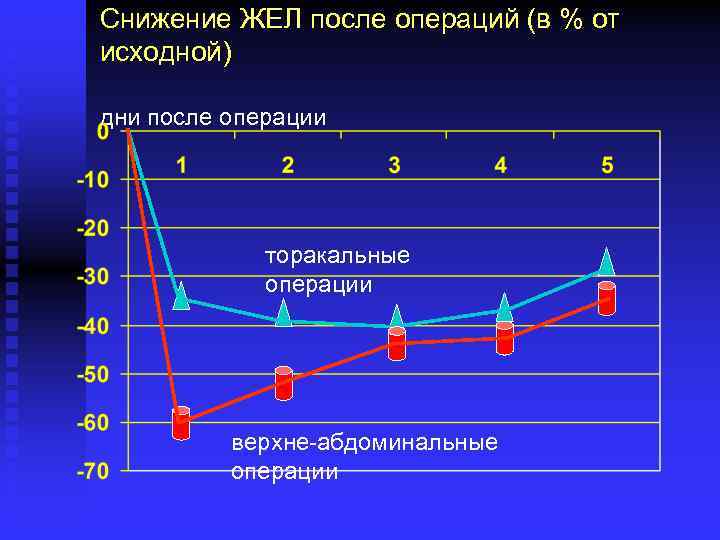
Снижение ЖЕЛ после операций (в % от исходной) дни после операции торакальные операции верхне-абдоминальные операции
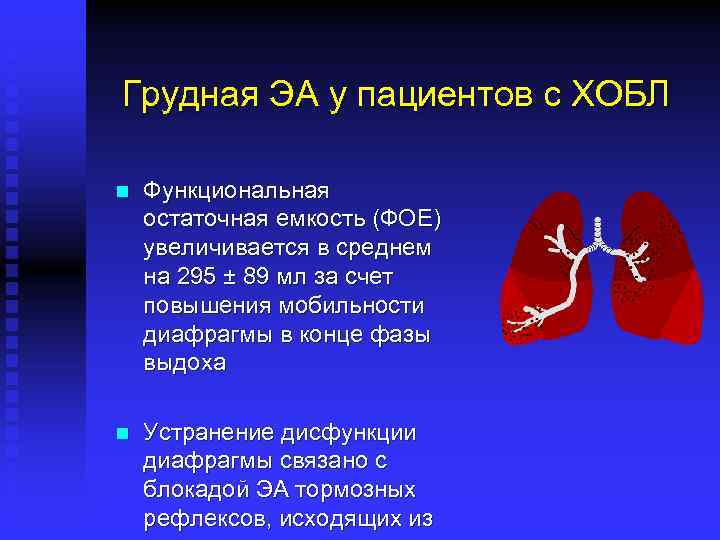
Грудная ЭА у пациентов с ХОБЛ n Функциональная остаточная емкость (ФОЕ) увеличивается в среднем на 295 ± 89 мл за счет повышения мобильности диафрагмы в конце фазы выдоха n Устранение дисфункции диафрагмы связано с блокадой ЭА тормозных рефлексов, исходящих из

Дыхательная система: системное влияние местных анестетиков на регуляцию дыхания n Минимальные плазменные концентрации МА при ЭА (2 -3 мкг/мл) повышают чувствительность дыхательного центра к изменениям СО 2 n Повышение концентрации МА в плазме до 8 мкг/мл снижает реактивность дыхательного центра за счет прямого воздействия на продолговатый мозг n В связи с этим, длительная инфузия МА является более безопасной, чем болюсное введение (Gross. // Anesthesiology, 1983, V. 59, P. 521)

ГЭА с использованием опиоидов у пациентов с ХОБЛ n Угнетение дыхания после эпидурального введения 56 мг морфина имеет 2 -х фазный характер – системный эффект (пик через 30 мин) и краниальное распространение в СМЖ (от 60 мин и более) n Реакция на изменение концентрации СО 2

ГЭА с использованием опиоидов у пациентов с ХОБЛ n После эпидурального введения фентанила реакция дыхательного центра на изменение концентрации СО 2 угнетается на 40%, однако данный эффект длится не более 1 часа n Сочетанное введение фентанила и МА не сопровождается угнетением дыхания, т. к. депрессорный
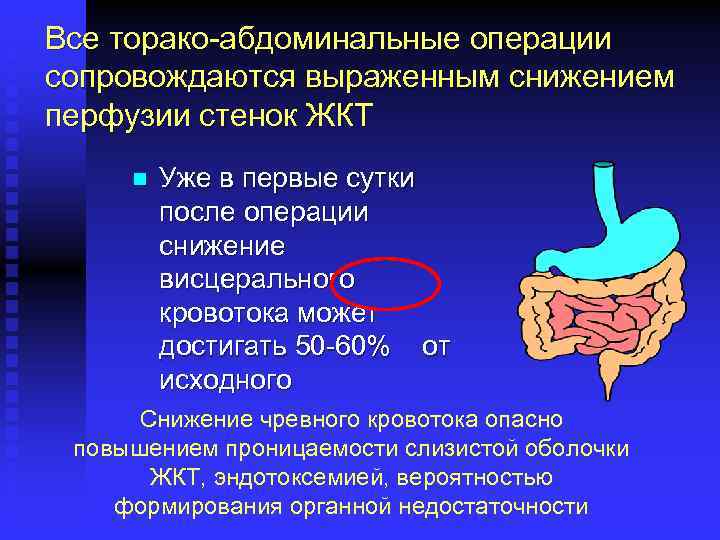
Все торако-абдоминальные операции сопровождаются выраженным снижением перфузии стенок ЖКТ n Уже в первые сутки после операции снижение висцерального кровотока может достигать 50 -60% от исходного Снижение чревного кровотока опасно повышением проницаемости слизистой оболочки ЖКТ, эндотоксемией, вероятностью формирования органной недостаточности
Все торако-абдоминальные операции сопровождаются выраженным снижением перфузии стенок ЖКТ n Снижение висцерального кровотока n ишемия кишечной стенки n транслокация бактериальной микрофлоры n Формирование органной недостаточности
Положительное влияние симпатической блокады при ЭА n Восстановление нормального чревного кровотока за счет симпатической блокады n Восстановление нормального р. Н кишечника и желудка n Предотвращение повышения концентрации эндотоксинов в воротной
Грудная эпидуральная анестезия у пациентов с ИБС n Грудная ЭА обладает кардиопротективным действием n снижает частоту аритмий, перераспределяет кровоток в миокарде в пользу субэндокардиальных
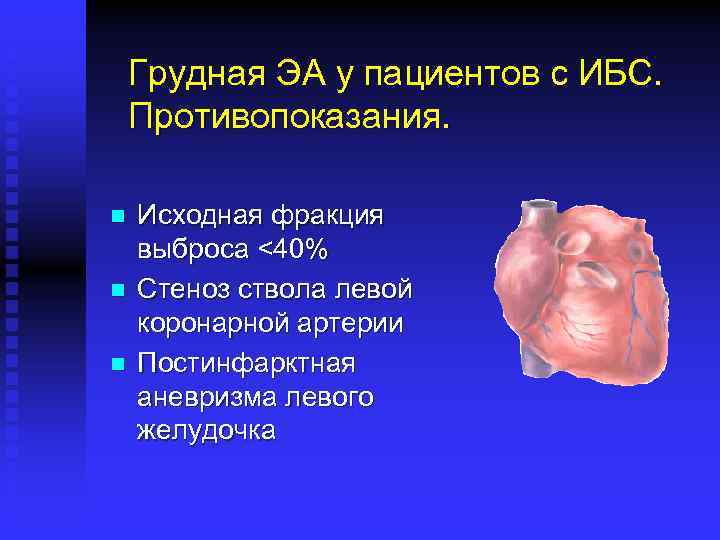
Грудная ЭА у пациентов с ИБС. Противопоказания. n n n Исходная фракция выброса <40% Стеноз ствола левой коронарной артерии Постинфарктная аневризма левого желудочка

n n ГЭА проводилась у 324 из 541 пациентов с ХОБЛ (60%), перенесших обширные абдоминальные операции На фоне ГЭА частота послеоперационной пневмонии составила 11%, без нее – 16% 30 -суточная летальность у пациентов с ГЭА – 5%, без – 9% Наиболее значимый превентивный эффект ГЭА был отмечен у пациентов с тяжелыми формами ХОБЛ

Анализ влияния метода послеоперационного обезболивания на частоту послеоперационной ишемии миокарда у пациентов, оперированных на аорте (Доказательства I-го уровня) n n ЭА > 24 часов. Снижение частоты послеоперационной ишемии миокарда на 44% по сравнению с пациентами, которые получали опиоидные анальгетики Мета-анализ 11 рандомизированных контролируемых исследований (1173 пациента) - Beattie W et al. , // Anesth. Analg. – 2001. - V. 93. - P. 853 -858.

Анализ влияния продленной ЭА на исходы хирургического лечения пациентов в различных подгруппах n Пациенты группы высокого риска (сосудистая хирургия) – снижение летальности на 50% n Пациенты группы более низкого риска (тотальное эндпротезирование тазобедренного сустава) – снижение летальности на 10% n Минимальное влияние ЭА на исход лечения в группах низкого рискадоклада на XXIV конгрессе ESRA, Берлин, и максимальное – в (Wu C. Из группах высокого риска сентябрь 2005)

Влияние продленной эпидуральной анальгезии на исход сосудистых операций n ЭА(Доказательства развитие предотвращает II-го уровня) послеоперационной гиперкоагуляции и частоту тромбозов ауто-венозных шунтов n Увеличивается объемный кровоток в сосудах нижних конечностей n За счет системного действия МА усиливается фибринолиз и тормозится аггрегация тромбоцитов (Christopherson R. et al, 1993 )

Влияние метода анестезии и послеоперационной анальгезии на исходы хирургического лечения в онокологии

онкологических операциях особенно важна периоперационная стабильность иммунного статуса имеются экспериментальные свидетельства увеличения вероятности метастазирования при угнетении иммунитета


Позитивная роль ЭА n Применение сочетанной анестезии с использованием ЭА в качестве компонента позволяет существенно снизить дозы препаратов общей анестезии (в частности, ингаляционных анестетиков и опиоидов) и, таким образом, уменьшить иммуносупрессивное влияние самой анестезии n основной позитивный эффект ЭА заключается в существенном сокращении послеоперационной потребности в опиоидах, угнетающих как клеточное, так и гуморальное звено иммунитета.

n Продемонстрировано 57% снижение частоты рецидивов рака у пациентов, которым проводилась продленная эпидуральная анальгезия после открытой радикальной простатэктомии, в сравнении с пациентами, которые обезболивались системным введением опиоидных анальгетиков n Период наблюдения - от 2, 8 до 12, 8 лет

n Выявлено 4 -х кратное снижение частоты рецидивов у пациенток, оперированных по поводу первичного рака молочной железы в условиях сочетанной анестезии (общая анестезия + паравертебральная блокада с пролонгацией ее на послеоперационный период), в сравнении с пациентами, которые были оперированы в условиях «чистой» общей анестезии, а послеоперационная анальгезия осуществлялась системным введением морфина n Средний период наблюдения – 32 месяца

Использование паравертебрального блока (ПВБ) при операциях мастэктомии плазмы пациенток, n При исследовании in vitro оперированных в условиях паравертебрального блока и седации пропофолом, была выявлена ее способность подавлять пролиферацию раковых клеток, в отличие от плазмы пациенток, которые были оперированы в условиях анестезии севофлюраном и опиоидными анальгетиками. (Exadactylos A et al. // Anesthesiology-2006; 105; 660 -664)
. = существует мнение о предпочтительном использовании тотальной внутривенной анестезии на основе пропофола, а не ингаляционных анестетиков при анестезиологическом обеспечении онкологических операций J. The role of the (Gottschalk A. , Sharma S. , Ford perioperative period in recurrence after cancer surgery. // Anesth. Analg. 2010; 110: 1636 -1643)

n Ретроспективное исследование выявило достоверное снижение летальности в течение 1 -5 лет после операции у пациентов, оперированных по поводу рака прямой кишки и получавших продленную ЭА в раннем послеоперационном периоде, в сравнении с теми, кому проводилась КПА морфином (25% и 34% соответственно) n Не было установлено подобной зависимости у пациентов, оперированных по поводу рака толстого кишечника

Позитивная роль ЭА n ЭА блокирует поток ноцицептивных стимулов из поврежденных тканей, снижая выраженность стрессответа n Модуляция симпатической активности при помощи МА активирует функции клеток-киллеров и иммунную систему в целом n Низкие плазменные концентрации МА снижают концентрацию провоспалительных цитокинов и активируют лимфоцитарный ответ

Является ли поясничная ЭА целесообразным компонентом интенсивной терапии периоперационного периода

n n Мета-анализ 10 исследований (всего 678 пациентов) Общее заключение о позитивном влиянии методик нейроаксиальной анестезии в сравнении с общей на течение интра- и послеоперационного периода при операциях ТЭТС
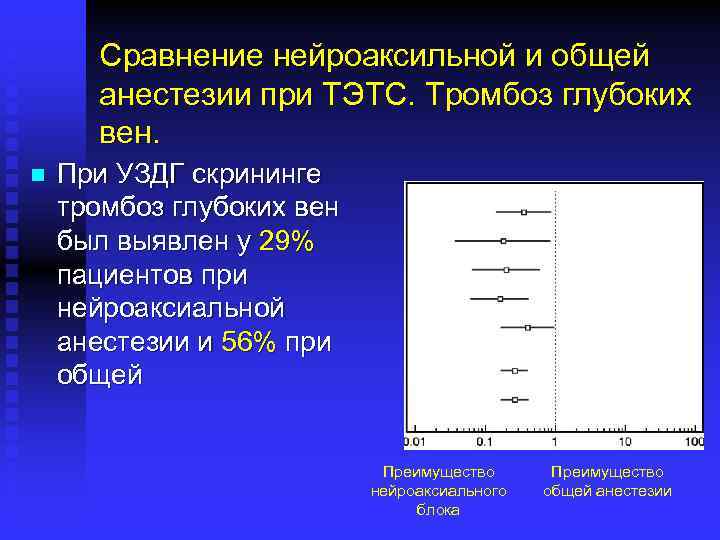
Сравнение нейроаксильной и общей анестезии при ТЭТС. Тромбоз глубоких вен. n При УЗДГ скрининге тромбоз глубоких вен был выявлен у 29% пациентов при нейроаксиальной анестезии и 56% при общей Преимущество нейроаксиального блока Преимущество общей анестезии

Сравнение нейроаксильной и общей анестезии при ТЭТС. ТЭЛА n При радиоизотопных исследованиях тромбоз ветвей легочной артерии был выявлен у 7% пациентов при нейроаксиальной анестезии и 20% при общей Преимущество нейроаксиального блока Преимущество общей анестезии
Продленная ЭА при переломах бедра n ЭА, начатая в предоперационном периоде, снижает частоту периоперационных кардиальных осложнений по сравнению с пациентами, получавшими традиционное обезболивание, в том числе, снижает частоту зарегистрированных эпизодов ишемии миокарда у пациентов пожилого возраста. (Matot I et al. // Anesthesiology. - 2003. – V. 98. – P. 156 -163, Sheinin H et al. // Acta Anaesth. Scand. – 2000. – V. 44. – P. 1061 -1070 )
Продленная ЭА при переломах ребер • При переломах ребер продленная ЭА местными анестетиками по эффективности превосходит блокаду межреберных нервов, а также интраплевральную анальгезию • Грудная ЭА снижает частоту развития пневмоний и потребность перевода на ИВЛ у пациентов с (Mehta et al. , 1998, Debreceni et al. , 2003, множественными доказательства II-го уровня) переломами ребер

ГЭА и риск раневой инфекции
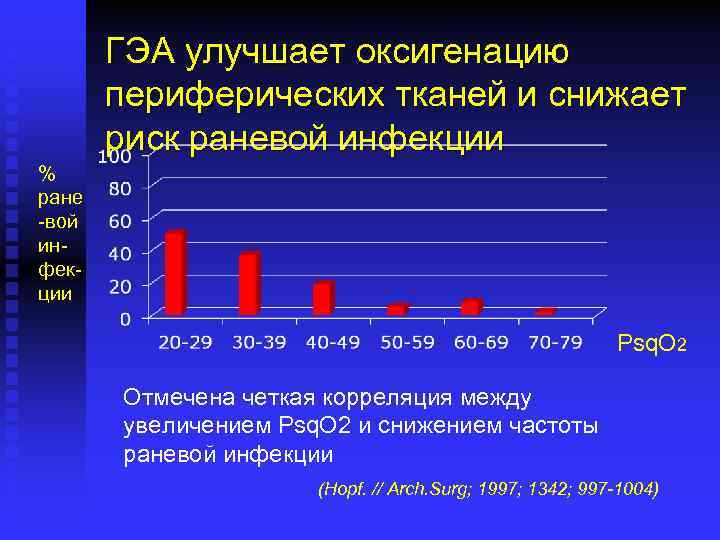
ГЭА улучшает оксигенацию периферических тканей и снижает риск раневой инфекции % ране -вой инфекции Psq. O 2 Отмечена четкая корреляция между увеличением Psq. O 2 и снижением частоты раневой инфекции (Hopf. // Arch. Surg; 1997; 1342; 997 -1004)

n n 3. 081 пациент перенесли операции тотального эндопротезирования тазобедренного или коленного суставов Инфекция послеоперационной раны на протяжении 30 суток наблюдения была отмечена у 2, 8% оперированных под общей анестезией и 1, 2% оперированных в условиях ЭА или СА

Патогенетические основы позитивного влияния ГЭА на риск раневой инфекции n Эффективность окислительного бактериального киллинга, осуществляемого нейтрофилами, полностью зависит от степени оксигенации периферических тканей n Оксигенация периферических тканей определяется характером локального кровотока, парциальным напряжением О 2 в тканях и(Hopf H et al. // Surg. Forum; 1988; 2 33 степенью экстракции О 39; 36)

Патогенетические основы позитивного влияния ГЭА на риск раневой инфекции n Некупированная послеоперационная боль снижает парциальное напряжение О 2 в периферических тканях ≈ на 15 мм. рт. ст. за счет вазоконстрикции n ГЭА увеличивает парциальное напряжение О 2 в периферических тканях ≈ на 15 -20 мм. рт. ст 1999; 354; 41 -42, Treschan (Aksa O et al. // Lancet; T et al. // Anesth. Analg; 2003; 96; 1553 -1557, )

ГЭА и риск раневой инфекции. n ГЭА модулирует эндокринно-метаболический стрессответ (стресс- гормоны являются иммуносупрессорами) n ГЭА за счет вазодилятации повышает парциальное напряжение О 2 в периферических тканях, что создает оптимальные условия для бактериального киллинга n ГЭА обеспечивает адекватную анальгезию, предотвращая симпатически обусловленную вазоконстрикцию и, соответственно, снижение тканевого РО 2(Sessler D. // Anesthesiology; 2010; 113; 265 -267)

Значение продленной ГЭА в комплексной интенсивной терапии тяжелого панкреатита и панкреонекроза Роанн, 27 октября 2006 года

Что определяет исход панкреонекроза ü ü На раннем этапе (до 7 суток) основную роль играет неконтролируемый системный воспалительный гиперответ Позднее – инфицирование поджелудочной железы

Механизмы панкреонекроза n Повышенная капиллярная проницаемость и связанные с ней нарушения микроциркуляции отмечаются уже в первые 2 -е суток заболевания n Мероприятия, направленные на восстановление нормальной микроциркуляции, должны положительно влиять на исход заболевания
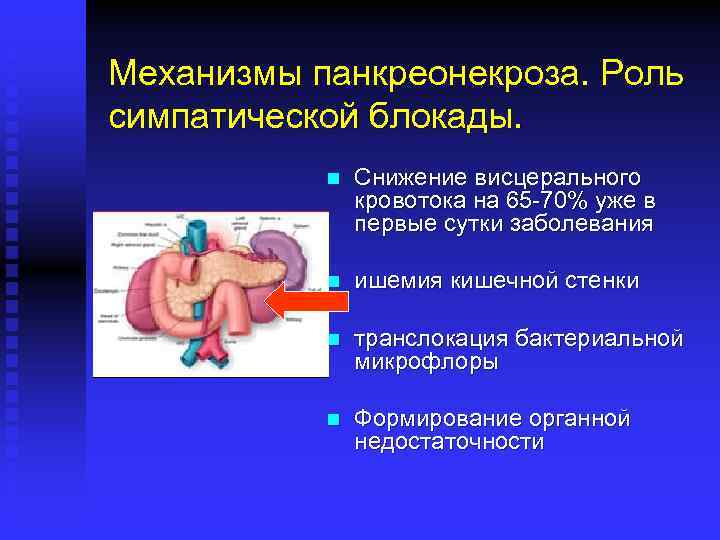
Механизмы панкреонекроза. Роль симпатической блокады. n Снижение висцерального кровотока на 65 -70% уже в первые сутки заболевания n ишемия кишечной стенки n транслокация бактериальной микрофлоры n Формирование органной недостаточности

Одним из основных условий эффективности лечения панкреонекроза является раннее начало адекватной антибактериальной терапии n Эффективная концен -трация антибиотика в железе зависит от степени нарушения капиллярного кровотока в ней n Восстановление нормальной микроцир-куляции – залог успеха АБТ

Оптимальный уровень катетеризации эпидурального пространства при панкреонекрозе – Th 8 -9 c краниальной ориентацией катетера Симпатическая иннервация железы исходит из сегментов Th 5 -11 ü поясничная ЭА вызывает рефлекторную констрикцию чревных сосудов, т. е. ухудшает спланхнический кровоток
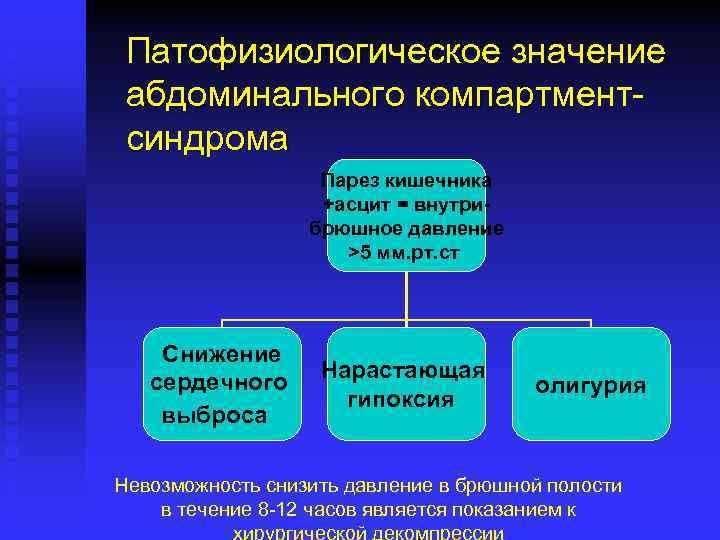
Патофизиологическое значение абдоминального компартментсиндрома Парез кишечника +асцит = внутрибрюшное давление >5 мм. рт. ст Снижение сердечного выброса Нарастающая гипоксия олигурия Невозможность снизить давление в брюшной полости в течение 8 -12 часов является показанием к хирургической декомпрессии

Патофизиологическое значение восстановления нормальной функции ЖКТ при тяжелом панкреатите и панкренекрозе ü Снижение внутрибрюшного давления за счет разрешения пареза и снижения накопления асцитической жидкости ü Восстановление барьерной функции кишечника (снижение вероятности транслокации бактерий и эндотоксинов) ü Возможность раннего начала энтерального питания ü Раннее разрешение абдоминального компартментсиндрома существенно улучшает прогноз заболевания

Оценка эффективности ЭА (121 пациент ОРИТ) из них 16 на ИВЛ (от 2 до 48 суток) n Средний срок пребывания в ОРИТ 12, 4 дня (от 2 до 101) n Прооперировано 36 пациентов (всего 64 операции) n ЭА в «чистом» виде обеспечила прекрасное качество обезболивания на протяжении 1, 083 из 1, 496 дней пребывания данных пациентов в ОРИТ (Bernhardt A. , Kortgen A. , Niesel H. Using epidural anesthesia in patients with acute pancreatitis prospective study of 121 patients. // Anaesthesiol Reanim. – 2002. – V. 27. - P. 16 -22. )

Оценка эффективности ЭА (121 пациент ОРИТ) из них 16 на ИВЛ (от 2 до 48 суток) n Даже у пациентов с тяжелой недостаточностью кровообращения не было отмечено гемодинамических сдвигов, связанных с эпидуральным введением МА n Концентрация амилазы и липазы нормализовалась, в среднем, в течение 17, 4 суток (от 1 до 19) (Bernhardt A. , Kortgen A. , Niesel H. Using epidural anesthesia in patients with acute pancreatitis - n Летальность –patients. // Anaesthesiol Reanim. – 2002. – V. 27. - P. 16 -22. ) prospective study of 121 2, 5% (3 пациента)

Методика продленной ЭА при тяжелом панкреатите и панкреонекрозе 1. Тест – доза – лидокаин 2% - 80 мг (4 мл) 2. В течение 20 -30 минут убедиться в отсутствии субарахноидального блока, стабильности гемодинамики, наличии анальгетического эффекта

Методика продленной ЭА при тяжелом панкреатите и панкреонекрозе n Скорость инфузии – от 4 до 6 мл/час n Минимальное воздействие на гемодинамику n При гипотензии – снизить скорость инфузии, ввести эпидурально 50 мкг (1 мл) фентанила

ПРИКАЗ ДЕПАРТАМЕНТА ЗДРАВООХРАНЕНИЯ Г. МОСКВЫ ОТ 13. 04. 2011 г. N 320 «О единой тактике диагностики и лечения острых хирургических заболеваний органов брюшной полости в лечебно-профилактических учреждениях Департамента здравоохранения г. Москвы» ОСТРЫЙ ПАНКРЕАТИТ. ……. . ЛЕЧЕНИЕ ОСТРОГО ПАНКРЕАТИТА: …… Адекватное обезболивание и борьба с парезом кишечника эффективно обеспечивается продленной эпидуральной анальгезией. Эпидуральное пространство катетеризируется на уровне Th 8 -9. В качестве анестетика целесообразно использование современных препаратов (ропивакаин, бупивакаин). Доза препарата индивидуальна, определяется необходимостью блокады 7 -8 сегментов спинного мозга.
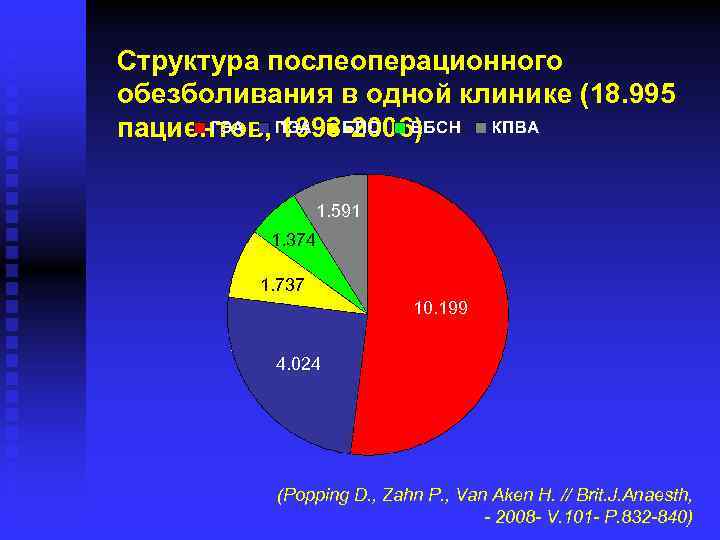
Структура послеоперационного обезболивания в одной клинике (18. 995 пациентов, 1998 -2006) 1. 591 1. 374 1. 737 10. 199 4. 024 (Popping D. , Zahn P. , Van Aken H. // Brit. J. Anaesth, - 2008 - V. 101 - P. 832 -840)
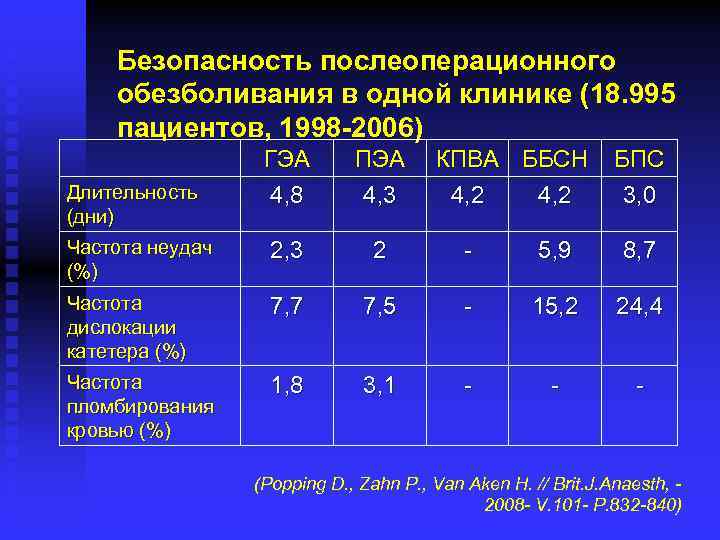
Безопасность послеоперационного обезболивания в одной клинике (18. 995 пациентов, 1998 -2006) ГЭА 4, 8 ПЭА 4, 3 Частота неудач (%) 2, 3 2 - 5, 9 8, 7 Частота дислокации катетера (%) 7, 7 7, 5 - 15, 2 24, 4 Частота пломбирования кровью (%) 1, 8 3, 1 - - - Длительность (дни) КПВА ББСН 4, 2 БПС 3, 0 (Popping D. , Zahn P. , Van Aken H. // Brit. J. Anaesth, 2008 - V. 101 - P. 832 -840)
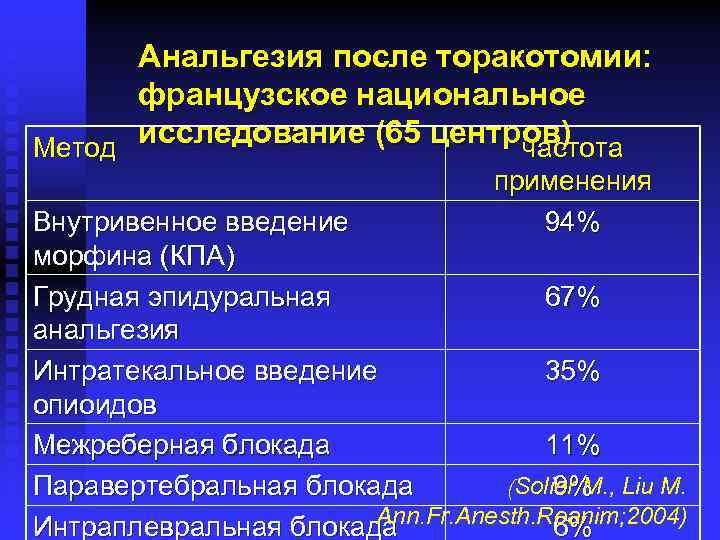
Анальгезия после торакотомии: французское национальное исследование (65 центров) Метод частота применения 94% Внутривенное введение морфина (КПА) Грудная эпидуральная 67% анальгезия Интратекальное введение 35% опиоидов Межреберная блокада 11% (Solier M. , Liu M. Паравертебральная блокада 9% Ann. Fr. Anesth. Reanim; 2004) Интраплевральная блокада 6%
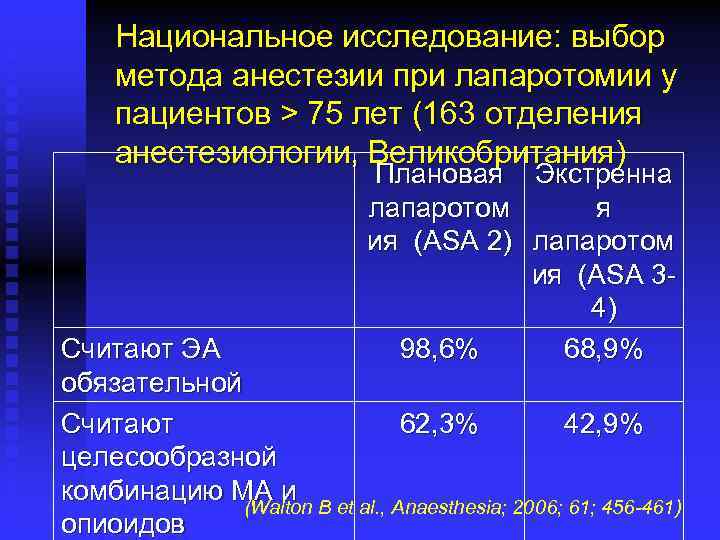
Национальное исследование: выбор метода анестезии при лапаротомии у пациентов > 75 лет (163 отделения анестезиологии, Великобритания) Плановая Экстренна лапаротом я ия (ASA 2) лапаротом ия (ASA 34) 98, 6% 68, 9% Считают ЭА обязательной Считают 62, 3% 42, 9% целесообразной комбинацию МА и (Walton B et al. , Anaesthesia; 2006; 61; 456 -461) опиоидов

ЗАКЛЮЧЕНИЕ n Эпидуральная анестезия и продленная эпидуральная анальгезия является не только и не столько методом обезболивания, в значительной степени данная методика является важнейшим компонентом интенсивной терапии интра- и послеоперационного периода, существенно влияющим на результаты хирургического лечения в

Основные принципы концепции ускоренной хирургической реабилитации. n n n Минимально инвазивная хирургия Отсутствие дренажей и зондов Хенрик Келет, Адекватное профессор, хирург (Копенгаген, Дания) обезболивание Ранняя активизация (Kehlet H. Multimodal approach to control postoperative Раннее начало pathophysiology and rehabilitation. Br. J. Anaesth. 1997; 78: 606 -617)

Средние сроки пребывания пациентов в клинике при использовании методов мультимодальной ускоренной реабилитации 1 -2 дня в клинике 2 -3 дня в клинике Каротидная эндартэктомия Нефрэктомия Резекция легкого Открытая гистерэктомия Радикальная простатэктомия Тотальное эндопротезирование тазобедренного сустава Операции при аневризмах аорты Гемиколонэктомия (Kehlet H. Labat lecture 2005: surgical stress and postoperative outcome – from here to where? // Reg. Anesth. Pain. Med. – 2006. – V. 31. – P. 47 -52. )
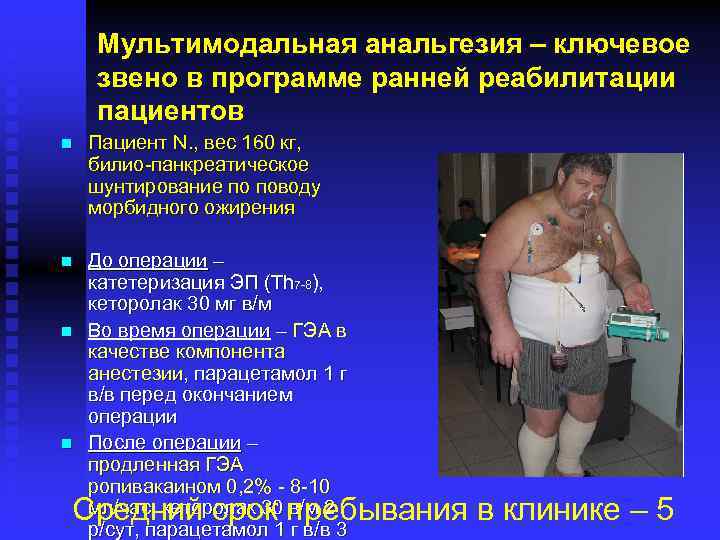
Мультимодальная анальгезия – ключевое звено в программе ранней реабилитации пациентов n Пациент N. , вес 160 кг, билио-панкреатическое шунтирование по поводу морбидного ожирения n До операции – катетеризация ЭП (Th 7 -8), кеторолак 30 мг в/м Во время операции – ГЭА в качестве компонента анестезии, парацетамол 1 г в/в перед окончанием операции После операции – продленная ГЭА ропивакаином 0, 2% - 8 -10 мл/час, кеторолак 30 в/м 2 р/сут, парацетамол 1 г в/в 3 n n Средний срок пребывания в клинике – 5

Мифы грудной эпидуральной анестезии Миф № 1 – «ЭА на грудном уровне технически сложна и сопряжена с высоким процентом неудач» n Частота неудач при высокой пункции эпидурального пространства не > 1% и сопоставима с аналогичным показателем других блокад (Giebler R. // Anesthesiology – 1997 - V. 86 – P. 55 -63)

Мифы грудной эпидуральной анестезии Миф № 2 – «грудная ЭА сопряжена с высоким риском повреждения твердой мозговой оболочки» n n Анализ 4. 000 ГЭА – ни одного неврологического осложнения Анализ 4. 000 ГЭА – 0, 72% случаев повреждения ТМО (Giebler R. // Anesthesiology – 1997 - V. 86 – P. 55 -63)
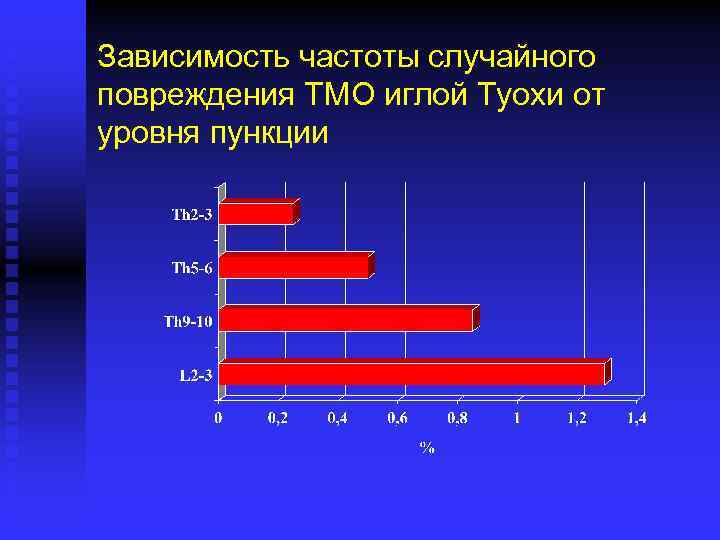
Зависимость частоты случайного повреждения ТМО иглой Туохи от уровня пункции

«Яд в руках специалиста является лекарством. Лекарство в руках дурака является ядом» . Джакомо Казанова (1725 -1798)

Человеческий фактор как основа безопасности n Анализируя любое осложнение регионарной анестезии – прежде всего посмотрите, кто находился на тупом конце иглы Alon P. Winnie

Спасибо за внимание!
Epiduralnaya_anestezia.ppt