lecture_5_komplement.ppt
- Количество слайдов: 32
 Енергія зв’язування знижує енергію активації переходу з константою швидкості
Енергія зв’язування знижує енергію активації переходу з константою швидкості
 Комплементарність між ферментом і субстратом • Коли кожна зв’язуюча група субстрату з'єднується з відповідним центром зв'язування ферменту, енергія зв'язування приймає максимальне значення. У цьому випадку говорять, що фермент і субстрат структурно комплементарні. • Структура субстрату змінюється в ході реакції, але структура недеформованого ферменту може бути комплементарна тільки одній формі субстрату.
Комплементарність між ферментом і субстратом • Коли кожна зв’язуюча група субстрату з'єднується з відповідним центром зв'язування ферменту, енергія зв'язування приймає максимальне значення. У цьому випадку говорять, що фермент і субстрат структурно комплементарні. • Структура субстрату змінюється в ході реакції, але структура недеформованого ферменту може бути комплементарна тільки одній формі субстрату.
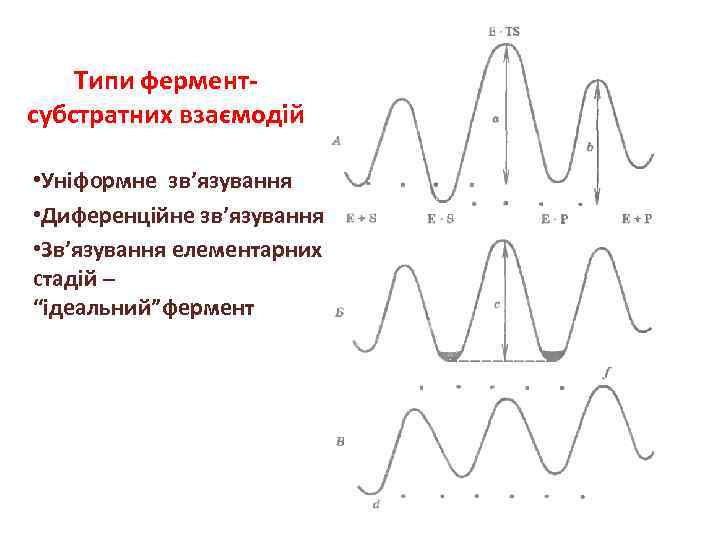 Типи ферментсубстратних взаємодій • Уніформне зв’язування • Диференційне зв’язування • Зв’язування елементарних стадій – “ідеальний”фермент
Типи ферментсубстратних взаємодій • Уніформне зв’язування • Диференційне зв’язування • Зв’язування елементарних стадій – “ідеальний”фермент
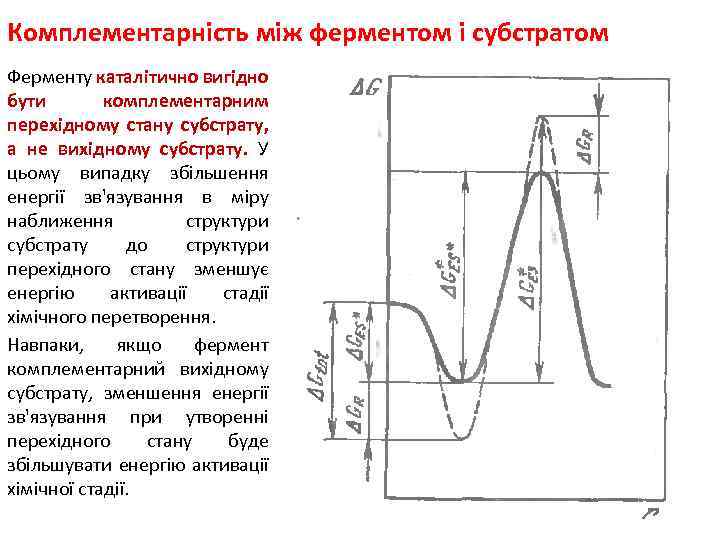 Комплементарність між ферментом і субстратом Ферменту каталітично вигідно бути комплементарним перехідному стану субстрату, а не вихідному субстрату. У цьому випадку збільшення енергії зв'язування в міру наближення структури субстрату до структури перехідного стану зменшує енергію активації стадії хімічного перетворення. Навпаки, якщо фермент комплементарний вихідному субстрату, зменшення енергії зв'язування при утворенні перехідного стану буде збільшувати енергію активації хімічної стадії.
Комплементарність між ферментом і субстратом Ферменту каталітично вигідно бути комплементарним перехідному стану субстрату, а не вихідному субстрату. У цьому випадку збільшення енергії зв'язування в міру наближення структури субстрату до структури перехідного стану зменшує енергію активації стадії хімічного перетворення. Навпаки, якщо фермент комплементарний вихідному субстрату, зменшення енергії зв'язування при утворенні перехідного стану буде збільшувати енергію активації хімічної стадії.
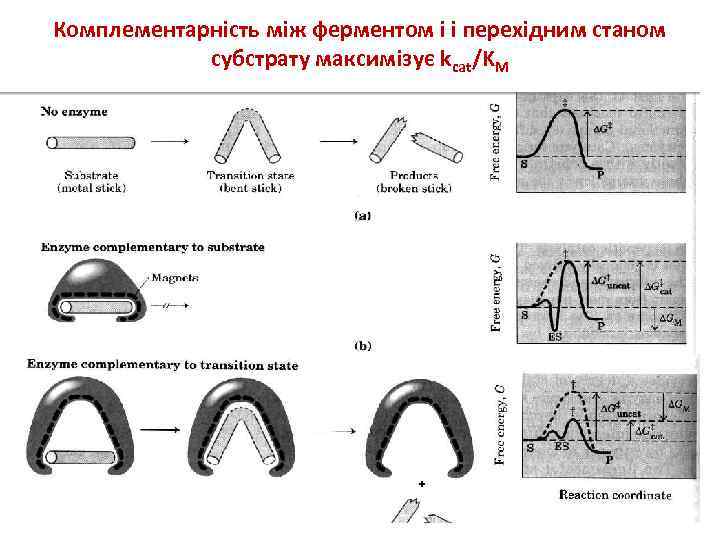 Комплементарність між ферментом і і перехідним станом субстрату максимізує kcat/KM
Комплементарність між ферментом і і перехідним станом субстрату максимізує kcat/KM
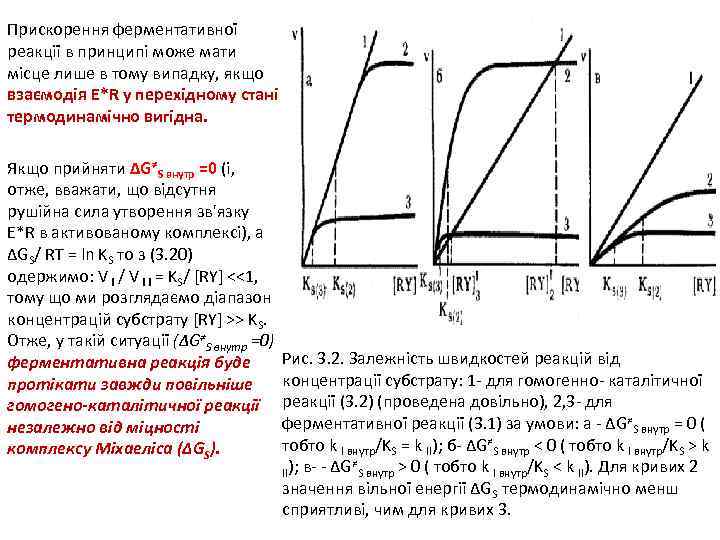 Прискорення ферментативної реакції в принципі може мати місце лише в тому випадку, якщо взаємодія E*R у перехідному стані термодинамічно вигідна. Якщо прийняти ΔG≠S внутр =0 (і, отже, вважати, що відсутня рушійна сила утворення зв'язку E*R в активованому комплексі), а ΔGS/ RT = ln KS то з (3. 20) одержимо: V I / V I I = KS/ [RY] <<1, тому що ми розглядаємо діапазон концентрацій субстрату [RY] >> KS. Отже, у такій ситуації (ΔG≠S внутр =0) ферментативна реакція буде протікати завжди повільніше гомогено-каталітичної реакції незалежно від міцності комплексу Міхаеліса (ΔGS). Рис. 3. 2. Залежність швидкостей реакцій від концентрації субстрату: 1 - для гомогенно- каталітичної реакції (3. 2) (проведена довільно), 2, 3 - для ферментативної реакції (3. 1) за умови: а - ΔG≠S внутр = 0 ( тобто k I внутр/KS = k II); б- ΔG≠S внутр < 0 ( тобто k I внутр/KS > k ≠ II); в- - ΔG S внутр > 0 ( тобто k I внутр/KS < k II). Для кривих 2 значення вільної енергії ΔGS термодинамічно менш сприятливі, чим для кривих 3.
Прискорення ферментативної реакції в принципі може мати місце лише в тому випадку, якщо взаємодія E*R у перехідному стані термодинамічно вигідна. Якщо прийняти ΔG≠S внутр =0 (і, отже, вважати, що відсутня рушійна сила утворення зв'язку E*R в активованому комплексі), а ΔGS/ RT = ln KS то з (3. 20) одержимо: V I / V I I = KS/ [RY] <<1, тому що ми розглядаємо діапазон концентрацій субстрату [RY] >> KS. Отже, у такій ситуації (ΔG≠S внутр =0) ферментативна реакція буде протікати завжди повільніше гомогено-каталітичної реакції незалежно від міцності комплексу Міхаеліса (ΔGS). Рис. 3. 2. Залежність швидкостей реакцій від концентрації субстрату: 1 - для гомогенно- каталітичної реакції (3. 2) (проведена довільно), 2, 3 - для ферментативної реакції (3. 1) за умови: а - ΔG≠S внутр = 0 ( тобто k I внутр/KS = k II); б- ΔG≠S внутр < 0 ( тобто k I внутр/KS > k ≠ II); в- - ΔG S внутр > 0 ( тобто k I внутр/KS < k II). Для кривих 2 значення вільної енергії ΔGS термодинамічно менш сприятливі, чим для кривих 3.
 • Якщо ж ΔG≠Sвнутр<0 (і отже, перехідний стан ферментативної реакції стабілізований зв'язком E*R), з (3. 20) випливає, що завжди існує такий інтервал концентрацій субстрату [RY], у якому VI/VII >1, тобто, ферментативний процес протікає швидше гомогеннокаталітичної реакції. Однак, сприяючі каталізу значення [RY] не повинні бути занадто великими, як видно з рівняння (3. 20), причому верхня границя цього інтервалу дана значенням [RY]`= exp[(ΔG≠S-ΔG≠Sвнутр )/ RT] при якому VI/VII =1 (мал. 3. 2 б). • З іншого боку, утворення зв'язку E*R не в перехідному стані, а у вихідному (у комплексі Міхаеліса XE*RY) відіграє негативну роль у каталізі: чим міцніший ферментсубстратний комплекс (чим більш негативні значення приймає величина ΔGS), тим менше значення [RY]`, рівне концентрації, до якої ферментативний процес (3. 1) по швидкості превалює над гомогеннокаталітичною реакцією (3. 2), і тим менший, як видно з (3. 20), сам ефект прискорення.
• Якщо ж ΔG≠Sвнутр<0 (і отже, перехідний стан ферментативної реакції стабілізований зв'язком E*R), з (3. 20) випливає, що завжди існує такий інтервал концентрацій субстрату [RY], у якому VI/VII >1, тобто, ферментативний процес протікає швидше гомогеннокаталітичної реакції. Однак, сприяючі каталізу значення [RY] не повинні бути занадто великими, як видно з рівняння (3. 20), причому верхня границя цього інтервалу дана значенням [RY]`= exp[(ΔG≠S-ΔG≠Sвнутр )/ RT] при якому VI/VII =1 (мал. 3. 2 б). • З іншого боку, утворення зв'язку E*R не в перехідному стані, а у вихідному (у комплексі Міхаеліса XE*RY) відіграє негативну роль у каталізі: чим міцніший ферментсубстратний комплекс (чим більш негативні значення приймає величина ΔGS), тим менше значення [RY]`, рівне концентрації, до якої ферментативний процес (3. 1) по швидкості превалює над гомогеннокаталітичною реакцією (3. 2), і тим менший, як видно з (3. 20), сам ефект прискорення.
 Докази на користь концепції стабілізації перехідного стану • Оцінки повної енергії ES взаємодії звичайно значно перевищують визначені зміни повної енергії комплексоутворення ; • Показано, що в серії субстратів змінюється каталітична константа при практично постійному значенні Ks (пепсин); • Направлений мутагенез груп, що беруть участь в зв’язуванні субстрата часто впливає не на зв’язування, а на каталіз (тирозил-т. РНКсинтетаза); • Інгібітори – аналоги перехідних станів характеризуються аномальними низькими значеннями Ki (алкілборні кислоти)
Докази на користь концепції стабілізації перехідного стану • Оцінки повної енергії ES взаємодії звичайно значно перевищують визначені зміни повної енергії комплексоутворення ; • Показано, що в серії субстратів змінюється каталітична константа при практично постійному значенні Ks (пепсин); • Направлений мутагенез груп, що беруть участь в зв’язуванні субстрата часто впливає не на зв’язування, а на каталіз (тирозил-т. РНКсинтетаза); • Інгібітори – аналоги перехідних станів характеризуються аномальними низькими значеннями Ki (алкілборні кислоти)

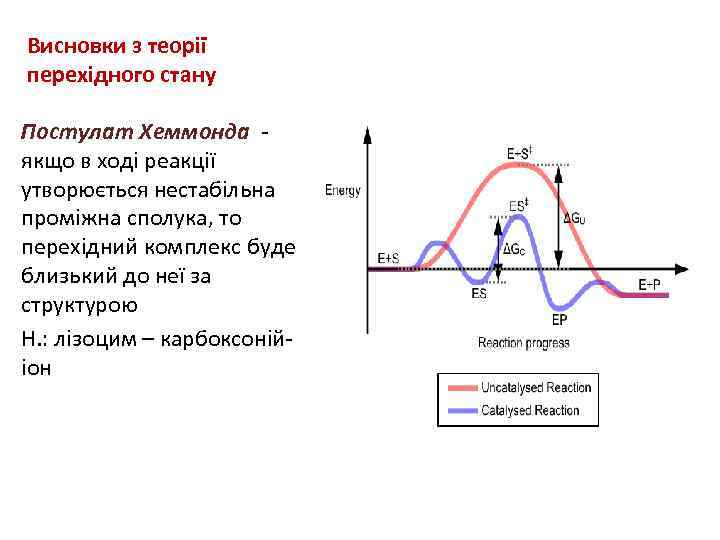 Висновки з теорії перехідного стану Постулат Хеммонда - якщо в ході реакції утворюється нестабільна проміжна сполука, то перехідний комплекс буде близький до неї за структурою Н. : лізоцим – карбоксоній- іон
Висновки з теорії перехідного стану Постулат Хеммонда - якщо в ході реакції утворюється нестабільна проміжна сполука, то перехідний комплекс буде близький до неї за структурою Н. : лізоцим – карбоксоній- іон
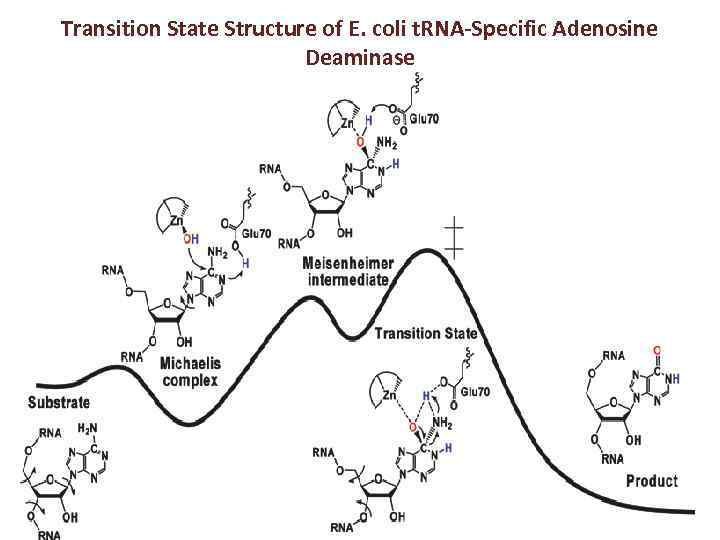 Transition State Structure of E. coli t. RNA-Specific Adenosine Deaminase
Transition State Structure of E. coli t. RNA-Specific Adenosine Deaminase
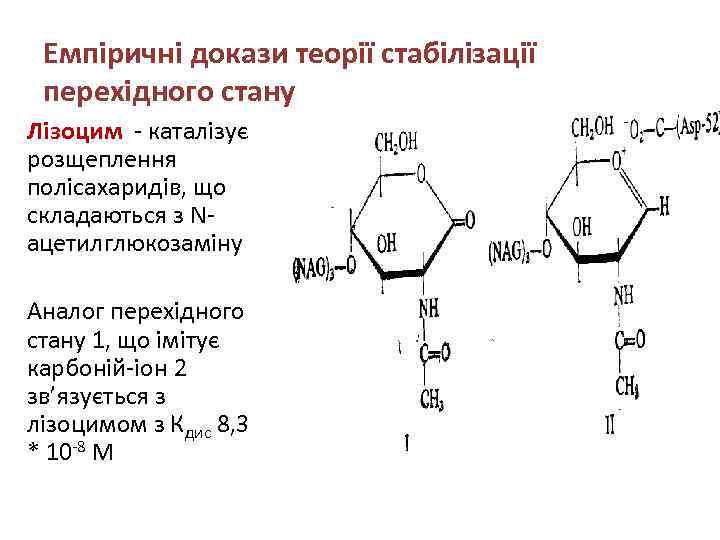 Емпіричні докази теорії стабілізації перехідного стану Лізоцим - каталізує розщеплення полісахаридів, що складаються з Nацетилглюкозаміну Аналог перехідного стану 1, що імітує карбоній-іон 2 зв’язується з лізоцимом з Кдис 8, 3 * 10 -8 М
Емпіричні докази теорії стабілізації перехідного стану Лізоцим - каталізує розщеплення полісахаридів, що складаються з Nацетилглюкозаміну Аналог перехідного стану 1, що імітує карбоній-іон 2 зв’язується з лізоцимом з Кдис 8, 3 * 10 -8 М
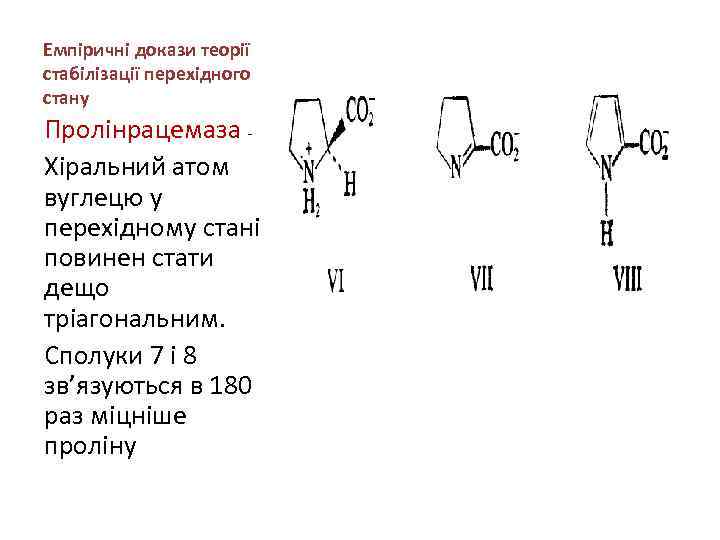 Емпіричні докази теорії стабілізації перехідного стану Пролінрацемаза - Хіральний атом вуглецю у перехідному стані повинен стати дещо тріагональним. Сполуки 7 і 8 зв’язуються в 180 раз міцніше проліну
Емпіричні докази теорії стабілізації перехідного стану Пролінрацемаза - Хіральний атом вуглецю у перехідному стані повинен стати дещо тріагональним. Сполуки 7 і 8 зв’язуються в 180 раз міцніше проліну
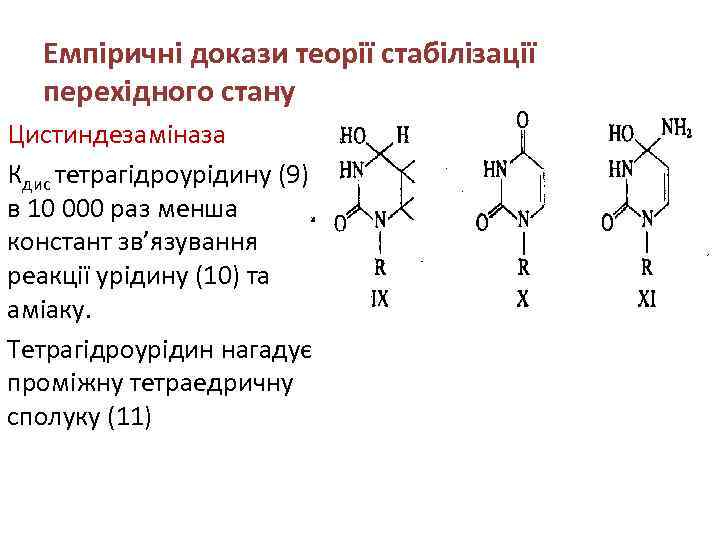 Емпіричні докази теорії стабілізації перехідного стану Цистиндезаміназа Кдис тетрагідроурідину (9) в 10 000 раз менша констант зв’язування реакції урідину (10) та аміаку. Тетрагідроурідин нагадує проміжну тетраедричну сполуку (11)
Емпіричні докази теорії стабілізації перехідного стану Цистиндезаміназа Кдис тетрагідроурідину (9) в 10 000 раз менша констант зв’язування реакції урідину (10) та аміаку. Тетрагідроурідин нагадує проміжну тетраедричну сполуку (11)
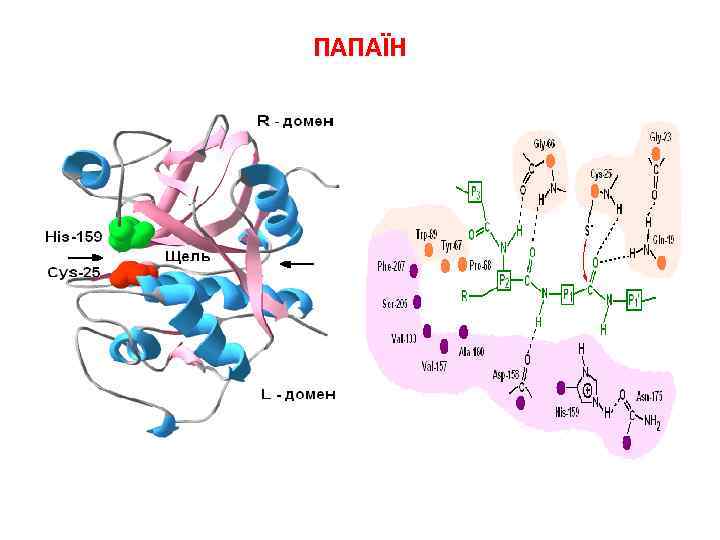 ПАПАЇН
ПАПАЇН
 Суперечності в теорії стабілізації перехідного стану 1. Стабілізація перехідного стану вимагає утворення нових взаємодій між Е і S, відсутніх у основному стані, що вимагає конформаційних змін ферменту або переорієнтації ряду груп ферменту Утворення перехідного стану -10 -12 -10 -13 с Конформаційні зміни у білку – 10 -6 -10 -4 с Осциляція ? Синхронізація?
Суперечності в теорії стабілізації перехідного стану 1. Стабілізація перехідного стану вимагає утворення нових взаємодій між Е і S, відсутніх у основному стані, що вимагає конформаційних змін ферменту або переорієнтації ряду груп ферменту Утворення перехідного стану -10 -12 -10 -13 с Конформаційні зміни у білку – 10 -6 -10 -4 с Осциляція ? Синхронізація?
 Суперечності в теорії стабілізації перехідного стану 2. Стабілізація перехідного стану вимагає використання енергії дестабілізації основного стану. Виграш енергії і її використання відбувається не різних стадіях процесу – вимагає існування механізмів “запасання” енергії в ході каталітичного акту Білок – пружне тіло, неоднорідне по густині? Активний центр – ділянка з найменшою густиною?
Суперечності в теорії стабілізації перехідного стану 2. Стабілізація перехідного стану вимагає використання енергії дестабілізації основного стану. Виграш енергії і її використання відбувається не різних стадіях процесу – вимагає існування механізмів “запасання” енергії в ході каталітичного акту Білок – пружне тіло, неоднорідне по густині? Активний центр – ділянка з найменшою густиною?
 Суперечності в теорії стабілізації перехідного стану • Важко пояснити постійність величин Ks в серіях субстратів, що сильно різняться за числом можливих контактів з ферментом Н. : субстрати пепсину Чим більше число взаємодій в основному стані – тим менша частина енергії використовується на стадії перехідного стану (що спостерігалось у ациламінокислот – субстратів хімотрипсину – пропорційність спорідненості і швидкості каталізу до гідрофобності )
Суперечності в теорії стабілізації перехідного стану • Важко пояснити постійність величин Ks в серіях субстратів, що сильно різняться за числом можливих контактів з ферментом Н. : субстрати пепсину Чим більше число взаємодій в основному стані – тим менша частина енергії використовується на стадії перехідного стану (що спостерігалось у ациламінокислот – субстратів хімотрипсину – пропорційність спорідненості і швидкості каталізу до гідрофобності )
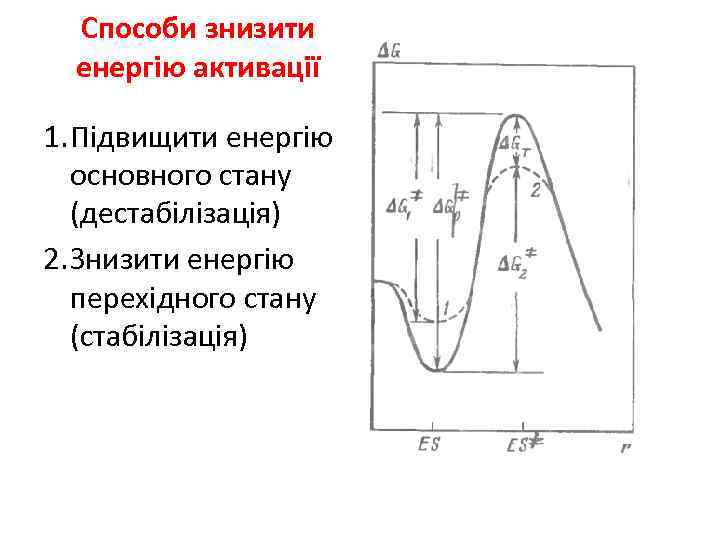 Способи знизити енергію активації 1. Підвищити енергію основного стану (дестабілізація) 2. Знизити енергію перехідного стану (стабілізація)
Способи знизити енергію активації 1. Підвищити енергію основного стану (дестабілізація) 2. Знизити енергію перехідного стану (стабілізація)
 Співвідношення між каталітичними константами і константою Міхаеліса 1. Незалежні зміни 2. “Краще зв’язування – кращий каталіз” 3. “Гірше зв’язування – кращий каталіз”
Співвідношення між каталітичними константами і константою Міхаеліса 1. Незалежні зміни 2. “Краще зв’язування – кращий каталіз” 3. “Гірше зв’язування – кращий каталіз”
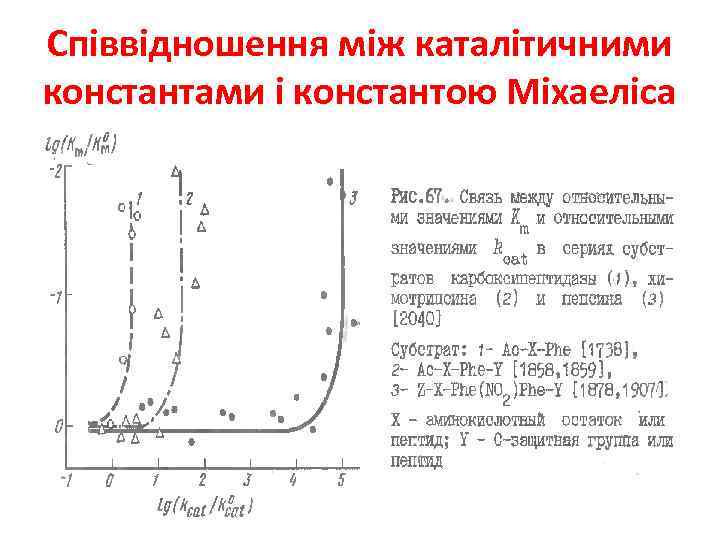 Співвідношення між каталітичними константами і константою Міхаеліса
Співвідношення між каталітичними константами і константою Міхаеліса
 Принцип максимізації КМ при постійному kcat/KM
Принцип максимізації КМ при постійному kcat/KM
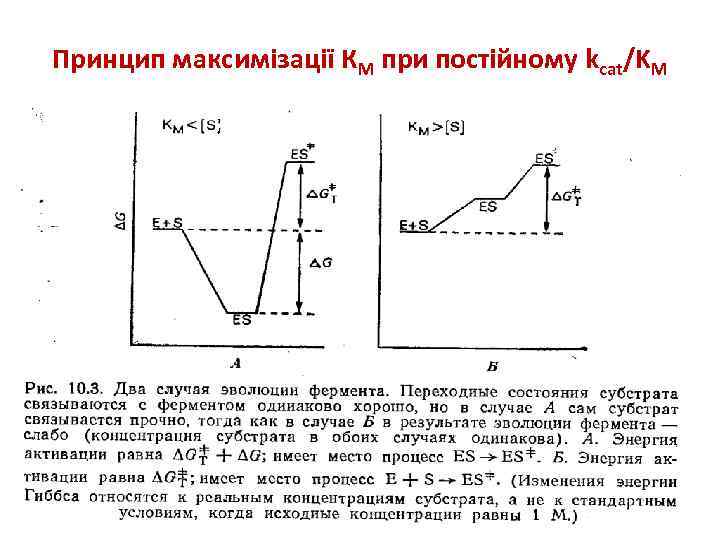 Принцип максимізації КМ при постійному kcat/KM
Принцип максимізації КМ при постійному kcat/KM
 NB!!! • Принцип максимізації КМ при постійному kcat/KM не завжди спостерігається для регуляторних ферментів, активність яких регулюється шляхом зміни КМ відповідних субстратів через алостеричні впливи Н. : КМ глюкози для гексокінази 0, 1 м. М, концентрація глюкози в еритроцитах 5 м. М
NB!!! • Принцип максимізації КМ при постійному kcat/KM не завжди спостерігається для регуляторних ферментів, активність яких регулюється шляхом зміни КМ відповідних субстратів через алостеричні впливи Н. : КМ глюкози для гексокінази 0, 1 м. М, концентрація глюкози в еритроцитах 5 м. М
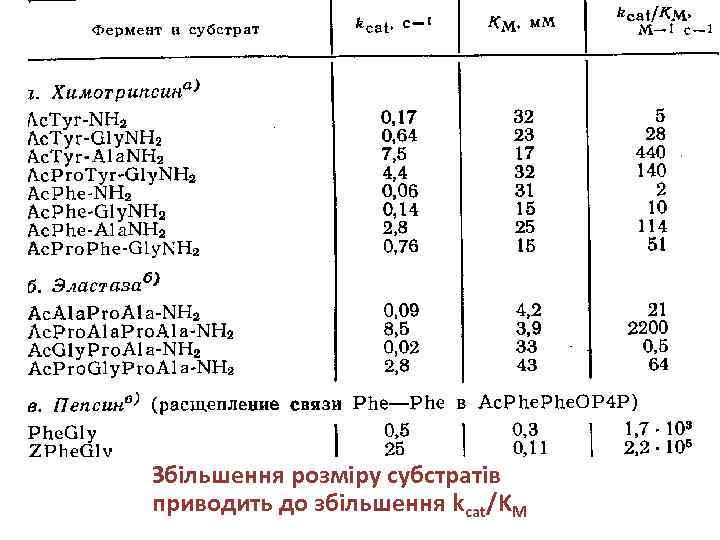 Збільшення розміру субстратів приводить до збільшення kcat/KM
Збільшення розміру субстратів приводить до збільшення kcat/KM
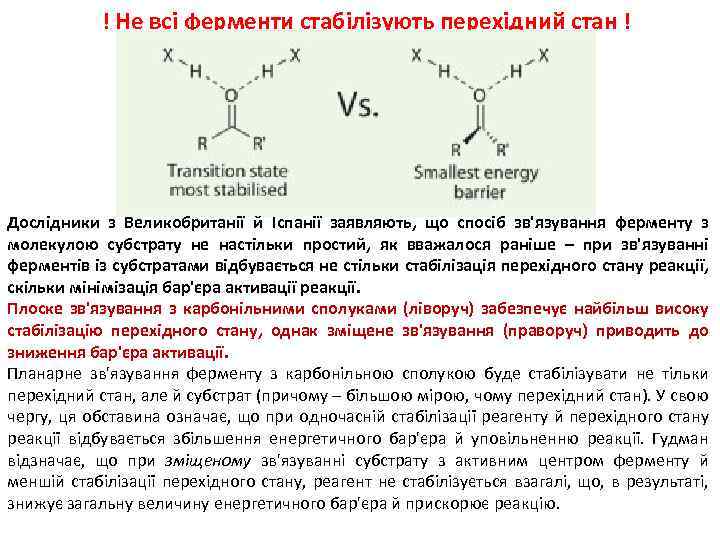 ! Не всі ферменти стабілізують перехідний стан ! Дослідники з Великобританії й Іспанії заявляють, що спосіб зв'язування ферменту з молекулою субстрату не настільки простий, як вважалося раніше – при зв'язуванні ферментів із субстратами відбувається не стільки стабілізація перехідного стану реакції, скільки мінімізація бар'єра активації реакції. Плоске зв'язування з карбонільними сполуками (ліворуч) забезпечує найбільш високу стабілізацію перехідного стану, однак зміщене зв'язування (праворуч) приводить до зниження бар'єра активації. Планарне зв'язування ферменту з карбонільною сполукою буде стабілізувати не тільки перехідний стан, але й субстрат (причому – більшою мірою, чому перехідний стан). У свою чергу, ця обставина означає, що при одночасній стабілізації реагенту й перехідного стану реакції відбувається збільшення енергетичного бар'єра й уповільненню реакції. Гудман відзначає, що при зміщеному зв'язуванні субстрату з активним центром ферменту й меншій стабілізації перехідного стану, реагент не стабілізується взагалі, що, в результаті, знижує загальну величину енергетичного бар'єра й прискорює реакцію.
! Не всі ферменти стабілізують перехідний стан ! Дослідники з Великобританії й Іспанії заявляють, що спосіб зв'язування ферменту з молекулою субстрату не настільки простий, як вважалося раніше – при зв'язуванні ферментів із субстратами відбувається не стільки стабілізація перехідного стану реакції, скільки мінімізація бар'єра активації реакції. Плоске зв'язування з карбонільними сполуками (ліворуч) забезпечує найбільш високу стабілізацію перехідного стану, однак зміщене зв'язування (праворуч) приводить до зниження бар'єра активації. Планарне зв'язування ферменту з карбонільною сполукою буде стабілізувати не тільки перехідний стан, але й субстрат (причому – більшою мірою, чому перехідний стан). У свою чергу, ця обставина означає, що при одночасній стабілізації реагенту й перехідного стану реакції відбувається збільшення енергетичного бар'єра й уповільненню реакції. Гудман відзначає, що при зміщеному зв'язуванні субстрату з активним центром ферменту й меншій стабілізації перехідного стану, реагент не стабілізується взагалі, що, в результаті, знижує загальну величину енергетичного бар'єра й прискорює реакцію.
 Релаксаційна концепція • Будь-яка теплова флуктуація призводить до змін структури “середовища” – фермента • У результаті виникає кінетична неврівноваженість в ході процесу реакції • Говорити про комплементарність та існування активаційного бар’єру немає сенсу • Зміни останнього пов’язані з конформаційними перетвореннями макромолекули, а власне хімічні перетворення – з ростом числа багатих енергією молекул
Релаксаційна концепція • Будь-яка теплова флуктуація призводить до змін структури “середовища” – фермента • У результаті виникає кінетична неврівноваженість в ході процесу реакції • Говорити про комплементарність та існування активаційного бар’єру немає сенсу • Зміни останнього пов’язані з конформаційними перетвореннями макромолекули, а власне хімічні перетворення – з ростом числа багатих енергією молекул
 Релаксаційна концепція Фермент – машина, у якій просторово суміщені механічні та статистичні компоненти, що володіє виділеними ступенями свободи та здатна використовувати внутрішню енергію для здійснення корисної роботи
Релаксаційна концепція Фермент – машина, у якій просторово суміщені механічні та статистичні компоненти, що володіє виділеними ступенями свободи та здатна використовувати внутрішню енергію для здійснення корисної роботи
 Релаксаційна концепція • Конформаційні зміни фермент-субстратного комплексу, індуковані приєднанням субстрату, носять характер релаксації і супроводжуються хімічними перетвореннями молекули субстрату Приєднання субстрату → локальні зміни геометрії і електронної структури активного центру (10 -12 -10 -13 с) → новий рівноважний стан субстрату і оточення на фоні незмінності стану решти глобули ферменту → стеричні напруження → релаксація макромолекули до нового стану супроводжується каталітичним перетворенням субстрату
Релаксаційна концепція • Конформаційні зміни фермент-субстратного комплексу, індуковані приєднанням субстрату, носять характер релаксації і супроводжуються хімічними перетвореннями молекули субстрату Приєднання субстрату → локальні зміни геометрії і електронної структури активного центру (10 -12 -10 -13 с) → новий рівноважний стан субстрату і оточення на фоні незмінності стану решти глобули ферменту → стеричні напруження → релаксація макромолекули до нового стану супроводжується каталітичним перетворенням субстрату
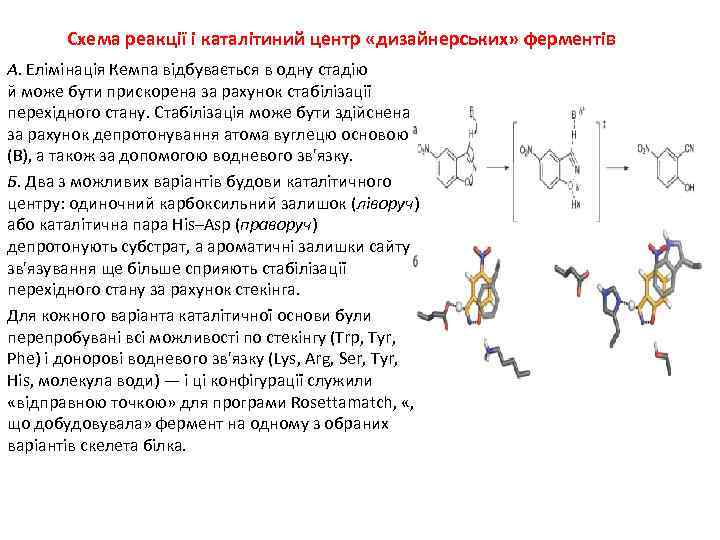 Схема реакції і каталітиний центр «дизайнерських» ферментів А. Елімінація Кемпа відбувається в одну стадію й може бути прискорена за рахунок стабілізації перехідного стану. Стабілізація може бути здійснена за рахунок депротонування атома вуглецю основою (B), а також за допомогою водневого зв'язку. Б. Два з можливих варіантів будови каталітичного центру: одиночний карбоксильний залишок (ліворуч) або каталітична пара His–Asp (праворуч) депротонують субстрат, а ароматичні залишки сайту зв'язування ще більше сприяють стабілізації перехідного стану за рахунок стекінга. Для кожного варіанта каталітичної основи були перепробувані всі можливості по стекінгу (Trp, Tyr, Phe) і донорові водневого зв'язку (Lys, Arg, Ser, Tyr, His, молекула води) — і ці конфігурації служили «відправною точкою» для програми Rosettamatch, «, що добудовувала» фермент на одному з обраних варіантів скелета білка.
Схема реакції і каталітиний центр «дизайнерських» ферментів А. Елімінація Кемпа відбувається в одну стадію й може бути прискорена за рахунок стабілізації перехідного стану. Стабілізація може бути здійснена за рахунок депротонування атома вуглецю основою (B), а також за допомогою водневого зв'язку. Б. Два з можливих варіантів будови каталітичного центру: одиночний карбоксильний залишок (ліворуч) або каталітична пара His–Asp (праворуч) депротонують субстрат, а ароматичні залишки сайту зв'язування ще більше сприяють стабілізації перехідного стану за рахунок стекінга. Для кожного варіанта каталітичної основи були перепробувані всі можливості по стекінгу (Trp, Tyr, Phe) і донорові водневого зв'язку (Lys, Arg, Ser, Tyr, His, молекула води) — і ці конфігурації служили «відправною точкою» для програми Rosettamatch, «, що добудовувала» фермент на одному з обраних варіантів скелета білка.
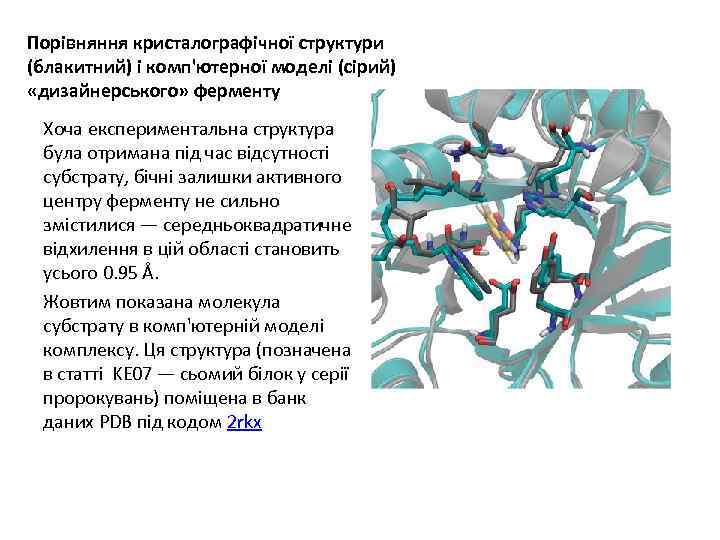 Порівняння кристалографічної структури (блакитний) і комп'ютерної моделі (сірий) «дизайнерського» ферменту Хоча експериментальна структура була отримана під час відсутності субстрату, бічні залишки активного центру ферменту не сильно змістилися — середньоквадратичне відхилення в цій області становить усього 0. 95 Å. Жовтим показана молекула субстрату в комп'ютерній моделі комплексу. Ця структура (позначена в статті KE 07 — сьомий білок у серії пророкувань) поміщена в банк даних PDB під кодом 2 rkx
Порівняння кристалографічної структури (блакитний) і комп'ютерної моделі (сірий) «дизайнерського» ферменту Хоча експериментальна структура була отримана під час відсутності субстрату, бічні залишки активного центру ферменту не сильно змістилися — середньоквадратичне відхилення в цій області становить усього 0. 95 Å. Жовтим показана молекула субстрату в комп'ютерній моделі комплексу. Ця структура (позначена в статті KE 07 — сьомий білок у серії пророкувань) поміщена в банк даних PDB під кодом 2 rkx
 Висновок 1. Особлива ділянка – активний центр 2. Утворення фермент-субстратного комплексу (ES комплекс) А. Багатоточкова взаємодія із субстратом Б. Зближення й орієнтація або переведення реакції у внутрішньомолекулярний режим 3. Підтримка мікрооточення активного центру в відмінному від водного розчину стані (витиснення води з активного центру) ⇒виграш в орієнтації бічних ланцюгів 4. Стабілізація перехідного стану (спорідненість ферменту вища до перехідного стану, а не до субстрату) ⇒пониження вільної енергії
Висновок 1. Особлива ділянка – активний центр 2. Утворення фермент-субстратного комплексу (ES комплекс) А. Багатоточкова взаємодія із субстратом Б. Зближення й орієнтація або переведення реакції у внутрішньомолекулярний режим 3. Підтримка мікрооточення активного центру в відмінному від водного розчину стані (витиснення води з активного центру) ⇒виграш в орієнтації бічних ланцюгів 4. Стабілізація перехідного стану (спорідненість ферменту вища до перехідного стану, а не до субстрату) ⇒пониження вільної енергії


