Энергетический обмен.ppt
- Количество слайдов: 22

ЭНЕРГЕТИЧЕСКИЙ ОБМЕН

Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ состоит из 3 этапов: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма. Поступление веществ в организм происходит в результате дыхания (кислород) и питания. Источником энергии для человека служит распад органических веществ пищи. С питательными веществами поступают преимущественно белки, полисахариды, жиры, которые в процессе пищеварения расщепляются на более мелкие молекулы (глюкоза, аминокислоты, жирные кислоты, глицерол). В клетках эти вещества подвергаются превращениям, включаясь в метаболизм (обмен веществ). Они могут использоваться для синтеза более сложных молекул (анаболизм) либо распадаются до конечных продуктов в процессах катаболизма.

Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО 2, Н 2 О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток. Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме.
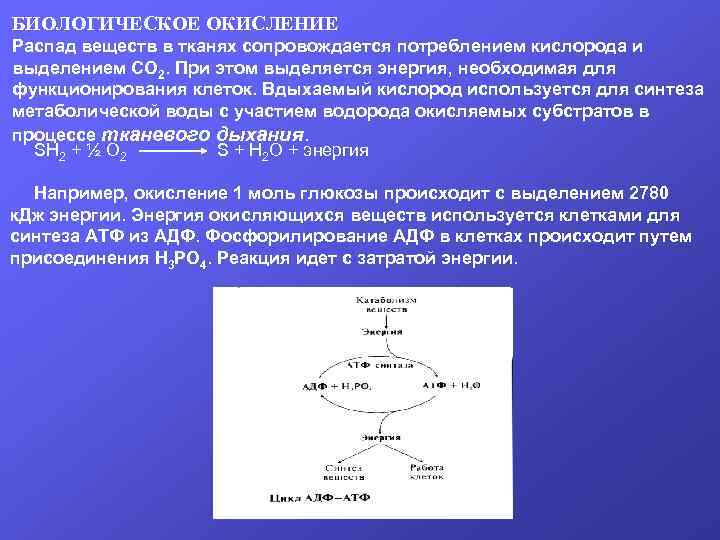
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ Распад веществ в тканях сопровождается потреблением кислорода и выделением СО 2. При этом выделяется энергия, необходимая для функционирования клеток. Вдыхаемый кислород используется для синтеза метаболической воды с участием водорода окисляемых субстратов в процессе тканевого дыхания. SH 2 + ½ О 2 S + Н 2 О + энергия Например, окисление 1 моль глюкозы происходит с выделением 2780 к. Дж энергии. Энергия окисляющихся веществ используется клетками для синтеза АТФ из АДФ. Фосфорилирование АДФ в клетках происходит путем присоединения Н 3 РО 4. Реакция идет с затратой энергии.

АТФ - молекула, богатая энергией, поскольку она содержит две макроэргические связи. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят ГТФ, УТФ и ЦТФ. Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ. При использовании АТФ в качестве источника энергии чаще всего происходит гидролиз только одной макроэргической связи, при этом выделяется около 50 к. Дж/моль энергии и опять образуется АДФ. Содержание АТФ в организме человека невелико и составляет около 50 г. Учитывая, что клетки не способны накапливать АТФ, а расход энергии происходит постоянно, в организме также постоянно идет синтез АТФ из АДФ и неорганического фосфата Н 3 РО 4. За сутки в организме человека может синтезироваться до 60 кг АТФ. В зависимости от источника энергии, обеспечивающего присоединение фосфатного остатка, выделяют два типа фосфорилирования АДФ: окислительное и субстратное.

Субстратное фосфорилирование АДФ идет за счет энергии макроэргических связей соединений (1, 3 -бисфосфоглицерата и фосфоенолпирувата, сукцинил-Со. А). Этот процесс может происходить как в матриксе митохондрий, так и в цитоплазме клеток независимо от присутствия кислорода. Окислительное фосфорилирование АДФ - превращение АДФ в АТФ происходит с использованием энергии переноса электронов от органических веществ к кислороду. Энергию для окислительного фосфорилирования поставляют ОВР. Процесс может происходить только в аэробных условиях с участием ферментов цепи переноса электронов (ЦПЭ) и АТФ-синтазы. Окислительное фосфорилирование АДФ – основной механизм синтеза АТФ в организме. Оно происходит в митохондриях, которые являются основными поставщиками АТФ и могут рассматриваться как «энергетические станции» клетки.

Мембраны митохондрий сильно различаются по составу и функциям. Внешняя мембрана свободно проницаема для многих небольших молекул до 5000 к. Да. Проницаемость внутренней мембраны ограничена и определяется наличием белков-переносчиков. Внутренняя мембрана митохондрии богата белками (80%). В нее включены все ферментные комплексы и компоненты ЦПЭ, отвечающей за окислительное фосфорилирование АДФ. Одним из самых крупных белков внутренней мембраны митохондрий является АТФ-синтаза. Это белок, состоящий из двух олигомерных комплексов (F 0 и F 1). F 0 состоит из 6 гидрофобных протомеров типа a, b, c, погруженных во внутреннюю мембрану митохондрий и формирующих Н+- проводящий канал. 3 дополнительные субъединицы связывают комплекс F 0 с комплексом F 1. Комплекс F 1 выступает в матриксе митохондрии и образует «пузырек» на внутренней поверхности мембраны митохондрии, имеющий активный центр для связывания АДФ и Н 3 РО 4. В нем происходит фосфорилирование и образование АТФ.

Межмембранное пространство также играет роль в производстве АТФ, так как может накапливать протоны, создающие заряд на поверхности внутренней мембраны, необходимый для активации АТФ-синтазы. Матрикс митохондрий состоит из ферментов, ДНК, РНК и рибосом. ОВР в клетке происходят в матриксе митохондрий. Важнейшими источниками энергии служат реакции дегидрирования. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH 2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О 2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н 2 О.

СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ЦПЭ Система ферментов и белков, обеспечивающая взаимосвязь (сопряжение) процессов окисления и фосфорилирования АДФ, получила название цепи переноса электронов (ЦП или дыхательной цепи. В основе ЦПЭ лежит работа 3 -х важнейших ферментативных комплексов. Первый ферментативный комплекс NADН-дегидрогеназа (I) представляет собой белок, имеющий простетическую группу – FMN, коферментом является рибофлавин (витамин В 2). NADН-дегидрогеназа катализирует перенос 2 Н с кофермента NADН на FMN, который переходит в форму FMNН 2. Второй протон поглощается из матрикса. Реакция протекает по уравнению: NADH + Н+ + Е (FMN) → NAD+ + Е (FMNH 2) С FMNH 2 электроны переносятся затем на ряд железо-серных белков (Fe. S), играющих ро второй простетической группы в молекуле NADH-дегидрогеназы. Атомы железа в таких белках могут принимать и отдавать электроны поочерёдно, перехо ферро- (Fe 2+) и ферри- (Fe 3+) состояния. Затем электроны переносятся на убихинон. Убихинон (кофермент Q 10) – жирорастворимое витаминоподобное вещество, широк распространённое в клетках всех организмах. Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, котора млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q 10. Убихинон способен восстанавливаться и превращаться в убихинон, имеющий 2 ОН-групп

В реакции восстановления убихинон принимает от FMNН 2 2 е, таким образом в результате работы NADH-дегидрогеназы кофермент NADH переходит в окисленную форму. NADH + Н+ + Q → NAD+ + QH 2. • Ферментный комплекс QH 2 -дегидрогеназа (III) представляет сложный белок, включающий цитохромы (b 1 и b 2) и цитохром с1. В ЦПЭ участвуют 5 типов цитохромов (а, а 3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов. Рабочей частью всех цитохромов является гемм, содержащий ион Fe 2+, который может принимать электрон и менять валентность. QН 2 -дегидрогеназа переносит электроны от убихинона на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на Fe. S-центры, на цитохром с1, а затем на цитохром с. Группы гема, подобно Fe. S-центрам, переносят только по одному электрону. Таким образом, от молекулы QH 2 2 электрона переносятся на 2 молекулы цитохрома b. • Цитохромоксидаза (ферментный комплекс IV) состоит из 2 цитохромов а и а 3, а также ионов меди, которые могут изменять свою валентность и участвуют в переносе электронов на кислород. Перенос электронов комплексом а, а 3, включает реакции: Cu+ ↔ Cu 2+ + e, Fe 2+ ↔ Fe 3+ + e. Цитохромы а и а 3 в восстановленной форме имеют высокое сродство к кислороду, который принимает два электрона и переходит в ионизированную форму. В активном центре цитохромоксидазы кислород присоединяет 2 Н+ из матрикса и образуется молекула воды.
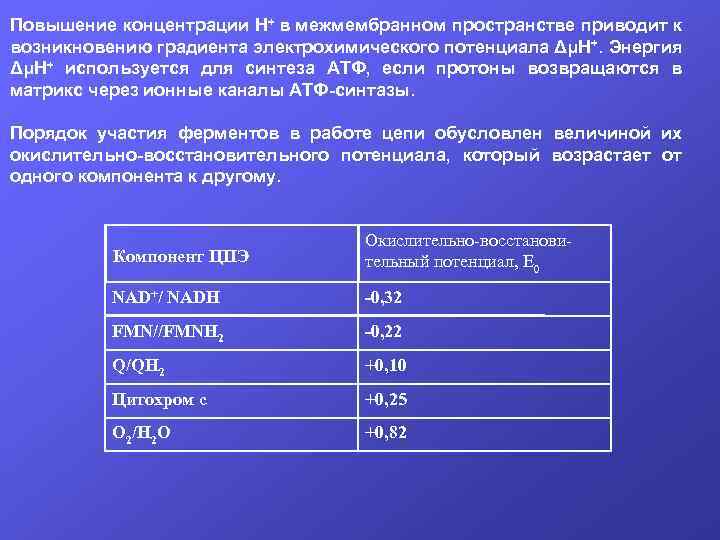
Повышение концентрации Н+ в межмембранном пространстве приводит к возникновению градиента электрохимического потенциала ΔμН+. Энергия ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. Порядок участия ферментов в работе цепи обусловлен величиной их окислительно-восстановительного потенциала, который возрастает от одного компонента к другому. Компонент ЦПЭ Окислительно-восстановительный потенциал, Е 0 NAD+/ NADH -0, 32 FMN//FMNH 2 -0, 22 Q/QH 2 +0, 10 Цитохром с +0, 25 О 2/Н 2 О +0, 82

Работу ЦПЭ объясняет хемиосмотическая теория Митчелла, основные положения которой объясняют механизмы сопряжения процессов биологического окисления и фосфорилирования АДФ. При движении от окисляемого субстрата к кислороду электроны теряют часть своей энергии. Эту энергию ферменты ЦПЭ используют для переноса протонов из матрикса в межмембранное пространство против градиента концентрации, т. е. комплексы ЦПЭ работают как протонный насос, перекачивая Н+. Градиент электрохимического потенциала стимулирует возвращение протонов из межмембранного пространства в матрикс. Но внутренняя мембрана митохондрий для Н+ непроницаема. Их перенос происходит с помощью фермента АТФ-синтазы (комплекс V), имеющего протонный канал F 0. Н+ межмембранного пространства присоединяются к ферменту, изменяя его заряд и конформацию. Это приводит к раскрытию протонного канала, переносу Н+ в матрикс по градиенту концентрации и активации поверхностной части фермента, катализирующей реакцию образования АТФ. АДФ + Н 3 РО 4 АТФ + Н 2 О Образующиеся молекулы АТФ траспортируются из матрикса в цитозоль АДФ-АТФтранслоказами, которые одновременно переносят АДФ в митохондрию.
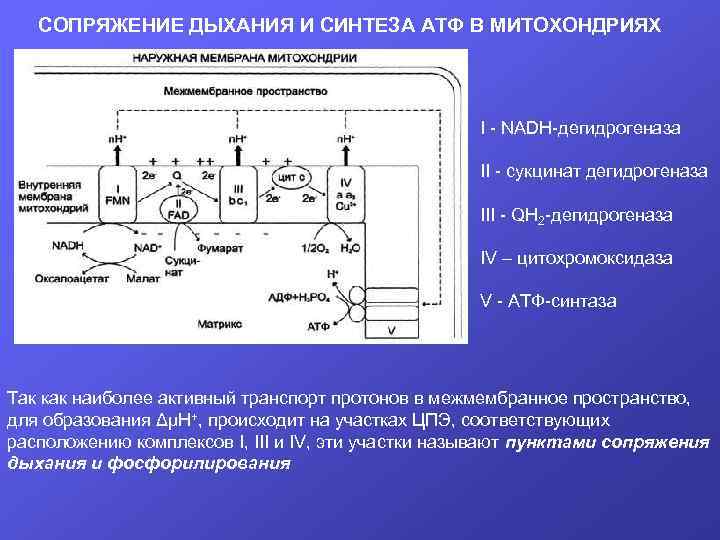
СОПРЯЖЕНИЕ ДЫХАНИЯ И СИНТЕЗА АТФ В МИТОХОНДРИЯХ I - NADH-дегидрогеназа II - сукцинат дегидрогеназа III - QН 2 -дегидрогеназа IV – цитохромоксидаза V - АТФ-синтаза Так как наиболее активный транспорт протонов в межмембранное пространство, для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования

Количество АТФ, образующееся в результате сопряжения работы ЦПЭ и АТФсинтазы, оценивается с помощью коэффициента окислительного фосфорилирования. Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; энергия электронов и протонов в ЦПЭ от FAD-зависимых дегидрогеназ (сукцинатдегидрогеназа), достаточна для активации АТФ-синтазы и фосфорилирования 2 молекул АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Для синтеза АТФ используется не вся энергия, выделяющаяся в процессе переноса электронов и протонов в ЦПЭ, а примерно 40 -50%. Более 30% всей энергии выделяется в виде тепла, обеспечивая поддержание температуры тела человека. Остальная энергия используется для работы клеток (например, для транспорта веществ через мембрану).

Биологические функции ЦПЭ • Использует энергию окисления субстратов для синтеза АТФ путем окислительного фосфорилирования • Обеспечивает поддержание температуры тела В норме скорость окисления первичных доноров Н+ и электронов регулируется содержанием АДФ. Выполнение клеткой работы с затратой АТФ приводит к накоплению АДФ, это активирует окисление субстратов и поглощение кислорода митохондриями клетки. Таким образом, клетки реагируют интенсивность метаболизма и поддерживают соотношение АТФ/АДФ на необходимом уровне. Зависимость интенсивности поглощения кислорода от концентрации АДФ называется дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т. е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз.
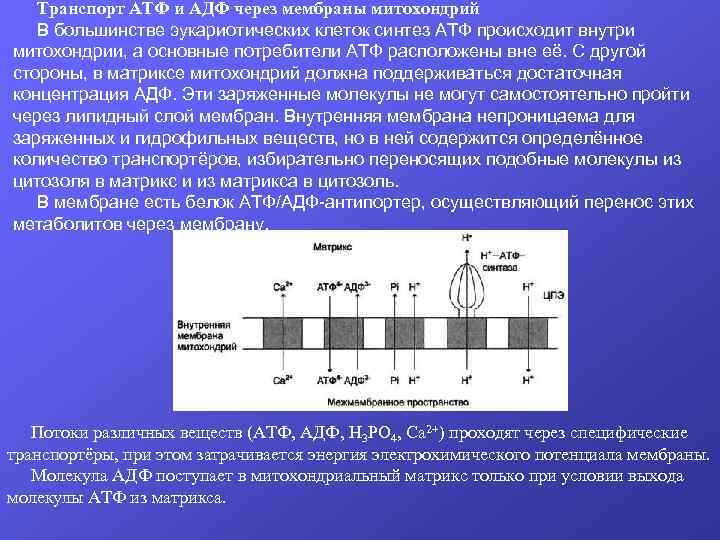
Транспорт АТФ и АДФ через мембраны митохондрий В большинстве эукариотических клеток синтез АТФ происходит внутри митохондрии, а основные потребители АТФ расположены вне её. С другой стороны, в матриксе митохондрий должна поддерживаться достаточная концентрация АДФ. Эти заряженные молекулы не могут самостоятельно пройти через липидный слой мембран. Внутренняя мембрана непроницаема для заряженных и гидрофильных веществ, но в ней содержится определённое количество транспортёров, избирательно переносящих подобные молекулы из цитозоля в матрикс и из матрикса в цитозоль. В мембране есть белок АТФ/АДФ-антипортер, осуществляющий перенос этих метаболитов через мембрану. Потоки различных веществ (АТФ, АДФ, Н 3 РО 4, Са 2+) проходят через специфические транспортёры, при этом затрачивается энергия электрохимического потенциала мембраны. Молекула АДФ поступает в митохондриальный матрикс только при условии выхода молекулы АТФ из матрикса.

Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ. Расчёты показывают, что на транспорт АТФ и АДФ расходуется около четверти свободной энергии протонного потенциала. Другие транспортёры тоже могут использовать энергию электрохимического градиента. Так переносится внутрь митохондрии неорганический фосфат, необходимый для синтеза АТФ. Непосредственным источником свободной энергии для транспорта Са 2+ в матрикс также служит протонный потенциал, а не энергия АТФ. Разобщение дыхания и фосфорилирования Некоторые химические вещества могут переносить протоны или другие ионы из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH 2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны (2, 4 динитрофенол, дикумарол, билирубин, тироксин).

С питанием человек получает органические вещества, не содержащие первичных доноров водорода для цепи переноса электронов (ЦПЭ). В ходе переваривания белки, жиры и углеводы распадаются на мономеры, которые всасываются и поступают в клетки тканей. В клетках эти соединения проходят специфические пути катаболизма и превращаются всего в два вещества – пируват (ПВК) и ацетил-Со. А. Пируват образуется в цитоплазме клеток из глюкозы, глицерола, аминокислот и поступает в матрикс митохондрий, где превращается в ацетил. Со. А. Ацетил-Со. А может образоваться в матриксе митохондрий при распаде жирных кислот. В митохондриях происходит распад пирувата до СО 2 и Н 2 О. В этом процессе можно выделить две стадии: окислительное декарбоксилирование пирувата и цикл трикарбоновых кислот (ЦТК).
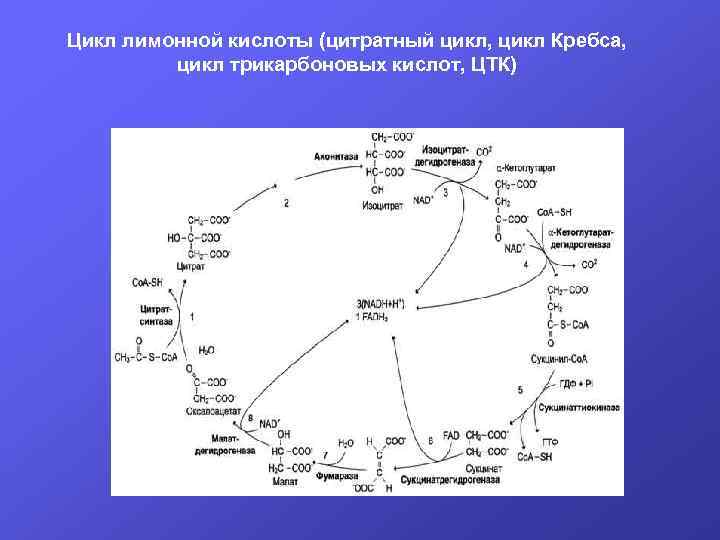
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК)
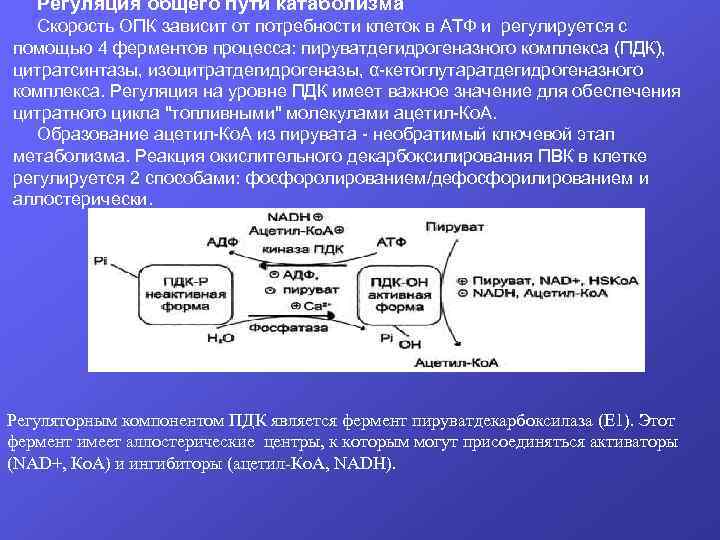
Регуляция общего пути катаболизма Скорость ОПК зависит от потребности клеток в АТФ и регулируется с помощью 4 ферментов процесса: пируватдегидрогеназного комплекса (ПДК), цитратсинтазы, изоцитратдегидрогеназы, α-кетоглутаратдегидрогеназного комплекса. Регуляция на уровне ПДК имеет важное значение для обеспечения цитратного цикла "топливными" молекулами ацетил-Ко. А. Образование ацетил-Ко. А из пирувата - необратимый ключевой этап метаболизма. Реакция окислительного декарбоксилирования ПВК в клетке регулируется 2 способами: фосфоролированием/дефосфорилированием и аллостерически. Регуляторным компонентом ПДК является фермент пируватдекарбоксилаза (Е 1). Этот фермент имеет аллостерические центры, к которым могут присоединяться активаторы (NAD+, Ко. А) и ингибиторы (ацетил-Ко. А, NADH).

Кроме трех основных ферментов в состав ПДК входят 2 регуляторных субъединицы - киназа ПДК и фосфатаза ПДК, которые могут фосфорилировать или дефосфорилировать фермент пируватдекарбоксилазу. В дефосфорилированной форме фермент активен и катализирует реакцию окислительного декарбоксилирования пирувата. Киназа ПДК является аллостерическим ферментом, ее активность зависит от концентрации многих соединений: ацетил-Ко. А, NADH и АТФ активируют киназу, а NAD+, Ко. А, пируват, АДФ ее ингибируют. Фосфатаза ПДК активируется Са 2+. В ЦТК цитратсинтаза, изоцитратдегидрогеназа и αКетоглутаратдегидрогеназный комплекс являются аллостерическими ферментами. Их активность зависит от соотношения АТФ/АДФ и NADH/NAD+ в клетке. Высокие концентрации АТФ и избыток NADH понижают их активность. Например, цитратсинтаза активируется оксалоацетатом и ингибируется при повышении концентрации цитрата и сукцинил-Ко. А в митохондриях. Сукцинил-Ко. А также является ингибитором и α-кетоглутаратдегидрогеназного комплекса. Самую медленную реакцию процесса катализирует изоцитратдегидрогеназа, поэтому при повышении в клетке концентрации АТФ и NADH активность этого фермента снижается в наибольшей степени. В мышцах при физической работе повышается содержание Са 2+, который является важным регуляторным фактором скорости ОПК. Са 2+ активирует фосфатазу ПДК, которая дефосфорилируется и активирует ПДК. Са 2+ активирует изоцитратдегидрогеназу и α-Кетоглутаратдегидрогеназный комплекс.
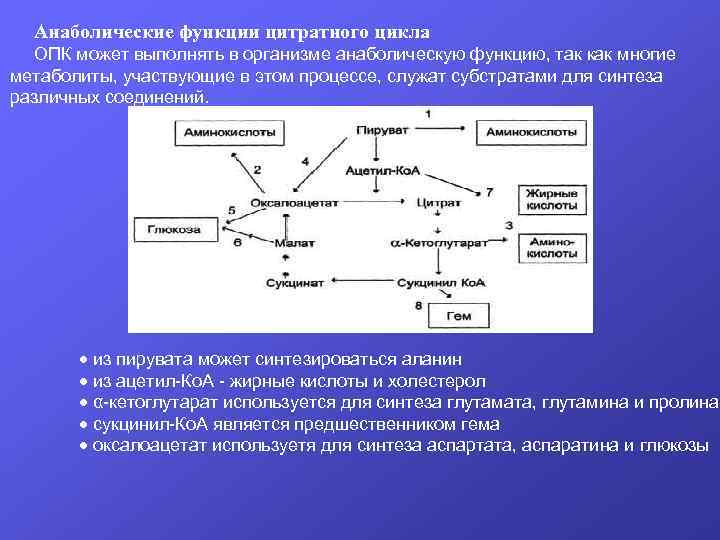
Анаболические функции цитратного цикла ОПК может выполнять в организме анаболическую функцию, так как многие метаболиты, участвующие в этом процессе, служат субстратами для синтеза различных соединений. из пирувата может синтезироваться аланин из ацетил-Ко. А - жирные кислоты и холестерол α-кетоглутарат используется для синтеза глутамата, глутамина и пролина сукцинил-Ко. А является предшественником гема оксалоацетат используетя для синтеза аспартата, аспаратина и глюкозы
Энергетический обмен.ppt