Биологическое окисление 11-1.ppt
- Количество слайдов: 22

Энергетический обмен. Основные этапы трансформации энергии катаболических процессов Тканевое дыхание
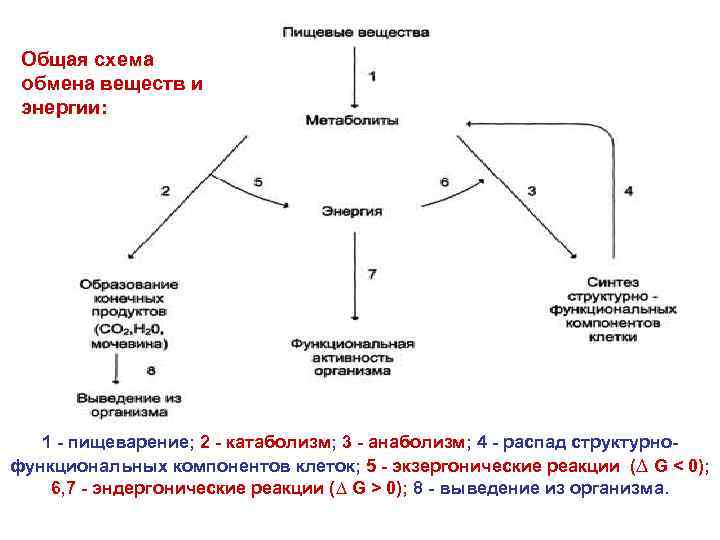
Общая схема обмена веществ и энергии: 1 - пищеварение; 2 - катаболизм; 3 - анаболизм; 4 - распад структурнофункциональных компонентов клеток; 5 - экзергонические реакции (∆ G < 0); 6, 7 - эндергонические реакции (∆ G > 0); 8 - выведение из организма.

Биологическое окисление – это … совокупность реакций окисления органических веществ (субстратов), выполняющих функцию энергетического обеспечения потребностей организма. …


Биологическое окисление… …сопровождается отщеплением от субстратов протонов и электронов, которые при участии промежуточных переносчиков передаются на кислород — конечный (терминальный) акцептор электронов у аэробных организмов.

Тканевое дыхание – это окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды.

Ферменты тканевого дыхания - это промежуточные переносчики протонов и электронов от окисляемого субстрата на кислород. Промежуточные переносчики связаны с внутренней мембраной митохондрий и образуют - дыхательную цепь.

Митохондрии - внутриклеточные энергетические центры • Внешняя мембрана гладкая • Внутренняя мембрана образует многочисленные складки или кристы • Матрикс примерно на 50% состоит из белка • Размер митохондрий обычно равен 2 -3 мкм в длину и около 1 мкм в диаметре

Дыхательная цепь (цепь транспорта электронов, электронотранспортная цепь, ЭТЦ) совокупность последовательных ОВР, в ходе которых при участии промежуточных переносчиков электронов происходит их перенос от исходного донора (восстановленный субстрат — SH 2) к терминальному акцептору электронов - кислороду.

Компоненты дыхательной цепи. В переносе электронов принимают участие: I. Пиридин-зависимые дегидрогеназы, для которых коферментами служат либо НАД+, либо НАДФ+ (никотинамидадениндинуклеотиды); II. Флавин-зависимые дегидрогеназы (флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН; III. Убихинон (коэнзим Q); IV. Цитохромы, относящиеся к гемопротеинам; V. Железосерные белки, содержащие негемовое железо.
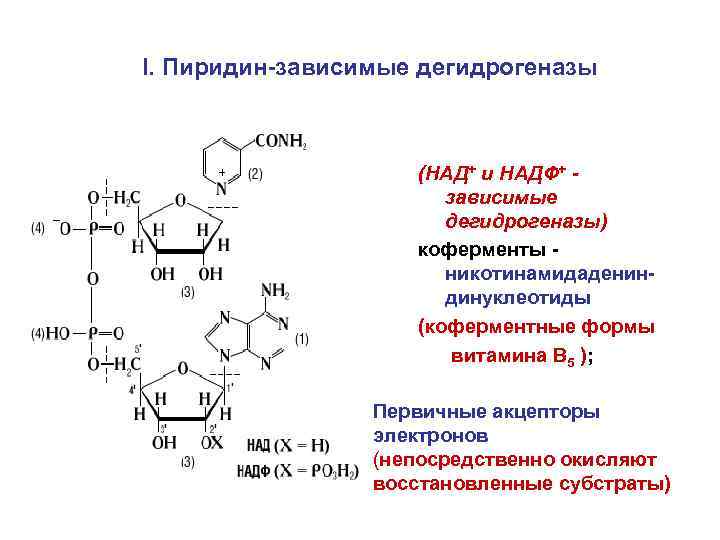
I. Пиридин-зависимые дегидрогеназы (НАД+ и НАДФ+ зависимые дегидрогеназы) коферменты никотинамидадениндинуклеотиды (коферментные формы витамина В 5 ); Первичные акцепторы электронов (непосредственно окисляют восстановленные субстраты)
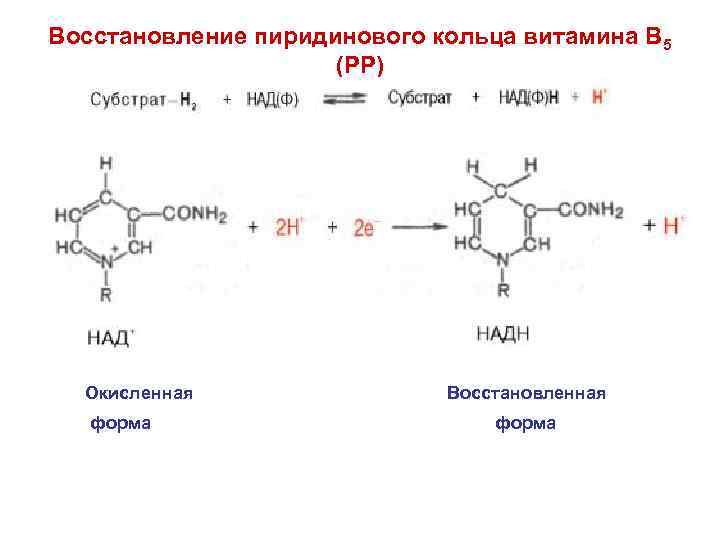
Восстановление пиридинового кольца витамина В 5 (РР) Окисленная форма Восстановленная форма

Особенности процессов с участием НАД+ и НАДФ+: 1. 2. 3. 4. 5. Обратимость, т. к. изменения энергии невелики. НАД-система участвует в процессах окисления и восстановления; Способность коферментов легко отделяться от дегидрогеназ: связь между ними и апоферментами непрочная, и они ассоциируют между собой только в момент реакции; НАД+ и НАДФ+ представляют собой коферменты большого числа дегидрогеназ, поэтому в процессах участвует множество субстратов; НАД+-зависимые дегидрогеназы локализованы в основном в матриксе митохондрий; НАДФ+-зависимые дегидрогеназы — преимущественно цитоплазматические ферменты.
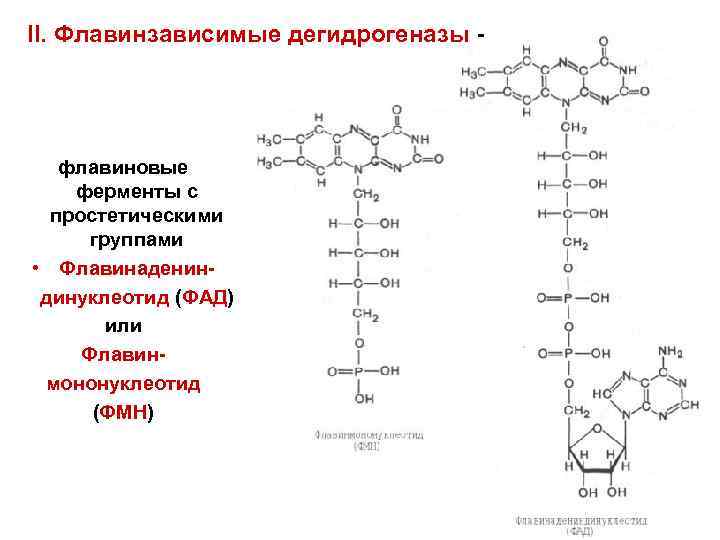
II. Флавинзависимые дегидрогеназы - флавиновые ферменты с простетическими группами • Флавинадениндинуклеотид (ФАД) или Флавинмононуклеотид (ФМН)
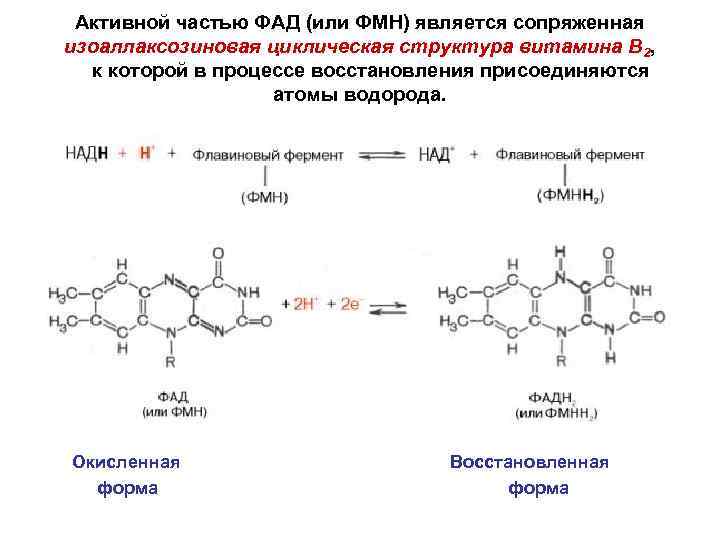
Активной частью ФАД (или ФМН) является сопряженная изоаллаксозиновая циклическая структура витамина В 2, к которой в процессе восстановления присоединяются атомы водорода. Окисленная форма Восстановленная форма

Особенности процессов с участием ФМН и ФАД 1. Коферменты прочно присоединены к апоферменту 2. ФАД-зависимые дегидрогеназы первичные акцепторы электронов, непосредственно окисляют восстановленные субстраты 3. ФМН-зависимая дегидрогеназа промежуточный переносчик электронов в дыхательной цепи, окисляет НАДН и восстанавливает коэнзим Q,
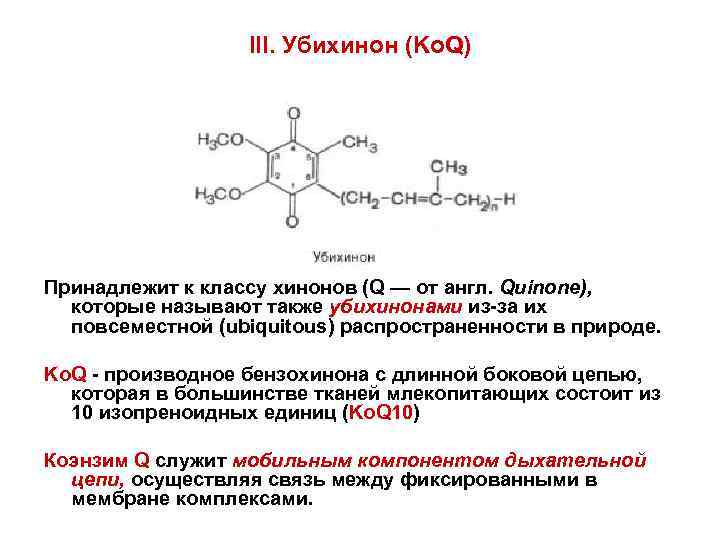
III. Убихинон (Ko. Q) Принадлежит к классу хинонов (Q — от англ. Quinone), которые называют также убихинонами из-за их повсеместной (ubiquitous) распространенности в природе. Ko. Q - производное бензохинона с длинной боковой цепью, которая в большинстве тканей млекопитающих состоит из 10 изопреноидных единиц (Ko. Q 10) Коэнзим Q служит мобильным компонентом дыхательной цепи, осуществляя связь между фиксированными в мембране комплексами.
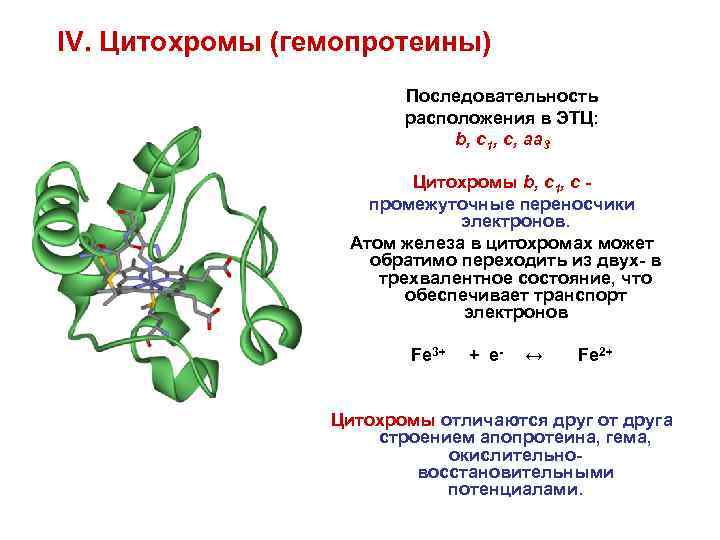
IV. Цитохромы (гемопротеины) Последовательность расположения в ЭТЦ: b, c 1, c, aa 3 Цитохромы b, c 1, c промежуточные переносчики электронов. Атом железа в цитохромах может обратимо переходить из двух- в трехвалентное состояние, что обеспечивает транспорт электронов Fe 3+ + e- ↔ Fe 2+ Цитохромы отличаются друг от друга строением апопротеина, гема, окислительновосстановительными потенциалами.
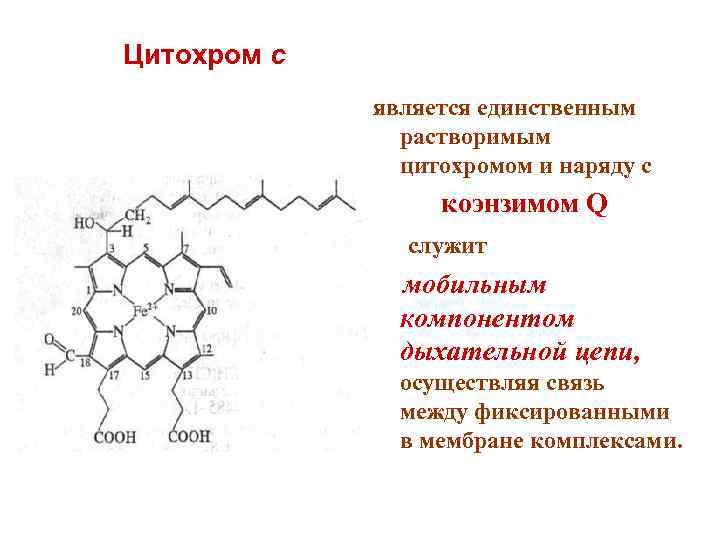
Цитохром с является единственным растворимым цитохромом и наряду с коэнзимом Q служит мобильным компонентом дыхательной цепи, осуществляя связь между фиксированными в мембране комплексами.

Комплекс aa 3 (цитохромоксидаза) - терминальный дыхательный фермент, непосредственно взаимодействующий с кислородом. • Окисленная форма цитохромоксидазы (Fе 3+) принимает электрон от восстановленного цитохрома с, переходя в восстановленную форму (Fе 2+): Fe 3+ + e- ↔ Fe 2+, которая затем вновь окисляется в Fе 3+- форму молекулярным кислородом: Fе 2+ + ½ О 2 → Fе 3+ + О. ‾ • Образовавшийся “активный” кислород присоединяет два протона из окружающей среды, в результате чего и образуется молекула воды: О . ‾ + 2 Н+ → Н 2 О

Структура цитохромоксидазы • В числе последних достижений молекулярной биохимии – установление тонкой структуры дыхательных ферментов с помощью рентгеноструктурного анализа. • С помощью электронного микроскопа с наивысшим доступным в настоящее время разрешением можно «увидеть» структуру цитохромоксидазы
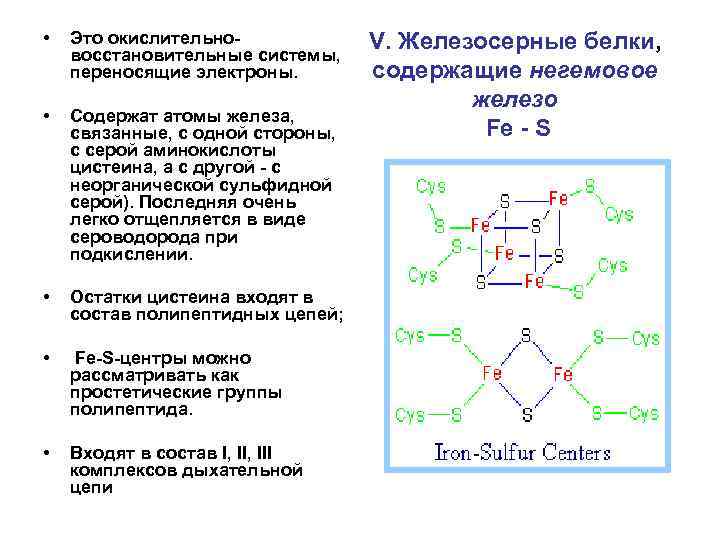
• Это окислительновосстановительные системы, переносящие электроны. • Cодержат атомы железа, связанные, с одной стороны, с серой аминокислоты цистеина, а с другой - с неорганической сульфидной серой). Последняя очень легко отщепляется в виде сероводорода при подкислении. • Остатки цистеина входят в состав полипептидных цепей; • Fe-S-центры можно рассматривать как простетические группы полипептида. • Входят в состав I, III комплексов дыхательной цепи V. Железосерные белки, содержащие негемовое железо Fe - S
Биологическое окисление 11-1.ppt