1fcfc55a2c99465509cb9c3cf264a8ad.ppt
- Количество слайдов: 55

Endometriumkarzinom H. Kölbl Universitätsklinik für Geburtshilfe und Frauenkrankheiten JGU Mainz 1

Was ist gesichert ? Dr. B. Euteneuer. Universitätsfrauenklinik Mainz

Endometriumkarzinom Häufigste maligne Erkrankung des Genitaltraktes der Frau n n Inzidenz 24, 7 / 105 Frauen pro Jahr mit einer altersstandardisierten Mortalität von 3, 4 / 105 Mittleres Erkrankungsalter 68 Jahre Der Altersgipfel zwischen 65 und 70 Jahren Das mediale Sterbealter bei 73 Jahren 3

Risikofaktoren: Endogene Risikofaktoren: Fettleibigkeit, frühe Menarche, späte Menopause, niedrige Parität, polyzystisches Ovarialsyndrom (PCO), östrogensezernierende Tumore Exogene Risikofaktoren: nicht-zyklische, alleinige Östrogen-Ersatztherapie, Tamoxifen - Gabe und vorhergehende Bestrahlungstherapie 4

Endometriumkarzinom Risikofaktoren, Histologie n l l l l Risikofaktoren: „klassische Trias“ (Hypertonie), Adipositas, Diabetes langfristige Östrogensubstitution Tamoxifen familiäre Disposition Histologie: Hormonsensibles vs. Nicht-hormonsensibles Endometriumkarzinom Endometrioides Adenokarzinom (80%) adenosquamöses Adenokarzinom ( 5%) Klarzell- und serös papilläre Karzinome (10%) 5

Endometriumkarzinom Neue Riskofaktoren I n l l n l Alkohol (Weiderpass et al. , 2001), 36, 856 Frauen prospektiv überwacht Alkoholikerinnen haben ein um 24% niedrigeres Risiko als die Gesamtbevökerung ! Alkoholikerinnen < 50 Jahre: RR: 1. 7 Alkoholikerinnen > 50 Jahre: RR: 0. 6 Alkoholeffekt in Bezug auf das Endometriumkarzinom ist altersabhängig ! Positive Peritonealzytologie (Hirai et al. , 2001) Endometriumkarzinomzellen verschwinden in > 90 % der Fälle innerhalb von 14 Tagen: Prognostische Bedeutung ? 6

Endometriumkarzinom Neue Riskofaktoren II n l l n n Positive Peritonealzytologie: (Obermair et al. , 2001): 369 Patientinnen: clinical stage I mit posiitiver Zytologie „. . . Positive peritoneal cytology. . . Clinically stage I. . . Adverse prognostic factor. “ Cytosol-VEGF-Konzentrationen als unabhängiger Prognosefaktor (Chen et al. , 2001) „. . . Immunohistochemical expression of cytokeratin in lymph nodes with undetected metastases. . . risk factor for recurrence. . . “ (Yabushita et al. , 2001) 7

Endometriumkarzinom Neue Riskofaktoren III n Urokinase-type plasminogen activator und plasminogen activator inhibitor 1 Überexpression korrelieren mit einer schlechteren Prognose (Tecimer et al. , 2001) n Immunhistochemisch festgestellte p 53 Überexpression als signifikanter Prognoseparameter (Sung et al. , 2000) 8

Endometriumkarzinom Tamoxifen n l Unter Tamoxifentherapie: höhere Rate an Endometriumkarzinomen, höheres Grading und höherers Stadium: schlechtere Prognose (Bergman et al. , 2000) Wichtig: Unklar ob dies auf Tamoxifen oder auf genetische Unterschiede, die zur Tamoxifeneinnahme (Mammakarzinom oder Prophylaxe) zurückzuführen ist (Tempfer et al. , 2000) TVS-follow-up: “high false positive rate, even with a cut-off rate of 10 mm. . . do not warrant endometrial screening by TVS in tamoxifen-treated patients“ 9

Endometriumkarzinom Genetics n n n Mikrosatelliten Instabilität (Lalloo et al. , 2001) Mutationen in PTEN und k-RAS Genen (Matias. Guiu et al. , 2001) CYP 17 Polymorphismus ist mit erhöhten Steroidhormonspiegeln assoziiert, jedoch paradoxerweise mit einem erniedrigtem Risiko für das Endometriumkarzinom (Haiman et al. , 2001) CYP 19 Polymorphismus als Risikofaktor des Endometriumkarzinoms (Berstein et al. , 2001) KRITISCHE KOMBINATION NOCH NICHT IDENTIFIZIERT ! 10

Endometriumkarzinom HRT und Endometriumkarzinom I n Literaturreview (Archer, 2001): l HRT > 5 Jahre: Östrogen: RR: 2. 0 -4. 0 HRT > 5 Jahre, Progesterone < 10 Tage pro Zyklus: RR: 1. 8 HRT > 5 Jahre, Progesterone > 10 Tage pro Zyklus: RR: 0. 8 -1. 4 l l l Inzidenz: 15 -20/100, 000 Frauen ! 11

Endometriumkarzinom HRT und Endometriumkarzinom II n HRT Therapie nach Endometriumkarzinom verschlechtert nicht die Prognose (Suriano et al. , 2001) egal ob Östrogen mit/ohne Progesteron n ACOG 2001: „The risks of HRT on the recurrence risk of endoemtrial cancer is unknown !!! HRT je nach Prognosefaktoren SERMs ohne Wirkung auf des Endometrium (Delmas et al. , 1997) ? l l 12

FIGO - Klassifikation seit 1988 anhand chirurgischer d. h. postoperativer Klassifizierung Voraussetzung: n Hysterektomie n bilaterale Adnexektomie ggf. Lymphadenektomie OP Ausdehnung abhängig von Prognosefaktoren (histologischem Typ, Myometrium-Infiltration, Grading) und individuellen anamnestischen Risikoprofil der Patientin Klinische Klassifizierung gilt nur noch bei primärer Bestrahlung 13

14

15

Differenzierung n Typ I Karzinom /östrogenabhängig (endometroides Adenokarzimom) Mehrzahl der Fälle n Typ II Karzinom / östrogenunabhängig n Seröses Karzinom n Klarzelliges Karzinom n Weitere Typen: n n n Mucinöses Adenokarzinom Primäres Plattenepithelkarzinom Undifferenziertes Karzinom Symptome: n Uterine Blutung in Postmenopause n Variation in Intensität und Frequenz der Blutung perimenopausal 16

Diagnostik bei Symptomen n Gynäkologische Untersuchung mit Fragestellung Ø Blutung aus Uterus bzw. Karzinomausdehnung über Uterus hinaus n Transvaginale Sonographie Ø Beurteilung von Endometrium u. pathologischer Befunde kleines Becken Generelle Abklärung postmenopausaler Blutung n Fraktionierte Abrasio Zusatzuntersuchungen: n Hysteroskopie zur definierten Gewebegewinnung der fraktionierten Abrasio vorangestellt (sonographischer Verdacht) n Hysteroskopie (Blutung und fraktionierter Abrasio mit Gewinnung von wenig Material oder bei negativer Histologie n Ausschluss Ovarial- bzw. Tubenkarzinom bei path. Abstich mit Verdacht auf Adenokarzinom und unauffälliger Hysteroskopie u. fraktionierter Abrasio 17

Endometriumkarzinom Diagnose, Hysteroskopie I n l l Endometrium-brush-Biopsie (Del Priore et al. , 2001, Dijkhuizen et al. , 2000)): verschiedene Brushes überprüft Sensitivität: 86 -95%, Spezifität: 100%, PPV 100%, NPV 100% Hysteroskopie (Garuti et al. , 2001): Hysteroskopie zeigt Sensitivität und Spezifität von 100% bzw. 87. 3% bezüglich Zervixbeteiligung. . . “high accuracy of hysteroscopy in excluding cervical spread. “ 18

Endometriumkarzinom Diagnose, Hysteroskopie II n D&C: Hyperplasie oder Carcinom in 9. 7 % bei Patientinnen mit Blutunggsstörung > 40 Jahre (Tabata et al. , 2001). n 20. 4 % aller bei D&C festgestellten G 1 Carcinome mussten auf G 2 upgegraded werden ! Intra= operativer Gefrierschnitt ! (Obermair et al. , 1999) 19

Endometriumkarzinom Diagnose, Hysteroskopie III n In 62. 5% versagte die D & C bei der Diagnose von intrauterinen Erkrankungen (Bettocchi et al. , 2001), Sensitivität 46%, Spezifität 100%, PPV 100%, NPV 7. 1% n normale endometriale Zellen im PAP-Abstrich können Indikator für endometriale Pathologie sein (Montz, 2001) 20

Endometriumkarzinom Bildgebung n l l n MRT als Staginguntersuchung (Frei et al. , 2001): Konstrastmittel MRT > US und CT in der Diagnose von Zervixbefall und myometraner Invasion MRT versus Inspektion in der Beurteilung von myometraner und zervikaler Beteiligung (Cunha et al. , 2001): Präoperatives MRT zeigt genaue Beurteilung ! Inspektion des Präparates bei der Operation zeigt vergleichbare Ergebnisse (Hardesty et al. , 2000) ! TVS ist als Screeninguntersuchung nicht geeignet ! (Fleischer et al. , 2001) 21

Früherkennung, Screening Zytologie n endouterines Sampling n Transvaginaler US n bei asymptomatischen Frauen ohne Prognoseverbesserung sinnvoll bei Hochrisikogruppen Adipositas, Diab. mell. , Tamoxifenbehandlung, Hyperplasien bei früheren Abrasiones 22

Endometriumkarzinom Screening n l n Transvaginaler Ultraschall (TVS): TVS vs. PMB (Gerber et al. , 2001): TVS bringt keinen Überlebensvorteil, sondern erhöhte Kosten durch unnötige Opertionen: nicht als Screening geeignet ! NO ADVANTAGE IN SCREENING FOR ENDOMETRIAL CANCER (Gottlieb, 2000) 23

Pathologie Präkanzerosen: n Atypische Hyperplasie umstritten Differenzierung nach WHO n Einfache Hyperplasie Risiko < 1% n Komplexe Hyperplasie ( Adenomatöse Hyperplasie Grad 1 und 2) Risiko 5 -10% n Atypische Hyperplasie (Adenomatöse Hyperplasie Grad 3) ca. 30% n Vorstufe der serös-papillären Tumore endometriales intraepitheliales Karzinom EIC (meist histopathologischer Zufallsbefund im Abradat) 24

§ Abrasiomaterial Getrennt nach Zervix- und Korpusabradat geschnitten in 2 -3 Stufen Befunderstellung nach WHO Klassifikation (Silverberg et al. 2003) § Art der endometrialen Hyperplasie – Tumortyp - Grading § Angabe ob atypische Hyperplasie oder G 1 - Tumor bzw. falls keine Differenzierung möglich § § § Dezidierter Hinweis auf seröses Adenokarzinom (schlechte Prognose - selbst bei fokalem Befall z. B. Korpuspolypen) Bei fehlender eindeutiger morphologisch nachweisbarer Beziehung zwischen Karzinom und zervikalen Stukturen ist dies meist während Kürettage disloziertes Tumorgewebe Nur zweifelsfreier ‚Nachweis einer Infiltation in endozervikale Drüsen bzw. endzervikales Stroma läßt sich in Abrasio in Stadium T 2 a oder T 2 b diagnostizieren 25

Anforderungen an histologischen Befund beim Abradat Art der Läsion (Hyperplasie, Karzinom) Bei Karzinomnachweis: n Tumortyp (WHO) n Grading n ggf. Lymphgefäßeinbrüche n Infiltration der endozervikalen Drüsen (T 2 a) bzw. Infiltration endozervikales Stroma (T 2 b) n ggf. Hormonrezeptorstatus 26

Hysterktomiepräparat Schnellschnitt: § Invasionstiefe in Myometrium sowie Vorliegen einer zervikalen Stromainfiltation oder Isthmuskarzinoms z. T. makroskopisch bzw. sonst histologisch § Indikation Schnellschnitt jedoch als Ausnahme betrachten da bei Lokalisation des Ca im Bereich der Tubenwinkel Beurteilung schwierig § Beurteilung der Ovarien auf metastatischen Befall – T 3 a bzw. FIGO IIIA Einfluss auf operatives Vorgehen § WHO Klassifikation zur Tumortypisierung - p. TMN-Klassifikation Stadieneinteilung (Wittekind et. al. 2002) § Anteil der serösen Differenzierung prozentual bei endometroiden und serösen Adenokarzinom 27

Anforderungen an histologischen Bericht Hysterktomiepräparat: n n n n Tumortyp (WHO) Grading (WHO) Lymph- oder Blutgefäßeinbrüche Staging (p. TNM und FIGO) Infiltrationstiefe mit Dicke Restmyometrium Tumorgröße R-Klassifikation (UICC) immunhistochemisch ermittelter Steroidrezeptorstatus Bei Lymphadenektomie: n Zahl histologisch untersuchter LK n Zahl befallene Lymphknoten n Lokalisation der befallenen Lymphknoten n Größter Durchmesser der größten LK n Angabe Kapseldurchbruch mit Infiltration in paranodales Fettgewebe 28

Endometriumkarzinom Prätherapeutisches Staging, Prognosefaktoren l Prognosefaktoren: Stadium Grading LVSI Peritonealzytologie Staging: klinische Untersuchung Thoraxröntgen, TVS, ev. MRT, CT Tumormarker l DIAGNOSE DURCH FRAKT. ABRASIO !! n l l 29

Prognosefaktoren: n Wert positiver Peritonealzytologie als unabhängiger Prognosefaktor zu betrachten Stadium I n Infiltrationstiefe in Myometrium, Lymph- und Blutgefäßinvasion n Estrogen- und Progesteronrezeptor eher geringer prognostischer Wert 30

Behandlung Endometriumhyperplasie Hyperplasie ohne Atypien Einfache Hyperplasie (glandulär-zystische Hyperplasie) Keine Präkanzerose Follikelpersistenz: Transformation Endometrium und Auslösung Abbruchblutung durch Gestagene 10 -14 Tage (12 -25. Zyklustag, Einsatz von Medroxyprogesteronacetat 10 -20 mg/die bzw. äquvalent) Unklare Situationen speziell bei uterinen Blutungsstörung: Ø Ø Ø Hysteroskopie Abrasio Ausschluss hormonbildender Ovarialtumore (sonograpische Kontrolle, FSH- und Östradiolbestimmung) 31

Behandlung Endometriumhyperplasie Hyperplasie ohne Atypien Komplexe Hyperplasie (adenomatöse Hyperplasie Grad 1 bzw. 2) Gestagengabe höher dosiert (Medroxyprogesteronacetat 100 mg/die, Megestrolacetat 4 x 20 mg/d p. o) nach 3 Monaten Kontrollkürettage Persistenz der Hyperplasie: Prämenopausale Patientin Kinderwunsch: Wiederholung Gestagentherapie Peri- und Postmenopausale Patientin Hysterektomie 32

Behandlung Endometriumhyperplasie Hyperplasie mit Atypien Einfache atypische Hyperplasie (glandulär-zystische Hyperplasie mit Atypien) 5 -10% Karzinomrisiko Vorgehen wie bei komplexer Hyperplasie ohne Atypie Bei Kinderwunsch: Therapie mit Gestagenen WDH Abrasio und Hysteroskopie nach 3 Monaten Abgeschlossene Familienplanung: Rat Hysterektomie 33

Behandlung Endometriumhyperplasie Hyperplasie mit Atypien Atypische Hyperplasie (adenomatöse Hyperplasie - Grad 3) 30% Karzinomrisiko Vaginale oder abdominale Hysterektomie mit/ohne Adnexe (? invasives Karzinom) Bei Kinderwunsch: Konservative Therapie wie bei komplexer Hyperplasie ohne Atypien Bei Persistenz morphologischer Veränderungen Hysterektomie empfehlen 34

Grundprinzipien der OP n n n n Fakultativ: präoperative Einlage alkoholgetränkter Tupfer bzw. Verschluss Zervikalkanal Zugang über untere mediane Laparatomie - bei reduziertem Allgemeinzustand (Adipositas, intern. Risiken) vaginaler HE besser als Strahlentherapie Spülzytologie: Douglas Raum, paracolische Rinnen, subdiaphragmatischer Raum bzw. Zytologie des Ascites Inspektion und Palpation Abdomen: Beckenorgane, Adnexe, Nachbarorgane, Intestinum, Uterus, pelvine und paraaortale LK, Netz, Leber, Zwerchfell, Peritoneum Führung Corpus uteri mit geraden stumpfen Klemmen, die Tubenabgänge mit Ligamenta rotunda erfassen Bei unklarem Stadium p. T 2 bei abgeklemmten Tuben zu OP Beginn Exstirpierter Uterus intraoperativ an Pathologie zur Abklärung Invasionstiefe und ggf. Schnellschnitt ? ? 35

Endometriumkarzinom Operation n l Vaginale Hysterektomie (Chan et al. , 2001) bei medizinisch „high risk“ Fällen: „Vaginal hysterectomy for the initial treatment of early-stage endometrial cancer is associated with a high rate of cure and minimal morbidity. “ Vaginale Hysterektomie und extraperitoneale Lymphadenektomie (Silver et al. , 2001): Vag. Hysterektomie, bil. Salpingo-Oophorektomie, extraperitoneale Lymphadenektomie: „least inavsive, . . . , short hospital stays, . . . , most-cost effective option. . . “ 36

Stellenwert des systematischen operativen Stagings n Basistherapie gewährleistet stadiengerechten Einsatz adjuvanter Massnahmen n Staging welches auch pelivine und paraaortale LK umfaßt erlaubt: n Ø beim Nachweis freier LK Verzicht auf perkutane Therapie (Ausnahme high-risk Karzinome) Ø beim Nachweis von Lymphknoten Metastasen gezielten Einsatz adjuvanter Massnahmen z. B. retroperitoneale Lymphonodektomie (systematisch -pelvine und paraaortale LK bis Nierenstiel umfassend) Ø bei Figo IA G 1 und günstige Zusatzkriterien (jung, perimenopausal, atypische Endometriumhyperplasie mit Übergang in G 1 -Karzinom) eventueller Verzicht auf Lymphonodektomie Ø Verzicht auf Lymphonodektomie bei relevanten Comorbiditäten (jedoch nicht Adipositas oder fehlende Infrastruktur zur Betreuung) dann Verlegung in gynäkologisch-onkologisches Zentrum 37

Stellenwert des systematischen operativen Stagings In fortgeschrittenen Stadien verbessert Hysterektomie und Debulking Effektivität palliativer Massnahmen Perkutane adjuvante Strahlentherapie bei FIGO I und II quoad vitam ist limitiert n n n Bei päoperativer fraktionierter Abrasio Typ II Karzinom zusätzlich Omentektomie und Entnahme von Peritonealbiopsien (inklusive Zwerchfellkuppeln) Intraoperativer Schnellschnitt der Hysterektomie oder pelviner LK obsolet in jedem Fall komplette pelvine und paraaortale Lymphonodektomie Laparoskopische Lymphonodektomie mit vaginaler HE bei Expertise Operateur ähnlich sicher wie abdominale HE –Studien z. B. AGO Uterus in Planung 38

Endometriumkarzinom Laparoskopie, Sentinel I n n l l n Laparoskopie (Eltabbakh et al. , 2001): 90 Patientinnen mit LAVH behandelt: 5. 8% Umstieg auf Laparotomie „early stage. . . Can be treated with laparoscopy with an excellent surgical outcome, shorter hospitalization, earlier recovery, and improved quality, but. . . Higher financial cost. “ Sentinel: kaum Daten, jedoch „routes of lymphatic spread (Mariani et al. , 2001): Iliaca ext. als die am haüfigsten befallene Lymphknoten= gruppe unabhängi vom Stadium 39

Endometriumkarzinom Laparoskopie II n l n l n Laparoskopie (Malur et al. , 2001): Laparoskopie versus Laparotomie: W“. . . Lower perioperative morbidity. . . “ Cave (Faught et al. , 1999): Port-site Metastasen bei mit Laparoskopie behandelten Patientinnen mit Frühstadien des Endometriumkarzinoms ! Cave (Sonoda et al. , 2001): LAVH signifikant öfter mit positiver Peritonealzytologie assoziiert !!! Aber auch bei der Laparotomie kann es zur Zellverschleppung kommen ! (Ryo et al. , 2001) 40
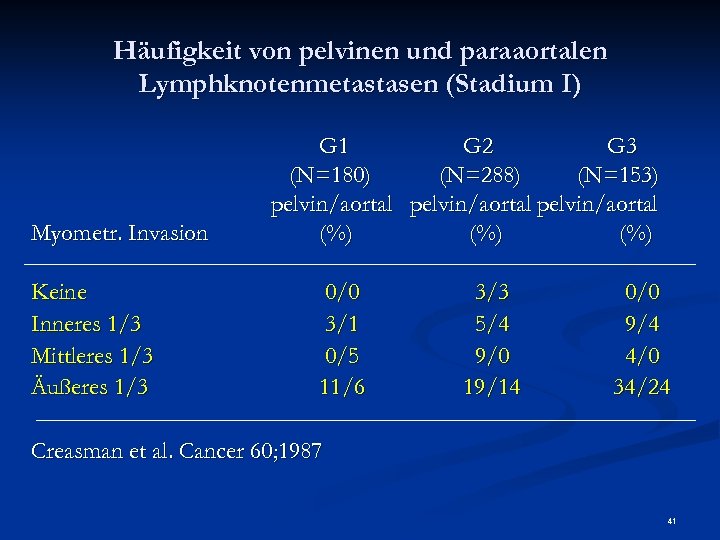
Häufigkeit von pelvinen und paraaortalen Lymphknotenmetastasen (Stadium I) Myometr. Invasion Keine Inneres 1/3 Mittleres 1/3 Äußeres 1/3 G 1 G 2 G 3 (N=180) (N=288) (N=153) pelvin/aortal (%) (%) 0/0 3/1 0/5 11/6 3/3 5/4 9/0 19/14 0/0 9/4 4/0 34/24 Creasman et al. Cancer 60; 1987 41

Beurteilung pelviner und paraaortaler LK -Bestandteil intraoperativen StagingsØ Entscheidung zur Lymphadenektomie (pelvin und paraaortal) nach Risikobzw. Prognosefaktoren bzw. Allgemeinzustand 42

OP stadienabhängig FIGO Ia G 1 n Totale abdominelle HE, Adnexektomie beiderseits, Zytologie, +/Lymphonodektomie pelvin u. paraaortal (kein Sampling) > 15 LKN FIGO Ia (G 2 -G 3) –Ic G 3 n Totale abdominelle HE mit Adnexektomie beiderseits, Zytologie Lymphonodektomie pelvin u. paraaortal (kein Sampling) abhängig von Risikofaktoren > 15 LKN 43

OP stadienabhängig FIGO IIa kein makroskopischer Befall der Zervix (Hysteroskopie) oder des zervikalen Stromas (Abradat) n Totale abdominale HE mit Adnexektomie beiderseits, pelvine und paraaortale Lymphadenektomie, Zytologie Es wird diskutiert in Stadium IIa: Einfache HE, pelvine und ggf. paraaortale Lymphadenektomie FIGO IIb Zervixbefall (Hysteroskopie ) und/oder Befall des zervikalen Stromas (Abradat) n Erweitert radikale abdominale HE mit Adnexektomie beiderseits, pelvine und paraaortale Lymphadenektomie, Zytologie 44

OP stadienabhängig FIGO IIIa (extrauterine, intraabdominelle Ausdehnung) IIIc n Totale abdominelle HE mit Adnexektomie beiderseits, pelvine und paraaortale Lymphadenektomie, Omentektomie, Debulking FIGO IIIb (vaginale Ausdehnung) Je nach Befund, lokaler Operabilität, Allgemeinzustand n Erweitert radikale abdominale HE mit Adnexektomie beiderseits, partieller/kompletter Kolpektomie, pelvine und paraaortale Lymphadenektomie oder n Hysterektomie mit Adnektomie bds. , Tumorexzision-Debulking aus der Scheide ggf. Lymponodektomie 45

OP stadienabhängig FIGO IV a (Tumorausbreitung mit Infiltration Harnblase und/oder Rektumschleimhaut) n bei isoliertem Befall von Blase und/oder Rektum ggf. vordere oder hintere Exenteration mit erweiterter radikaler HE, Adnexektomie beiderseits, pelvine und paraaortale Lymphadenektomie FIGO IVb (Fernmetasasen) n Kombinierter Einsatz OP, Bestrahlung, Gestagene, Zytostatika Bei guter lokaler Operabilität HE zur Blutstillung. Debulking zur Verbesserung der Effizienz der systemischen oder strahlentherapeutischen pallitaiven Maßnahmen Bei isolierten inguinalen und/oder operablen intaperitonealen Metastasen OP wie Stadium III 46

OP stadienabhängig Typ II Karzinome (seröse und klarzellige Karzinome) Stadien gerechte OP wie Typ I Karzinome Zusätzlich: n Omentektomie n Multiple peritoneale Biopsien n Wenn extrauterine Manifestation maximales Tumor Debulking zur Verbesserung der Effizienz systemischer oder strahlentherapeutischer palliativer Massnahmen Vorgehen bei inadäquatem operativen Staging n Stadium IA G 1, G 2: Nachsorge n Stadium IB G 1: Nachsorge oder Brachytherapie n Stadium IB G 2: Nachsorge oder Brachytherapie n Stadium IB G 3, IC, II: Korrektes operatives Staging nachholen dann stadiengerechte adjuvante Therapie 47

Primäre Strahlentherapie bei inoperablen Patienten Indikation zur kombinierten Tele-Brachytherapie Stadium I-III n Alleinige Brachytherapie bei kleinen Tumoren, red. Allgemeinzustand n Stadium IV primäre perkutane Bestrahlung kleines Becken n 48

Adjuvante Strahlentherapie nach Hysteradnexektomie (HAE) 1. p. T 1 a. G 1/2; p. T 1 b. G 1 c. N 0: keine adjuvante Therapie 2. p. T 1 a. G 3; p. T 1 b. G 2/3 c. N 0: Brachytherapie der Scheide (bei Risikofaktoren G 3 tiefe myometrane Infiltration, L 1, Alter > 60 Jahre kann zusätzliche Teletherapie des Beckens erwogen werden 3. p. T 1 c, p. T 2 a/b, p. T 3 a/b/c c. N 0 und alle T und c. N+: Teletherapie+/- Brachytherapie 4. Alle serösen und klarzelligen Karzinome: Teletherapie +/- Brachytherapie, alternativ Ganzabdomenbestrahlung +/- Brachytherapie 49

Systemische Therapie Ergebnisse von adjuvanter, systemischer Hormontherapie oder Chemotherapie entäuschend und bis heute nicht indiziert Ausnahme evtl. seröses Adenokarzinom mit platinhaltiger adjuvanter Therapie 50

Endometriumkarzinom Chemotherapie n l n n l Phase I für „advanced disease“: Paclitaxel + Doxorubicin + Cisplatin mit G-CSF (Fleming et al. , 2001) Tamoxifen enttäuschte in der Therapie von rezidivierenden oder fortgeschritteen Endometriumkarznomen (Thigpen et al. , 2001) High-risk Endometriumkarzinom: konkomitante Radiotherapie mit Paclitaxel als „safe and accaptable treatment“, Phase I (Frigerio et al. , 2001) 51

Rezidiv/Metastasen n Stadium Ia G 1, Ia G 2, Ib G 1 3 -4% n Stadium Ic-IIIb 70% erste 3 Jahre Ø Ø 80% Scheidenrezidiv erste 2 Jahre Vaginale Rezidive Therapie möglich 5 Jahresüberlebensrate 40 -50% (Behandlung: OP Strahlentherapie bzw. Kombination) n 1. Wahl Hormontherapie falls keine OP oder Strahlentherapie möglich (Gestagentherapie 200 mg Medroxyprogesteron-acetat/die p. o. ) abhängig von Rezeptorstatus n Zytostatika: Adriamycin, Cisplatin, Ifosfamid bzw. Epirubicin Carboplatin Ø Remissionsdauer 3 -4 Monate. Mediane Überlebenszeit 6 -8 Monate Anastrozol und Letrozol bisher minimale Aktivität – Studien zu Fulvestrant laufen - Doxetaxel Uterus 4 Studie abegeschlossen gute Wirksamkei t- Pacitaxel/Carboplatin z. Zt. zunehmend eingesetzt aufgrund vertretbarer Toxizität 52

Endometriumkarzinom Nachsorge n l l l Frühstadien weisen 15 % Rezidivrate auf: 75% aller Rezidive in den ersten 3 Jahren 30% lokoregionäre und 70% systemische Rezidive: Lunge, Abdomen, Lymphknoten, Leber Nach Rezidiv 5 -Jahresüberlebensrate <10% Nachsorgeschema: Klinische Untersuchung Lungenröntgen Symptomorientierte Diagnostik 53

Nachsorge n Psychische u. soziale Betreuung. Selten Einstufung Schwerbehinderung >50% n Viele behandlungsbedürftige Begleiterkrankungen, 6 -10% Zweitmalignome - Mamma u. Magen –Darm- Trakt n Nachsorgeprogramm: Gynäkologische Untersuchung, Zytologie Scheidenabschluss unter kolposkopischer Kontrolle. In ersten 3 Jahren post OP vierteljährlich Früherkennung von Metastasen anhand Blutuntersuchung oder Bildgebung kein Vorteil hinsichtlich Überleben n Systemische Östrogen-Gestagen-Substitution im Stadium I bedarf individueller Beurteilung 54

Endometriumkarzinom Zusammenfassung n n l n Das Endometriumkarzinom gilt als das häufigste gynäkologische Malignom: Standards vorhanden: operatives Management, keine adjuvante Therapie bei low-risk Frühstadien; LSK zunehmend etabliert EBM I Standards fehlen: Screening, Diagnose, adjuvanter Therapie, Nachsorge, Rezidivbehandlung usw. Prospektive Studien und Expertenkonsensus bis adäquate Ergebnisse vorhanden sind von derzeit von größter Bedeutung !!! 55
1fcfc55a2c99465509cb9c3cf264a8ad.ppt