Report7-ЭСК.ppt
- Количество слайдов: 39

Эмбриональные и тканевые стволовые клетки
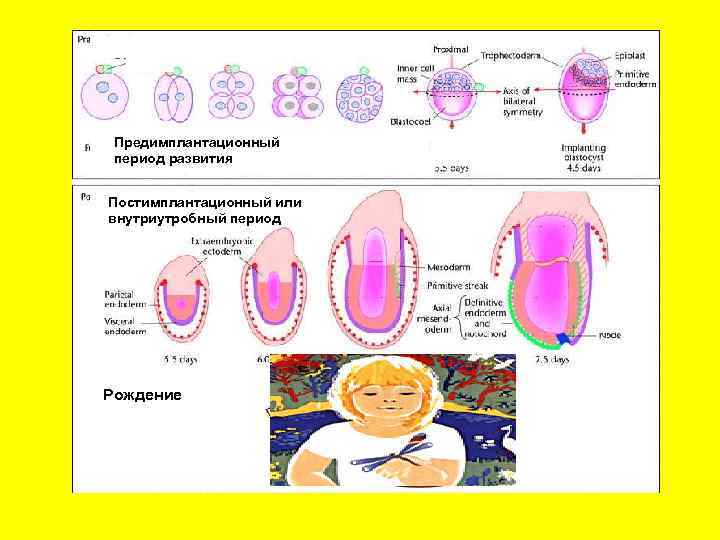
Предимплантационный период развития Постимплантационный или внутриутробный период Рождение
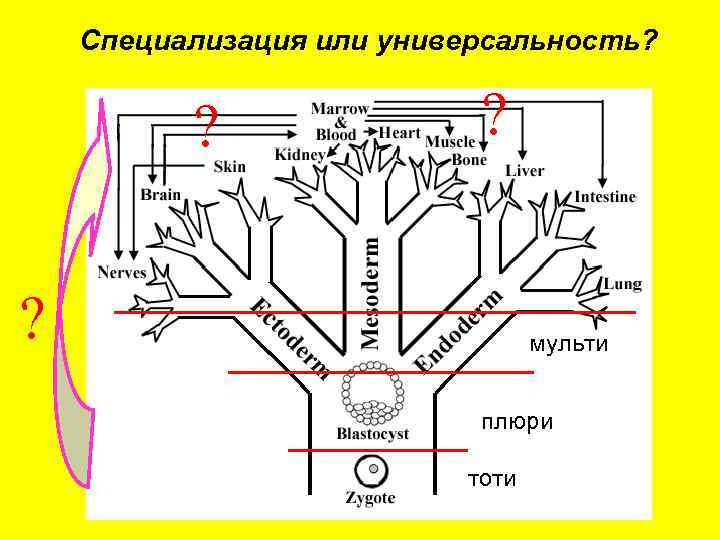
Специализация или универсальность? ? мульти плюри тоти

• Определения Тотипотентные– (полностью, лат) дифференцировка в трофоэктодерм, ткани эмбриона, и постэмбриональные ткани 3 х зародышевых слоев. Плюрипотентные – (много, греч. ) дифференцировка в ткани эмбриона и постэмбриональные ткани 3 х зародышевых слоев. Мультипотентные – (много, лат. ) дифференцировка в ткани внутри зародышевых слоев ? ? ? Олигопотентные – (несколько, греч. ) дифференцировка в разные клетки в пределах определенной ткани Предшественники – дифференцировка в определенные клетки в пределах определенной ткани Зигота Эмбриональные стволовые клетки Соматические стволовые клетки Гемопоэтические, нейральные
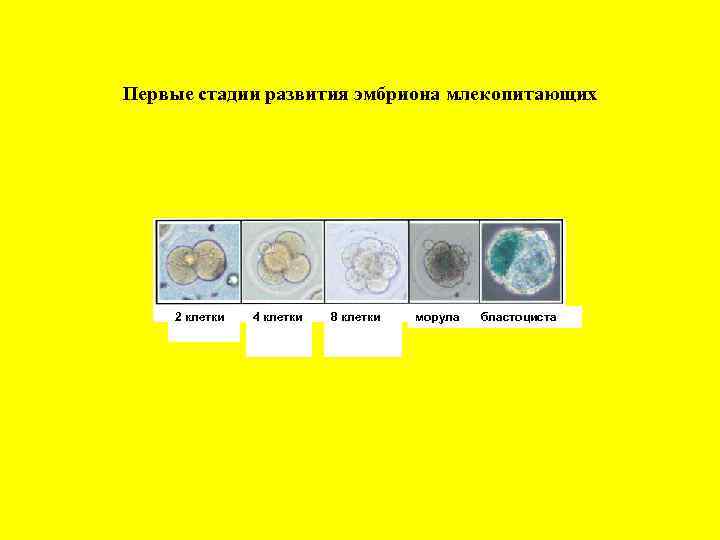
Первые стадии развития эмбриона млекопитающих 2 клетки 4 клетки 8 клетки морула бластоциста
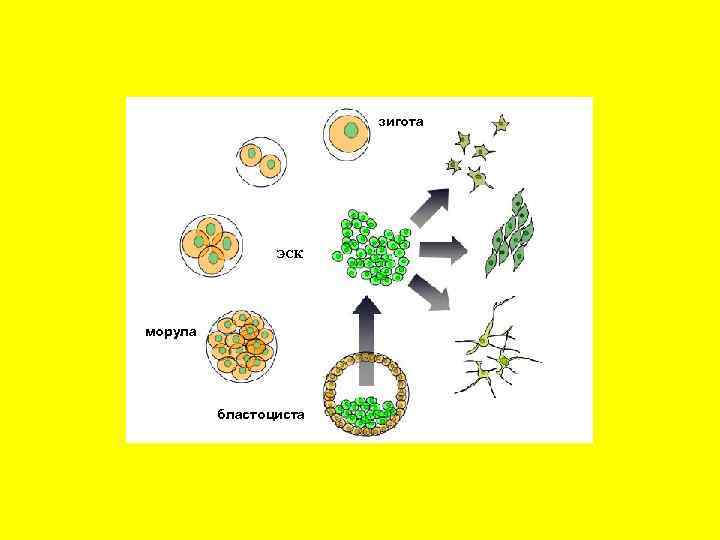
зигота ЭСК морула бластоциста

Свойства ЭС клеток 1. ЭСК клетки сохраняют потенциал при длительном культивировании in vitro (свыше 1 года) 2. ЭСК клетки размножаются практически безгранично 3. ЭСК клетки сохраняют нормальный хромосомный состав

Мышиные ЭСК с генотипом 129 способны давать начало ВСЕМ клеткам взрослого организма ЭСК: Мышиные других линий Свиньи Кролика Приматов J. Cell. Mol. Med. Vol 8, No 4, 2004 Может быть НЕ очень нормальная генетика (повышенная частота тератом) дает преимущество ЭСК из 129 линии?

Оценка потенциала ЭСК в системе in vitro Длительное культивирование in vitro требует специальных условий ЭСК способны к индуцированной и управляемой дифференцировки in vitro ЭСК способны дифференцироваться в любые клетки взрослого организма ЭСК способны дифференцироваться в тканевые структуры ЭСК способны дифференцироваться даже в половые клетки
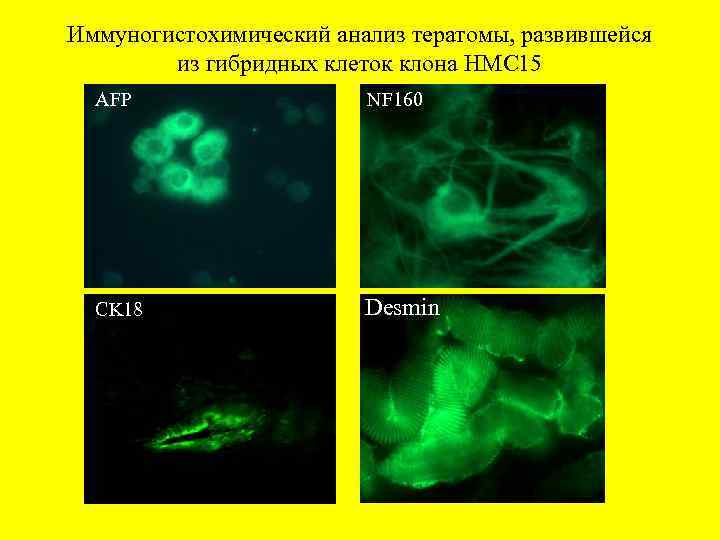
Иммуногистохимический анализ тератомы, развившейся из гибридных клеток клона НМС 15 AFP NF 160 CK 18 CK 1 Desmin

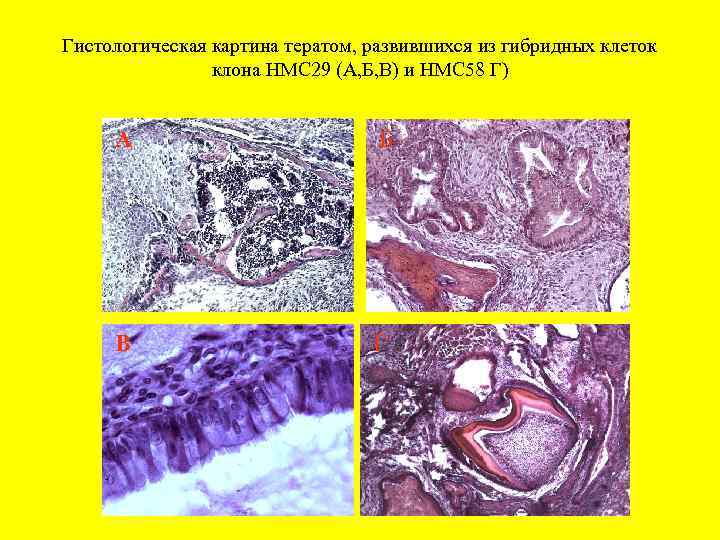
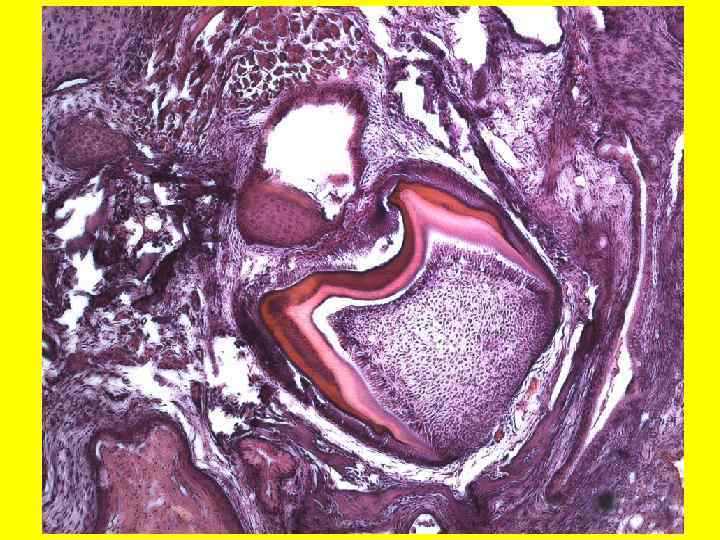
Гистологическая картина тератом, развившихся из гибридных клеток клона НМС 29 (А, Б, В) и НМС 58 Г) A Б В Г
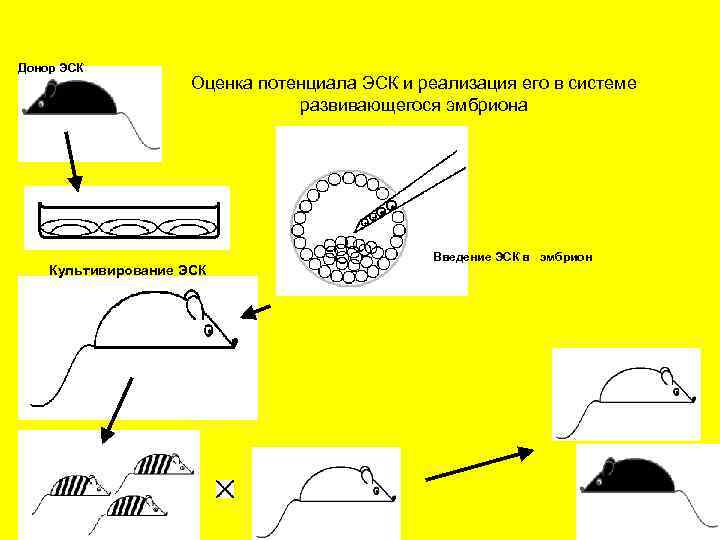
Донор ЭСК Оценка потенциала ЭСК и реализация его в системе развивающегося эмбриона Культивирование ЭСК Введение ЭСК в эмбрион

Оценка потенций гибридных клеток НESS 2 путем введения их в бластоцисту линии C 57 BL Слева – мышь С 57 BL, донор бластоцист; В центре - мышь 129/Ola, донор НМ-1 клеток; Справа - химерная самка, развившаяся из бластоцисты, в которую были инъецированы клетки НESS 2


Схема стратегии выделения клеток-предшественников сперматогенеза из культур эмбриональных стволовых клеток мыши с использованием двух генно-инженерных конструкций с генами репортерами, GFP и Ds. Red под контролем промоторов гена Stra 8 (1, 4 т. п. о. ) и гена Prm 1 (0, 5 т. п. о. ). Эти районы промоторов способны определять специфическую экспрессию репортерных генов в пре-мейотических и гаплоидных сперматогониальных клетках. Обе конструкции содержат ген neomycin phosphotransferase II (Neo-resistant) под контролем промотора «раннего» белка и энхансера вируса SV 40 (Nayernia et al. , 2006)

Hubner et al. Derivation of oocytes from mouse embryonic stem cells. Science 2003, 300: 1251 -1256.
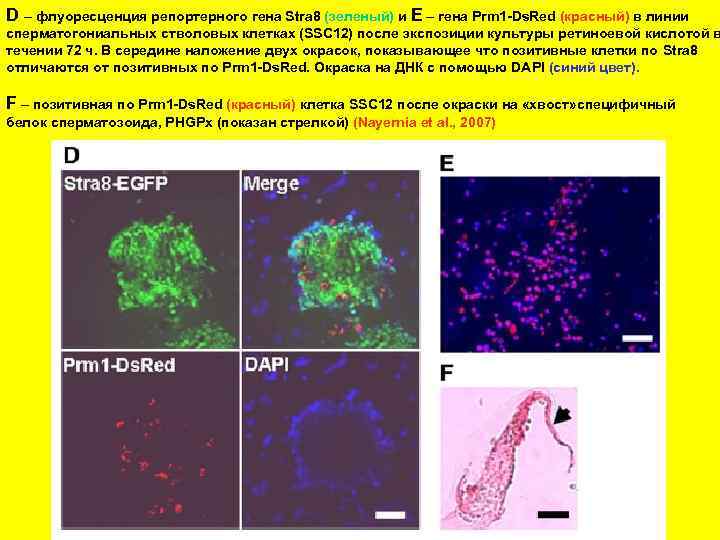
D – флуоресценция репортерного гена Stra 8 (зеленый) и E – гена Prm 1 -Ds. Red (красный) в линии сперматогониальных стволовых клетках (SSC 12) после экспозиции культуры ретиноевой кислотой в течении 72 ч. В середине наложение двух окрасок, показывающее что позитивные клетки по Stra 8 отличаются от позитивных по Prm 1 -Ds. Red. Окраска на ДНК с помощью DAPI (синий цвет). F – позитивная по Prm 1 -Ds. Red (красный) клетка SSC 12 после окраски на «хвост» специфичный белок cперматозоида, PHGPx (показан стрелкой) (Nayernia et al. , 2007)
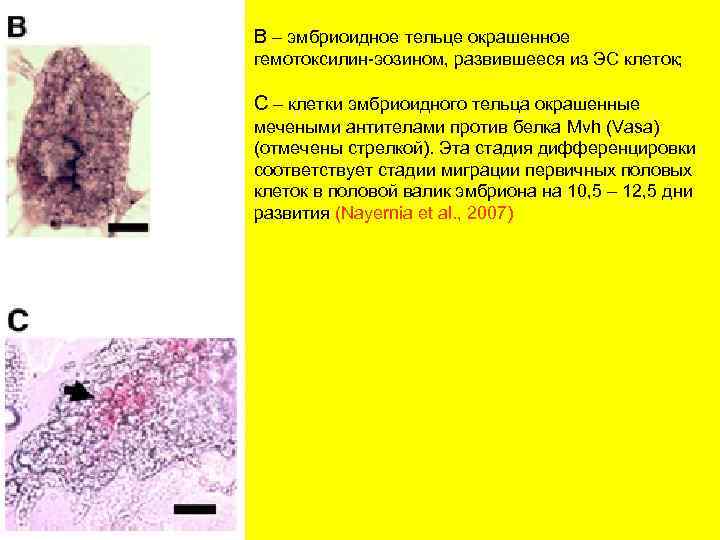
В – эмбриоидное тельце окрашенное гемотоксилин-эозином, развившееся из ЭС клеток; С – клетки эмбриоидного тельца окрашенные мечеными антителами против белка Mvh (Vasa) (отмечены стрелкой). Эта стадия дифференцировки соответствует стадии миграции первичных половых клеток в половой валик эмбриона на 10, 5 – 12, 5 дни развития (Nayernia et al. , 2007)
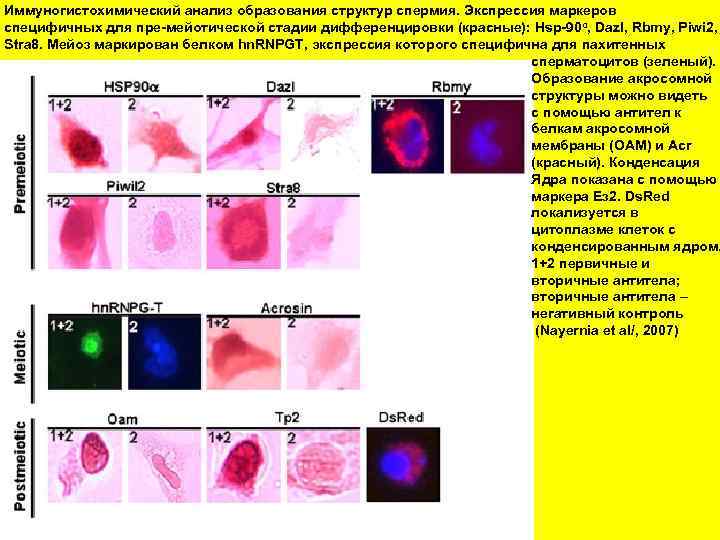
Иммуногистохимический анализ образования структур спермия. Экспрессия маркеров специфичных для пре-мейотической стадии дифференцировки (красные): Hsp-90α, Dazl, Rbmy, Piwi 2, Stra 8. Мейоз маркирован белком hn. RNPGT, экспрессия которого специфична для пахитенных сперматоцитов (зеленый). Образование акросомной структуры можно видеть с помощью антител к белкам акросомной мембраны (OAM) и Acr (красный). Конденсация Ядра показана с помощью маркера Ез 2. Ds. Red локализуется в цитоплазме клеток с конденсированным ядром. 1+2 первичные и вторичные антитела; вторичные антитела – негативный контроль (Nayernia et al/, 2007)
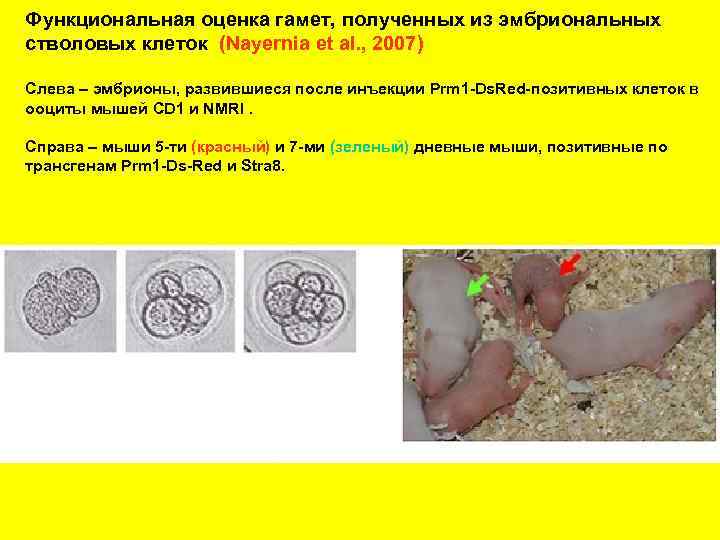
Функциональная оценка гамет, полученных из эмбриональных стволовых клеток (Nayernia et al. , 2007) Слева – эмбрионы, развившиеся после инъекции Prm 1 -Ds. Red-позитивных клеток в ооциты мышей CD 1 и NMRI. Справа – мыши 5 -ти (красный) и 7 -ми (зеленый) дневные мыши, позитивные по трансгенам Prm 1 -Ds-Red и Stra 8.
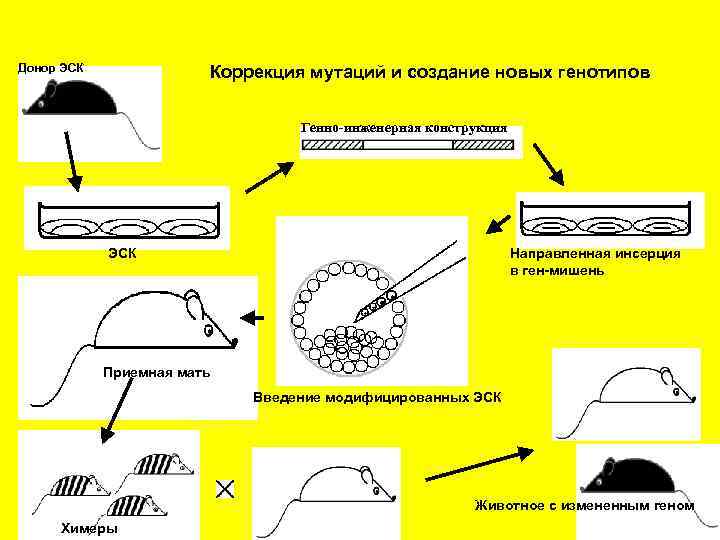
Донор ЭСК Коррекция мутаций и создание новых генотипов Генно-инженерная конструкция ЭСК Направленная инсерция в ген-мишень Приемная мать Введение модифицированных ЭСК Животное с измененным геном Химеры

Способы направленной генетической модификации геномов ЭСК и возможности генетической коррекции мутантных генов Введение новых натуральных генов или генно-инженерных конструкций посредством трансфекции ЭСК Ген-направленные мутации или коррекции мутаций Направленное воздействие на функции индивидуальных генов Перенос индивидуальных хромосом от одного индивидуума в геном другого Создание новых кариотипов

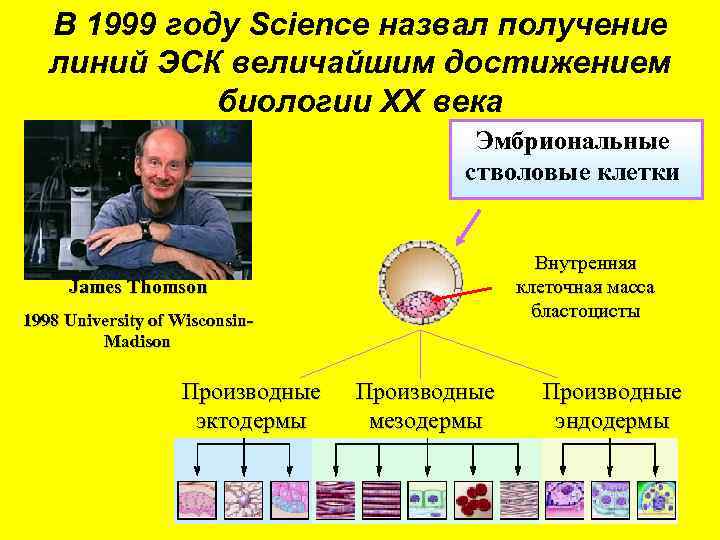
В 1999 году Science назвал получение линий ЭСК величайшим достижением биологии ХХ века Эмбриональные стволовые клетки Внутренняя клеточная масса бластоцисты James Thomson 1998 University of Wisconsin. Madison Производные эктодермы Производные мезодермы Производные эндодермы
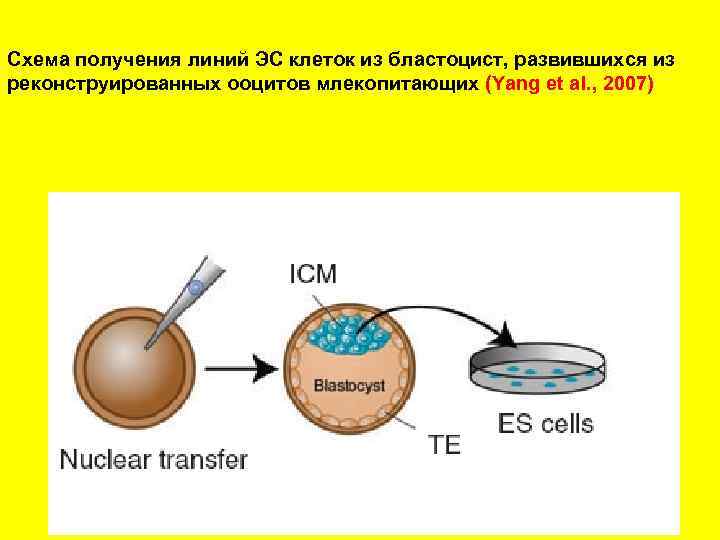
Схема получения линий ЭС клеток из бластоцист, развившихся из реконструированных ооцитов млекопитающих (Yang et al. , 2007)
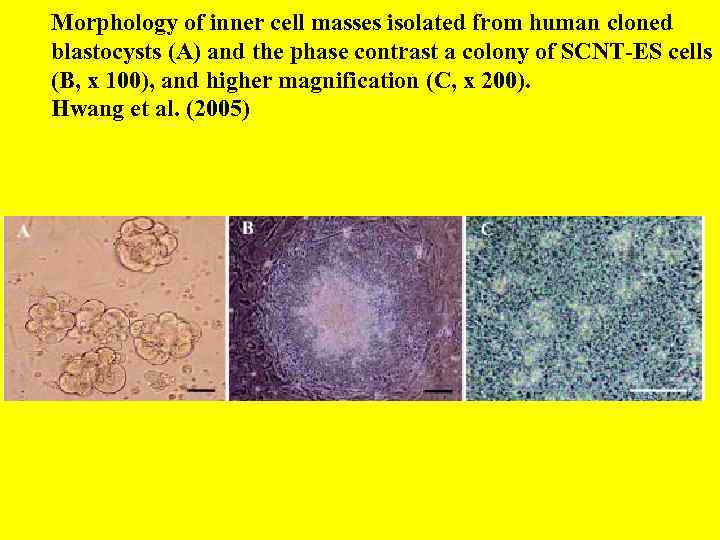
Morphology of inner cell masses isolated from human cloned blastocysts (A) and the phase contrast a colony of SCNT-ES cells (B, x 100), and higher magnification (C, x 200). Hwang et al. (2005)
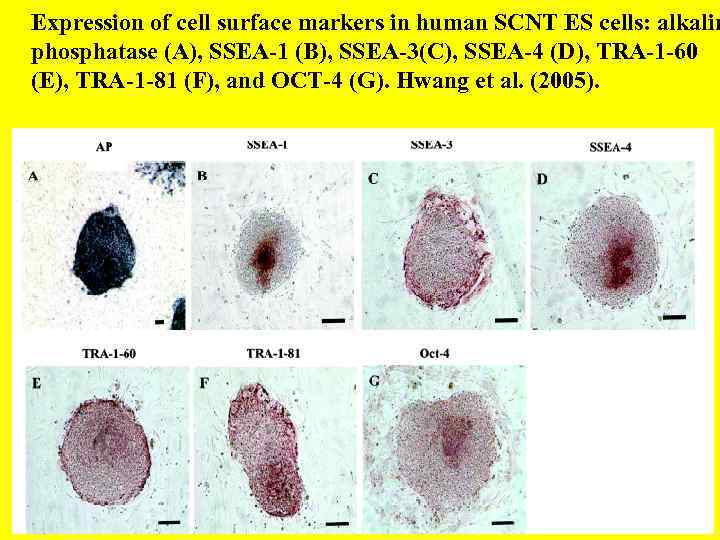
Expression of cell surface markers in human SCNT ES cells: alkalin phosphatase (A), SSEA-1 (B), SSEA-3(C), SSEA-4 (D), TRA-1 -60 (E), TRA-1 -81 (F), and OCT-4 (G). Hwang et al. (2005).
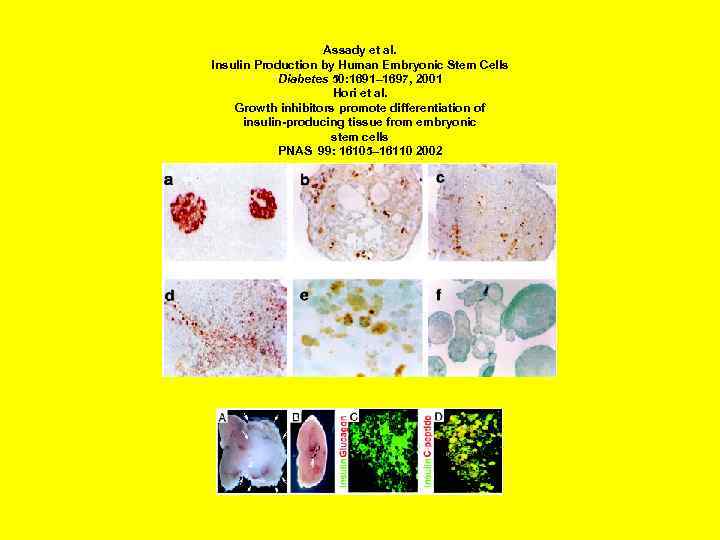
Assady et al. Insulin Production by Human Embryonic Stem Cells Diabetes 50: 1691– 1697, 2001 Hori et al. Growth inhibitors promote differentiation of insulin-producing tissue from embryonic stem cells PNAS 99: 16105– 16110 2002
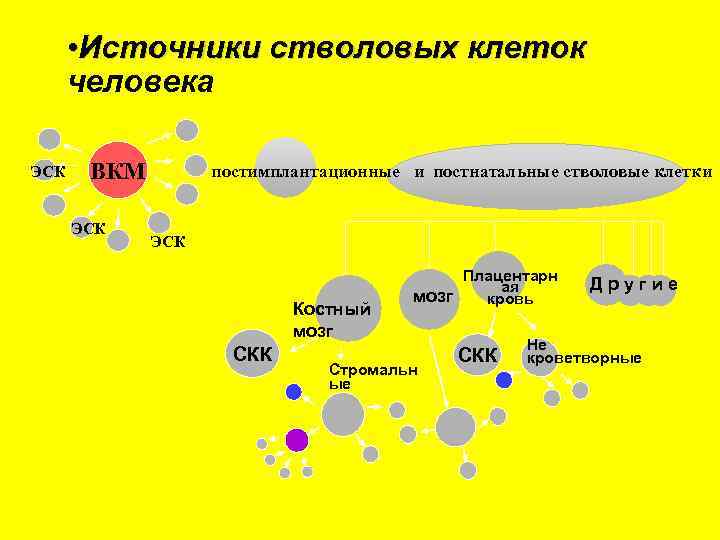
• Источники стволовых клеток человека ЭСК ВКМ ЭСК постимплантационные и постнатальные стволовые клетки ЭСК Костный мозг СКК Плацентарн ая мозг кровь Стромальн ые СКК Другие Не кроветворные
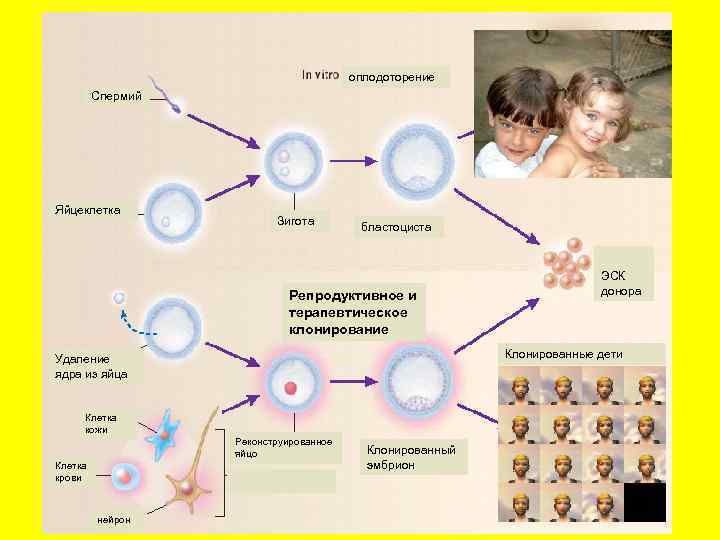
оплодоторение Спермий Яйцеклетка Зигота бластоциста Репродуктивное и терапевтическое клонирование Клонированные дети Удаление ядра из яйца Клетка кожи Реконструированное яйцо Клетка крови нейрон ЭСК донора Клонированный эмбрион
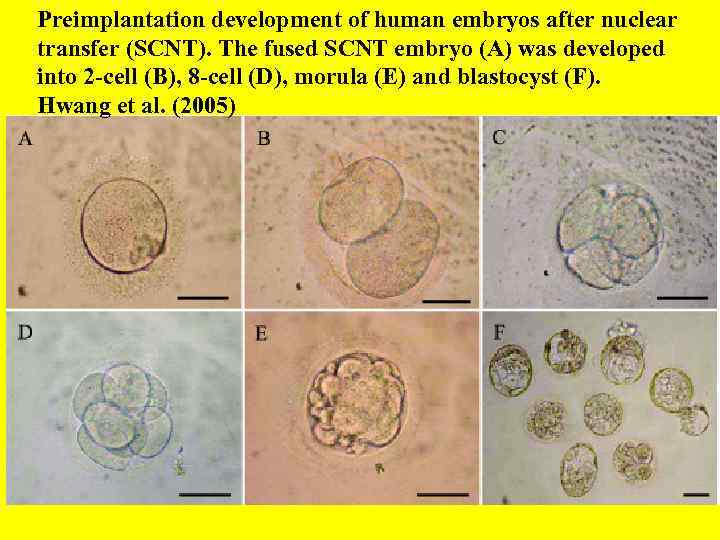
Preimplantation development of human embryos after nuclear transfer (SCNT). The fused SCNT embryo (A) was developed into 2 -cell (B), 8 -cell (D), morula (E) and blastocyst (F). Hwang et al. (2005)

Необходимые условия для развития терапевтического клонирования и регенеративной медицины с использованием ЭСК 1. Совершенствование методов управления дифференцировкой ЭСК на основе фундаментальных исследований; 2. Оценить риски связанные с мутациями на генном и хромосомном уровнях; 3. Оценка онкологического риска применении ЭСК в терапии;
Report7-ЭСК.ppt