edeeb4ee47ff0ee4d18ef254198c5661.ppt
- Количество слайдов: 37
 Елица Павлова Осигуряване на Качеството 05/12/2007 GMP ИЗИСКВАНИЯ КЪМ ПРОЦЕСИТЕ НА ОПАКОВАНЕ И ЕТИКЕТИРАНЕ
Елица Павлова Осигуряване на Качеството 05/12/2007 GMP ИЗИСКВАНИЯ КЪМ ПРОЦЕСИТЕ НА ОПАКОВАНЕ И ЕТИКЕТИРАНЕ
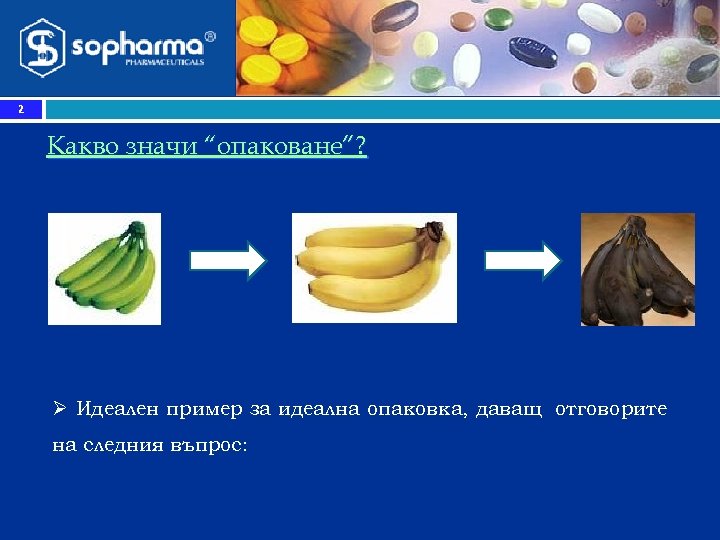 2 Какво значи “опаковане”? Ø Идеален пример за идеална опаковка, даващ отговорите на следния въпрос:
2 Какво значи “опаковане”? Ø Идеален пример за идеална опаковка, даващ отговорите на следния въпрос:
 3 Защо е необходимо да се опакова лекарственият продукт? Ø Предпазване и съхранение Ø Идентификация и информация Ø Удобство
3 Защо е необходимо да се опакова лекарственият продукт? Ø Предпазване и съхранение Ø Идентификация и информация Ø Удобство
 4 Какви материали се използват за опаковане? Ø Стъкло Ø Алуминиево фолио Ø PVC фолио Ø Хартия Ø Картон
4 Какви материали се използват за опаковане? Ø Стъкло Ø Алуминиево фолио Ø PVC фолио Ø Хартия Ø Картон
 5 Типове опаковки Ø Първични опаковки ü Защита на лекарствения продукт ü Директен контакт с продукта Ø Вторични опаковки ü Идентификация ü Допълнителна защита на продукта
5 Типове опаковки Ø Първични опаковки ü Защита на лекарствения продукт ü Директен контакт с продукта Ø Вторични опаковки ü Идентификация ü Допълнителна защита на продукта
 6 EU GMPs Ø 5. 2 Всички действия, свързани с материалите и продуктите (приемане, карантина, анализ, съхранение, етикетиране, освобождаване, разработване, опаковане и разпространение), трябва да се извършват в съотвествие с писмени процедури или инструкции и, където е необходимо, записани. * Това изискване присъства и в 21 CFR, Subpart G - Контрол върху пакетиране и етикетиране § 211. 122 – Изследване на материали и критерии за употреба.
6 EU GMPs Ø 5. 2 Всички действия, свързани с материалите и продуктите (приемане, карантина, анализ, съхранение, етикетиране, освобождаване, разработване, опаковане и разпространение), трябва да се извършват в съотвествие с писмени процедури или инструкции и, където е необходимо, записани. * Това изискване присъства и в 21 CFR, Subpart G - Контрол върху пакетиране и етикетиране § 211. 122 – Изследване на материали и критерии за употреба.
 7 EU GMPs Ø 5. 40 Към поръчките, употребата и контрола на първичните. . . опаковъчни материали трябва да се обръща същото внимание, както към другите изходни материали: ü СОП – ове ü Утвърдени спецификации ü Одити
7 EU GMPs Ø 5. 40 Към поръчките, употребата и контрола на първичните. . . опаковъчни материали трябва да се обръща същото внимание, както към другите изходни материали: ü СОП – ове ü Утвърдени спецификации ü Одити
 8 EU GMPs Ø 5. 41 Съществено значение трябва се обръща на отпечатаните материали: ü Не е позволен достъп на неоторизирани лица до складовете, в които се съхраняват. ü Единичните етикети и други насипни материали се съхраняват и транспортират в отделни контейнери, за да се предотврати смесване (mix – up). ü Само оторизиран и обучен персонал има право да отпуска за употреба опаковъчния материал.
8 EU GMPs Ø 5. 41 Съществено значение трябва се обръща на отпечатаните материали: ü Не е позволен достъп на неоторизирани лица до складовете, в които се съхраняват. ü Единичните етикети и други насипни материали се съхраняват и транспортират в отделни контейнери, за да се предотврати смесване (mix – up). ü Само оторизиран и обучен персонал има право да отпуска за употреба опаковъчния материал.
 9 EU GMPs Ø 5. 42 Всяка поръчка или партида. . . опаковъчен материал би трябвало да получи уникален референтен номер/ идентификационен знак. Ø 5. 43 Първични опаковъчни материали с изтекъл срок на годност. . . трябва да бъдат унищожени и това да бъде документирано.
9 EU GMPs Ø 5. 42 Всяка поръчка или партида. . . опаковъчен материал би трябвало да получи уникален референтен номер/ идентификационен знак. Ø 5. 43 Първични опаковъчни материали с изтекъл срок на годност. . . трябва да бъдат унищожени и това да бъде документирано.
 10 EU GMPs Ø 5. 44 Когато се прави програма за опаковане, особено внимание трябва да се обърне на действия, свързани с минимизиране на риска от кръстосано смесване или замяна. замърсяване,
10 EU GMPs Ø 5. 44 Когато се прави програма за опаковане, особено внимание трябва да се обърне на действия, свързани с минимизиране на риска от кръстосано смесване или замяна. замърсяване,
 11 21 CFR, Subpart G Контрол върху опаковане и етикетиране Ø § 211. 122 (а). . . Опаковъчни и етикетиращи материали, преди да бъдат използвани ü е необходимо да бъдат взети съответен брой проби; ü да бъдат анализирани. (h) Всички печатни устройства на производствената линия трябва да бъдат проверявани, за да се осигури съответствието на етикетите с утвърдените спецификации
11 21 CFR, Subpart G Контрол върху опаковане и етикетиране Ø § 211. 122 (а). . . Опаковъчни и етикетиращи материали, преди да бъдат използвани ü е необходимо да бъдат взети съответен брой проби; ü да бъдат анализирани. (h) Всички печатни устройства на производствената линия трябва да бъдат проверявани, за да се осигури съответствието на етикетите с утвърдените спецификации
 12 21 CFR, Subpart G Контрол върху опаковане и етикетиране § 211. 125 Отпечатване на етикeти (d) Излишъкът отпечатани етикети, съдържащи партиден номер/ срок на годност, трябва да бъде унищожен. (е) Върнатите немаркирани етикети трябва да бъдат съхранявани по начин, осигуряващ идентификация и непозволяващ смесване (f) Писмените процедури трябва да описват с подробности процеса на отпечатване, етикетиране, освобождаване * Тези изисквания присъстват и в EU GMPs 5. 57 контрол и
12 21 CFR, Subpart G Контрол върху опаковане и етикетиране § 211. 125 Отпечатване на етикeти (d) Излишъкът отпечатани етикети, съдържащи партиден номер/ срок на годност, трябва да бъде унищожен. (е) Върнатите немаркирани етикети трябва да бъдат съхранявани по начин, осигуряващ идентификация и непозволяващ смесване (f) Писмените процедури трябва да описват с подробности процеса на отпечатване, етикетиране, освобождаване * Тези изисквания присъстват и в EU GMPs 5. 57 контрол и
 13 Спецификации - EU Chapter 4: Документация Ø Трябва да има подходящи и валидни спецификации за. . . опаковъчни материали. . . , които включват: ü Наименование на продукта ü Инструкции за пробовземане и анализ ü Препратки към фармакопейни статии ü Лекарствена форма, доза и големина на разфасовката ü Условия за съхранение и предпазни мерки ü Максимален период на съхранение преди преанализ ü Одобрени доставчици/ производители ü Мостра – одобрена и утвърдена
13 Спецификации - EU Chapter 4: Документация Ø Трябва да има подходящи и валидни спецификации за. . . опаковъчни материали. . . , които включват: ü Наименование на продукта ü Инструкции за пробовземане и анализ ü Препратки към фармакопейни статии ü Лекарствена форма, доза и големина на разфасовката ü Условия за съхранение и предпазни мерки ü Максимален период на съхранение преди преанализ ü Одобрени доставчици/ производители ü Мостра – одобрена и утвърдена
 14 Прoбовземане - EU annex 8 Ø Планът за пробовземане трябва да разглежда приетото количество, изискваното качество, природа на материала, методи за производство и информация за ОК системата на производителя. Ø Статистически определеният брой проби също се включва в Плана за пробовземане.
14 Прoбовземане - EU annex 8 Ø Планът за пробовземане трябва да разглежда приетото количество, изискваното качество, природа на материала, методи за производство и информация за ОК системата на производителя. Ø Статистически определеният брой проби също се включва в Плана за пробовземане.
 15 Прoбовземане Ø Пробовземането следва Military Standard и ISO 15378 Първични опаковъчни материали за фармацевтични продукти. ØКачество се определя от: ü история на доставчика ü критични елементи (за асептични продукти и най – малкият дефект може да доведе до липса на стерилност)
15 Прoбовземане Ø Пробовземането следва Military Standard и ISO 15378 Първични опаковъчни материали за фармацевтични продукти. ØКачество се определя от: ü история на доставчика ü критични елементи (за асептични продукти и най – малкият дефект може да доведе до липса на стерилност)
 П 16 Прoбовземане - EU annex 8 Ø Валидни заключения не могат да се базират върху анализи, проведени с непредставителни проби. Ø Правилното пробовземане е съществена част от ОК Ø Персоналът трябва да бъде обучен върху плановете за взимане на проби, СОП – ове, техники и оборудване, за да се минимизира замърсяването, отклонения в записите/ необичайни явления
П 16 Прoбовземане - EU annex 8 Ø Валидни заключения не могат да се базират върху анализи, проведени с непредставителни проби. Ø Правилното пробовземане е съществена част от ОК Ø Персоналът трябва да бъде обучен върху плановете за взимане на проби, СОП – ове, техники и оборудване, за да се минимизира замърсяването, отклонения в записите/ необичайни явления
 17 Тестване на Първични опаковъчни материали Ø Преглед на сертификата за анализ на производителя ü Сертификатът за качество трябва да включва следната информация: o Наименование o Партиден номер (ако не е посочен, потребителят има право да образува собствен партиден писмени и утвърдени процедури) o Показатели, норми и резултати o Заключение номер, съгласно
17 Тестване на Първични опаковъчни материали Ø Преглед на сертификата за анализ на производителя ü Сертификатът за качество трябва да включва следната информация: o Наименование o Партиден номер (ако не е посочен, потребителят има право да образува собствен партиден писмени и утвърдени процедури) o Показатели, норми и резултати o Заключение номер, съгласно
 18 Тестване на Първични опаковъчни материали Ø Физико – химичен анализ Ø Може да се прлилагат други изследвания - киселинност/ основност на стъкло; тестване на комбинация от елементи (шише и капачка; капкомер, капачка и шише)
18 Тестване на Първични опаковъчни материали Ø Физико – химичен анализ Ø Може да се прлилагат други изследвания - киселинност/ основност на стъкло; тестване на комбинация от елементи (шише и капачка; капкомер, капачка и шише)
 19 Квалификация на опаковъчните машини ØURS ØDQ – определя функционалните и оперативни спецификации ØIQ – изпълнение и документиране на инсталирането в съответната среда ØOQ – тестване на оборудването в избраната среда, за да се докаже, че се спазват функционалните и оперативни спецификации ØPQ – тестване на системата, за да се потвърди, че функционира без избрания процес отклонения в избраната среда за
19 Квалификация на опаковъчните машини ØURS ØDQ – определя функционалните и оперативни спецификации ØIQ – изпълнение и документиране на инсталирането в съответната среда ØOQ – тестване на оборудването в избраната среда, за да се докаже, че се спазват функционалните и оперативни спецификации ØPQ – тестване на системата, за да се потвърди, че функционира без избрания процес отклонения в избраната среда за
 20 EU GMPs – опаковъчни процеси Ø 5. 45 Преди да започне процес е необходимо да бъдат предприети мерки, с които да се осигури почистване на апаратурата, опаковащите машини и друго оборудване от всякакви продукти, материали или документи от предишен процес. Това почистване трябва да бъде извършено в съответствие с подходящ checklist. Ø 5. 44 . . . Различните пакетирани в близост продукти един до съществува физическо разделяне не трябва друг, да освен бъдат ако не
20 EU GMPs – опаковъчни процеси Ø 5. 45 Преди да започне процес е необходимо да бъдат предприети мерки, с които да се осигури почистване на апаратурата, опаковащите машини и друго оборудване от всякакви продукти, материали или документи от предишен процес. Това почистване трябва да бъде извършено в съответствие с подходящ checklist. Ø 5. 44 . . . Различните пакетирани в близост продукти един до съществува физическо разделяне не трябва друг, да освен бъдат ако не
 21 EU GMPs – опаковъчни процеси Ø 5. 46 Наименованието и партидният номер на продукта трябва да бъдат отбелязани на всяка зона/линия за опаковане. Ø 5. 47 Всички продукти и опаковъчни материали, които се използват трябва да бъдат проверени при доставяне в отдел Опаковка за количество, идентичност и съответствие с утвърдените писмени инструкции.
21 EU GMPs – опаковъчни процеси Ø 5. 46 Наименованието и партидният номер на продукта трябва да бъдат отбелязани на всяка зона/линия за опаковане. Ø 5. 47 Всички продукти и опаковъчни материали, които се използват трябва да бъдат проверени при доставяне в отдел Опаковка за количество, идентичност и съответствие с утвърдените писмени инструкции.
 22 EU GMPs – опаковъчни процеси Ø 5. 51. . . Етикетите на ролка се предпочитат пред единичните. Ø 5. 52 Необходимо е да се проверява дали четците на кодове, броячите и всички подобни електронни средства са точни. Ø 5. 50 … Когато маркирането на опаковката е ръчна операция, трябва да се извършват проверки през определени интервали от време. Ø 5. 53 Отпечатаната и щампована информация върху опаковъчните материали трябва да бъде отчетлива и устойчива към избледняване или изтриване.
22 EU GMPs – опаковъчни процеси Ø 5. 51. . . Етикетите на ролка се предпочитат пред единичните. Ø 5. 52 Необходимо е да се проверява дали четците на кодове, броячите и всички подобни електронни средства са точни. Ø 5. 50 … Когато маркирането на опаковката е ръчна операция, трябва да се извършват проверки през определени интервали от време. Ø 5. 53 Отпечатаната и щампована информация върху опаковъчните материали трябва да бъде отчетлива и устойчива към избледняване или изтриване.
 23 EU GMPs – опаковъчни процеси Ø 5. 54 On-line контролът по време на опаковъчния процес включва: ü обща оценка на външния вид ü дали продуктът е изцяло комплектован ü дали са използвани правилните опаковъчни материали за съответния продукт ü дали вторичните печати върху опаковката са точни ü правилно ли функционират уредите за наблюдение на опаковъчната линия
23 EU GMPs – опаковъчни процеси Ø 5. 54 On-line контролът по време на опаковъчния процес включва: ü обща оценка на външния вид ü дали продуктът е изцяло комплектован ü дали са използвани правилните опаковъчни материали за съответния продукт ü дали вторичните печати върху опаковката са точни ü правилно ли функционират уредите за наблюдение на опаковъчната линия
 24 EU GMPs – опаковъчни процеси Ø 5. 56 Всяко, отчетено по време на процеса, значително или необичайно отклонение от количеството bulk продукт и опаковъчни материали и количеството на готовия продукт трябва да бъде разследвано и документирано.
24 EU GMPs – опаковъчни процеси Ø 5. 56 Всяко, отчетено по време на процеса, значително или необичайно отклонение от количеството bulk продукт и опаковъчни материали и количеството на готовия продукт трябва да бъде разследвано и документирано.
 25 EU GMPs – опаковъчни процеси Ø 5. 57. . . всички неизползвани опаковъчни материали, върху които е отпечатан партиден номер/ срок на годност, трябва да бъдат унищожени и процесът да бъде документиран. Одобрена писмена процедута трябва да бъде прилагана, когато некодирани опаковки се връщат в склада. * Същите изисквания присъстват и в 21 CFR, § 211. 122 – Процеси на опаковане и етикетиране и § 211. 134 – Проверка на лекарствен продукт
25 EU GMPs – опаковъчни процеси Ø 5. 57. . . всички неизползвани опаковъчни материали, върху които е отпечатан партиден номер/ срок на годност, трябва да бъдат унищожени и процесът да бъде документиран. Одобрена писмена процедута трябва да бъде прилагана, когато некодирани опаковки се връщат в склада. * Същите изисквания присъстват и в 21 CFR, § 211. 122 – Процеси на опаковане и етикетиране и § 211. 134 – Проверка на лекарствен продукт
 26 Отговорности и пълномощия Ø Технологът на склада е отговорен за контролирането и документирането на количеството и вида на приетите/ отпуснатите/ бракуваните опаковъчни материали Ø Ръководител Сектор Опаковка потвърждава, че е получен исканият материал Ø Персоналът почистването на от Сектор Опаковка е отговорен за зоната за опаковане от артикули на предишен продукт/ партида, преди да бъдат внесени материалите за следващ опаковъчен процес. Ø ОК изпълняват контолна функция.
26 Отговорности и пълномощия Ø Технологът на склада е отговорен за контролирането и документирането на количеството и вида на приетите/ отпуснатите/ бракуваните опаковъчни материали Ø Ръководител Сектор Опаковка потвърждава, че е получен исканият материал Ø Персоналът почистването на от Сектор Опаковка е отговорен за зоната за опаковане от артикули на предишен продукт/ партида, преди да бъдат внесени материалите за следващ опаковъчен процес. Ø ОК изпълняват контолна функция.
 27 Избор на печатна база Ø Желаят ли да работят по СОП на фармацевтичното предприятие Ø Притежават ли система по качество Ø Персонал Ø Съоръжения Ø Складова база Ø Цена Печатните бази подлежат на валидиране и трябва да се одитират веднъж годишно.
27 Избор на печатна база Ø Желаят ли да работят по СОП на фармацевтичното предприятие Ø Притежават ли система по качество Ø Персонал Ø Съоръжения Ø Складова база Ø Цена Печатните бази подлежат на валидиране и трябва да се одитират веднъж годишно.
 28 Взаимоотношения между печатна база и фармацевтично предприятие Ø Поръчка се прави само при одобрена спецификация Ø В печатната база не трябва да има повече от една версия на макет и матрица за даден продукт Ø Макетите и матриците на различни продукти трябва да се съхраняват поотделно и “под ключ” Ø Важно е да бъде известна точната бройка отпечатани материали и брак
28 Взаимоотношения между печатна база и фармацевтично предприятие Ø Поръчка се прави само при одобрена спецификация Ø В печатната база не трябва да има повече от една версия на макет и матрица за даден продукт Ø Макетите и матриците на различни продукти трябва да се съхраняват поотделно и “под ключ” Ø Важно е да бъде известна точната бройка отпечатани материали и брак
 29 Изготвяне на нови опаковъчни материали Ø За нов лекарствен продукт или корекция на вече съществуващ е необходимо да се приготви макет Ø Макетът се одобрява от ОК и Отдел Регистрация. Ø В случаите когато се заменя стара версия, печатната база трябва да върне макета и матрицата, за да бъдат унищожени ØПечатната база трябва матрицата да бъде одобрена да изпрати мостра преди
29 Изготвяне на нови опаковъчни материали Ø За нов лекарствен продукт или корекция на вече съществуващ е необходимо да се приготви макет Ø Макетът се одобрява от ОК и Отдел Регистрация. Ø В случаите когато се заменя стара версия, печатната база трябва да върне макета и матрицата, за да бъдат унищожени ØПечатната база трябва матрицата да бъде одобрена да изпрати мостра преди
 30 Изготвяне на нови опаковъчни материали Ø ОК писмено одобрява произведената мостра Ø КК съгласува с подпис и дата шест мостри от даден продукт (напр. шест етикета), с цел подновяване на утвърдените каталози за: ü Склад ü Търговски отдел ü ОК ü КК ü Отдел Опаковка ü Спецификация на лекарствен продукт
30 Изготвяне на нови опаковъчни материали Ø ОК писмено одобрява произведената мостра Ø КК съгласува с подпис и дата шест мостри от даден продукт (напр. шест етикета), с цел подновяване на утвърдените каталози за: ü Склад ü Търговски отдел ü ОК ü КК ü Отдел Опаковка ü Спецификация на лекарствен продукт
 31 Преглед/ ревизия на опаковъчните материали Извършва се в следните случаи: Ø Изисквания на регулаторните органи Ø Сигнал Ø Годишен преглед на продукта Ø Маркетинг
31 Преглед/ ревизия на опаковъчните материали Извършва се в следните случаи: Ø Изисквания на регулаторните органи Ø Сигнал Ø Годишен преглед на продукта Ø Маркетинг
 32 Рискове Ø Оценката се базира върху: ü Човешки фактор ü Апаратура ü Материали ü Методи: контролирана опаковъчните материали. документация, оригинал на
32 Рискове Ø Оценката се базира върху: ü Човешки фактор ü Апаратура ü Материали ü Методи: контролирана опаковъчните материали. документация, оригинал на
 33 Рискове ØГрешен партиден номер Ø Липсващи партиден номер/ срок на годност Ø Блед печат Ø Липса на текст Ø Размазани етикети Ø Липсващи етикети Ø Лошо залепени етикети/ кутии
33 Рискове ØГрешен партиден номер Ø Липсващи партиден номер/ срок на годност Ø Блед печат Ø Липса на текст Ø Размазани етикети Ø Липсващи етикети Ø Лошо залепени етикети/ кутии
 34 Рискове Ø Смяната на печатна база или вида материал би довела до промяна в цветовете, текста и др. Затова такова действие се предприема, само ако е крайно наложително.
34 Рискове Ø Смяната на печатна база или вида материал би довела до промяна в цветовете, текста и др. Затова такова действие се предприема, само ако е крайно наложително.
 35 Заключение Ø 21 CFR 211. 122 (b) Всички опаковъчни материали, отговарящи на утвърдени писмени спецификации могат да бъдат освободени и използвани. Всички опаковъчни материали, които не отговарят на тези спецификации трябва да бъдат отхвърлени Ø(c) Трябва да се следят записите за: ü Всяка получена пратка ü Всяка една партида опаковъчен материал ü Всеки процес (употреба, анализ. . )
35 Заключение Ø 21 CFR 211. 122 (b) Всички опаковъчни материали, отговарящи на утвърдени писмени спецификации могат да бъдат освободени и използвани. Всички опаковъчни материали, които не отговарят на тези спецификации трябва да бъдат отхвърлени Ø(c) Трябва да се следят записите за: ü Всяка получена пратка ü Всяка една партида опаковъчен материал ü Всеки процес (употреба, анализ. . )
 36 Заключение Ø 21 CFR 211. 122 (d) Етикетите за: ü Всеки един лекарствен продукт; ü Доза; ü Концентрация, трябва да се съхраняват отделно. Достъпът ограничен. до складовото помещение трябва да бъде
36 Заключение Ø 21 CFR 211. 122 (d) Етикетите за: ü Всеки един лекарствен продукт; ü Доза; ü Концентрация, трябва да се съхраняват отделно. Достъпът ограничен. до складовото помещение трябва да бъде
 37 Благодря за вниманието!
37 Благодря за вниманието!
